
4.2. Изменения в химическом составе хроматина при его активации
Удаление гистона H1 из транскрипционно активного хроматина1*2* [151 - 154]. В ранних опытах Дж. Боннера (США) было показано, что ДНК в составе хроматина является гораздо худшей матрицей, чем свободная ДНК. На основании этих наблюдений было высказано предположение, что гистоны являются репрессорами транскрипции.
Л. Н. Ананьева и Ю. В. Козлов в нашей лаборатории поставили задачей выяснить, обладают ли ингибирующим действием все гистоны или только некоторые из них. Для этого из хроматина клеток асцитного рака Эрлиха мышей удаляли гистоны экстракцией растворами NaCl с постепенно повышающейся концентрацией. Полученные препараты служили матрицей для синтеза РНК. Транскрипцию вели в присутствии РНК-полимеразы из кишечной палочки, E. coli, которую брали в избытке, и смеси нуклеозидтрифосфатов. В интервале 0,4-0,6 М NaCl происходила резкая деконденсация материала, выражающаяся в набухании ядерного геля и даже растворении ДНП (если далее вести механическую обработку). При этом, как было показано, избирательно удалялся гистон HI. Одновременно с деконденсацией хроматина происходило резкое усиление его матричной активности (рис. 26). Дальнейшее увеличение концентрации солей в экстрагирующем растворе вело к удалению других гистонов и некоторому, но не слишком выраженному дополнительному увеличению матричной активности.
![Рис. 26. Влияние гистона HI на матричную активность ДНК в составе хроматина. а - влияние удаления белков из хроматина (1) на матричную активность (2) последнего в присутствии экзогенной РНК-полимеразы кишечной палочки, а также на гибридизуемость синтезирующейся РНК (3). Гистоны и негистоновые белки экстрагировали растворами NaCl повышающейся концентрации. В интервале 0,4 М NaCl - 0,6 М NaCl избирательно удалялся гистон H1. Синтезированную РНК гибридизовали с избытком ДНК при промежуточных величинах С><sub>0</sub>t. Тем самым гибридизуемость выявляет процентное содержание в синтезированной РНК повторяющихся последовательностей (по результатам, полученным Л. Н. Ананьевой, Ю. В. Козловым и автором); б - основные параметры синтеза РНК на разных матрицах: свободной ДНК, исходном хроматине (ДНП<sub>0</sub>) и хроматине, из которого удален гистон H1 экстракцией 0,6 М NaCl (ДНП<sub>0,6</sub>). Синтез РНК вели с помощью РНК-полимеразы кишечной палочки в присутствии меченых нуклеозидтрифосфатов: [<sup>14</sup>C]-ATP и либо [γ-<sup>32</sup>P]-ATP, либо [γ-<sup>32</sup>P]-GTP. [<sup>14</sup>C]-UMP включалась во всю РНК, a [γ-<sup>32</sup>P] - только в начало цепи (pp<sup>x</sup>A- или pp<sup>x</sup>G). Иными словами, включение [<sup>32</sup>Р] давало информацию об инициации синтеза, а [<sup>14</sup>С] - о самом синтезе РНК. В части опытов через 3-4 мин после начала инкубации в среду добавляли рифампицин-антибиотик, препятствующий инициации новых цепей РНК, но не влияющий на уже начатый синтез, т. е. на элонгацию. 1 - включение [<sup>14</sup>С] - UMP, 2 - то же после добавления рифампицина; 3 - включение [γ-<sup>32</sup>P]-ATP + GTP; 4 - то же после добавления рифампицина. На основании этих кривых включения можно рассчитать основные параметры РНК-полимеразной реакции (по результатам, полученным Ю. В. Козловым и автором)](pic/000033.jpg)
Рис. 26. Влияние гистона H1 на матричную активность ДНК в составе хроматина. а - влияние удаления белков из хроматина (1) на матричную активность (2) последнего в присутствии экзогенной РНК-полимеразы кишечной палочки, а также на гибридизуемость синтезирующейся РНК (3). Гистоны и негистоновые белки экстрагировали растворами NaCl повышающейся концентрации. В интервале 0,4 М NaCl - 0,6 М NaCl избирательно удалялся гистон H1. Синтезированную РНК гибридизовали с избытком ДНК при промежуточных величинах С0t. Тем самым гибридизуемость выявляет процентное содержание в синтезированной РНК повторяющихся последовательностей (по результатам, полученным Л. Н. Ананьевой, Ю. В. Козловым и автором); б - основные параметры синтеза РНК на разных матрицах: свободной ДНК, исходном хроматине (ДНП0) и хроматине, из которого удален гистон H1 экстракцией 0,6 М NaCl (ДНП0,6). Синтез РНК вели с помощью РНК-полимеразы кишечной палочки в присутствии меченых нуклеозидтрифосфатов: [14C]-UTP и либо [γ-32P]-ATP, либо [γ-32P]-GTP. [14C]-UMP включалась во всю РНК, a [γ-32P] - только в начало цепи (ppxA- или ppxG). Иными словами, включение [32Р] давало информацию об инициации синтеза, а [14С] - о самом синтезе РНК. В части опытов через 3-4 мин после начала инкубации в среду добавляли рифампицин-антибиотик, препятствующий инициации новых цепей РНК, но не влияющий на уже начатый синтез, т. е. на элонгацию. 1 - включение [14С] - UMP, 2 - то же после добавления рифампицина; 3 - включение [γ-32P]-ATP + GTP; 4 - то же после добавления рифампицина. На основании этих кривых включения можно рассчитать основные параметры РНК-полимеразной реакции (по результатам, полученным Ю. В. Козловым и автором)
Исследовались также и свойства синтезированной in vitro РНК с помощью гибридизации с тотальной ДНК мышей. При этом выявлялась фракция РНК, синтезированная на повторяющихся последовательностях ДНК. Оказалось, что в хроматине транскрипция повторяющихся последовательностей ДНК ограничена. Однако уже после экстракции хроматина 0,6 М NaCl, когда удалялся гистон H1, гибридизационные свойства РНК, синтезированной на матрице такого хроматина и на матрице свободной ДНК, становились неразличимыми. Мы предположили, что гистоны H2a, H2b, H3 и H4 (тогда их называли иначе - умеренно богатые лизином и богатые аргинином гистоны) не участвуют в подавлении транскрипции, а играют чисто структурную роль в организации хроматина, тогда как гистон H1 (в старой терминологии гистон, богатый лизином) является ингибитором синтеза РНК. Одновременно он же является фактором, обусловливающим конденсацию хроматина (см. выше).
Позднее Ю. В. Козлов изучил механизм ингибирования транскрипции гистоном H1, опять-таки на бесклеточной системе с РНК-полимеразой, выделенной из Е, coli. Было изучено влияние гистона H1 на процессы инициации и элонгации (см. рис. 26, табл. 4). Оказалось, что он в несколько раз снижает число цепей РНК, инициируемых на матрице нативного хроматина. Особенно резко ингибируется элонгация: РНК-полимераза прочитывает не более 100-150 п. н. ДНК, после чего останавливается. Между тем на хроматине, из которого гистон H1 удален, РНК-полимераза прочитывает по несколько тысяч пар нуклеотидов, причем длина цепей не отличается от длины цепей, синтезируемых на матрице свободной ДНК. Правда, на свободной ДНК по сравнению с хроматином, из которого удален гистон H1, более эффективно идут процессы инициации синтеза РНК. Был сделан вывод, что гистон H1, конденсируя хроматин, создает препятствия на пути РНК-полимеразы и останавливает тем самым синтез РНК.

Таблица 4. Основные параметры РНК-полимеразной реакции на разных матрицах (по результатам, полученным Ю. В. Козловым и автором)
* (ДНПМ - ДНП, изолированный с помощью обработки мочевиной, который полностью солюбилизирован, но при этом сохраняет гистон H1.)
В свете современных данных о соленоидном строении 300 А-ДНП фибриллы, которое зависит от присутствия гистона H1, этот результат легко объясним. Действительно, в соленоиде РНК-полимераза, очевидно, не может прочитать более 100 п. н. из-за чисто топологических запретов.
Согласно нашей гипотезе, при активации гена должно было происходить удаление гистона H1. Однако проверить ее в то время не удалось. Лишь сравнительно недавно появились данные об утрате гистона H1 из хроматина при активации генов. Так, при выделении активно транскрибируемых областей хроматина, например мини-ядрышек из ряда организмов, в них не был обнаружен гистон H1. Нет его и у дрожжей, где все гены потенциально активны.
Убедительные результаты были получены в лаборатории А. Д. Мирзабекова В. Л. Карповым и О. В. Преображенской. Они разработали метод "гибридизации с тенями гистонов". Для этого ДНК сшивали с гистонами с помощью диметилсульфата в условиях, когда пришивается в среднем одна молекула гистона на отрезок ДНК длиной около 200-300 п. н. Затем ДНК фрагментировали и проводили двумерный электрофорез в полиакриламидном геле с додецилсульфатом натрия. После прогона в первом направлении разрушали пришитые к ДНК гистоны протеиназой и вели разгонку во втором направлении уже свободной ДНК. Так как при первом раунде электрофореза разные гистоны по-разному замедляли движение фрагментов ДНК, то после второго прогона выявлялось несколько диагоналей (рис. 27). Обычно хорошо видны три: одна, соответствующая исходно свободной ДНК, другая - исходным комплексам ДНК с сердцевинными гистонами и третья (нижняя) - исходному комплексу ДНК с гистоном H1. Полученные ДНК переносятся на фильтр и гибридизуются с той или иной пробой. Если для гибридизации брали неактивный участок генома, например спейсер рибосомного гена дрозофилы, то метка связывалась со всеми диагоналями. Если, однако, как пробу использовали ген теплового шока, который транскрибировался в клетках, из которых выделяли хроматин, то гибридизация с диагональю, соответствующей комплексам ДНК с гистоном H1, была резко ослаблена или вообще отсутствовала. Иными словами, в ядрах перед пришивкой ДНК транскрибируемого гена не имела контактов с гистоном H1.
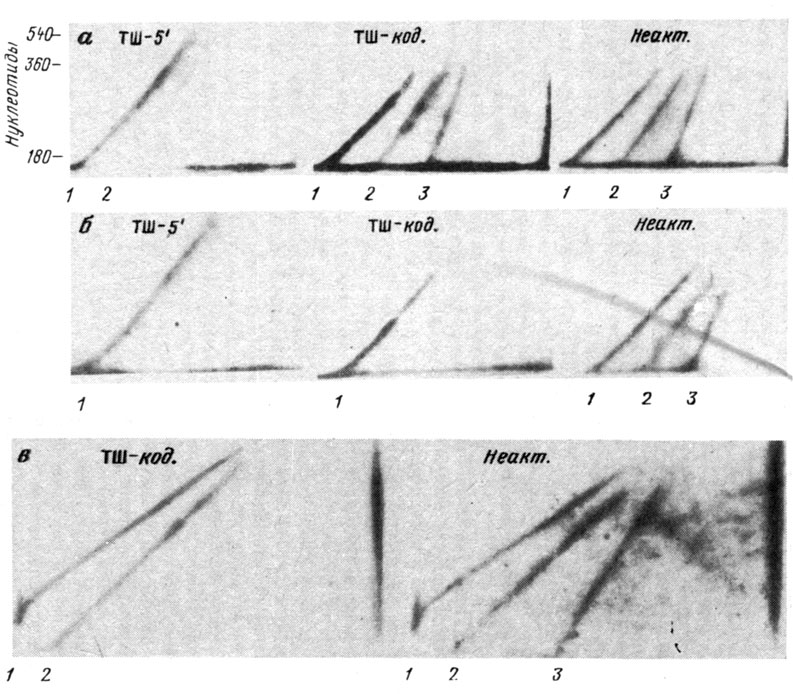
Рис. 27. Утрата гистона H1 и сердцевинных гистонов при активации транскрипции. Опыты велись на клетках культуры D. melanogaster (а, б) в условиях культивирования при 25° (а) и теплового шока (б). В случае а экспрессия генов теплового шока отсутствует, в случае б - идет весьма активно. Кроме того, опыты велись на дехорионизованных эмбрионах (в), где экспрессия генов теплового шока находится на среднем уровне. После образования ДНК-белковых комплексов, выделения фрагментов ДНК, их двумерного разделения (в вертикальном направлении после удаления белка) и переноса на фильтр вели гибридизацию одних и тех же фильтров с разными пробами: с регуляторной областью гена р70 теплового шока (ТШ-5'); с кодирующей областью того же гена (ТШ-код); с пробой транскрипционно неактивной инсерции в ген рДНК (неакт.). В неактивном гене видны три диагонали; 1 - свободная ДНК, 2 - комплексы ДНК с гистонами октамера; 3 - комплексы ДНК С гистоном H1. Видно ослабление или исчезновение ДНК-гистоновых комплексов при активации хроматина (по результатам, полученным А. Д. Мирзабековым и соавт.)
Хотя все имеющиеся сейчас данные, взятые по отдельности позволяют и другие интерпретации, в совокупности они служат серьезным свидетельством в пользу удаления гистона H1 из активного хроматина. Однако механизм этого процесса пока совершенно неясен.
Судьба нуклеосом при активации хроматина2* [ 154-157]. Менее однозначным является вопрос о судьбе гистонов H2a, H2b, H3 и H4, формирующих сердцевину нуклеосомы. В вышеупомянутых опытах Ю. В. Козлова их присутствие практически не влияло на транскрипцию ДНК РНК-полимеразой из E. coli. При изучении продуктов гидролиза хроматина эукариот многие авторы нашли, что нуклеосомы содержат ДНК активных генов, т. е. последние тоже организованы в нуклеосомы. Полученные на большом экспериментальном материале данные А. Д. Мирзабекова и сотр. показывают, что нуклеосомы, содержащие активно транскрибируемую ДНК, принципиально устроены так же, как и нуклеосомы, содержащие неактивную ДНК, хотя некоторые ДНК-гистоновые контакты в них изменяются.
Были также проведены опыты по гибридизации с тенями гистонов, о которых шла речь в предыдущем разделе (см. рис. 27). Препараты с диагоналями готовили из клеток дрозофилы, в которых гены теплового шока либо вообще не работали, т. е. были выключены, либо они работали на низком уровне, или, наконец, они были стимулированы тепловым шоком к активной транскрипции. Во всех случаях контрольной пробой служила ДНК спейсера рибосомного гена, которая гибридизовалась во всеми тремя диагоналями, в том числе с диагональю, произошедшей из комплексов ДНК с сердцевинными гистонами.
Ген теплового шока тоже нормально гибридизовался с этой диагональю из клеток, где он не транскрибировался. Однако с материалом, полученным из клеток с умеренной транскрипцией гена теплового шока, гибридизация второй диагонали была существенно понижена. Наконец, если диагонали получали из клеток с очень активным синтезом мРНК теплового шока, то вторая диагональ при гибридизации вообще была не видна (как и третья), и выявлялась лишь диагональ, соответствовавшая не сшитой с гистонами ДНК- Общий вывод, сделанный из работ с использованием метода ДНК-белковых сшивок, состоял в том, что при транскрипции движущаяся вдоль цепи ДНК РНК-полимераза обратимо сталкивает нуклеосомы с ДНК и транскрибирует фактически голую ДНК. Если уровень транскрипции невысок и РНК-полимераз, ползущих вдоль ДНК, немного, то нуклеосомы успевают образоваться вновь на участке, через который РНК-полимераза уже прошла. Если же транскрипция идет активно, то нуклеосомная структура ДНК не успевает восстановиться, и ДНК вообще лишена гистонов. В то же время постулируется, что организация нуклеосом в активном хроматине практически не отличается от таковой в неактивном. Недавно А. Д. Мирзабеков и сотр. воспроизвели опыты по пришивке гистонов к ДНК с помощью другого метода, путем обработки изолированных ядер препаратами платины. Этот метод мягче диметилсульфатного. Были получены принципиально те же результаты.
Наряду с этой группой данных имеются исследования, в которых авторы приходят к несколько отличным выводам. В. Гаррард и А. Ворсел (США), изучая состояние активных генов в хроматине с помощью нуклеазного гидролиза и с помощью электронной микроскопии, пришли к выводу о том, что нуклеосомы в активном хроматине остаются, но претерпевают структурные изменения типа разворота, превращаясь в полунуклеосомы. В результате на электрофореграммах гидролизатов микрококковой нуклеазой периодичность ~ 200 п. н. заменяется периодичностью ~ 100 п. н. При электронной микроскопии число бусин удваивается, а их размеры уменьшаются. Предполагается, что РНК-полимераза может проходить через такие развернутые нуклеосомы.
В пользу этой возможности говорят и данные, полученные Т. Коллером (Швейцария). Им разработан оригинальный метод изучения нуклеосом. Клетки обрабатывают псораленом, веществом, которое связывается с ДНК, и затем при УФ облучении сшивает между собою две цепи ДНК. Однако если ДНК входит в состав нуклеосом, реакции ее с псораленом не происходит. Поэтому, если выделенную из обработанных клеток ДНК проденатурировать в присутствии формальдегида (он препятствует ренатурации ДНК), то при электронной микроскопии на ДНК видны чередующиеся пузырьки (две цепи денатурировавшей ДНК), соответствующие нуклеосомам, связанные между собою ординарными нитями (сшитая, не способная к денатурации ДНК), соответствующими межнуклеосомным линкерам. Вначале изучали активно транскрибируемые гены рибосомной РНК, входящие в состав экстрахромосомных структур и поэтому легко анализируемые с помощью электронной микроскопии. В них пузырьки, соответствующие нуклеосомам, не видны, т. е. по всей вероятности, гистоны полностью удаляются из транскрибируемых областей. Интересно, что в нетранскрибируемых областях, спейсерах, пузырьки в ДНК (нуклеосомы) хорошо видны.
Однако на мини-хромосомах SV40, которые транскрибируются РНК-полимеразой II, а не РНК-полимеразой I, как гены рибосомной РНК, были получены другие результаты (рис. 28). Транкскрипционно активные мини-хромосомы выявляются благодаря наличию на них растущих цепей РНК (обычно одной или двух). Такие мини-хромосомы составляют 1-2 % от всех мини-хромосом, выделенных из клетки. Они, однако, содержат то же самое число пузырьков, что и неактивные мини-хромосомы, причем их размеры одинаковы в обоих случаях. Наиболее интересным является то, что цепи РНК отходят как от линкеров, так и непосредственно от пузырьков, т. е. РНК-полимераза, очевидно, транскрибирует нуклеосомы. Эти данные свидетельствуют в пользу разворота нуклеосом и транскрипции их РНК-полимеразой.
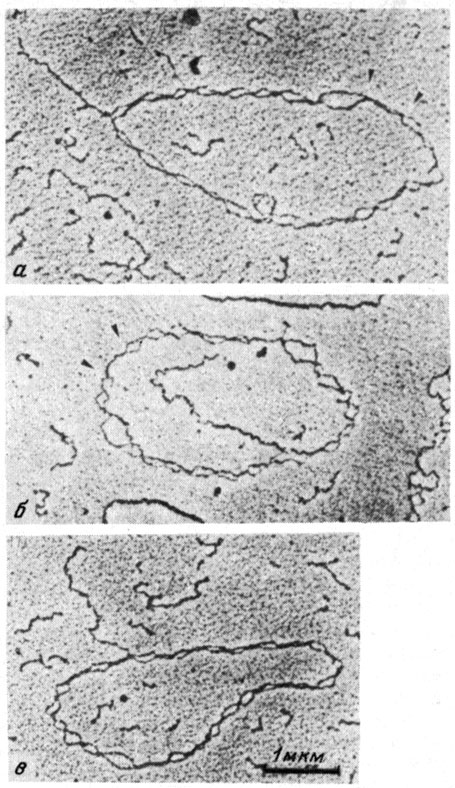
Рис. 28. Электронно-микроскопическое изучение транскрипции в мини-хромосомах SV40 Препараты ДНК после сшивки мини-хромосом псораленом и денатурации. Нуклеосомы, в которых сшивка ДНК не происходит, выглядят как пузырьки. Видно (стрелки), что цепи РНК могут отходить как от нуклеосом (а, б), так и от линкеров (в). Треугольники показывают свободную от нуклеосом зону (по результатам, полученным Т. Коллером и соавт.)
Все перечисленные выше результаты не являются прямыми, и поэтому окончательное решение вопроса о судьбе нуклеосом при транскрипции должны дать будущие эксперименты.
Модификация гистонов и гистоновые варианты: связь с активным хроматином [158, 159]. Еще в начале 60-х годов Олфри (США) показал, что гистоны могут подвергаться различным модификациям. Так, гистон HI фосфорилируется по ε-аминогруппам лизинов. Гистоны H3 и H4 ацетилируются по тем же группам. Имеется и ряд других модификаций (метилирование, ADP - рибозилирование, убикитинирование и др.).
Сразу возникло предположение, что энзиматические модификации гистонов могут влиять на структуру хроматина и на его активность. Действительно, при фосфорилировании лизина происходит замена одного положительного заряда в гистоне на отрицательный, при апеллировании - утрата положительного заряда и т. д. Именно благодаря таким изменениям в заряде модифицированные гистоны можно отделить от немодифицированных при проведении гель-электрофореза в ацетатном буфере с мочевиной. Так, в высокоразрешающем электрофорезе гистон H4 дает не одну, а четыре полосы, соответствующие молекулам, не ацетилированным и ацетилированным по одному, двум и трем остаткам лизина. В разных тканях соотношение между фракциями меняется. Разделяются на несколько фракций гистоны H3, H2a, H2b и H1 (разная степень ацетилирования и фосфорилирования).
К сожалению, до настоящего времени отсутствуют хорошие методы разделения транскрипционно активного и неактивного хроматина и поэтому трудно приписать измененные формы гистонов тому или иному состоянию хроматина. Наиболее интересные данные в этом направлении были получены тем же В. Олфри (США). При гидролизе активного хроматина он выделил необычные частицы, которые седиментировали в сахарозном градиенте медленнее, чем обычные нуклеосомы, и, по мнению автора, соответствовали развернутым нуклеосомам. В этих частицах, названных А-частицами, присутствовали все сердцевинные гистоны. В отличие от нормальных нуклеосом SH-группы гистона H3 в А-частицах были доступны для ряда химических реагентов, и благодаря этому А-частицы можно отделить от нуклеосом с помощью фракционирования на колонках с хлормеркурибензоатом (реагент, связывающий SH-группы). В А-частицах повышено содержание ацетилированных форм гистонов. Автор предполагает, что ацетилирование гистонов при активации хроматина ведет к развороту нуклеосомных частиц, а это, в свою очередь, повышает доступность SH-групп гистона H3.
Некоторые из гистонов кодируются более чем одним типом генов. В результате для этих гистонов существует несколько вариантов, немного различающихся по своей аминокислотной последовательности. Иногда в процессе онтогенеза происходит закономерная замена одного подкласса гистона на другой. Остается, однако, неясным, имеет ли это какое-либо регуляторное значение. Вопрос, очевидно, может быть также решен после разработки адекватных методов выделения транскрипционно активного хроматина.
Особое положение занимает гистон H1. Для него существуют варианты, резко отличающиеся по своей структурной организации. Таким вариантом является, например, гистон Н5, который замещает значительную часть гистона H1 в ядрах эритроцитов птиц. По всей вероятности, это замещение является важным фактором полного выключения транскрипции в ядрах эритроцитов. В обычных клетках существует вариант гистона H1 - гистон H10. Его содержание составляет малую долю от всего гистона H1. Есть ряд противоречащих друг другу данных о том, что H10 связан с активными генами или, наоборот, с устойчиво выключенными генами. Вопрос остается открытым.
Белки HMG могут участвовать в организации активного хроматина1* [160-166]. Помимо гистонов, хроматин содержит множество негистоновых белков, функция которых не известна. Среди них, очевидно, должны быть структурные белки, ферменты, обеспечивающие протекание процессов репликации, транскрипции и др., и регуляторные белки. Э. Джонс (Великобритания) попытался выделить белковые компоненты, присутствующие в достаточно большом количестве, что позволило бы провести их анализ и идентификацию. Ему действительно удалось изолировать новый класс ядерных белков, названный им "группой белков с высокой подвижностью" (high mobility group), или HMG-белки. Название зависело от высокой подвижности этих белков при электрофорезе в геле. Фракция HMG-белков распадается на ряд индивидуальных компонентов. Среди них наиболее представительны и хорошо охарактеризованы HMG-1, HMG-2, HMG-14 и HMG-17.
HMG-белки имеют невысокую молекулярную массу. Они обогащены как основными, так и дикарбоновыми аминокислотами. Содержание HMG-белков составляет примерно 7ю от содержания гистонов. В ядрах из разных типов клеток оно может варьировать. В данном контексте нас больше всего интересуют белки HMG-14 и HMG-17, для которых были получены данные о возможной роли в активации транскрипции. Х. Вайнтрауб (США) показал, что экстракция ядер 0,35 М NaCl, которая извлекает HMG-белки, меняет некоторые свойства активного хроматина, которые восстанавливаются при добавлении к хроматину HMG-14 и HMG-17. Г. Диксон (Канада) обнаружил эти белки в составе нуклеосом, освобождавшихся из хроматина на ранних этапах гидролиза нуклеазой, которые, по его данным, были обогащены ДНК тракстипционно активных генов.
![Рис. 29. Возможная связь HMG-белков (14 и 17) с активным хроматином. а - выявление субнуклеосом в гидролизатах хроматина микрококковой нуклеазой. На разных этапах гидролиза появляются те или иные фракции субнуклеосом. Электрофорез велся в полиакриламидном геле в неденатурирующих условиях. Окраска этидийбромидом, на правом столбике - флюорография; б - использование двумерного электрофореза для выяснения белкового состава субнуклеосом CH2 и CH3. Хроматин, меченный [><sup>14</sup>С] по белку, гидролизовали микрококковой нуклеазой и разделяли двумерным электрофорезом (1-е направление — недиссоциирующая среда, 2-е направление - раствор додецилсульфата натрия), после чего вели авторадиографию для выявления белков. Буквами указаны HMG-белки, которые в момент проведения опыта еще не были идентифицированы с известными. Сейчас мы знаем, что А - это HMG-1, В - HMG-2, E - HMG-14, G - HMG-17, HMG-белки F и H идентифицированы неточно, вероятно, H тоже соответствует HMG-17. Видно, что HMG-белки входят в состав мононуклеосом (МН-2 и МН-3) и субнуклеосом CH-2 (HMG-17) и CH-3 (HMG-14); в - демонстрация обогащения ДНК CH-2 и CH-3 транскрибирующимися последовательностями. ДНК, выделенную из полос CH-2 и CH-3 L-клеток, метили по 5'-концам [<sup>32</sup>Р] и затем гибридизовали с гяРНК из L-клеток. Гибриды выявляли путем гельфильтрации. 1 - CH-2 ДНК; 2 - CH-3 ДНК; 3 - тотальная ДНК клетки (по результатам, полученным В. В. Бакаевым и соавт.)](pic/000038.jpg)
Рис. 29. Возможная связь HMG-белков (14 и 17) с активным хроматином. а - выявление субнуклеосом в гидролизатах хроматина микрококковой нуклеазой. На разных этапах гидролиза появляются те или иные фракции субнуклеосом. Электрофорез велся в полиакриламидном геле в неденатурирующих условиях. Окраска этидийбромидом, на правом столбике - флюорография; б - использование двумерного электрофореза для выяснения белкового состава субнуклеосом CH2 и CH3. Хроматин, меченный [14С] по белку, гидролизовали микрококковой нуклеазой и разделяли двумерным электрофорезом (1-е направление — недиссоциирующая среда, 2-е направление - раствор додецилсульфата натрия), после чего вели авторадиографию для выявления белков. Буквами указаны HMG-белки, которые в момент проведения опыта еще не были идентифицированы с известными. Сейчас мы знаем, что А - это HMG-1, В - HMG-2, E - HMG-14, G - HMG-17, HMG-белки F и H идентифицированы неточно, вероятно, H тоже соответствует HMG-17. Видно, что HMG-белки входят в состав мононуклеосом (МН-2 и МН-3) и субнуклеосом CH-2 (HMG-17) и CH-3 (HMG-14); в - демонстрация обогащения ДНК CH-2 и CH-3 транскрибирующимися последовательностями. ДНК, выделенную из полос CH-2 и CH-3 L-клеток, метили по 5'-концам [32Р] и затем гибридизовали с гяРНК из L-клеток. Гибриды выявляли путем гельфильтрации. 1 - CH-2 ДНК; 2 - CH-3 ДНК; 3 - тотальная ДНК клетки (по результатам, полученным В. В. Бакаевым и соавт.)
В. В. Бакаев в нашей лаборатории пришел к выводу о роли HMG-белков в транскрипции с помощью другого экспериментального подхода. При электрофоретическом анализе гидролизатов хроматина он выявил, помимо нуклеосом и олигонуклеосом, минорные компоненты, обладающие большей подвижностью. Они были названы субнуклеосомами и, очевидно, являлись продуктами дальнейшего распада нуклеосомы (рис. 29, табл. 5). Субнуклеосома СН-7 соответствовала нуклеосоме, утратившей по одной молекуле Н2а и Н2Ь и содержавшей ДНК, укороченную на 40 п. н., СН-6 соответствовала комплексу ДНК длиной 30-40 п. н. с гистоном H1, отщепляющемуся от МН-2 при ее превращении в МН-1. СН-4 содержала отрезок ДНК и пару гистонов H2a и H2b (продукт реакции МН-1→СН-7→СН-4). Две субнуклеосомы, СН-3 и СН-2, состояли из короткой ДНК и HMG-белков (HMG-14 и HMG-17). Можно было предположить, что они являются участками линкера, связанными с белками HMG-14 и HMG-17, переходящими в раствор при переваривании соответствующих нук-леосом. СН-2 и СН-3 были собраны, из них выделена ДНК, которую метили по концам и изучали ее гибридизацию с ядерной РНК. Оказалось, что ДНК из СН-2 и СН-3 гораздо эффективнее гибридизуется с ядерной РНК, чем тотальная, фрагментированная до тех же размеров ДНК клетки.

Таблица 5. Состав субнуклеосом (по результатам, полученным В. В. Бакаевым и соавт.)
Отсюда был сделан вывод, что ДНК, связанная с белками HMG-14 и HMG-17, вероятно, происходит из транскрипционно активного хроматина.
Все эти данные, полученные независимо, позволили предположить, что HMG-14 и HMG-17 каким-то образом связаны с активацией генов. Механизм активации был, однако, совершенно непонятным. HMG-14 и HMG-17 не могли быть первичными факторами, включающими ген, так как они лишены специфичности. Можно было думать, что они участвуют в поддержании "открытой конформации" активного хроматина.
В последующие годы появился скептицизм относительно роли HMG-14 и HMG-17 в активации хроматина. В частности, недавно А. Д. Мирзабеков и сотр. с помощью метода гибридизации с белковыми тканями получили данные об обеднении активного хроматина HMG-14 и HMG-17. Поскольку, однако, все вышеперечисленные данные являются косвенными, в целом вопрос о роли HMG-белков остается открытым и требует дальнейшего изучения.
Топоизомераза I и белки, прочно связанные с ДНК, входят в состав транскрипционно активного хроматина1* [167]. С. Элгин (США), а за нею ряд других авторов показали, что транскрипционно активный хроматин содержит топоизомеразу I, фермент, релаксирующий суперспирализованную ДНК. Впервые это было продемонстрировано на цитологических препаратах политенных хромосом дрозофилы с помощью флюоресцирующих антител к топоизомеразе I. Этот фермент вносит в ДНК одноцепочечный разрыв и ковалентно связывается с образовавшимся 5'-концом ДНК. Это позволяет ДНК свободно вращаться в месте разрыва. Затем фрагмент отщепляется, а фосфодиэфирная связь в ДНК восстанавливается. По молекулярной массе топоизомераза I, или сокращенно топо I, гетерогенна. Наиболее тяжелый компонент имеет молекулярную массу 135 кДа, а наиболее богато представленный - 80 кДа. При ее расщеплении протеиназами образуются более короткие полипептиды, сохраняющие тем не менее ферментативную активность.
Антибиотик каптотецин является ингибитором топо I, причем при обработке им клеток фермент образует ковалентные сшивки с ДНК в том месте, где он находился в момент контакта с антибиотиком. Место таких сшивок легко определить методом картирования с помощью гибридизационной метки. Этим путем было обнаружено, что топо I присутствует исключительно в транскрибируемых областях генома, т. е., вероятнее всего, она работает в кооперации с РНК-полимеразой II, снимая возникающие при транскрипции местные перекручивания ДНК.
Другим белковым компонентом, выявляемым в транскрибируемых областях генома, является набор белков, прочно связанных с ДНК (ПСБ), которая соответствует транскрибируемой ДНК клетки (см. разд. 3.4).
С. В. Разиным и В. В. Чернохвостовым была сделана попытка детально охарактеризовать комплексы ДНК с ПСБ. Фрагменты ДНК длиной в 1-2 т. п. н., связанные с ПСБ, очищали и подвергали равновесному ультрацентрифугированию в градиенте плотности CsCl. Их плавучая плотность оказалась равной 1,7 г/см3, т. е. она соответствовала плавучей плотности свободной ДНК, не содержащей белка. В ходе опытов, поставленных для объяснения этого парадокса, было обнаружено, что обработка ДРНКазой ведет к уменьшению плавучей плотности комплексов до 1,62-1,65 г/см3. Приблизительные расчеты, основанные на плотности белка (~ 1,3 г/см3) и РНК (~ 1,9 г/см3), (показывают, что на каждую молекулу ДНК приходится около 150 кДа белка и около 200 нуклеотидов РНК. Природа этой РНК неясна, но получены данные о ее гомогенности и уникальной нуклеотидной последовательности.
Таким образом, многое в отношении комплексов ДНК с ПСБ остается загадочным, но, по всей вероятности, им принадлежит существенная роль в организации транскрипционной машины. Их исследование продолжается в настоящее время.
Деметилирование ДНК в транскрибирующихся генах2* [168-172]. Еще одной важной особенностью активного хроматина является деметилирование определенных участков ДНК. В неактивных генах большая часть цитидиловых остатков в составе CG-последовательностей метилируется. Впервые Б. В. Ванюшиным в лаборатории А. Н. Белозерского было продемонстрировано, что ДНК в разных тканях одного животного различаются по уровню метилирования С. На основании этого было высказано предположение о возможной регуляторной роли метилирования в дифференцировке. Позднее многими авторами было показано, что в транскрибирующейся ДНК некоторые области оказываются недометилированными. Наиболее широко используемый метод анализа - сравнение рестриктных карт, полученных с рестриктазами, узнающими одну и ту же последовательность, например CGCG или CCGG, но обладающими разной чувствительностью к метилированию. Одна из рестриктаз расщепляет и метилированную и неметилированную последовательности, а другая - только неметилированную. Обычно неметилированные последовательности локализованы в регуляторной области гена. Область собственно гена, его кодирующей части и интронов одинаково метилирована как в работающих, так и в молчащих генах.
При введении в клетки метилированной ДНК ее экспрессия в клетке оказывается значительно сниженной по сравнению с неметилированной ДНК. Получены данные, согласно которым при репликации ДНК состояние метилирования ДНК воспроизводится: если одна из цепей метилирована, то новообразованная цепь также метилируется в том же самом месте.
Одно время складывалось впечатление, что метилирование-деметилирование цитидина в CG-последовательностях регуляторной области - это главный механизм инактивации-активации гена. Однако в последнее время появился ряд данных, противоречащих этой гипотезе. Так, полностью метилированная по CG ДНК SV40 активно экспрессируется. В то же время в ДНК дрозофиллы вообще не выявляется метилцитозин. Возможно, что деметилирование С является следствием активации гена и лишь закрепляет состояние транскрипционной активности. Здесь, как и в других областях изучения активации гена, нужны новые эксперименты.
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'