
3.5. Заключение
Из четырех способов переноса генетического материала у микроорганизмов, описанных в главе 3, наиболее эффективный и широко используемый прием для быстрого построения генетических карт - конъюгация. В настоящее время из всех микроорганизмов, особенно грамотрицательных, выделено большое количество плазмид, в том числе способных к собственному переносу и мобилизации хромосомы хозяина. Выше были рассмотрены свойства классического полового фактора - плазмиды F кишечной палочки. Некоторые конъюгативные плазмиды имеют сходство с F-фактором (R1, R6-5, R100 Col V2-K94 и др.) в гомологии системы переноса, относятся к группам несовместимости FI - III и имеют F-подобные половые волоски. Другие конъюгативные плазмиды относятся к иным группам несовместимости и сообщают донорным штаммам иные свойства по сравнению с донорами F-типа. Например, доноры P. aeruginosa, несущие FP2, значительно менее эффективны (10-2-10-3 клеток популяции вызывают перенос), чем F+, не образуют волосков и 30-80 % рекомбинантов наследует FP2.
У некоторых микроорганизмов - гонококков, пневмококков и пурпурных фотосинтезирующих бактерий - конъюгация клеток происходит в особых физиологических условиях без участия плазмид. Для усиления донорной функции штаммов, несущих определенные плазмиды, в отдельных случаях успешно использованы транспозоны (Tnl у P. aeruginosa и V. cholerae, Тn5 у A. tumefaciens), которые были включены в состав плазмид. Таким образом, существует целый ряд половых факторов, отличающихся от половой плазмиды F Е. coli К-12 и используемых для картирования хромосомы у разных групп микроорганизмов (табл. 3.8).

Таблица 3.8. Плазмиды бактерий, переносящие хромосому
Единицей измерения для генетических карт, построенных по результатам конъюгации у Е. coli К-12, S. typhimurium, P. aeruginosa, P. putida, P. mirabilis, принята длина хромосомы, перенесенной в стандартных физиологических условиях за 1 мин. Метод конъюгации использован также для генетического картирования Acinetobacter, Agrobacterium, Caulobacter, Rhizobium, Rhodopseudomonas, Vibrio. Генетические карты микроорганизмов приведены в главе 8. Из всех карт только генетические карты Е. coli К-12, S. typhimurium, В. subtilis содержат наибольшее число генов по сравнению с остальными микроорганизмами, хотя и эти карты далеки от насыщения.
Метод трансдукции, основанный на анализе частоты котрансдукции неселективных маркеров, дает возможность определить порядок цистронов на значительно меньшем расстоянии по сравнению с конъюгацией. Частоты котрансдукции можно преобразовать в нормальные единицы рекомбинации и физические единицы с помощью специальной формулы. Трансдукция посредством бактериофага PBS1 дала возможность установить сцепление между большими пучками локусов и объединить все группы сцепления в одну кольцевую карту генома В. subtilis. Данный метод картирования использован также для установления структуры генома у S. typhimurium, P. aeruginosa, P. mirabilis, С. crescentus и В. thuringiensis.
Генетическая трансформация, ограниченная узкими рамками сцепления, не дает возможности определить непрерывную карту сцепления генов и поэтому используется сравнительно редко. С помощью генетической трансформации частично построены карты для В. subtilis, S. aureus, Neisseria gonorrhoeae. Объединение отдельных групп сцепления стафилококка в единую кольцевую карту осуществлено с помощью слияния протопластов, которое открывает хорошие перспективы для генетического картирования любых микроорганизмов. Обычно для построения генетических карт применяют не один, а комбинацию разных методов - конъюгацию и трансдукцию, трансформацию и трансдукцию, трансформацию и слияние протопластов и т. д.
Необходимо отметить, что к настоящему времени разработано много разнообразных и эффективных методик для генетического и физического анализа ДНК Е. coli, которые могут оказаться пригодными для изучения и других видов микроорганизмов [11]. Они посвящены отдельным вопросам мутагенеза (специфичность мутагенов и мутаторов, распределение нонсенс-мутаций, использование транспозонов для получения мутантов, локализованный мутагенез, обогащение популяции клеток мутантами, выделение делекционных и промоторных мутантов), генетической рекомбинации (эффект маркера, аллель-специфические эффекты, негативная интерференция, горячие точки, использование пула транспозонов и дупликаций, физические и рекомбинационные единицы, интегративная супрессия, использование фага Ми, слияние генов и плазмид) и клонирования генов. Кроме того, имеется ряд практических руководств и описаний методик [6-8] и обзоров [10, 11, 22, 23, 34, 35] по генетике бактерий и молекулярной генетике микроорганизмов, из которых можно почерпнуть много ценной информации как теоретического, так и практического характера.
Сведения о коллекциях микроорганизмов, в том числе охарактеризованных генетически и поддерживаемых в СССР, можно найти в изданиях [3-5, 8а]. Генетически охарактеризованные штаммы микроорганизмов (грибы, дрожжи, актиномицеты и бактерии) и бактериофагов, не представляющих промышленного значения, можно получить из Центрального музея промышленных микроорганизмов при ВНИИ генетики и селекции промышленных микроорганизмов Министерства медицинской и микробиологической промышленности СССР.
Список микроорганизмов, генетические карты которых представлены в главе 8, включает 20 наименований (табл. 3.9). Только генетические карты E.coli К-12, S. typhimurium и В. subtilis содержат наибольшее число генов по сравнению с остальными микроорганизмами, хотя и эти карты еще далеки от насыщения, судя по размерам гена и генома.
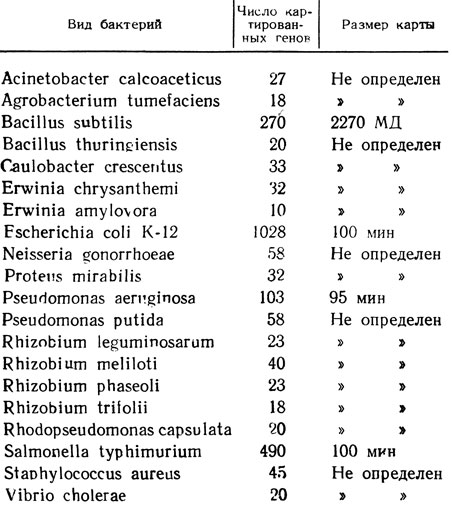
Таблица 3.9. Генетические карты бактерий
Наличие свыше тысячи картированных генов и масштаб карты у Е. coli К-12 дали возможность провести топологический и функциональный анализы хромосомы. Еще в 1976 и 1980 гг. Бэчмен и соавт. [10, 11] отметили неравномерную плотность генов на карте. Обнаружено четыре пучка высокой плотности генов на кольцевой калиброванной карте генома, которые почти симметрично располагались вокруг области начала репликации хромосомы. Продукты указанных генов вовлечены в биосинтез макромолекул. В области терминации репликации ДНК, расположенной по отношению к началу репликации на противоположном участке карты (от 31,3 до 35,45 мин), отмечается низкая концентрация генетических локусов. Эта область, возможно, используется для поддержания структурной организации комплекса нуклеоида с мембраной на конечной стадии цикла репликации ДНК. На основании приведенных данных сделано предположение [10] о топологической и функциональной связи между локализацией генов и структурой компактно упакованного нуклеоида кишечной палочки. Областям с высокой плотностью генов соответствуют сегменты хромосомы, расположенные на поверхности нуклеоида, а областям с низкой плотностью генов - внутренние участки ядерного тельца. Кроме того, авторы предположили, что хромосома в нуклеоиде может быть разделена на два полугенома, имеющих функциональную и топологическую комплементарность. Относительное увеличение числа генетических локусов возле начала репликации, связанное с перекрывающимися (преждевременными) циклами репликации ДНК, может обеспечить повышенный синтез макромолекул.
De Martelaere и Van Gool [15] осуществили количественный анализ распределения 798 генетических локусов на кольцевой карте генома Е. coli К-12, включающий проверку симметрии и повторения локусов согласно плотности их распределения, а также биохимического и функционального родства продуктов соответствующих генов. Авторы подтвердили предположения Бэчмен и соавт. [10] о наличии симметрии в плотности распределения генов на карте, главная ось которой расположена на 85,5-й минуте карты, возле точки начала репликации (на 82,7-й минуте) хромосомы, вокруг которой отмечается наибольшая плотность генов (рис. 3.7). Все исследованные локусы были разделены на четыре класса согласно их биохимическому и функциональному родству. Были рассчитаны дополнительные оси симметрии для каждого класса функционально родственных локусов, которые расположены на 29, 49,5 (56), 90 и 43-й минутах для классов локусов соответственно I, II, III и IV. Таким образом, главная ось симметрии делит карту на два полугенома, которые, вероятно, топологически комплементарны.
![Рис. 3.7. Распределение плотности 798 генетических локусов на кольцевой карте E. Coli K-12 [15]: sa - головная ось симметрии распределения генов; n - число генетических локусов. Карта разделена на области, характеризующиеся гомогенной плотностью генов](pic/000061.jpg)
Рис. 3.7. Распределение плотности 798 генетических локусов на кольцевой карте E. Coli K-12 [15]: sa - головная ось симметрии распределения генов; n - число генетических локусов. Карта разделена на области, характеризующиеся гомогенной плотностью генов
Второй важный вывод цитируемой работы - распределение на карте функциональных доменов, занимающих 42 % всей длины карты и не имеющих регулярности в повторении. Такая организация дуплицированных генов может быть результатом транспозиции. Имеет место количественная корреляция между числом сайтов интеграции F-плазмиды и ДНК фагов и распределением границ функциональных доменов в пределах длины интервала карты. Коэффициент корреляции, рассчитанный по линейной регрессии, составляет 0,701. Организация хромосомы E.coli из функциональных модулей должна облегчать обмен функциональных блоков ДНК путем рекомбинации с экстрахромосомной ДНК. Кроме того, такая организация обеспечивает надоперонный механизм контроля координированного проявления функционально родственных генов, оперативность которого может зависеть от структурной организации нуклеоида in vivo.
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'