
4.2. Слияние протопластов
Опубликован обзор работ [13] о возможности получения и регенерации протопластов у стрептомицетов, а также их успешного использования для доказательства генетической рекомбинации при данном способе искусственного объединения геномов. В шестифакторном слиянии протопластов S. coelicolor A3 (2) проведен анализ спор массовых культур и отдельных колоний регенерантов [15].
Частота множественных кроссинговеров при слиянии протопластов на порядок выше таковой при конъюгационных скрещиваниях. Это объясняется полной диплоидностью слившейся клеточной единицы по сравнению с меродиплоидностью клетки при конъюгации и множественностью раундов рекомбинации после слияния протопластов. Выделенные рекомбинанты были гаплоидами. Ни одна колония после слияния и регенерации протопластов не содержала всех аллелей родителей ни в форме обоих родительских генотипов, ни в форме пары комплементарных рекомбинантов. Авторы предполагают, что один или оба генома родителей фрагментируются с потерей некоторых сегментов и затем в результате рекомбинации восстанавливается один родительский геном и один или много рекомбинантных геномов. Частота рекомбинации достигала в среднем 6-17 % и не зависела от половых плазмид SCP1 или SCP2*.
На основании равномерного распределения кроссинговеров по всей длине хромосомы и значительного преобладания двойных перекрестов над четверными и шестерными (305:93:2) Хопвуд и Райт [15] сделали вывод о пригодности метода слияния протопластов для картирования новых штаммов стрептомицетов, у которых не обнаружена эффективная система конъюгационного переноса хромосомы.
Baltz [5], Zippel и соавт. [19] и Нага и соавт. [11] использовали метод слияния протопластов для предварительного картирования генов соответственно у Streptomyces fradiae, S. hygroscopicus и S. griseus. На основании минимума четверных кроссинговеров четыре ауксотрофных маркера были распределены на кольцевой хромосоме S. griseus в последовательности pro-leu-arg-trp. Ген синтеза фактора А, контролирующего цитодифференциацию и биосинтез стрептомицина, не удалось локализовать на карте из-за его экстрахромосомальной природы. На хромосомной карте S. hygroscopicus ауксотрофные маркеры распределены следующим образом: ... ile-val-lys-trp-mеtA-arg-thr-metB... .
Hranueli и соавт. [16] провели сравнительный анализ рекомбинантов после конъюгационных скрещиваний и слияния протопластов у S. rimosus. Частота рекомбинации в первом случае составляла 4 ⋅ 10-5- 2 ⋅ 10-4, во втором - 8 ⋅ 10-2, т. е. при слиянии протопластов она была на 2-3 порядка выше. При обоих способах скрещивания возникали два типа рекомбинантов - гаплоиды и прототрофоподобные гетерогеноты, растущие на всех диагностических и минимальной средах и выщепляющие при пересевах обоих родителей рекомбинанты до 4-5-й субкультуры. Их частота составляла 35-50 % всех рекомбинантов. В табл. 4.7 приведен анализ рекомбинантов, выделенных после обычных скрещиваний и слияния протопластов. Как видно из данных табл. 4.7 и рис. 4.4, наибольшее число рекомбинантов образовалось в результате двойных кроссинговеров, хотя при слиянии протопластов число четверных перекрестов на один порядок больше по сравнению с конъюгацией (соответственно 13,3 и 1,5 %). Таким образом, метод слияния протопластов пригоден для картирования хромосомы S. rimosus.
![Таблица 4.7. Анализ рекомбинантов, выделенных после конъюгации и слияния протопластов штаммов 252 his-4 pro-1 tyr-1 и 1054 nic-1 rib-4 pdx-9 S. rimosus [18]](pic/000073.jpg)
Таблица 4.7. Анализ рекомбинантов, выделенных после конъюгации и слияния протопластов штаммов 252 his-4 pro-1 tyr-1 и 1054 nic-1 rib-4 pdx-9 S. rimosus [18]
![Рис. 4.4. Частота аллелей рекомбинантов на кольцевых геномах родительских штаммов 252 (внешнее кольцо) и 1054 (внутреннее кольцо) [16]: а - конъюгация; б - слияние протопластов](pic/000074.jpg)
Рис. 4.4. Частота аллелей рекомбинантов на кольцевых геномах родительских штаммов 252 (внешнее кольцо) и 1054 (внутреннее кольцо) [16]: а - конъюгация; б - слияние протопластов
М. Е. Подгорская и соавт. [4] показали образование трех типов колоний рекомбинантов при слиянии протопластов у S. griseus - гаплоидных рекомбинантов, гетероклонов и нестабильных частично или полностью диплоидных рекомбинантов. Частота возникновения рекомбинантов при слиянии протопластов составляла 10-16 % и значительно превышала фертильность конъюгационных скрещиваний (10-6-10-7). Анализ трех гетероклонов и 488 отдельных колоний после шестифакторного слияния протопластов в неселективных условиях представлены в табл. 4.8 и на рис. 4.5. Как видно из табл. 4.8, гетероклоны при слиянии протопластов по характеру сегрегации родительских и рекомбинантных генотипов не отличаются от аналогичных клонов, выделенных при конъюгации: отсутствие или резкое нарушение эквивалентного соотношения членов пары комплементарных генотипов родителей и рекомбинантов. Среди индивидуальных колоний регенерантов также наблюдается преобладание числа колоний одного родителя (антибиотикообразующего) при равной пропорции протопластов обоих штаммов до слияния. Независимо от генетической природы колоний рекомбинантов (сегреганты гетероклонов или гаплоиды), количественное распределение генотипов пропорционально числу кроссинговеров, что дает возможность установить сцепление и порядок распределения маркеров на карте. В данном слиянии протопластов была уточнена локализация локуса smp-1 и вновь картированы локусы lys-1, his-4 и tet-1 с определением их расстояний на карте. Таким образом, метод слияния протопластов можно применять для картирования новых штаммов стрептомицетов, у которых отсутствуют эффективные системы естественного переноса генов подобно штамму S. coelicolor A3 (2).
![Таблица 4.8. Генетический анализ рекомбинантов после слияния протопластов штаммов S. griseus 68 leu-I thi-1 smp-1 X 12 his-4 lys-1 tet-1 [4]](pic/000075.jpg)
Таблица 4.8. Генетический анализ рекомбинантов после слияния протопластов штаммов S. griseus 68 leu-I thi-1 smp-1 X 12 his-4 lys-1 tet-1 [4]
(Примечание. Гетероклоны выделены на селективной среде после рассева спор колоний регенерантов; отдельные колонии регенерантов анализировали в неселективных условиях Фигурными скобками выделены комплементарные генотипы.)
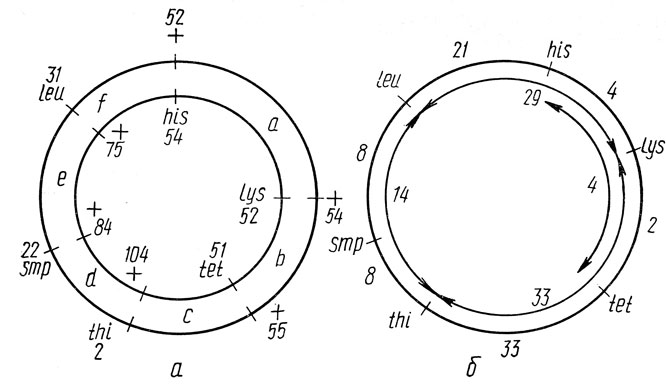
Рис. 4.5. Частота аллелей сегрегантов на кольцевых геномах родителей 68 (наружное кольцо) и 12 (внутреннее кольцо) (а) и расстояние между маркерами на генетической карте в единицах рекомбинации (б)
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'