
Приложение 9
Примеры расчета сцепления
В разд. 3.4.2 были описаны методы обследования родословных на предмет выявления сцепления. Таблицы и формулы для реальных расчетов можно найти в работах [882; 796; 797; 798].
Мы приведем два примера расчета сцепления: в одном устанавливается не очень тесное сцепление двух признаков, детерминируемых Х-хромосомными генами, а в другом - тесное сцепление двух аутосомных признаков.
Пример: сцепление между Х-хромосомными генами глазного альбинизма и группы крови Xg [661]. На рис. П.9.1 - П.9.3 представлены три большие родословные, в которых сегрегируют Х-сцепленные гены глазного альбинизма и группы крови XG. Информацию о сцеплении дают 25 сыновей 11 матерей, о которых известно, что они гетерозиготны как по глазному альбинизму, так и по антигену XG. В табл. П.9.1 приведена классификация сибств трех родословных в соответствии с их типами в таблицах [882; 796; 797; 798] и распределением логарифмических шансов. Отношение правдоподобий Р(9) родословной для частоты рекомбинации 9 вычисляется следующим образом:
log P(θ) = z(θ),
Р(θ) = 10z(θ),
где z(θ) - табулированный логарифмический шанс.
![Рис. П.9.1. Семья с Х-сцепленным глазным альбинизмом (семья М из табл. П.9.1) [661]](pic/000231.jpg)
Рис. П.9.1. Семья с Х-сцепленным глазным альбинизмом (семья М из табл. П.9.1) [661]
![Рис. П.9.2. Семья с Х-сцепленным глазным альбинизмом (семья W из табл. П.9.1; обозначения такие же, как и на рис. П.9.1) [661]](pic/000232.jpg)
Рис. П.9.2. Семья с Х-сцепленным глазным альбинизмом (семья W из табл. П.9.1; обозначения такие же, как и на рис. П.9.1) [661]
![Рис. П.9.3. Семья с Х-сцепленным глазным альбинизмом (семья L из табл. П.9.1; обозначения такие же, как и на рис. П.9.1) [661]](pic/000233.jpg)
Рис. П.9.3. Семья с Х-сцепленным глазным альбинизмом (семья L из табл. П.9.1; обозначения такие же, как и на рис. П.9.1) [661]
![Таблица П.9.1. Логарифмические шансы сцепления глазного альбинизма и группы крови Xg [661]](pic/000234.jpg)
Таблица П.9.1. Логарифмические шансы сцепления глазного альбинизма и группы крови Xg [661]
На рис. П.9.4 приведены логарифмические шансы и их интерполяция. Вероятность сцепления (θ = 0,175) в 18 раз выше, чем вероятность отсутствия сцепления.
![Рис. П.9.4. Относительная вероятность сцепления между геном глазного альбинизма и группой крови Xg на основе логарифмических шансов (табл. П.9.1). Отметим, что относительная вероятность сцепления (9 = 0,175) в 18 раз выше, чем вероятность отсутствия сцепления [661]](pic/000235.jpg)
Рис. П.9.4. Относительная вероятность сцепления между геном глазного альбинизма и группой крови Xg на основе логарифмических шансов (табл. П.9.1). Отметим, что относительная вероятность сцепления (θ = 0,175) в 18 раз выше, чем вероятность отсутствия сцепления [661]
До сих пор 11 сибств оценивались независимо друг от друга, т. е. не учитывался тот факт, что они принадлежат трем большим родословным. Рассмотрение этого аспекта может помочь извлечь значительно больше информации. Это требует составления индивидуальных уравнений для трех родословных. Имеются компьютерные программы для обсчета таких больших родословных [831]. Результаты подобного машинного расчета приведены в табл. П.9.2. На рис. П.9.5 сравниваются распределения логарифмических шансов при различных частотах рекомбинации для машинного расчета и для раздельного расчета по 11 сибствам. И в этом случае частота рекомбинации оказывается равной ≈ 0,175, но вероятность сцепления при этом теперь в 470 раз больше. Как и ожидалось, при компьютерном анализе удалось извлечь значительно больше информации из имеющихся данных.
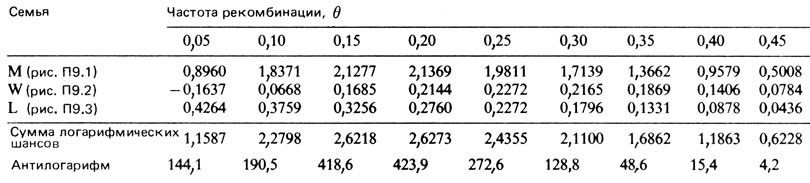
Таблица П.9.2. Логарифмические шансы (при компьютерном анализе) сцепления глазного альбинизма и группы крови Xg
![Рис. П.9.5. Относительная вероятность сцепления между геном глазного альбинизма и группой крови XG. Данные получены с использованием компьютера (верхняя кривая) и с помощью описанного варианта метода логарифмических шансов (нижняя кривая). Нижняя кривая совпадает с приведенной на рис. П.9.4, но вычерчена на другой шкале. Отметим, что компьютер извлек значительно больше информации из этих данных. Частота рекомбинации остается 0,175, но относительная вероятность сцепления в 470 раз выше, чем вероятность отсутствия сцепления [661]](pic/000237.jpg)
Рис. П.9.5. Относительная вероятность сцепления между геном глазного альбинизма и группой крови XG. Данные получены с использованием компьютера (верхняя кривая) и с помощью описанного варианта метода логарифмических шансов (нижняя кривая). Нижняя кривая совпадает с приведенной на рис. П.9.4, но вычерчена на другой шкале. Отметим, что компьютер извлек значительно больше информации из этих данных. Частота рекомбинации остается 0,175, но относительная вероятность сцепления в 470 раз выше, чем вероятность отсутствия сцепления [661]
В 1980 г. Конейлли и Ривас [612а] сформулировали несколько полезных правил для изучения сцепления. Обычно выбирается главный локус, например локус редкого заболевания с аутосомно-доминантным типом наследования, и исследуется наличие сцепления с несколькими другими тестовыми локусами, ответственными за наиболее распространенные системы генетического полиморфизма. Один из родителей должен быть гетерозиготным как по тестовому локусу, так и по главному. Следовательно, тестовые локусы следует выбирать таким образом, чтобы максимизировать информативность браков. Наибольшее количество гетерозигот по тестовому локусу можно ожидать, если частоты двух кодоминантных маркерных аллелей равны или если рецессивный аллель встречается немного чаще доминантного. Изучение сцепления - процедура трудоемкая и дорогостоящая. Иногда можно сохранить время и деньги, если анализ начать со скринирования, используя предварительную информацию для отбора тестовых локусов, а уже затем проводить более детальный анализ. Если известно, что два тестовых локуса относительно тесно сцеплены, то следует изучать только один из них. Например, HLA-тестирование требует много времени и средств. Между тем локус Bf тесно сцеплен с HLA, но его протестировать намного легче. Следовательно, для скринирования следует использовать именно этот локус.
При увеличении числа локусов, которые можно включить в анализ сцепления, шансы установления сцепления возрастают. Например, если локусы равномерно распределены по геному и если анализ сцепления указывает на θ = 0,4 как на максимальное значение частоты рекомбинации, вероятность выявления по крайней мере одного сцепления равна 0,35 при 20 маркерах и 0,5 при 30 маркерах. Дополнительную информацию дает знание о принадлежности маркеров конкретным хромосомам. Например, обнаружение сцепления с редкой кожной аномалией (акрокератоэластоидоз) дает положительные, но статистические незначимые логарифмические шансы для двух маркеров; остальные маркеры дают отрицательные шансы. Обычно больше никаких выводов сделать нельзя. Однако, поскольку ранее для этих двух локусов была установлена принадлежность хромосоме 2, то главный локус также можно приписать этой хромосоме и предположить сцепление с маркерным локусом [688а].
Как упоминалось в разд. 3.4.2, реальное расстояние по карте между двумя локусами можно получить на основе оценки 0 по рис. 3.26. С увеличением плотности генетической карты человека все чаще будет устанавливаться сцепление трех и более локусов. Для оптимального картирования целого района следует объединить оценки частот рекомбинации между парами таких локусов. Правила и формулы для такого многоточечного картирования можно найти в работе [612а].
В последние годы в анализ сцепления вовлекается все большее количество полиморфных систем по сайтам рестрикции (разд. 2.3.3.9). Этот анализ приобретает поэтому все большую ценность в медицинской генетике. При использовании полиморфных сайтов многоточечное картирование станет скорее правилом, чем исключением.
На рис. П.9.6 приведена большая родословная, в которой аутосомно-доминантное заболевание - несовершенный дентиногенез (12550) - сегрегирует вместе с GC-типами белка [559]. Имеются три аллеля GC1S, GC1F и GC2. Полный анализ родословной подразумевает вычисление вероятностей генотипов индивидов, которые не могли быть типированы по маркеру (1.1,2; И. 1,2). Тогда можно подсчитать шансы всей родословной. Этот подсчет труден, но, к счастью, имеется компьютерная программа (LIPED), и детальное описание ее работы можно получить у автора, д-ра Отта [831].
![Рис. П.9.6. Родословная, в которой сегрегируют аутосомно-доминантный ген несовершенного ретиногенеза и ген специфического фактора крови GC [559]. Объяснения и анализ сцепления приводятся в тексте](pic/000238.jpg)
Рис. П.9.6. Родословная, в которой сегрегируют аутосомно-доминантный ген несовершенного ретиногенеза и ген специфического фактора крови GC [559]. Объяснения и анализ сцепления приводятся в тексте
В табл. П.9.3 приведены логарифмические шансы для θМ (частота рекомбинации у мужчин) и θF (частота рекомбинации у женщин). Максимальный логарифмический шанс составляет 7,9238 при θМ = 0,05 для мужчин и θF = 0,25 для женщин. В табл. П.9.4 представлены более подробные расчеты для "критической" области табл. П.9.3: наилучшие оценки θМ = 0,05 и θF = 0,24, логарифмический шанс z = 7,9277.
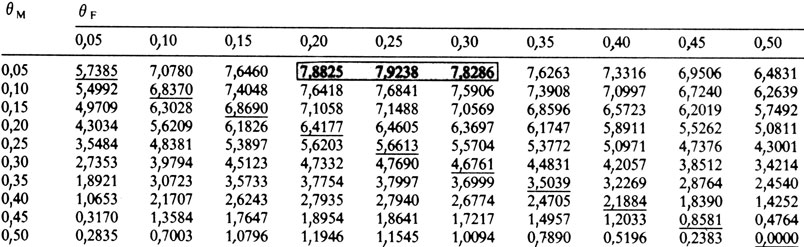
Таблица П.9.3. Родословная с несовершенным дентиногенезом и типами крови GC
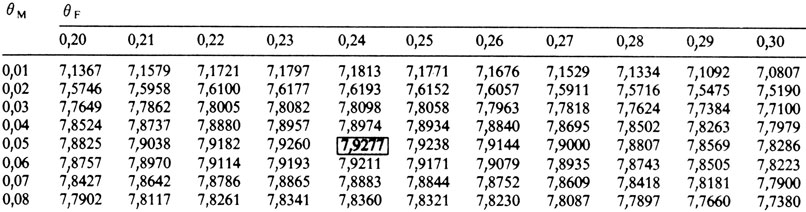
Таблица П.9.4. Часть табл. П.9.3 с более точными делениями
Таблица П.9.5. Методы картирования генов человека и их стандартные обозначения
1. F - анализ расщепления и сцепления признаков в семьях (family studies); так были картированы, например, локусы группы крови AB0 и ногте-надколенного синдрома,
FC - включение в семейный анализ вариантов хромосомного полиморфизма, например, гетерохроматинового района длинного плеча 1-й хромосомы при картировании локусов групп крови Даффи, (Duffy).
2. S - анализ совместной сегрегации клеточных признаков и хромосом в клонированных in vitro гибридных соматических клетках.
3. М - перенос генов в составе микроклеток (microcell mediated), например, при картировании локуса коллагена (COLA1) в хромосоме 17.
4. С - перенос генов в составе хромосомных фрагментов (chromosome mediated), например, при картировании гена галактокиназы с маркером-сопереносчиком - геном тимидинкиназы.
5. R - радиационное облучение клеток человека с последующим "спасением" их от гибели путем гибридизации с необлученными клетками других видов (метод радиационно-индуцированной сегрегации генов в клеточных культурах Госса-Харриса); с помощью этого метода был подтвержден порядок генов в длинном плече Х-хромосомы.
6. А - гибридизация ДНК-РНК или ДНК-ДНК на хромосомах in situ; например, при картировании генов рибосомных РНК в акроцентрических хромосомах и генов легкой каппа-цепи в хромосоме 2.
7. HS - ДНК/к ДНК гибридизация в растворе ("кот-анализ"), например, картирование бета-глобинового гена в хромосоме 11 на основе анализа ДНК, выделенной из клонированных гибридных клеток.
8. RE - рестрикционный анализ и реконструирование физической карты района, например, в случае кластера бета-глобиновых генов (НВВС) в хромосоме lip или в участке физического сцепления трех фибриногеновых генов в 4q или в случае кластера аполипопротеиновых генов АРОА1, АРОСЗ и АР0А4 в 11 q:
а) в комбинации с методом гибридизации соматических клеток, например, в случае НВВС в 11р;
б) в комбинации с сортировкой изолированных хромосом, например, в случае картирования гена инсулина в районе lip; (включая методику LEBO с использованием двулучевого лазерного сортера хромосом и дот-блот-гибридизации как при картировании гена М-фосфорилазы гликогена (PYGM) в 11q).
9. D - картирование с помощью делений (сочетание хромосомной делении и фенотипических признаков гемизиготности), с помощью трисомий (наличие трех аллелей высокополиморфного локуса) и эффекта дозы гена (корреляция трипликации части или всей хромосомы с 50%-ным или большим увеличением активности генного продукта); примеры картирования: кислая фосфатаза-1 (ACPI) в 2р; глутатион-редуктаза (GSR) в 8р. (Метод включает также анализ копийности ДНК как, например, в случае фибриногеновых генов, картированных в сегменте 4q2.)
10. AAS - на основе сравнения аминокислотных последовательностей белков; например, предположение о сцеплении дельта- и бета-глобиновых генов следует из данных по аминокислотной последовательности гемоглобина Лепоре (Lepore), содержащего фрагменты обоих полипептидов; (метод может включать также анализ "гибридной" структуры белка с помощью моноклональных антител; так, вывод о тесном сцеплении локусов MN и Ss был сделан также и на основе изучения лепореподобного варианта антигенов группы крови MNSs).
11. LD - установление факта неравновесия по сцеплению, например, в случае бета- и дельта-глобиновых генов (НВВ, HBD).
12. V - индукция аденовирусом визуально явного изменения морфологии определенного участка хромосомы (изменения, вероятно сходного по феноменологии с "пуффингом" в политенных хромосомах у насекомых и сопровождаемого активацией киназ); таковы примеры сайтов модификации на хромосомах 1 и 17 аденовирусом 12.
13. СН - изменение морфологии хромосомного участка в сочетании с характерным фенотипом, но при неустановленном сцеплении (метод FC) или невыявленных делениях (D) и вирусных модификациях (V); например, отсутствие сегмента 13ql4 в некоторых случаях ретинобластомы. К этой группе методов относится и анализ "ломких" (фрагильных) сайтов в хромосомах. Например, фрагильный сайт в сегменте Xq27 является специфическим маркером одной из форм Х-сцепленной умственной отсталости. Фрагильные сайты полезны как маркеры в семейных исследованиях сцепления, например, FS16q22 и гаптоглобина.
14. ОТ - центромерное картирование, например, по данным о сцеплении фосфоглюкомутазы-3 (PGM3) с центромерой хромосомы 6.
15. ЕМ - исключающее картирование, т. е. сужение возможной области локализации генов путем исключения районов генома, покрываемых картированными делениями. Исключить какие-то районы можно и на основе данных об отрицательных величинах лод-баллов, полученных при анализе сцепления в семьях с маркерными хромосомами и другими картированными локусами; так, например, были получены данные в пользу локализации генов MNSs в районе 4q.
16. Н - на основе установленной гомологии (или эволюционной консервативности) групп генной синтении; правда, в ряде случаев это может привести к ошибочным предположениям как, например, в случае вывода о локализации гена С-полипептида лактатдегидрогеназы (LDHC) в 12р, позже картированного в 11-й хромосоме.
Степень надежности установленной региональной локализации генов в хромосомах или сцепления между двумя локусами оценивается по четырем градациям:
С - (confirmed) "подтверждено": т. е. наблюдалось по крайней мере в двух лабораториях или в нескольких семьях из разных источников;
Р - (provisional) "предварительно" ("пока условно"): т. е. установлено по данным из одной лаборатории или об одной семье;
I - (inconsistent) "противоречиво": т. е. результаты разных лабораторий не согласуются;
T, L - и т. п. - (tentative, in limbo) "сомнительно", "в архив": т. е. установлено менее надежно, чем в случае (Р), но регистрируется по эвристическим соображениям.
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'