
II.4. Модельные объекты и их роль в генетическом анализе
Особую роль в генетическом анализе играют так называемые модельные объекты, работая с которыми исследователь может значительно ускорить и облегчить процесс анализа. Модельным объектом обычно считают организмы, удовлетворяющие большинству требований экспериментатора при решении определенной генетической задачи, прежде всего обеспечивающие большую разрешающую способность анализа.
Впервые внимание к важности модельных объектов в генетических исследованиях привлек И. Г. Мендель. Он посвятил этому вопросу специальный раздел в работе "Опыты над растительными гибридами", так и назвав его: "Выбор подопытных растений". Он писал, что выбор растительной группы, которая будет служить опытам, должен быть сделан с наивозможной осторожностью, если мы не хотим подвергнуть риску самый успех опыта (1965). И далее перечислял качества, особенности растений, удобных для генетических опытов: наличие у них константных альтернативно проявляющихся признаков, хорошая плодовитость гибридов, простота постановки скрещиваний, сравнительно короткий период вегетации.
Со времен Менделя в практику генетических исследований введены многие модельные объекты, которые используются для решения различных генетических задач. Это дрозофила, кукуруза, мышь, арабидопсис, дрожжи, нейроспора, кишечная палочка (Е. coli) и др.
Рассмотрим некоторые эукариотические объекты, наиболее широко используемые в научных исследованиях и учебном процессе, и оценим их возможности и вклад в решение основных задач генетического анализа.
Дрозофила (Drosophila melanogaster)
Род Drosophila относится к семейству Drosophilidae отряда Diptera. К настоящему времени описано более тысячи видов, относящихся к этому роду. Генетически наиболее изучены Dr. melanogaster, virilis, funebris. Дрозофила - один из прекраснейших модельных объектов, обладающий всеми качествами, необходимыми для успешного проведения генетического анализа. С 1909 г. в генетических экспериментах широко используют Dr. melanogaster.
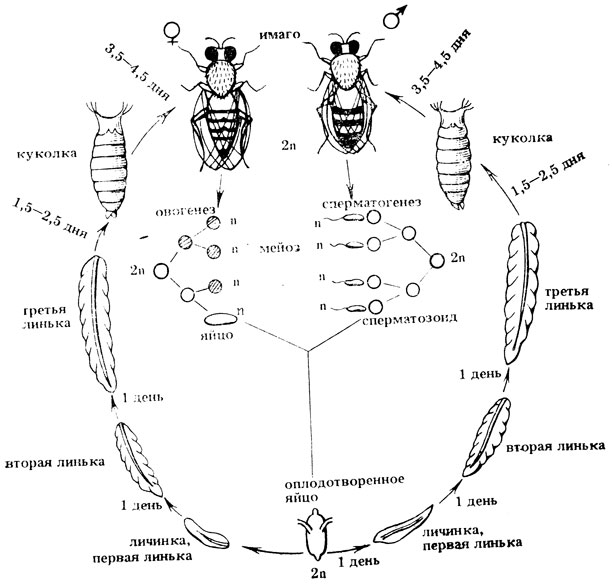
Рис. II.6. Жизненный цикл дрозофилы (Drosophila melanogaster)
Дрозофила - насекомое с полным превращением. В лаборатории при оптимальной температуре (24-25°С) цикл ее развития проходит за 9-10 дней. Продолжительность стадий в этих условиях: яйцо - 1 день, личинка - 4,5-5 дней, куколка - 3,5- 4,5 дней, имаго. Личиночная стадия делится на три возраста - от линьки до линьки, перед окукливанием личинка теряет подвижность (рис. II.6). Вылупившиеся самки в течение 6-12 час не способны к спариванию и оплодотворению, примерно 67% самцов в первые сутки спаривания бывают стерильными. Установлено, что самцы и самки становятся половозрелыми на вторые сутки после вылупления и максимальная половая активность и плодовитость проявляется у 4-5-дневных мух. Для скрещивания используют только неоплодотзоренных (виргинных) самок, так как в семяприемнике оплодотворенной самки в течение нескольких суток (до 2-3 недель) может сохраняться сперма от предыдущей копуляции (длительность ее сохранения зависит от ее жизнеспособности и скорости расходования). Молодые самки и самцы в течение первых 3-4 час после вылета имеют более длинное светлое тело, еще не расправившиеся крылья, сложенные на спинке. В последующие часы девственные самки не отличаются от оплодотворенных. Отбор виргинных самок начинают обычно с первого дня вылета мух - сначала отбирают светлых виргинных самок, затем удаляют из пробирок всех вылетевших мух и дважды в день с интервалом около 10 час отбирают из культур всех вылетевших самок. Самки начинают откладывать яйца на 2-3-й день после вылупления. Число яиц в суточной кладке быстро увеличивается и достигает максимума на 4-5-й день (50-70 яиц в сутки), затем интенсивность кладки медленно уменьшается. Репродуктивный период у самцов продолжается 20-50 дней, у самок - 30-80 дней. За этот период самки способны спариваться до 10 раз, и количество потомков одной самки может достигать 1-3 тыс. Плодовитость мух зависит от плотности популяции и температуры содержания имаго. При высокой плотности культуры отмечено уменьшение плодовитости, причем реакция самок на плотность популяции - генетически обусловленный и изменчивый признак. Максимальная плодовитость проявляется при температуре 24°С, максимум интенсивности откладки при 28°С. С понижением температуры развитие дрозофилы сильно замедляется, так при 10°С оно растягивается до 70 дней и больше. При повышении температуры развитие ускоряется. Однако следует помнить, что при температуре 31° самцы дрозофилы становятся стерильными из-за потери подвижности сперматозоидов, причем их фертильность восстанавливается при перенесении мух в нормальные условия.
Важно знать, что у самцов и самок дрозофилы имеются существенные различия в протекании мейоза. У самок зрелый овоцит I находится на стадии метафазы I, второе деление мейоза осуществляется в оплодотворенном яйце. У самцов в профазе I отсутствуют стадии лептонемы, зигонемы, пахинемы, не образуется синаптонемный комплекс, отсутствуют хиазмы и не идет кроссинговер. Это приводит к тому, что мейотические мутации проявляют свое действие либо только у самцов, либо только у самок.
К несомненным достоинствам дрозофилы следует отнести наличие огромного числа разнообразных мутаций, большинство из которых хорошо проявляется фенотипически, малое число хромосом (2n = 8), простоту разведения.
Не удивительно, что в течение многих лет (примерно до 40-х гг.) дрозофила была основным объектом в теоретических исследованиях и в учебном процессе по генетике. Именно исследования на дрозофиле привели к разработке хромосомной теории наследственности, генетической теории определения пола, выяснению механизмов возникновения мутаций и разработке методов их количественной оценки, а также методов цитологического картирования на политенных хромосомах. На дрозофиле изучали действие радиации и других мутагенных факторов, проведены исследования в области популяционной и эволюционной генетики. Число исследований на дрозофиле вновь резко возросло в последние 10-20 лет в связи с разработкой новых подходов и использованием методов молекулярной биологии, биохимии и генетической инженерии. Это позволило проанализировать содержание и состав ДНК и РНК в метафазных и политенных хромосомах, структуру некоторых генов у дрозофилы. Политенные хромосомы используют для изучения процессов транскрипции и репликации ДНК, а также в филогенетических исследованиях разных видов Diptera. Применение методов фракционирования белков позволяет изучать генетику изоферментов у дрозофилы, на основе которой строятся биохимические карты, изучается регуляция активности генов, контролирующих изоферменты, а также генная активность в онтогенезе. Особый раздел работы на дрозофиле - культивирование эмбриональных клеток и имагинальных дисков - способствует решению проблем генетики соматических клеток и генетики развития. Среди замечательных заслуг дрозофилы следует назвать открытие мобильных генетических элементов (МГЭ) и супермобильных локусов. Можно сказать, что по полноте информации о структуре генома среди высших эукариот дрозофила стоит на первом месте.
Кукуруза (Zea mays Z.)
Кукуруза - один из основных объектов фундаментальных исследований в области генетики и селекции растений. Это раздельнополое однодомное растение из семейства Graminaceae. Ее диплоидный набор хромосом равен 20, хромосомы легко анализируется в световом микроскопе, т. е. удобны для цитогенетического анализа. Простота кастрации (удаление мужских соцветий - метелок), наличие мутаций, вызывающих мужскую стерильность, возможность завязывания семян как при перекрестном опылении, так и при самоопылении, наличие огромного числа разнообразных мутаций облегчает работы по гибридизации. Кроме того, кукуруза имеет высокий коэффициент размножения: пыльцой одного мужского соцветия можно опылить более 100 женских соцветий и получить при этом до 50 тыс. семян; за один день можно осуществить до 100 скрещиваний. Именно поэтому она широко используется не только в научных исследованиях, но и в учебном процессе, так как на ее крупных женских соцветиях (початках) легко и просто проводить анализ расщеплений по признакам семян.
В настоящее время у кукурузы выявлены генные, хромосомные, геномные и цитоплазматические наследственные изменения; наилучшим образом изучены генные мутации. К 1980 г. описано до 450 генов, для 360 из них определены группы сцепления. Изучены и описаны гены, контролирующие поведение хромосом в митозе и мейозе, ферментные системы, образование хлорофилла и других пигментов; структуры и функции вегетативных органов; структуру и окраску эндосперма; регуляторные системы, ответственные за мутабильность и экспрессию других генов, за развитие разных элементов системы размножения, обусловливающих мужскую и женскую стерильность, избирательность оплодотворения и т. д. У кукурузы найдены спонтанные и получены индуцированные различные хромосомные перестройки: нехватки, транслокации, дупликации, инверсии. В последние годы на ней широко используются транслокации для определения групп сцепления. Получены полиплоидные формы кукурузы, и многие из них хорошо изучены. Эуплоидная серия включает гаплоиды, диплоиды, триплоиды, тетраплоиды и др. Встречаются у кукурузы и анеуплоиды - трисомики и моносомики.
На кукурузе впервые наряду с дрозофилой были получены цитологические доказательства кроссинговера и открыты мобильные генетические элементы (Мак-Клинток, 1938, 1950). На ней изучалось влияние длительного инбредирования и эффекты гетерозиса у растений и разрабатывались приемы гибридной селекции на основе получения и скрещивания чистых линий (межлинейные и двойные межлинейные гибриды); хорошо изучены цитоплазматические мутации, особенно мутации, связанные с цитоплазматической мужской стерильностью (ЦМС), использование которой составляет одно из достижений генетики кукурузы и генетики растений в целом.
Дрожжи (Saccharomyces cerevisiae)
Дрожжи - одноклеточные грибы - относятся к классу Ascomycetes. Дрожжевая клетка содержит дискретное ядро, окруженное ядерной мембраной, и другие органеллы (например, митохондрии), а также два типа плазмид. Жизненный цикл включает гапло- и диплофазу. В зависимости от соотношения этих фаз различают гомоталличные дрожжи, у которых гаплоидны только аскоспоры, и гетероталличные с устойчивыми гапло- и диплофазами. Их вегетативные диплоидные клетки (2n = 34) образуются при копуляции гаплоидных клеток противоположных типов спаривания - а и α. Эти клетки неограниченно долго растут и образуют колонии, размножение которых осуществляется почкованием. Вегетативные гаплоидные клетки могут служить в качестве гамет. Для получения гибридов гаплоидные клетки а- и α-типов выращивают в жидкой среде в течение одних суток. Образовавшиеся при этом диплоидные зиготы изолируют из смеси родительских клеток либо микроманипулятором, либо с помощью генетических маркеров на селективных средах. Важно, что смена дипло- и гап-лофаз легко контролируется экспериментально путем переноса диплоидных зигот на бедную среду, содержащую только ацетат "атрия. В этих условиях диплоидная зигота вступает в мейоз, в результате которого образуется 4 гаплоидных аскоспоры, расположенных в сумке случайным образом. Слияние аскоспор противоположных типов спаривания вновь приводит к образованию-диплоидных клеток (рис. II. 7).
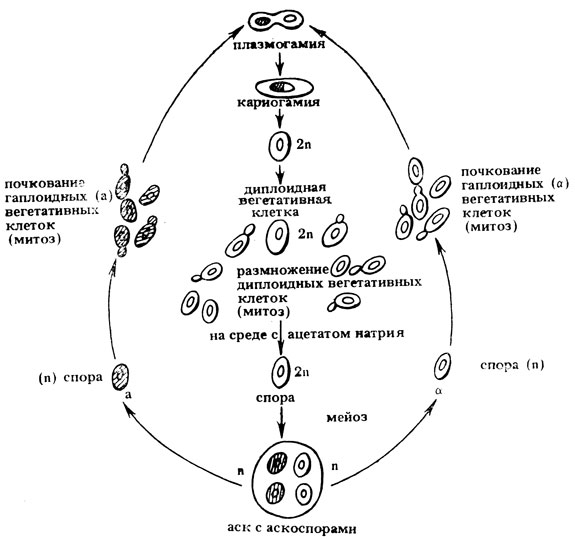
Рис. II.7. Жизненный цикл дрожжей (Saccharomyces cerevisiae)
Для изучения мейотического расщепления выделяют аскоспоры, проращивают их и учитывают фенотипы развившихся от них культур, т. е. регистрация расщепления проводится на гаплоидном уровне. Расщепление анализируется либо на случайной выборке спор, либо методом тетрадного анализа (см. гл. III).
Все штаммы Saccharomyces cerevisiae могут расти как в аэробных, так и в анаэробных условиях, что делает их хорошим объектом для изучения генетики митохондрий. К недостаткам дрожжей можно отнести очень мелкие, практически невидимые в световом микроскопе хромосомы, что исключает возможность проведения на них цитогенетических исследований.
Первые работы по генетике микроорганизмов связаны с дрожжами. Это изучение влияния рентгеновских лучей на изменчивость (Надсон, Филиппов, 1925). С 1937 г. начались систематические работы по гибридизации дрожжей. На них проведено изучение механизмов конверсии генов и разработаны модели рекомбинационного анализа; они используются почти во всех экспериментах по биохимической и молекулярной генетике.
Нейроспора (Neurospora crassa)
Нейроспора - хлебная плесень - многоклеточный гриб, его вегетативное тело состоит из нитей (гифов), переплетение которых образует мицелий. Клетки гриба многоядерны, и ядра гаплоидны, перегородки между стенками клеток мицелия имеют отверстия, так что цитоплазма гриба объединена. На гифах формируются вегетативные споры (конидии) с разным числом ядер: многоядерные макроконидии или одноядерные микроконидии, при прорастании которых вновь образуется мицелий. Таким образом, бесполое размножение нейроспоры осуществляется прорастанием спор. Мицелии диких штаммов способны к неограниченному росту.
На соответствующих средах гриб образует плодовые тела, называемые перитециями.
Для полового размножения необходимо участие двух плесеней противоположных типов спаривания А и а. Половой процесс, носящий название гаметангиомии, осуществляется с участием специализированных клеток - гаметангиев. Женский гаметангий состоит из двух частей - аскогона и тонких длинных волокон - трихогин (от греч. трихос - волос, гине - самка). В качестве мужского гаметангия выступают гаплоидные микроконидии. При оплодотворении конидия по трихогине попадает в аскогон. Гаплоидные ядра после плазмогонии объединяются попарно, образуя дикарион. Из аскогона вырастают аскогенные гифы, в которых ядра дикариона синхронно делятся. На аскогенных гифах в плодовых телах (перитециях) развиваются сумки (аски). После оплодотворения оба гаплоидных ядра существуют некоторое время раздельно и многократно делятся митотически, образуя множество аскогенных гиф. Спустя определенное время кончик каждой аскогенной гифы выпячивается и изгибается. Ядра в ней делятся митотически, и образуются четыре гаплоидных ядра. Затем возникают три клетки, две из них содержат по одному, и одна-два гаплоидных ядра, которые сливаются и образуют диплоидное ядро зиготы. Зигота делится мейотически, при этом в обоих делениях сохраняется ориентация веретена и споры располагаются в определенном (линейном) порядке. Четыре гаплоидные споры еще раз делятся митотически и образуется аск с 8 упорядоченными спорами, расположенными вдоль оси аска (рис. II. 8).
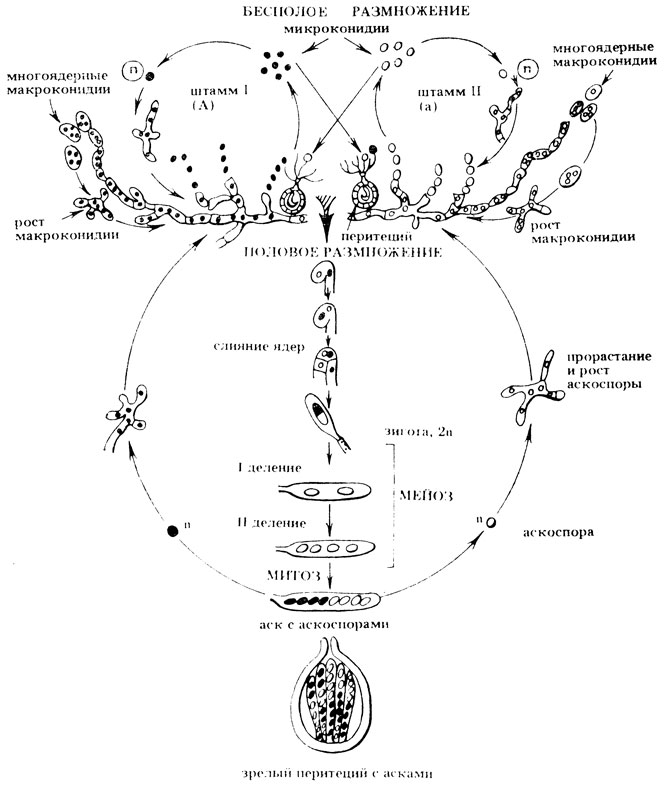
Рис. II.8. Жизненный цикл нейроспоры (Neurospora crassa) Аспергилл (Aspergillus nidulans)
Гифы разных штаммов нейроспоры могут сливаться и образовывать гетерокарион, содержащий ядра разного генотипа, на котором могут формироваться как гомо-, так и гетерокариотические макроконидии, а также микроконидии с генотипами исходных штаммов.
В генетических исследованиях нейроспора появляется в 40-х гг. нашего столетия, и опыты на ней позволяют сформулировать основополагающую гипотезу "один ген - один фермент". На нейроспоре получены прямые доказательства закона чистоты гамет, прохождения кроссинговера на стадии четырех нитей; разработан метод тетрадного анализа, на ней ведется изучение митохондриального наследования; биохимических и молекулярных генетических процессов.
Представитель класса Ascomycetes из семейства Aspergillaceae. Это гомоталлический гриб, половой цикл которого сходен с циклом нейроспоры. Бесполое размножение осуществляется с помощью конидий. Мицелий диких штаммов не способен к неограниченному росту, он образует многочисленные гаплоидные зеленые колонии (n = 8). На питательной среде примерно через 6 час конидии прорастают, и из каждой конидии образуется бесцветная гифа, разделенная на множество клеток с помощью перегородок с отверстиями, через которые ядра могут перемещаться из клетки в клетку. Гифы, переплетаясь, образуют мицелий. Через 20 час начинается созревание мицелия, его ядра увеличиваются, хромосомы большинства клеток становятся политенными. В клетках, в которых не происходит политенизации хромосом, при их дифференцировке возникают особые гифы - конидионосцы. На конце конидионосца формируется пузырек, который отделяется от него перегородкой. При созревании пузырька образуются выросты - одноядерные клетки (первичные стеригмы). Последние образуют одну или две вторичные одноядерные стеригмы, при делении которых формируется шарообразная конидия. После 100 делений возникают цепочки одноядерных конидий, которые постепенно стареют, меняя цвет, и отмирают. Но многие из них сохраняют жизнеспособность в течение нескольких лет. Цепочки конидий образуют колонообразную головку. Гифы разных мицелиев могут срастаться, при этом образуется гетерокарион, содержащий ядра разных генотипов. Если конидионосец формируется на гетерокариотическом мицелии, то образующиеся цепочки конидий могут быть генетически и фенотипически различными (так как в каждую конидиогенную клетку попадает только одно ядро), например, зелеными и белыми.
Половой процесс у аспергилла протекает на среде, содержащей мало азота и много восстановителей. При этом формируются половые органы - спирально закрученные, короткие гифы, при слиянии которых возникает двуядерная клетка, от которой отходят многочисленные аскогенные гифы. Ядра в этих гифах делятся митотически и после деления остаются рядом. Аскогенные гифы обрастают мицелием и превращаются в примордий, развивающийся в клейстотеций, в котором формируются аски. Гаплоидные ядра родоначальников асков сливаются и сразу же происходит мейоз, образуется 4 гаплоидных дочерних ядра, которые делятся митотически и превращаются в аскоспоры, расположенные в аске беспорядочно. Количество асков в зрелом клейстотеций может колебаться от 10 до 100 000 (рис. II. 9).
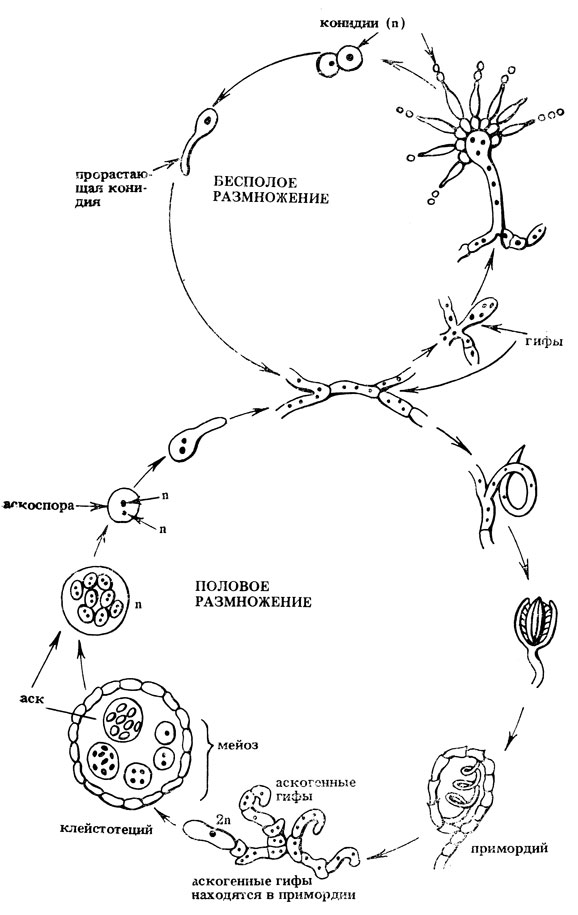
Рис. II.9. Жизненный цикл аспергилла (Aspergillus nidulans)
На аспергилле Понтекорво с сотрудниками (1952) открыл парасексуальный процесс, доказав существование митотической рекомбинации. Это дало возможность использовать парасексуальный процесс в генетическом анализе не только на аспергилле, но и на других грибах. На аспергилле впервые был разработан специальный метод картирования с использованием гаплоидизации гетерозиготных диплоидов, на нем применяют те же методы генетического анализа, что и на других микроорганизмах - анализ случайной выборки спор, митотической сегрегации и др.
Следует указать, что для каждого генетического объекта создается своя собственная генетическая номенклатура, символика, с помощью которой обозначаются доминантные и рецессивные мутации, хромосомные перестройки, записываются генотипы линий и штаммов. Объем настоящего пособия не позволяет привести генетическую номенклатуру модельных объектов, с ней можно ознакомиться в литературе, приведенной в конце главы.
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'