
X.2.1. Грибы-аскомицеты как тест-системы для выявления и учета рецессивных мутации
В качестве тест-систем используют дрожжи, нейроспору, аспергилл. Преимущества их применения для оценки частоты разных типов генных мутаций состоят в высокой разрешающей способности генанализа, сопоставимой с разрешающей способностью у прокариот. Она обусловлена возможностью получения очень больших выборок (108-109 и более клеток) и использования селективных методов для выделения мутантных клеток, что позволяет создавать скрининг-тесты.
С помощью грибных тест-систем можно изучать частоту спонтанных мутаций разных генов, летальное и мутагенное действие УФ, радиации, азотистой кислоты, алкилирующих соединений и др.; они позволяют проводить отбор и идентификацию биохимических (ауксотрофных) мутаций, мутаций резистентности к различным факторам - температуре, антибиотикам и пр.; определять частоты обратного мутирования.
Широко используются ауксотрофные мутации в генетических исследованиях на дрожжах. Для их выделения из популяции прототрофных клеток чаще всего применяют метод реплик или отпечатков, предложенный Ледербергами в 1952 г. Колонии с испытуемых чашек с помощью репликатора переносят на полную и минимальную среды. Колонии, растущие на полной, но не растущие на минимальной среде, отбирают как ауксотрофные. Идентификацию ауксотрофных мутантов проводят с помощью селективных сред, представляющих собой минимальные среды с добавкой каких-либо факторов роста: аминокислот, витаминов, азотистых оснований. Например, метод Холлидея (Holliday, 1956) позволяет определить потребность мутантов в 36 ростовых факторах. Для этого мутантов высевают на 12 чашек с селективными средами, сочетания ростовых факторов в которых представлены в табл. X.1.
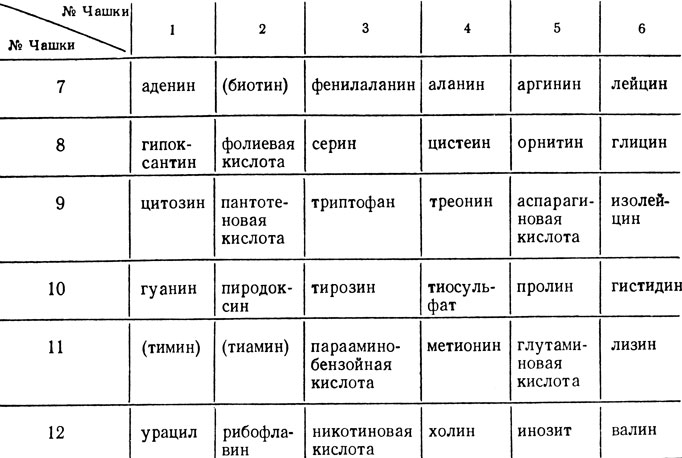
Таблица X.1. Сочетания факторов роста для идентификации ауксотрофных мутантов (метод Холлидея)
Примечание: в скобках даны вещества, входящие в состав минимальной среды для дрожжей-сахаромицетов, а также не усваиваемые дрожжами.
Мутантные колонии вырастают только на одной из чашек по горизонтали (1-6) и на одной - по вертикали (7-12). Например, аукострофный мутант, для роста которого необходим гуанин,- на 1-й и 10-й чашках.
Количество мутаций определяют на селективной, а общее число жизнеспособных клеток - на стандартной полной среде. Частота возникновения мутантов вычисляется как отношение числа колоний, выросших на селективной среде, к общему числу жизнеспособных клеток на полной среде (с учетом разведения клеток). Для учета мутаций некоторых генов на дрожжах используют также окраску колоний. Например, у ауксотрофных мутантов, у которых блокирован один из последних этапов синтеза аденина, происходит накопление красного пигмента и формируются колонии красного цвета. На этом основана тест-система по выявлению таких мутантов - "от белого к красному". Другие мутанты, нарушающие ранние этапы синтеза аденина, образуют белые колонии. Тест "от красного к белому" позволяет обнаруживать этих мутантов среди аденин-зависимых красных мутантов.
По окраске колоний обнаруживают также мутантов, утративших способность сбраживать лектозу: на соответствующей индикаторной среде (ЕВМ-агар) колонии мутантов окрашены в белый, а колонии дикого типа - в красный цвет.
Принадлежность фенотипически сходных мутантов к одному или разным генам определяется с помощью теста на аллелизм.
У нейроспоры на гетерокариотическом мицелии при вегетативном размножении образуются многоядерные макроконидии. В одном из их ядер может возникнуть рецессивная летальная мутация, которая обнаруживается только в гомокарионе.. Для ее выявления используют тест Этвуда (Atwood, 1953). Получают гетерокарион с ядрами двух типов. Одни содержат ауксотрофную мутацию по какому-либо фактору роста (например, по лизину) и видимую рецессивную мутацию (а), обусловливающую медленный рост гомокариона на полной среде, в результате чего образуются амицелиальные колонии, похожие на дрожжевые. Другие ядра маркированы ауксотрофной мутацией по другому фактору роста (например, по гистидину). Макроконидии, образующиеся на таком мицелии, бывают двух типов: гомокариотические и гетерокариотические, в одной из которых может возникнуть рецессивная летальная мутация, например, в лизинзависимом ядре. Каждую конидию высевают на минимальную среду, на которой растут только гетерокариотические конидии, вновь образуя гетерокарион, в одной из клеток которого оказываются ядра с рецессивной леталью. Чтобы получить гомокарион с леталью, макроконидии из каждой культуры отдельно высевают на селективную среду, содержащую фактор роста, необходимый для прорастания гомокариона, образующего амицелиальные колонии (в нашем примере на среду с лизином). На этой среде гетерокариотические конидии образуют нормальные мицелиальные и амицелиальные (гомокариотические по лизину) колонии. Гомокариотические конидии, в которых сохранится гистидинзависимое ядро, на ней не прорастают. Если в какой-либо из гетерокариотических конидий в лизинзависимом ядре содержится рецессивная летальная мутация, то на селективной среде не будут расти и амицелиальные гомокариотические конидии. Таким образом, отсутствие амицелиалъных колоний на селективной среде свидетельствует о наличии рецессивной мутации в лизинзависимом ядре. Частота летальных мутаций определяется как доля культур без амицелиальных колоний от общего числа проанализированных культур. Используя этот метод, можно исследовать весь геном на возникновение рецессивных летальных мутаций как при индуцированном, так и при спонтанном мутагенезе (рис. Х.5).
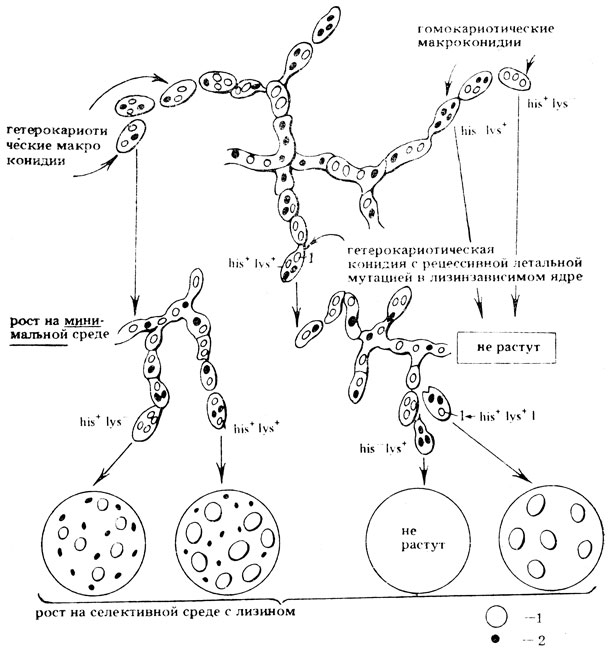
Рис. Х.5. Тест Этвуда на рецессивные летали у нейроспоры 1 - нормальные мицелиальные колонии, 2 - амицелиальные колонии. Отсутствие амицелиальных колоний свидетельствует о наличии рецессивной летальной мутации в лизинзависимом ядре
Для выявления и учета обратных мутаций (истинных реверсий или супрессорных мутаций) клетки ауксотрофных штаммов выращивают на средах без необходимых факторов роста и подсчитывают выросшие на них колонии, которые растут только благодаря образованию обратных мутаций. Частоту мутаций при этом определяют как отношение числа мутантов или к числу исходно высеянных, или к числу выживших клеток. Этот скрининг-метод применим к любым микроорганизмам, а также к клеткам млекопитающих.
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'