
3.2. Первый уровень организации хроматина - 100 Å-нуклеосомная фибрилла
Открытие нуклеосом [89-92]. В 1973 г. Д. Хьюиш и Л. Буржойн (Австралия), переваривая хроматин эндогенной нуклеазой ядер при низкой ионной силе в присутствии ионов Mg и Ca и затем исследуя размеры получаемых фрагментов с помощью электрофореза в полиакриламидном геле, сделали наблюдение огромной важности. Оказалось, что получаемые при этом фрагменты ДНК образуют при электрофорезе серию дискретных полос с размерами, кратными примерно 200 п. н. Тем самым авторы открыли существование в хроматине дискретных повторяющихся единиц, выщепляемых нуклеазой (рис. 12). Вслед за тем К. Ван Хольде (США) расфракционировал ядерный экстракт, подвергнутый нуклеазному гидролизу ультрацентрифугированием в сахарозном градиенте, и выделил частицы с коэффициентом седиментации около 11S, равно как и серию более крупных частиц, по своим седиментационным характеристикам напоминавшим олигомеры US-частиц. Одновременно А. Олинс и Д. Олинс (США), исследуя в электронном микроскопе препараты хроматина, обнаружили, что в определенных условиях хроматиновые фибриллы выглядят как тонкие нити с сидящими на них бусинами ~10 нм в диаметре (см. рис. 12). Наконец, Р. Корнберг (Кембридж, Великобритания) проанализировал состав частиц и показал, что каждая частица содержит отрезок ДНК длиной 150-200 п. н. и 8 молекул гистонов: по две молекулы гистонов H2a, H2b, H3 и H4. Эта частица была позднее названа "нуклеосомой". Нуклеосомы можно получить, переваривая хроматин не только эндогенной нуклеазой, но и легко доступной нуклеазой стафилококков. Позднее нуклеосомы получали и с помощью других нуклеаз, в частности с помощью ДНКазы I и ДНКазы II.
Нуклеосомы и гистон H11* [93-95]. После открытия нуклеосом на повестку дня встал вопрос о месте гистона HI в структуре нуклеосом.
Этот вопрос к тому моменту интенсивно исследовался в нашей лаборатории. Дело в том, что еще в 1967 г. мы с Ю. В. Ильиным обнаружили, что гистон HI резко отличается от остальных по своему влиянию на свойства ДНП. В этой работе проводилось ступенчатое удаление гистонов при постепенном повышении солевой концентрации в экстрагирующих растворах. Оказалось, что уже в 0,6 М NaCl ДНП переходит в раствор, хотя при этом удаляется лишь небольшая часть всех гистонов, а именно гистон HI. Более того, освобожденный от гистона H1 ДНП (обозначенный как ДНП0,6) становится растворимым и при физиологических концентрациях солей (в 0,14 М NaCl). Однако ДНП0,6 вновь становился нерастворимым, агрегировал, если к нему добавляли гистон HI в эквимолярном соотношении и снижали концентрацию NAC1 с 0,6 М до 0,14 М.
![Рис. 12. Разные способы выявления нуклеосом. а - электрофорез в полиакриламидном геле ДНК, выделенной из хроматина клеток асцитного рака Эрлиха после его гидролиза микрококковой нуклеазой. Видна лестницца из дискретных фрагментов с размерами, кратными 200 п. н.; б - электронная микроскопия препаратов хроматина клеток асцитного рака Эрлиха после мягкой нуклеазной обработки. Препараты получены методом напыления. Видны вытянутые фибриллы с нуклеосомами (У) и фибриллы в форме зигзага (2) Размер нуклеосом составляет ~ 100 А в диаметре; в - разделение моно- и олигонуклеосом ультрацентрифугированием в сахарозном градиенте. Клетки асцитного рака Эрлиха метили [3H]-тимидином (ДНК) и [14С]-аминокислотами (белки) выделяли хроматин и после обработки микрококковой нуклеазой ультрацентрифугировали материал в сахарозном градиенте. Хорошо видны пики моно- (1), ди- (2) и три- (3) нуклеосом (по результатам, полученным В. В. Бакаевым и соавт.)](pic/000018.jpg)
Рис. 12. Разные способы выявления нуклеосом. а - электрофорез в полиакриламидном геле ДНК, выделенной из хроматина клеток асцитного рака Эрлиха после его гидролиза микрококковой нуклеазой. Видна лестницца из дискретных фрагментов с размерами, кратными 200 п. н.; б - электронная микроскопия препаратов хроматина клеток асцитного рака Эрлиха после мягкой нуклеазной обработки. Препараты получены методом напыления. Видны вытянутые фибриллы с нуклеосомами (1) и фибриллы в форме зигзага (2). Размер нуклеосом составляет ~ 100 А в диаметре; в - разделение моно- и олигонуклеосом ультрацентрифугированием в сахарозном градиенте. Клетки асцитного рака Эрлиха метили [3H]-тимидином (ДНК) и [14С]-аминокислотами (белки) выделяли хроматин и после обработки микрококковой нуклеазой ультрацентрифугировали материал в сахарозном градиенте. Хорошо видны пики моно- (1), ди- (2) и три- (3) нуклеосом (по результатам, полученным В. В. Бакаевым и соавт.)
Действие гистона HI было специфическим. Требовалось добавить гораздо большее количество какого-либо другого гистона, чтобы получить тот же самый эффект. Был сделан вывод, что гистон H1 играет особую роль в организации структуры хроматина, вызывая его резкую конденсацию, особенно при физиологических солевых концентрациях. Эти результаты нашли потом многочисленные подтверждения в работах других авторов, использовавших различные физические методы для регистрации конденсации хроматина.
Естественно, что после открытия нуклеосом мы вновь вернулись к вопросу о месте гистона H1 в структуре хроматина. В. В. Бакаев и А. Я. Варшавский проверили, существуют ли нуклеосомы в препаратах хроматина, лишенных гистона H1, т. е. в ДНП0,6, и обнаружили их там. Далее они разработали новый подход к фракционированию нуклеосом - электрофорез в полиакриламидном или агарозном гене в неденатурирующих условиях при низкой ионной силе. При агарозном электрофорезе хорошо разделяются моно-, ди- и тринуклеосомы, гораздо лучше, чем при ультрацентрифугировании в сахарозном градиенте. Более того, каждый из компонентов, в свою очередь, дает по нескольку полос (рис. 13).
Чтобы определить, за счет чего возникают эти дополнительные полосы, был разработан вариант двумерного электрофореза. В первом направлении разделение велось, как описано выше, а затем гель обрабатывали детергентом, додецилсульфатом натрия (ДСН), разрушающим нуклеопротеидные комплексы; во втором направлении разгонка велась в присутствии ДСН. После окончания электрофореза определялось положение ДНК и белка. Оказалось, что наиболее быстро бегущая полоса мононуклеосом, названная МН-1 (мононуклеосома 1), содержит ДНК длиной 145 п. н. и по две молекулы гистонов H2a, H2b, H3 и H4, т. е. гистоновый октамер. Следующие компоненты - МН-2 и МН-3 - содержат ДНК длиной 165 и 195 п. н. и все гистоны, включая и гистон H1. Таким образом, нуклеосома может либо содержать, либо не содержать гистон H1, но в последнем случае размеры ДНК оказываются меньшими по сравнению с полным повторяющимся элементом ДНК (см. рис. 13).
![Рис. 13. Выявление субфракций мононуклеосом с помощью электрофореза в неденатурирующих условиях. а - разделение мононуклеосом на три фракции путем электрофореза гидролизата хроматина микрококковой нуклеазой в полиакриламидном геле в 1 мМ ЭДТА, рН 7,8, мн - мононуклеосомы, дн - динуклеосомы; б - анализ гистонового состава мононуклеосом с помощью двумерного электрофореза. Клетки асцитного рака Эрлиха метили [14С]-аминокислотами. Гидролизат хроматина разделяли в направлении 1 в неденатурирующих условиях, а в направлении 2 - в присутствии додецилсульфата натрия. Белки выделяли по метке с помощью флюорографии. Видно, что МН-1 не содержат гистона HI, а МН-2 и МН-3 содержат (по результатам, полученным В. В. Бакаевым и соавт.)](pic/000019.jpg)
Рис. 13. Выявление субфракций мононуклеосом с помощью электрофореза в неденатурирующих условиях. а - разделение мононуклеосом на три фракции путем электрофореза гидролизата хроматина микрококковой нуклеазой в полиакриламидном геле в 1 мМ ЭДТА, рН 7,8, мн - мононуклеосомы, дн - динуклеосомы; б - анализ гистонового состава мононуклеосом с помощью двумерного электрофореза. Клетки асцитного рака Эрлиха метили [14С]-аминокислотами. Гидролизат хроматина разделяли в направлении 1 в неденатурирующих условиях, а в направлении 2 - в присутствии додецилсульфата натрия. Белки выделяли по метке с помощью флюорографии. Видно, что МН-1 не содержат гистона HI, а МН-2 и МН-3 содержат (по результатам, полученным В. В. Бакаевым и соавт.)
В опытах других авторов было найдено, что 145 п. н. - это минимальный размер нуклеосомной ДНК. При дальнейшем переваривании нуклеазами происходит разрушение нуклеосом. Поэтому частицы с ДНК 145 п. н. были названы "сердцевинами нуклеосом" ("core particles"). Очевидно, что они содержат только гистоновый октамер (т. е. 8 молекул гистонов H2a, H2b, H3 и H4). Они же соответствуют бусинам на электронных микрофотографиях. В их состав гистон HI не входит.
Частицы размером ~ 195 п. н. соответствуют полным нуклеосомам, т. е. они включают в свой состав не только сердцевину, но и область между бусинами, линкер (соединитель), и в них уже присутствует гистон HI (одна молекула на нуклеосому), который, очевидно, взаимодействует с областью линкера. Таким образом, гистон HI действительно занимает особое структурное положение в нуклеосоме, не входя непосредственно в сердцевину последней. Размеры полной нуклеосомы могут варьировать у разных видов и в разных тканях.
Структура нуклеосомы [96-101]. Основные данные о строении нуклеосомы получены с помощью четырех методических подходов:
- рентгеноструктурного анализа относительно низкого разрешения кристаллов сердцевин нуклеосом (проведенного А. Клюгом, Великобритания);
- изучения контактов ДНК с гистонами с помощью методов пришивки к ДНК, разработанных и использованных А. Д. Мирзабековым и сотр.;
- анализа гистоновых контактов с помощью обычных методов сшивки белков бифункциональными агентами;
- детального изучения характера переваривания ДНП нуклеосом различными нуклеазами, прежде всего ДНКазой I.
Подходы 1 и 4 позволили понять расположение ДНК в нуклеосоме. Согласно данным рентгеноструктурного анализа, ДНК наматывается на поверхность гистоновой глобулы, октамера, образуя примерно 1,5 негативных супервитка в составе сердцевинной частицы. Данные рентгеноструктурного анализа объясняют наблюдения по характеру переваривания ДНК сердцевины ДНКазой I, вносящей в ДНК одноцепочечные разрывы. Оказалось, что ДНКаза I разрезает ДНК в составе нуклеосом по местам, расположенным на расстоянии 10 п. н. друг от друга, причем две цепи ДНК рассекаются не в одних и тех же точках, но со сдвигом. Это легко объясняется, если допустить, что при наматывании на октамер ДНК взаимодействует с последним одной своей стороной и что шаг двойной спирали ДНК в нуклеосоме составляет 10 п. н. Тогда через каждые 10 нуклеотидов одна из цепей ДНК будет занимать наружное положение, удобное для атаки ДНКазой I.
Локализация гистонов относительно ДНК была установлена в работах А. Д. Мирзабекова и сотр. Для этого изолированные сердцевины или полные нуклеосомы обрабатывали диметилсульфатом в условиях, когда он реагировал с небольшим числом пуриновых оснований ДНК. При последующей обработке эти метилированные пурины отщеплялись, и освободившаяся альдегидная группа дезоксирибозы взаимодействовала с основными аминокислотами белка. ДНК при этом расщеплялась. В результате образовывался комплекс 5'-концевого фрагмента ДНК с белком, пришитым к его З'-концу. Полученные ковалентно связанные комплексы ДНК и индивидуальных гистонов разделяли электрофорезом в полиакриламидном геле. Затем разрушали либо ДНК, либо белок и вели электрофорез в другом направлении. В результате можно было определить с высокой точностью природу гистона, вошедшего в комплекс, и длину ДНК от ее 5'-конца в нуклеосоме до места контакта с данным гистоном.
Структура нуклеосомы, полученная таким образом, изображена на рис. 14. Не вдаваясь в детали, отмечу, что на каждой из цепей ДНК контакты ДНК с гистонами идут с интервалами в 10 п. н. и расположены в двойной спирали напротив участков другой цепи, чувствительных к ДНКазе I. Каждый гистон образует несколько контактов с ДНК. В целом контакты гистонов H3 и H4 располагаются преимущественно в центре, а гистонов H2a и H2b - по краям нуклеосомной ДНК. Гистон H1 в основном образует наиболее периферийные контакты, захватывающие область линкера.
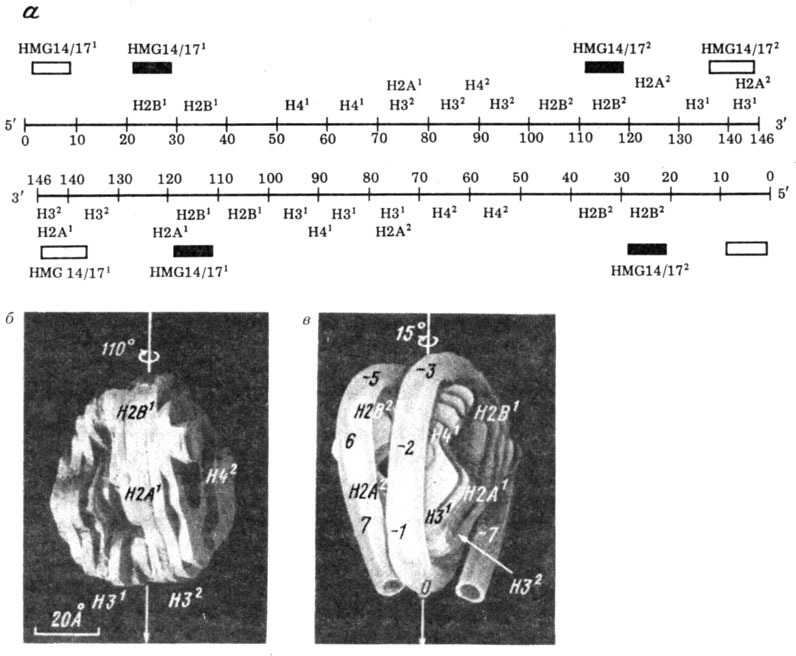
Рис. 14. Структура нуклеосомы. а - расположение контактов ДНК с различными гистонами и HMG-белками вдоль цепи ДНК в сердцевине нуклеосомы по данным анализа местоположений ДНК-белковых сшивок, индуцированных диметилсульфатом (по результатам, полученным А. Д. Мирзабековым и соавт.); б-в - модель нуклеосомы Клуга, построенная на основании данных β-рентгеноструктурного анализа и результатов А. Д. Мирзабекова: б - белковый октамер; в - октамер с навитой на него ДНК; вид под разными углами
Сопоставив собственные данные рентгеноструктурного анализа, данные о ДНК-гистоновых контактах и менее информативные данные о гистон-гистоновых сшивках, Клуг предложил пространственную модель нуклеосомы, которая, по-видимому, не очень далека от истины. ДНК в В-форме (шаг спирали 10 п. н.) намотана на дисковидный октамер, в котором для этого имеются соответствующие борозды.
В центральной части ДНК находятся гистоны H3 и H4, а на периферии - гистоны H2a и H2b. Структура обладает симметрией 2-го порядка (см. рис. 14). Нуклеосомный диск имеет ПО А в диаметре (именно по его окружности намотана ДНК) и 57 А в высоту.
100 Å-нуклеосомная фибрилла. При очень низкой ионной силе и в отсутствие двухвалентных катионов хроматин выглядит как фибриллы с бусинами, находящиеся на расстоянии 100-200 Å. Часто бусины располагаются в форме зигзага. Так же выглядит хроматин, лишенный гистона H1, даже и при более высоких концентрациях солей.
При повышении ионной силы в препаратах, содержащих H1, происходит структурный переход, заключающийся в формировании равномерной фибриллы диаметром 100 Å, в которой нуклеосомы тесно прилегают друг к другу, и линкеры практически неразличимы. Вероятно, октамеры, слипаясь своими свободными от ДНК поверхностями, образуют сплошной белковый тяж, на который намотана ДНК, в том числе и линкерная. Таким образом, на каждую полную нуклеосому придется по два витка ДНК. По всей вероятности, in vivo нуклеосомы в основном образуют такую 100 Å-фибриллу.
В лаборатории А. Д. Мирзабекова с помощью описанных выше методов изучалась организация не только нуклеосом, но и спейсера. Кроме гистона H1, в его упаковке принимает участие гистон H3, а иногда и гистон H2b. Регулярное расположение сердцевины нуклеосомы в спейсере, при котором размеры его всегда кратны 10 п. н., обеспечивает образование непрерывной суперспирали ДНК.
Поскольку диаметр ДНК составляет 20 Å то, следовательно, диаметр 100 Å-фибриллы превышает его в 5 раз. В то же время линейные размеры структуры сокращаются в 7 раз, т. е. происходит 7-кратная компактизация ДНК.
Фазирование нуклеосом1* [102-107]. Важен и широко дискутируется вопрос о том, локализованы ли нуклеосомы в определенных местах ДНК или они распределяются случайным образом, если же не случайно, то какие законы управляют их связыванием с ДНК. По данному вопросу проведено много исследований, но результаты остаются противоречивыми, и, по-видимому, ответ не является однозначным.
Одним из экспериментальных подходов к изучению вопроса был разработан нами с С. А. Недоспасовым и К. Ву (США). Это метод анализа локализации разрыва в ДНК с помощью гибридизационного картирования. В западной литературе метод называют "indirect end labeling" (непрямая метка концов). Хроматин подвергают ограниченному гидролизу нуклеазой. После этого выделяют из него ДНК и обрабатывают рестриктазой, расщепляющей ДНК недалеко от той области генома, которую исследуют. ДНК подвергают электрофорезу, переносят на нитроцеллюлозный фильтр и гибридизуют с меченой пробой. Эта проба представляет собою небольшой рестриктный фрагмент (длиной 200-400 п. н.), прямо прилежащий в геноме к вышеупомянутому рестриктному сайту, рядом с которым располагается исследуемая зона. Определив далее размеры фрагментов, гибридизующихся с пробой, можно точно локализовать места, по которым нуклеаза расщепляет ДНК в составе хроматина (рис. 15).
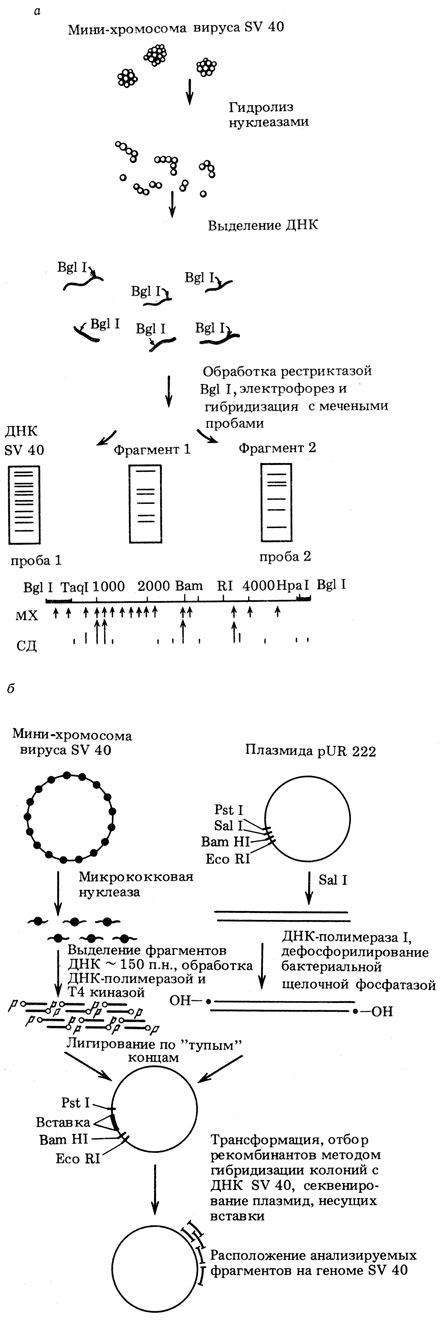
Рис. 15. Схема экспериментальных подходов к изучению расположения нуклеосом на ДНК в хроматине на модели мини-хромосомы SV40. а - метод гибридизационного картирования нуклеазных разрывов. В данном случае ДНК расщепляли эндонуклеазой BgII, вносящей один разрыв в ДНК SV40, и гибридизовали либо с тотальной ДНК (SV40), либо с короткими пробами, которые прилежат с двух сторон к сайту рестрикции Bgll. На основе проведенных опытов была составлена карта разрывов микрококковой нуклеазой ДНК SV40 в составе мини-хромосомы (MX) или свободной ДНК в растворе (СД). Видно частичное, но не полное перекрывание этих карт; б - метод молекулярного клонирования нуклеосомных сердцевин. Таким образом было проанализировано около 300 нуклеосом из мини-хромосомы SV40 (по результатам, полученным С. А. Недоспасовым, А. С. Шаховым и автором)
Недостатком метода является, однако, то, что и свободная ДНК расщепляется нуклеазами неравномерно, и в свободной ДНК есть точки предпочтительной первичной атаки нуклеазами, причем ни одна из известных пока нуклеаз не является исключением. Поэтому в опытах по гибридизационному картированию разрывов надо всегда тщательно сравнивать результаты, полученные на хроматине и на свободной ДНК. Иногда они совпадают, иногда - нет. Только в последнем случае можно делать вывод, что эти разрывы отражают организацию хроматина. Сейчас разработаны новые методы химического расщепления ДНК, которые менее чувствительны к ее структуре и могут быть использованы более успешно.
Другой методический подход, разработанный в нашей лаборатории С. А. Недоспасовым и А. Н. Шаховым, приложим к участкам ДНК с известной нуклеотидной последовательностью. Он состоит в анализе клонированных нуклеосомных фрагментов ДНК. Опыты велись, как и в первом случае,на мини-хромосоме SV40. Ее подвергали расщеплению микрококковой нуклеазой и затем убирали концы ДНК с помощью экзонуклеазы и нуклеазы S1, с тем чтобы получить только сердцевины нуклеосом. Выделенную ДНК клонировали в плазмиде и получали большое число клонов. Каждый клон содержал в виде вставки отрезок ДНК длиной около 145 п. н., соответствующий той или иной нуклеосоме. Далее можно либо определить первичную структуру большого числа вставок, либо предварительно с помощью гибридизации отобрать колонии, соответствующие той или иной области генома, и изучать только их (см. рис. 15). Поскольку нуклеотидная последовательность генома SV40 известна, то достаточно выяснить распределение во вставке только одного нуклеотида. Так, мы изучали распределение по длине ДНК только одного Т, а затем по соответствующим таблицам находили место генома, которому соответствует данный клон.
Результаты наших опытов с использованием обоих подходов показали, что разные области генома SV40 различаются по своим свойствам. В некоторых из них имеются четко выраженные предпочтительные места локализации нуклеосом. В других областях, наоборот, нуклеосомы располагаются более или менее случайно. В области, где положение нуклеосом наиболее фиксировано, можно тем не менее выявить не один, а три основных варианта их расположения вдоль ДНК, т. е. и здесь ситуация не полностью однозначна.
Сходные работы были выполнены в лаборатории Г. Цахау (ФРГ) на различных сателлитных ДНК. Было показано, что ДНК "фазирована", но число возможных рамок достаточно велико. В наиболее хорошо изученной α-сателлитной ДНК зеленой мартышки число рамок равно восьми. Таким образом, нуклеосомы могут образовываться в разных местах ДНК. Есть, однако, и случаи, когда положение нуклеосом в определенных участках ДНК в хроматине более или менее однозначно, например в спейсере некоторых гистоновых генов.
Что же в таком случае определяет положение нуклеосом? Таких факторов может быть несколько.
Один из таких факторов - негистоновые белки, узнающие и прочно связывающиеся с определенными последовательностями ДНК. Например, в центромерах у дрожжей, т. е. в областях хромосом, с которыми при митозе взаимодействуют нити веретена, располагаются белки, прочно связывающиеся с отрезком ДНК около 150 п. н. длиной. Этот участок ДНК полностью защищен от действия нуклеаз. Непосредственно рядом с ним, в обе стороны от защищенного участка, нуклеосомы строго фазированы, занимая лишь одно положение. Этот феномен можно обозначить как феномен "стенки". Чем ближе к стенке, тем более фазированы нуклеосомы.
Другим фактором, определяющим положение нуклеосом, является степень гибкости ДНК, которая, в свою очередь, является функцией от нуклеотидной последовательности. Имеется много расчетных работ по гибкости ДНК, но они пока носят гипотетический характер. Постепенно накапливаются и более строгие данные, вытекающие из анализа трехмерной структуры ДНК. Места, где ДНК гнется сильнее, вероятно, будут предпочтительны для формирования нуклеосом. В то же время есть участки ДНК, которые вообще не способны образовывать нуклеосомы. Так, ДНК типа поли(dA)/поли(dT) или ДНК в Z-форме не образуют нуклеосом.
Если в ДНК встречаются подобные типы последовательностей, то они будут определять фазирование нуклеосом в этой области и отчасти в прилежащих. При реконструкции нуклеосом из ДНК и гистонов в таких областях воссоздается исходная организация. В тех же местах фибриллы, где первый и второй факторы фазирования отсутствуют, можно ожидать более или менее случайное распределение нуклеосом вдоль ДНК.
В настоящее время нет никаких указаний на функциональное значение фазирования нуклеосом. Возможно, что характер их расположения вдоль ДНК не имеет функционального значения. Это, конечно, не касается участков хроматина, которые вообще не содержат нуклеосом и о которых пойдет речь в гл. 4.
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'