
3.3.1*2* Второй уровень организации хроматина: соленоид или нуклеомер
Литература: [108-113]
Еще в ранних электронно-микроскопических работах Г. Риса (США) было установлено, что в ядрах ДНК входит в основном в состав фибрилл с диаметром 250-300 Å, что, очевидно, существенно превышает диаметр нуклеосомной фибриллы. Позднее Ю. С. Ченцов (МГУ) показал, что при низкой ионной силе в отсутствие Mg + в ядрах с помощью электронной микроскопии выявляются 100 Å-фибриллы, но при увеличении ионной силы или добавлении ионов Mg2+ они переходят в более толстые, 300 Å-фибриллы, состоящие из периодических утолщений и перетяжек. Подобные структурные переходы удается наблюдать и в модельных опытах в растворе. А. Клуг (Великобритания) провел электоонную микроскопию 300 Å-фибрилл, полученных из раствора, и показал, что она имеет сравнительно регулярную организацию, образуя соленоид. На один шаг соленоида приходится вЧфеднем 6 нуклеосом, что дает при их плотной упаковке диаметр 300 Å и шаг спирали 100 Å (рис. 16).
Попытки реконструировать структуру 300 Å-фибриллы на основании электронно-микроскопического изучения хроматина внутри клеток были предприняты Ю. С. Ченцовым. Он пришел к выводу о неравномерности диаметра фибриллы по ее длине и развил представления, согласно которым она состоит из чередующихся гранул (300 Å в диаметре) и более тонких соединительных участков. Гранулы были названы нуклеомерами. Подобные гранулы были затем описаны на Западе, только под другим термином "super-beads". На ранних стадиях нуклеазного гидролиза хроматина наблюдали обогащение экстракта олигонуклеосомами, содержащими по 7-8 нуклеосом (нуклеомеры?), но эти результаты не были достаточно воспроизводимыми. Как бы то ни было, в настоящее время вопрос о деталях строения соленоида, т. е. о втором уровне упаковки ДНК в хроматине, остается открытым.
Если принять модель регулярного соленоида, это даст степень снижения линейных размеров хромосомной фибриллы в 6 раз по сравнению со 100 Å-нуклеосомной фибриллой, а по сравнению со свободной ДНК - примерно в 40 раз. Хотя детали строения соленоида не установлены, ясно, с какими белками связано его образование. 300 Å-фибрилла распадается, коль скоро из хроматина удаляется тем или иным способом гистон HI, и ее нельзя восстановить ни при каких концентрациях солей в растворе. Как отмечалось выше, Ю. В. Ильин в нашей лаборатории в свое время показал решающую роль гистона HI в конденсации хроматина. Очевидно, что эта конденсация зависит от перехода 100 Å-фибриллы в 300 Å, причем последняя уже, как, правило, нерастворима в водных растворах, давая преципитат. В более поздних работах нашей лаборатории зависимость конденсации хроматина от присутствия гистона HI была продемонстрирована на примере мини-хромосомы SV40. В присутствии H1 они выглядели при электронной микроскопии как компактные частицы ~300 Å в диаметре. Удаление гистона H1 вело к разворачиванию структуры и появлению четко различимых нуклеосом, связанных линкерной ДНК. Их число равно 22-24 на мини-хромосому (см. рис. 16).
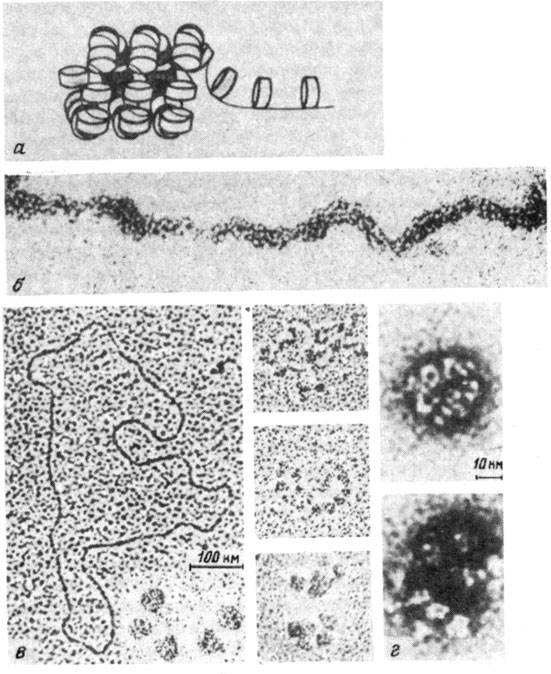
Рис. 16. Второй уровень упаковки ДНК в хроматине, 300 Å-фибрилла. а - возможная упаковка нуклесомной фибриллы в соленоид. Диски соответствуют отдельным нуклеосомам. (Модели А. Ворсела и А. Клуга); б - электронная микроскопия 300 Å-фибриллы - видно, что она состоит из нуклеосом (по результатам, полученным Б. Хамкало); в - электронно-микроскопическое изучение стадий компактизации ДНК SV40 в мини-хромосому. По часовой стрелке: свободная релаксированная ДНК; мини-хромосома типа 'бусин на нити'; 100 Å-фибрилла; мини-хромосома, состоящая из больших гранул типа нуклеомеров; мини-хромосома в компактной форме (диаметр 300 Å, соответствует по степени компектизации 300 Å-фибрилле). ЭМ выполнена после напыления. Образование компактных структур полностью зависит от наличия гистона H1; г - компактная (сверху) и раскрученная (внизу) формы мини-хромосомы SV40 при высоком разрешении. ЭМ выполнена после негативного контраста (по результатам, полученным В. В. Бакаевым, С. А. Недоспасовым и соавт.)
Каким образом гистон H1 вызывает переход из нуклеосомной фибриллы в соленоид, не известно. Предполагается, что молекулы гистона H1, лежащие в разных витках соленоида, взаимодействуют между собою, вызывая стягивание витков. Другое предположение состоит в том, что одна молекула H1 может взаимодействовать с двумя участками ДНК, расположенными в соседних витках. Большой интерес представляют опыты Дж. Томас (Великобритания), которая установила упорядоченное расположение гистона H1 вдоль нуклеосомной фибриллы. При проведении химической реакции с реагентами, сшивающими между собою белки, и последующем анализе продуктов реакции, было установлено, что две молекулы гистона HI всегда сшиваются таким образом, что аминоконец (голова) одной молекулы соединяется с карбоксильным концом (хвост) другой. Комплексы голова-голова и хвост-хвост не образовывались. Таким образом, гистоны H1 расположены одинаковым образом вдоль нуклеосомной нити.
Было показано, что гистон HI содержит гидрофобную среднюю часть и богатые лизином N- и С- концы, связывающиеся с ДНК. Весьма вероятно, что именно взаимодействие больших гидрофобных блоков гистонов H1 между собою стягивает соседние витки соленоида
По всей вероятности, расположение витков в соленоиде не связано с последовательностями ДНК, входящими в его состав, т. е. этот уровень организации хроматина безразличен к последовательностям ДНК. Последние могут, однако, оказывать влияние на структуру соленоида через "фазирование" нуклеосом. Нерегулярности в соленоиде могут быть отражением нерегулярности в расположении нуклеосом вдоль цепи ДНК. Вопрос этот, однако, нуждается в специальном изучении.
Вероятно, соленоидная (или нуклеомерная) упаковка характерна для неактивного, не работающего хроматина. При переходе его в транскрипционно-активное состояние соленоид должен разрушаться, исходя хотя бы из топологических соображений.
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'