
3.4.1* Третий уровень организации хроматина: петли
Открытие ядерного скелета (остова) и приклепления к нему петель ДНК1* [114-124]. Третий уровень компактизации ДНК в хроматине определяется дальнейшей укладкой 300 Å-фибриллы в петли, прикрепляющиеся своими концами к скелетным образованиям клеточного ядра или метафазных хромосом. Последние часто обозначают как ядерный матрикс и хромосомный остов соответственно.
Открытие ядерного матрикса было сделано в лаборатории И. Б. Збарского. В конце 40-х-начале 50-х годов были начаты активные исследования изолированных клеточных ядер А. Мирским в США и И. Б. Збарским в СССР. Мирский впервые описал негистоновые белки ДНП. И. Б. Збарский и С. С. Дебов провели анализ материала ядер, остающегося после удаления ДНП концентрированными солевыми растворами, и открыли в составе его кислый белок, растворимый в разбавленных щелочах, и нерастворимый остаточный белок.
В 1956 г. я начал свою работу в лаборатории И. Б. Збарского (Институт морфологии животных им. А. Н. Северцова АН СССР) и занялся по его предложению более детальным цитологическим анализом процесса фракционирования ядер по Збарскому и Дебову. Было установлено, что фракция кислого белка включает в себя материал как ядрышка, так и более мелких образований, рассеянных по ядру, а также выявляемых и в метафазных хромосомах.
Затем мы с Ю. С. Ченцовым провели электронно-микроскопический анализ изолированных ядер после их экстракции различными растворами и обработки нуклеазами (рис. 17). Наиболее интересные картины были получены после обработки ядер ДНКазой I с последующей экстракцией либо только 0,14 М NaCl, либо 0,14 М NaCl, затем 1-2 М NaCl. В первом случае в ядрах, хорошо сохранивших свою форму, хотя они и потеряли растворимые белки и часть ДНП (но не весь), выявлялись нитевидные образования диаметром 300-600 А. Если же мы дополнительно экстрагировали ядра 1-2 М NaCl, чтобы убрать полностью гистоны, то в ядрах на срезах были видны опять-таки ядерная мембрана, ядрышки и фибриллы, но их диаметр был меньше - около 100 Å, причем они состояли из нитей и гранул несколько большего диаметра (~200 Å). В световом микроскопе места скопления этого фибриллярного компонента окрашивались на РНК. Обработка РНКазой удаляла гранулярный компонент фибрилл. Было похоже, что такие фибриллы образовались из более толстых, получаемых на предыдущем этапе экстракции. Кстати, как те, так и другие во многих случаях контактировали с ядерной оболочкой, а иногда с ядрышком. После обработки препаратов разбавленными щелочными растворами в них оставались только ядерные оболочки. Таким образом, рибонуклеопротеины клеточного ядра образуют ядрышки и фибриллярный материал, располагающийся внутри ядра. Составляющие фибриллярный компонент нити были названы нами нуклеонемами.
В той же работе мы с Ю. С. Ченцовым выдвинули гипотезу об общей структурной организации клеточного ядра, согласно которой в основе каждой хромосомы лежит осевая структура, представленная нуклеонемой, прикрепляющейся концами к ядерной оболочке, а нити ДНП, в свою очередь, прикрепляются к этой осевой структуре. Мы приводили в пользу предложенной гипотезы следующие аргументы. Утолщение нуклеонем после экстракции только 0,14 М NaCl объяснялось тем, что "хвосты" ДНК, оставшиеся связанными с нуклеонемами, преципитировали вместе с гистонами на нуклеонемах в 0,14 М NaCl; 2 М NaCl удалял гистоны, и сохранившаяся ДНК уже не осаждалась на нуклеонемах. При нашей обработке препаратов ДНК не была видна в электронном микроскопе. Если мы не обрабатывали ядра ДНКазой, но экстрагировали раствором NaCl промежуточной концентрации (экстракция гистонов!), то ядра набухали, ДНК в них сохранялась, но была практически невидимой на срезах. Зато прекрасно проявлялись нуклеонемы. Очевидно, что эти аргументы не являлись решающими, но тем не менее в основных чертах предложенная модель соответствует сегодняшним представлениям. Через несколько лет после нашей публикации аналогичные данные получил Х. Буш в США.
Затем Г. Блобел (США) обнаружил, что непосредственно под ядерной мембраной располагается белковый слой, состоящий в основном из трех родственных белков с молекулярной массой около 70 кДа. Этот белковый слой был назван ламиной, а составляющие его три главные белка - ламинами. Наконец, Р. Березней и Д. Коффи (США) провели детальное исследование белкового состава ядер с помощью электрофореза в полиакриламидном геле. Они одновременно несколько усовершенствовали процедуру фракционирования. Ими же была введена и новая терминология. Материал ядра, остающийся после удаления ДНП, назван ядерным матриксом. В свою очередь, ядерный матрикс разделен на ламину и внутренний ядерный матрикс, соответствующий нуклеонемам.
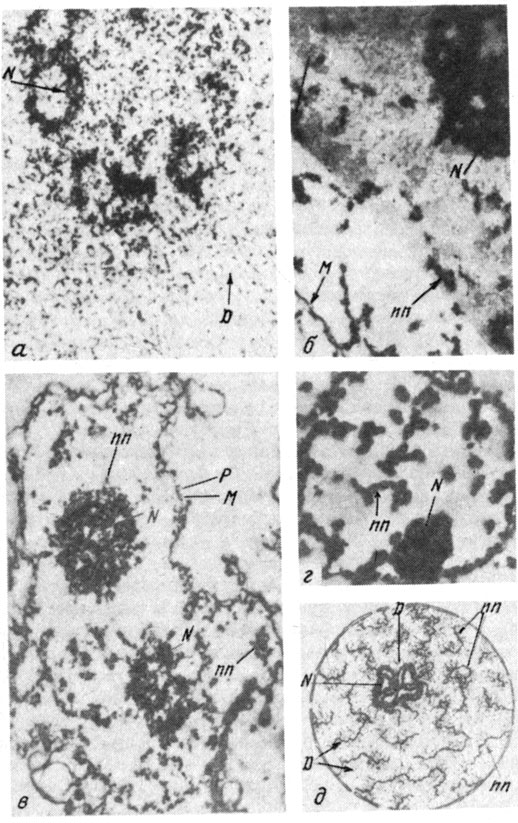
Рис. 17. Электронно-микроскопическое исследование изолированных клеточных ядер, подвергнутых различным обработкам. а - участок изолированного клеточного ядра, фиксированного OsO4 в растворе с низкой ионной силой; б - ядра экстрагировали 0,4 М NaCl и фиксировали OsO4 в 0,4 М NaCl. Хроматин, лишенный гистона H1, деконденсирован и практически не виден. При этом хорошо проявляются нуклеонемы; в - ядра обрабатывали ДНКазой I и затем 2 М NaCl. Фиксация OsO4 в 2 М NaCl. В ядре, кроме ядерной оболочки и ядрышек, видны тонкие 100 Å-фибриллы с 200 Å-гранулами, нуклеонемы; г - ядра обрабатывали ДНКазой I и затем 0,14 М NaCl. Фиксация OsO4 в 0,14 М NaCl. Нуклеонемы выглядят как более толстые нити, видимо, в связи с налипанием на них ДНП; д - гипотетическая модель ядра. Обозначения: N - ядрышко, M - ядерная мембрана, P - поры ядерной мембраны, D - фибриллы хроматина, nn - нуклеонемы (по результатам, полученным автором и Ю. С. Ченцовым)
В последнее время мы часто используем в качестве функционального, т. е. для обозначения белкового остова хромосомы (хроматина), термин "ядерный скелет", понимая термин "ядерный матрикс" в операциональном смысле, т. е. как материал, остающийся после удаления из ядра ДНП, включая сюда не только белки, но ДНК и РНК.
Следующий важный шаг для понимания организации ядра сделали П. Кук и И. Бразел (Великобритания), которые показали, что если удалить из ядер все гистоны концентрированным солевым раствором или даже дегергентами, то ДНК не уходит из ядер, но остается в составе ядерного матрикса, образуя суперспирализованные петли. Был сделан вывод, что ДНК прикреплена в определенных точках к скелетным структурам ядра (см. выше). Аналогичные данные получены рядом других авторов.
Далее У. Лэммли (Швейцария), обработав метафазные хромосомы ионным детергентом, либо 2 М NaCl, показал с помощью электронной микроскопии, что вся ДНК хромосомы входит в состав петель длиной 30-90 т. п. н., прикрепляющихся к белковой осевой структуре хромосомы, расположенной в центре последней ("хромосомному остову") (рис. 18). После этих работ ядерный матрикс стал одной из популярных областей исследования, и появилось множество сообщений, как доказывающих, так и опровергающих его реальность. Противники ядерного матрикса аргументировали свои взгляды большой лабильностью последнего и изменчивостью его картины в электронном микроскопе. Крайняя точка зрения состоит в том, что внутренний ядерный матрикс, нуклеонемы, и остов метафазных хромосом являются результатом агрегации белков и РНК, происходящей во время экстракции 2 М NaCl. Однако в пользу "прижизненности" остова хромосом был получен целый ряд довольно убедительных данных. В частности, при окраске скелетных элементов метафазных хромосом серебром они выглядят одинаково как в исходных хромосомах, так и после их экстракции 2 М NaCl (или ДНКазой+2 М NaCl). Флюоресцирующие антитела к белкам остова также выявляют последний в нативных, не экстрагированных хромосомах.
За последние годы появилось также много работ по электронно-микроскопическому изучению тотальных препаратов метафазных хромосом. Полученные картины хорошо согласуются с представлением, согласно которому 300 Å-фибриллы ДНП отходят от неких центральных осевых структур, образуя петли (см. рис. 18). При набухании хромосом некоторые из этих петель разворачиваются, превращаясь в фибриллы типа бусин на нити.
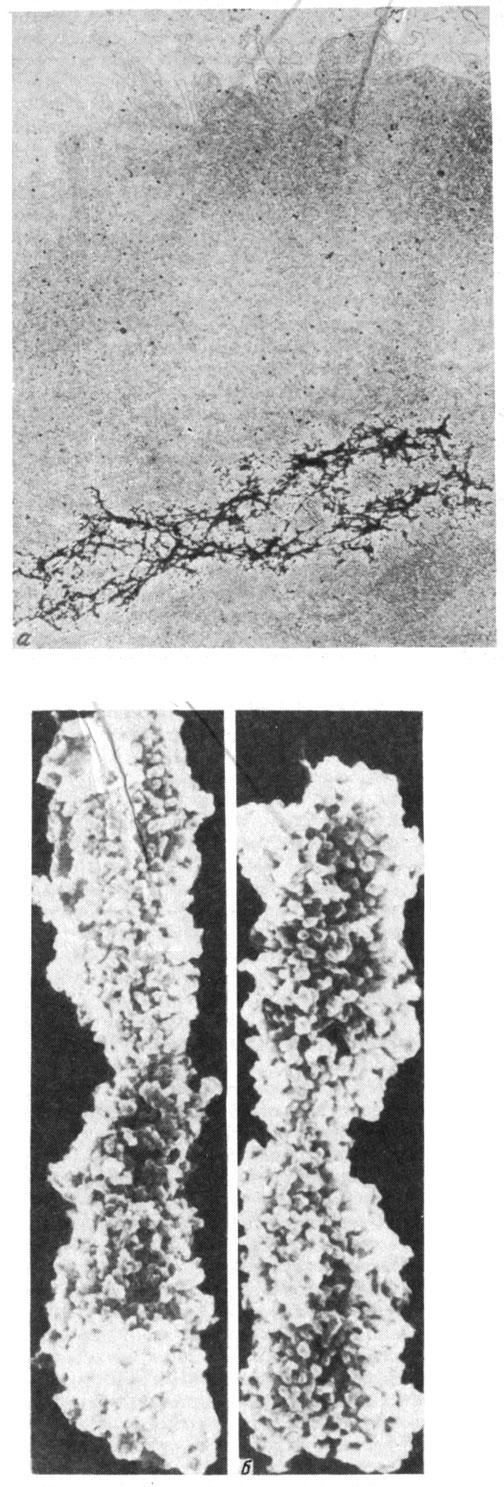
Рис. 18. Петельная организация метафазных хромосом. а - петли ДНК в метафазных хромосомах после удаления из них гистонов. Внутри хромосомы четко виден белковый остов, к которому прикреплены петли ДНК; б - цельные метафазные хромосомы в электронном микроскопе. Видно, что они состоят из 300 Å-фибрилл, в свою очередь образующих структуры типа петель (по результатам, полученным У. Лэммли и Х. Бушем)
Сложнее обстоит дело с интерфазными ядрами, в которых окраска и серебром и антителами к белкам остова дает диффузное распределение по всему ядру. Последнее вполне естественно, если учесть деконденсацию хромосом в ядре, а также малый диаметр нуклеонем. Для выяснения "прижизненности" ядерного скелета и вынесения его функциональной роли было крайне важно установить природу белков и ДНК, входящих в его состав, и выяснить, являются ли места прикрепления ДНК к ядерному остову случайными или нет.
Специфичность ДНК в местах прикрепления к скелету1* [125-129]. Все опыты ставятся по очень простой схеме. Клеточные ядра обрабатывают нуклеазами либо специфическими (рестриктазами), либо неспецифическими (микрококковая нуклеаза, ДНКаза I, ДНКаза II), после чего удаляют гистоны и отщепившуюся ДНК тем или иным способом (2 М NaCl, детергент, экстракция при низкой ионной силе). Иногда нуклеазная обработка повторяется после этого еще раз. В других случаях удаление гистонов 2 М NaCl или детергентом проводится перед нуклеазной обработкой. Если ядра выделены в условиях, исключающих нуклеазный гидролиз, то экстракция 2 М NaCl или детергентами удаляет только гистоны (дегистонизация), тогда как вся ДНК остается связанной с ядерным остатком.
Первые опыты по характеристике ДНК, остающейся в ядерном матриксе после переваривания рестриктазами (EcoRI и HindllI) или микрококковой нуклеазой, были проведены в нашей лаборатории С. В. Разиным и В. Л. Мантьевой. В этих опытах ядерный матрикс выделяли из L-клеток мыши путем экстракции 2 М NaCl.
По мере углубления гидролиза (это особенно четко проявляется в опытах с микрококковой нуклеазой) падает размер и уменьшается количество ДНК, удерживаемой в ядерном матриксе. Простые расчеты позволили определить, что средний размер петли ДНК, выявляемый в таких опытах, т. е. среднее расстояние между двумя соседними точками прикрепления, составляет от 60 до 70 т. п. н.
Когда размеры оставшейся прикрепленной ДНК составили около 500-1000 п. н., с этой ДНК, которую мы далее обозначаем ямДНК (ДНК ядерного матрикса), были проведены ренатурационные опыты. Ее метили и ренатурировали в присутствии избытка тотальной ДНК клетки. В опытах такого рода выясняется, с какой фракцией ДНК коренатурирует меченая ДНК, которую берут в очень малых количествах. Оказалось, что ямДНК, полученная как из интерфазных ядер, так и из метафазных хромосом, обогащена повторяющимися нуклеотидными последовательностями и представляет собою неслучайную субфракцию от тотальной ядерной ДНК.
После этого появился ряд работ других авторов, часть которых подтверждали, а другие опровергали наши выводы. Дальнейшие эксперименты позволили объяснить эти противоречия. Результаты зависят от метода выделения. Если сразу проводить удаление гистонов и отщепившейся ДНК 1-2 М NaCl или малыми концентрациями детергента (например, дийодосалицилата лития, введенного в практику Лэммли), то ямДНК представляет неслучайную фракцию. Однако если перед этим инкубировать ядра в растворах с очень низкой ионной силой (например, 1 мМ ЭДТА), то происходит полное усреднение и ямДНК становится неотличимой от тотальной ДНК. Нам кажется наиболее вероятным, что при предынкубации в растворах с низкой ионной силой происходит разрушение нативных контактов ДНК с матриксом, и этим объясняется случайный характер получаемого распределения ДНК. В пользу этой интерпретации говорят недавние опыты П. Кука и соавт. (Великобритания), которые разработали новый метод изоляции ядерного матрикса. Клетки заключали в агарозный гель, так что каждая оказывалась в своей отдельной камере. Их лизировали, промывали и в результате получали ядра, опять-таки сидящие в отдельных ячейках геля. Это препятствовало их агрегации при дальнейшей обработке. Затем ДНК подвергали нуклеазному гидролизу и удаляли отщепившуюся ДНК с помощью электрофореза при физиологических концентрациях солей. ДНК, остающаяся прикрепленной к остову, оказалась неслучайной фракцией ДНК: она была сильно обогащена транскрибирующимися последовательностями (см. разд. 3.4).
Наконец, за последние годы были выполнены работы, в которых авторы изучали места прикрепления ДНК к ядерному скелету в определенных индивидуальных областях генома. Были получены четкие данные, свидетельствующие в пользу специфичности мест прикрепления ДНК, причем в ряде случаев эти места прикрепления не зависели от процесса транскрипции (как в опытах Кука).
Первые такие данные были получены независимо У. Лэммли (Швейцария) и в совместной работе С. В. Разина (наша лаборатория) с К. Шеррером (Франция). В первой изучались места прикрепления гистоновых генов к ядерному скелету в культуре клеток дрозофилы, во второй - места прикрепления в районе α-глобиновых генов в эритробластах и эритроцитах кур. В обеих работах были обнаружены специфические места взаимодействия. Мы вернемся к этим исследованиям ниже.
Возникает вопрос, имеют ли места прикрепления ДНК к скелету функциональное значение?
Прикрепления сателлит-ной ДНК к ядерному скелету1* [130, 131]. В опытах С. В. Разина и О. В. Яровой измеряли размеры ДНК, остающейся с ядерным матриксом при предельном переваривании ДНК микрококковой нуклеазой. Приэлектрофорезе выделенной ДНК было обнаружено два дискретных компонента, резко различающихся по своей молекулярной массе: один с размерами ~ 150 п. н., а другой с размерами ~10 т. п. н. (рис. 19).
Фрагменты длиной ~10 т. п. н. оказались весьма устойчивыми к различным обработкам. Во-первых, они были защищены от нуклеазы и в том случае, если последнюю добавляли после удаления гистонов 2 М NaCl. Во-вторых, их присутствие не зависело от условий выделения ядерного матрикса. Так, предынкубация ядер в 1 мМ ЭДТА, резко снижавшая содержание коротких фрагментов, не сказывалась на фракции длинных фрагментов.
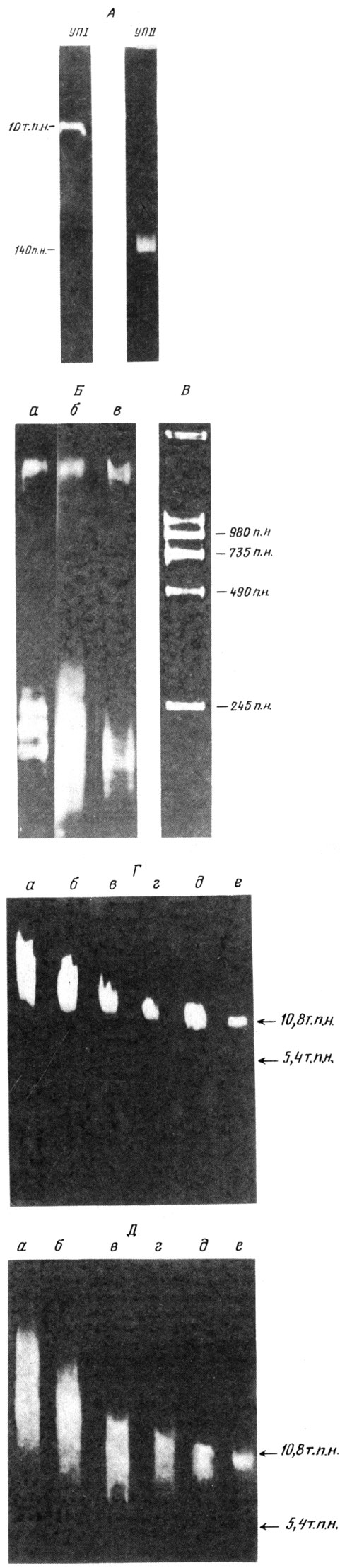
Рис. 19. Два типа прикрепления ДНК к ядерному скелету, различающиеся по размеру защищенной белками ДНК. А - выявление двух типов защищенных от нуклеаз фрагментов в составе ядерного матрикса клеток асцитного рака Эрлиха мышей. Электрофорез ДНК в агарозном геле вели в условиях, когда выявлялся лишь один из типов ДНК, а другой или удалялся из геля, или оставался на старте. Видно, что в обоих случаях защищенные от микрококковой нуклеазы фрагменты гомогенны по размеру. УШ и УПП - участки прикрепления I и II типа; Б - существование двух типов прикреплений в ядерном матриксе из разных источников: а - печень крысы, ядра обрабатывали микрококковой нуклеазой; б- культура клеток дрозофилы (линия КС); в - эритроциты кур; в случаях б, в ядра обрабатывали ДНКазой 1. Электрофорез в 1,4%-ном агарозном геле позволяет одновременно видеть оба типа защищенной ДНК; В - тяжелый компонент ямДНК мыши представлен сателлитной ДНК, богатой А-T-парами. Электрофорез ДНК тяжелого компонента вели после обработки эндонуклеазой EcoRII. Видно, что вся ДНК переходит в серию полос с размерами, кратными 245 п. н. (субъединица сателлитной ДНК); Г-Д - полная защищенность тяжелого компонента от микрококковой нуклеазы. Электрофорез ямДНК вели в 0,7%-ном нейтральном (Г) или щелочном (Д) агарозном геле. Препараты выделены после обработки возрастающими дозами нуклеазы. Ядерный матрикс содержал 1,75% (а), 0,73 (б), 0,29 (в), 0,11 (г), 0,04 (д) и 0,02 % (е) от всей ДНК. Стрелки указывают позиции маркеров 1(10,8 и 5,4 т. п. н.). Таким образом, тяжелый компонент имеет размер 10 т. п. н. и не содержит даже одноцепочечных разрывов (по результатам, полученным С. В. Разиным и соавт.)
При равновесном ультрацентрифугировании в CsCl очищенная ямДНК с размерами около 10 т. п. н. взвешивалась в зоне с плотностью 1,69 г/см3, что соответствует плотности сателлитной ДНК мыши. При переваривании рестриктазой EcoRI был получен набор дискретных фрагментов с размерами, кратными 245 п. н., что также характерно для сателлитной ДНК, состоящей из коротких повторяющихся последовательностей. Таким образом, длинные защищенные фрагменты состоят из сателлитной ДНК, хотя только небольшая ее доля входит в состав защищенной от нуклеаз фракции (~ 0,2 %). Расчеты показывают, что число таких фрагментов на ядро составляет ~ 100, т. е. около двух на хромосому. Ряд косвенных данных позволяет предположить, что эти места прикрепления располагаются на ядерной ламине. Известно, что сателлитная ДНК локализуется в области центромеров и теломеров хромосом. Учитывая все это, можно с большой вероятностью предположить, что длинные защищенные от нуклеаз участки сателлитной ДНК представляют собою места стабильного прикрепления хромосом к ядерной ламине и тем самым к ядерной оболочке в области центромеров и/или теломеров.
Прикрепление к ядерному скелету транскрибируемой ДНК1* [127, 132-136]. Рядом авторов было найдено, что ДНК, остающаяся прикрепленной к ядерному скелету после переваривания рестриктазами или нуклеазами, обогащена транскрибирующимися последовательностями. Ядерный матрикс из эритроидных клеток обогащен глобиновыми генами, а ядерный матрикс из клеток яйцеводов - овальбуминовыми генами, но не наоборот.
Поскольку, однако, вскоре появились и прямо противоположные данные, то С. В. Разин и О. В. Яровая решили разобраться в этом вопросе более глубоко. Они нашли, что при стандартном выделении ядерного матрикса из клеток миеломы мышей, активно продуцирующей иммуноглобулин, ямДНК, остающаяся связанной со скелетными структурами после отщепления 90-95 % всей ядерной ДНК, содержит во много раз больше последовательностей, гибридизующихся с клонированными генами тяжелых цепей иммуноглобулинов, чем отщепившаяся или тотальная ДНК (рис. 20). В то же время у фибробластов мышей, в которых иммуноглобулины не синтезируются, никакого обогащения ядерного матрикса иммуноглобулиновыми генами найдено не было. Таким образом, данные о связывании транскрибирующейся ДНК с ядерным матриксом были подтверждены. Далее оказалось, что если перед выделением ядерного матрикса ядра инкубировали в растворах с низкой ионной силой, распределение иммуноглобулиновых генов между отщепленной и связанной ДНК было равномерным. Это объясняло имевшиеся в литературе противоречия. Все, следовательно, зависит от используемого метода выделения ядерного матрикса. Вероятно, предынкубация в 1 мМ ЭДТА каким-то образом разрушает ассоциацию транскрибирующейся ДНК с ядерным скелетом, т. е. именно она вызывает артефакт (а не прямая экстракция 2 М NaCl). На это указывает упомянутая выше работа Кука и сотр., которые выделяли ядерный матрикс из ядер, заключенных в агарозный гель, пользуясь только растворами с физиологической концентрацией солей. В этих опытах транскрибируемая ДНК опять-таки оказалась связанной с ядерным скелетом, что является сильным доказательством существования такой ассоциации in vivo.
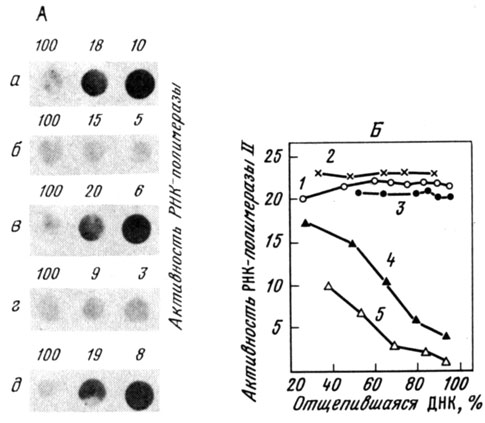
Рис. 20. Демонстрация связи транскрипционно активного хроматина с ядерным скелетом. А - гибридизация меченой последовательности иммуноглобулинового гена Cμ с различными препаратами ДНК из клеток мыши; а - ДНК ядерного матрикса (ямДНК) из клеток гибридомы мыши, синтезирующей иммуноглобулин IgM (кодируемый вышеуказанным геном); выделенные ядра обрабатывали микрококковой нуклеазой и экстрагировали в 2 М NaCl; б - ямДНК из клеток SVT2; выделение ядерного матрикса велось, как в а; в - ямДНК из гибридомы; ядра перед экстракцией 2 М NaCl обрабатывали ДНКазой I и РНКазой А; г - ямДНК из клеток гибридомы; ядра после нуклеазной обработки экстрагировали раствором с низкой ионной силой и затем 2М NaCl; д - ямРНК из клеток гибридомы; ядра обрабатывали микрококковой нуклеазой, затем 2 М NaCl и далее раствором с низкой ионной силой. Цифры указывают содержание ДНК, оставшейся в препарате ядерного матрикса в процентах от тотальной ДНК- Они зависят от глубины нуклеазной обработки в каждом отдельном случае. Первая цифра (100) получалась в отсутствие нуклеазной обработки. Видно, что ямДНК гибридомы обогащена Ср генами в случае, если ядра после нуклеазного гидролиза обрабатывают 2 М NaCl, но не раствором с низкой ионной силой. В то же время предварительная обработка 2 М NaCl предупреждает диссоциацию транскрибирующейся ДНК Б - связь РНК-полимеразы II с ямДНК. Приводится общая PHK-полимеразная активность в препарате ямДНК в зависимости от процента ДНК, отщепленной от ядерного матрикса. 1 - ядра обрабатывали микрококковой нуклеазой и далее 2 М NaCl; 2 - обработка ДНКазой I и 2 М NaCl; 3 - обработка ДНКазой I + РНКазой А и 2 М NaCl; 4 - обработка микрококковой нуклеазой и раствором с низкой ионной силой; 5 - обработка микрококковой нуклеазой, раствором с низкой ионной силой и 2 М NaCl. Синтез РНК вели в растворе, содержащем 0,25 М сульфата аммония, что позволяет выявлять эндогенную РНК-полимеразу II. Активность РНК-полимеразы II выражали в пикомолях на 10й ядер (по результатам, полученным С. В. Разиным и соавт.)
Каким образом происходит ассоциация транскрибирующейся ДНК с ядерным матриксом? Участвуют ли в этом РНК, РНК-полимераза или другие факторы? Были поставлены опыты двух типов. Во-первых, ядра обрабатывали на той или иной стадии выделения ядерного матрикса РНКазой, разрушая новообразованную РНК- Это, однако, никак не сказывалось на обогащении ядерного матрикса активными генами (в данном случае - иммуноглобулиновыми) . Следовательно, взаимодействие с ядерным скелетом происходит не через новообразованную про-мРНК, хотя последняя, как это показано в большом числе работ, тоже связана с ядерным матриксом (см. гл. 5).
В другой серии опытов исследовалось распределение связанной с ДНК РНК-полимеразы II во фракции ДНК, оставшейся в ядерном матриксе после удаления той или иной части всей ДНК- Оказалось, что общая активность РНК-полимеразы ядерного матрикса оставалась неизменной при удалении от 10 до 98 % всей ДНК, и в результате ее удельная активность на единицу ДНК возрастала в 50 раз. Так было при получении ядерного матрикса экстракцией 2 М NaCl. Если же проводить предобработку ядер в растворе с очень низкой ионной силой, то общая активность РНК-полимеразы II в ядерном матриксе падала строго пропорционально снижению содержания ДНК (см. рис. 20).
Итак, очевидно, взаимодействие транскрибирующейся ДНК с ядерным скелетом вовлекает каким-то образом сам транскрипционный комплекс, включая РНК-полимеразу II. Обработка растворами с очень низкой ионной силой разрушает это взаимодействие. Отсюда, однако, не следует, что сама РНК-полимераза II взаимодействует с ядерным скелетом.
Прочно связанные белки клеточного ядра, ядерный матрикс и транскрипция1* [137-139]. С. В. Разиным и соавт. в нашей лаборатории был сделан еще один шаг на пути понимания природы этого взаимодействия. Была установлена связь ядерного матрикса, транскрипционного комплекса и так называемых прочно связанных с ДНК белков.
Рядом авторов, начиная с работ Т. Андо и Т. Иде (Япония), было показано, что при выделении ДНК остаются прочно связанными с ней некоторые полипептиды, в основном с молекулярной массой ~ 50-60 кДа. Мы предположили, что эти белки могут играть роль в прикреплении ДНК к ядерному матриксу, и исследовали распределение прочно связанных белков между связанной с матриксом и отщепленной ДНК. Опыты велись на фибробластах мыши (L-клетках).
После разделения ямДНК (подбирали такие условия нуклеазного гидролиза, чтобы размеры ее составляли 3-5 т. п. н.) и отщепившейся ДНК их отделяли от свободных белков ультрацентрифугированием в сульфате цезия в присутствии детергента саркозила. Далее проводили химическое мечение белков, оставшихся в препарате ДНК, с помощью радиоактивного [1251]. ДНК полностью разрушали нуклеазами, а белки разделяли электрофорезом и выявляли авторадиографически благодаря метке. Таким способом в препаратах ДНК было выявлено 7 белковых компонентов с молекулярными массами 60, 50, 43, 37, 31, 27 и 18 кДа, обозначенных как - p60, p50 и т. д. Оказалось, что все они, кроме p18, присутствуют исключительно в составе ДНК ядерного матрикса, и только p18 распределен равномерно в обеих фракциях ДНК (рис. 21).
![Рис. 21. Прочно связанные с ДНК белки (ПСД-белки) и их ассоциация с тран-скрипционно активной ДНК. A - электрофореграмма ПСД-белков. Из L-клеток мыши получали ямДНК и отщепившуюся ДНК, очищали их от белков ультра-центрифугированием в градиенте плотности CS><sub>2</sub>SO<sub>4</sub> в присутствии саркозила и метили белки радиоактивным йодом. После этого ДНК разрушали ДНКазой, разделяли белки электрофорезом в полиакриламидном геле в додецил сульфате натрия. На рисунке приведены авторадиографы электрофореграмм; а - ПСД-белки из ямДНК; б - то же, но после обработки β-меркаптоэтанолом (SH-реагент), который удаляет основную часть двух тяжелых белков; в - ПСД-белки в отщепленной ДНК; Б - дот-гибридизация между меченной [32Р] α-глобиновой ДНК курицы с ДНК, связанной и не связанной с ПСД-белками. Видно, что во всех клетках эритроидного ряда (но не фибробластах) ПСД-белки ассоциированы с транскрибируемой ДНК (по результатам, полученным С. В. Разиным и соавт.)](pic/000027.jpg)
Рис. 21. Прочно связанные с ДНК белки (ПСД-белки) и их ассоциация с тран-скрипционно активной ДНК. A - электрофореграмма ПСД-белков. Из L-клеток мыши получали ямДНК и отщепившуюся ДНК, очищали их от белков ультра-центрифугированием в градиенте плотности CS2SO4 в присутствии саркозила и метили белки радиоактивным йодом. После этого ДНК разрушали ДНКазой, разделяли белки электрофорезом в полиакриламидном геле в додецил сульфате натрия. На рисунке приведены авторадиографы электрофореграмм; а - ПСД-белки из ямДНК; б - то же, но после обработки β-меркаптоэтанолом (SH-реагент), который удаляет основную часть двух тяжелых белков; в - ПСД-белки в отщепленной ДНК; Б - дот-гибридизация между меченной [32Р] α-глобиновой ДНК курицы с ДНК, связанной и не связанной с ПСД-белками. Видно, что во всех клетках эритроидного ряда (но не фибробластах) ПСД-белки ассоциированы с транскрибируемой ДНК (по результатам, полученным С. В. Разиным и соавт.)
Если заменить при ультрацентрифугировании в сульфате цезия саркозил на более мягкий диссоциирующий агент - гуанидинхлорид, то в ямДНК открывается существенно больше белков. Опять-таки все эти белки не видны во фракции отщепившейся ДНК.
Одни и те же прочно связанные белки (ПСБ) были выявлены нами в препаратах ямДНК из интерфазных ядер и из метафазных хромосом, т. е. они не утрачивались в течение всего клеточного цикла.
Мы предположили, что ПСБ участвуют в прикреплении петель ДНК к ядерному скелету. Однако поскольку, как мы уже отчасти видели, имеется несколько разных типов прикрепления (см. также последующие разделы), важно было выяснить, к какому из них имеют отношение ПСБ. Для этого в ряде лабораторий, и в том числе в нашей, С. В. Разиным и соавт. было проведено выделение ДНК, входящей в комплекс с ПСБ, и изучены ее гибридизационные свойства. В этих экспериментах использовали препараты фрагментированной тотальной ДНК, очищенные центрифугированием в градиенте плотности сульфата цезия в присутствии саркозила. Фрагменты ДНК, содержащие ПСБ, отделяли от свободной ДНК путем связывания с нитро-целлюлозными фильтрами, на которых белки задерживаются. Задержанную на фильтрах фракцию ДНК элюировали с фильтров и характеризовали с помощью гибриди-зационных экспериментов.
Оказалось, что связанные с белками фрагменты тотальной ДНК эритробластов обогащены глобиновыми генами, активно транскрибирующимися в этих клетках, в той же мере как и ямДНК эритробластов (см. рис. 21). Следовательно, ПСБ преимущественно присутствуют в составе транскрипционно активного хроматина. Ассоциация глобиновых генов с ПСБ сохраняется и в эритроцитах кур, хотя там синтез глобиновой РНК уже прекращен. В то же время в фибробластах цыпленка комплексы ДНК-ПСБ обеднены глобиновыми генами. Итак, ПСБ ассоциированы как с транскрибируемыми, так и с потенциально транскрибируемыми генами. Однако только в эритробластах кур, но не в эритроцитах, комплексы ДНК-ПСБ находились в составе ямДНК. Следовательно, прекращение транскрипции ДНК ведет к утрате связи между ядерным матриксом и комплексами ДНК-ПСБ. Приведенные данные указывают на участие ПСБ в процессах транскрипции и, возможно, в связывании с ядерным скелетом транскрибирующейся ДНК. В настоящее время исследуется природа ПСБ.
Контакты концов единиц транскрипции с ядерным скелетом через топоизомеразу II [128, 140-142]. В 1984 г. У. Лэммли (Швейцария) разработал новый метод выделения ядерного матрикса, исключив использование концентрированных солевых растворов. Вместо этого гистоны и отщепленную ДНК удаляли в растворах с низкой ионной силой детергентом дийодсалицилатом лития (ЛИС). Исследовали места прикрепления к ядерному остову гистоновых генов на культуре клеток дрозофилы, где эти гены довольно активно транскрибируются. ДНК после удаления из ядер гистонов с помощью экстракции ЛИС переваривали рестриктазами и затем определяли наличие или отсутствие определенных рестриктных фрагментов в связанной и отщепившейся ДНК путем гибридизации меченых гистоновых концов с блотами по Саузерну. Гистоновые гены, как известно, представлены повторяющимися кластерами, каждый из которых состоит из пяти генов для пяти разных гистонов. Все гистоновые гены разделены спейсерами. Оказалось, что при выделении ядерного матрикса с помощью ЛИС лишь одна область из гистонового кластера выявляется в составе ядерного матрикса, а остальные участки переходят в раствор. Зона связывания кластера с ядерным остовом лежит между генами для гистонов H1 и H3, и она обогащена АТ-парами (рис. 22).
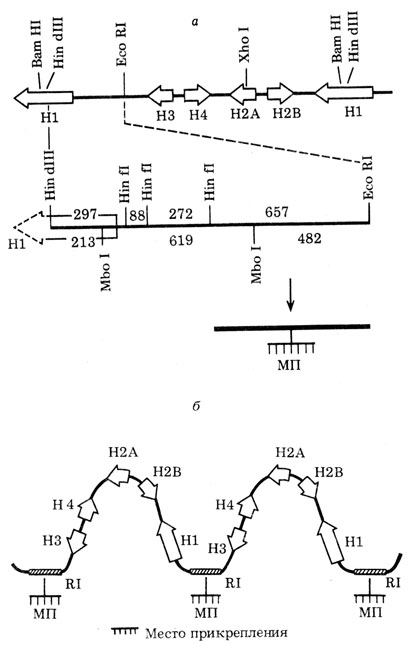
Рис. 22. Специфическое место прикрепления к хромосомному остову в повторе гистоновых генов D. melanogaster на препаратах ядерного матрикса, полученного с помощью детергента ЛИС. а - рестриктная карта повторяющейся единицы, содержащей гистоновые гены. На ней указаны 657 п. н. HinfI/EcoRI-фрагмент, остающийся связанным с остовом после обработки дегистонизированных ядер рестриктазами; б - схема, иллюстрирующая петли, содержащие гистоновые гены дрозофилы; МП - место прикрепления (по результатам, полученным У. Лэммли и соавт.)
Путем обработки ядерного матрикса разными рестриктазами и экзонуклеазой удалось уточнить структуру зоны связывания. Она состоит из двух участков, защищенных белками от экзонуклеаз, по 200 п. н. каждый, а между ними расположен участок, атакуемый после дегистонизации рестриктазой и экзонуклеазами, длиной около 100 п. н. Области связывания с белками ядерного матрикса содержат много последовательностей, которые узнаются ферментом топоизомеразой II.
Вслед затем Лэммли и соавт. исследовали таким же методом ряд других генов дрозофилы, в том числе гены теплового шока, алкогольдегидрогеназы, участок генома, включающий область длиной в 320 т. п. н., и др. Оказалось, что для активных или потенциально активных генов точки прикрепления к ядерному матриксу располагаются лишь перед 5'-концом и за 3'-концом гена. Они как бы обрамляют ген. Их локализация более или менее близка к локализации энхансера, хотя утверждение о совпадении энхансеров и мест прикрепления пока нельзя считать доказанным. Там, где гены не активны или мало активны, это правило не выдерживается, и в таких областях генома места прикрепления вообще встречаются реже (одно на 20-100 т. п. н.). Итак, фракционирование детергентом разрушает лишь часть связей транскрипционного комплекса с ядерным скелетом, но сохраняет другие типы контактов, в частности контакты ядерного скелета с местами, окружающими с двух сторон активные гены.
Какова природа белков, ответственных за прикрепление в этих точках? Рядом авторов было показано, что ядерный матрикс содержит большие количества фермента топоизомеразы II. Последняя составляет один из основных белков ядерного матрикса. В хорошо очищенном остове метафазных хромосом топоизомераза II - это один из двух главных белковых компонентов. Некоторые данные позволяют предположить, что в прикреплениях ДНК к ядерному скелету, выявляемых методом с использованием ЛИС, основную роль как раз и играет топоизомераза II. В тех случаях, когда известны нуклеотидные последовательности ДНК в местах прикрепления, там всегда обнаруживаются сигнальные последовательности, узнаваемые этим ферментом. Более того, связывание антител к топоизомеразе II с препаратами ядерного матрикса ведет к увеличению размеров области, защищенной от действия экзонуклеазы. Это является уже довольно прямым подтверждением предположения о роли топоизомеразы II в связывании ДНК с ядерным остовом.
В приведенных опытах нельзя было исключить, однако, возможность артефактного связывания ДНК. Дело в том, что если просто добавить меченые рестриктные фрагменты к препаратам ядерного матрикса, выделенным с помощью ЛИС, то происходит избирательное связывание тех же самых фрагментов, которые выявляются и в самом ядерном матриксе. Поэтому сейчас трудно сказать, что же на самом деле происходит в клеточном ядре in vivo.
Ассоциация репликативных вилок с ядерным матриксом [143, 144]. Р. Березней и Д. Коффи (США) впервые обнаружили, что ДНК, метившаяся после пульсовой метки [3H]-тимидином, в основном выявляется во фракции ядерного матрикса. В последующем эти результаты получили подтверждение в работах многих других авторов. Меченная в ходе короткого импульса ДНК остается связанной с ядерным скелетом и в том случае, если для выделения ядерного матрикса использовали метод электроэлюции в растворе с физиологической концентрацией солей. Следовательно, данный тип ассоциации ДНК с ядерным остовом не является артефактом, вызванным, скажем, экстракцией раствором с высокой ионной силой. Очевидно, репликативная машина образует комплекс с ядерным скелетом и, таким образом, все участки ДНК при репликации временно ассоциируются с ядерным скелетом. Общий вклад репликативных вилок в ДНК ядерного матрикса, однако, очень невелик, составляя, как показывают простые расчеты, не более 1 % всех взаимодействий ДНК с ядерным скелетом. Детали этого взаимодействия изучены мало, хотя есть данные, согласно которым с ядерным матриксом связан ряд ферментов, участвующих в репликации, а именно ДНК-полимераза а и ДНК-праймаза.
Начала репликации - места устойчивого взаимодействия ДНК со скелетными структурами ядра1* [145-147]. В настоящее время с помощью двух подходов установлено, что одним из мест прикрепления ДНК к ядерному скелету являются начала репликации ДНК, причем эти прикрепления не являются временными. Они сохраняются и в условиях полного отсутствия репликации, т. е. они не связаны непосредственно с функционированием ядра.
Первый подход предложен Ф. Ванкой и соавт. (Голландия). Он заключается в том, что клетки синхронизируют, блокируя вступление их в фазу S, т. е. фазу репликации, а затем одновременно разрешают репликацию и добавляют меченый предшественник. При этом после короткой инкубации помеченными, очевидно, окажутся в основном начала репликации. Оказалось, что меченная таким образом ДНК остается предпочтительно связанной с ядерным скелетом на всех последующих стадиях клеточного цикла. В то же время импульсная метка, включенная в ДНК в середине S-фазы, быстро перемещается в удаленные от ядерного скелета части петель ДНК.
Другой подход разработан в нашей лаборатории С. В. Разиным и Е. М. Луканидиным. Он заключается в физическом выделении фрагментов ДНК, включающих начала репликации, и фрагментов ДНК, содержащих места прикрепления к ядерному скелету, и сравнении их между собою.
Фрагменты ДНК, содержащие начала репликации, выделяли по модифицированному методу Р. Мартина (США) (рис. 23). Клетки метили в течение длительного времени [14С]-тимидином и затем (после удаления намеченных нуклеотидов из среды) в течение нескольких минут [3Н]-дезоксицитидином и бромдезоксиуридином (БДУ). Таким образом, тотальная ДНК была мечена [14С], а новообразованная - [3Н] и, кроме того, новообразованная ДНК была более тяжелой за счет включения БДУ. Как видно из рис. 23, новообразованная ДНК может присутствовать на концах длинных растущих цепей ДНК, полностью занимать только что начатые новые цепи ДНК и, наконец, находиться в области репарации ДНК. Только что начатые цепи ДНК, очевидно, содержат в своем составе начала репликации.
![Рис. 23. Стабильные прикрепления ДНК к ядерному скелету в областях, содержащих начала репликации ДНК. а - схема выделения начал репликации из культуры клеток эритробластов кур, меченных в течение нескольких минут [3Н] -дезоксицитидином и бромдезоксиуридином; тяжелые цепи новообразованной ДНК обозначены жирными линиями; б - распределение импульсно меченной [3Н] и меченной в течение 48 ч [МС] ДНК после первого (А) и последнего (Б) ультрацентрифугирования в градиенте плотности CsCl. На седиментограмме (Б) выявляется лишь импульсно меченная тяжелая ДНК; 1 - [3Н]; 2 - [14С]; 3 - плотность CsCl; в - доказательства специфичности мест прикреплений ДНК к ядерному скелету. Фрагменты ямДНК эритробластов (1) или эритроцитов (3) или тотальной ДНК (2) размером ~5 т. п. н. метили и ренатурировали в присутствии избытка ямДНК эритроцитов (того же размера). Перед проведением ренатурации ДНК дробили на 200 н.- фрагменты. Анализ ренатурации вели с помощью хроматографии на гидроксиапатите. Велся учет только ренатурации уникальных последовательностей ДНК (интервал Cot от 10*102 до 104). Видно, что ямДНК эритроцитов - это небольшая специфическая фракция тотальной ДНК, составляющая менее 10 % ее. Она также является подфракцией ям ДНК эритробластов (около 1/3 последней); г - коренатурация меченой ДНК начал репликации с избытком тотальной ДНК (1), ямДНК эритробластов (2) и ямДНК эритроцитов (3). Во всех случаях ренатурация начал репликации идет на 100 %. Все уникальные последовательности, окружающие начала репликации, выявляются в составе ямДНК как эритробластов, так и эритроцитов; д - опыт по выяснению локализации начал репликации на α-глобиновом домене курицы; л, α><sup>D</sup>, α<sup>А</sup> - глобиновые гены, А - рестриктные фрагменты клонов, содержащих область α-глобиновых генов; I, II, III и IV - клоны и рестриктазы, приведенные на нижней схеме; Б - гибридизация блотов с тотальной ДНК (выявление повторяющихся последовательностей); В - гибридизация с началами репликации (фрагменты ДНК размером ~2 т. п. н.). Цифрами отмечены фрагменты, гибридизующиеся с ori-ДНК, но не с тотальной ДНК. Внизу приведены карты (I -IV) клонов и фрагменты, гибридизующиеся с тотальной ДНК (тот) и ori-ДНК (ори), а также общая карта области с указанием мест локализации ori-ДНК. С теми же участками гибридизуется и ямДНК из эритроцитов кур (по результатам, полученным С. В. Разиным и соавт.)](pic/000029.jpg)
Рис. 23. Стабильные прикрепления ДНК к ядерному скелету в областях, содержащих начала репликации ДНК. а - схема выделения начал репликации из культуры клеток эритробластов кур, меченных в течение нескольких минут [3Н] -дезоксицитидином и бромдезоксиуридином; тяжелые цепи новообразованной ДНК обозначены жирными линиями; б - распределение импульсно меченной [3Н] и меченной в течение 48 ч [МС] ДНК после первого (А) и последнего (Б) ультрацентрифугирования в градиенте плотности CsCl. На седиментограмме (Б) выявляется лишь импульсно меченная тяжелая ДНК; 1 - [3Н]; 2 - [14С]; 3 - плотность CsCl; в - доказательства специфичности мест прикреплений ДНК к ядерному скелету. Фрагменты ямДНК эритробластов (1) или эритроцитов (3) или тотальной ДНК (2) размером ~5 т. п. н. метили и ренатурировали в присутствии избытка ямДНК эритроцитов (того же размера). Перед проведением ренатурации ДНК дробили на 200 н.- фрагменты. Анализ ренатурации вели с помощью хроматографии на гидроксиапатите. Велся учет только ренатурации уникальных последовательностей ДНК (интервал C0t от 10*102 до 104). Видно, что ямДНК эритроцитов - это небольшая специфическая фракция тотальной ДНК, составляющая менее 10 % ее. Она также является подфракцией ям ДНК эритробластов (около 1/3 последней); г - коренатурация меченой ДНК начал репликации с избытком тотальной ДНК (1), ямДНК эритробластов (2) и ямДНК эритроцитов (3). Во всех случаях ренатурация начал репликации идет на 100 %. Все уникальные последовательности, окружающие начала репликации, выявляются в составе ямДНК как эритробластов, так и эритроцитов; д - опыт по выяснению локализации начал репликации на α-глобиновом домене курицы; л, αD, αА - глобиновые гены, А - рестриктные фрагменты клонов, содержащих область α-глобиновых генов; I, II, III и IV - клоны и рестриктазы, приведенные на нижней схеме; Б - гибридизация блотов с тотальной ДНК (выявление повторяющихся последовательностей); В - гибридизация с началами репликации (фрагменты ДНК размером ~2 т. п. н.). Цифрами отмечены фрагменты, гибридизующиеся с ori-ДНК, но не с тотальной ДНК. Внизу приведены карты (I-IV) клонов и фрагменты, гибридизующиеся с тотальной ДНК (тот) и ori-ДНК (ори), а также общая карта области с указанием мест локализации ori-ДНК. С теми же участками гибридизуется и ямДНК из эритроцитов кур (по результатам, полученным С. В. Разиным и соавт.)
Следующий этап работы - выделение ДНК и "выплавление" новообразованных цепей путем инкубации ДНК при температуре, близкой к денатурирующей. При этом новообразованная ДНК размером от 100-200 п. н. до 4-5 т. п. н. выплавляется из длинных цепей ДНК за счет "миграции ветвей" и образует более короткие двухцепочечные молекулы. При ультрацентрифугировании в сахарозном градиенте эти цепи можно отделить от основной массы ДНК, меченной [14С], поскольку размеры последней значительно больше. Однако § легкая фракция, кроме фрагментов ДНК с началами репликации, будет содержать обломки меченой [3Н] ДНК, фрагменты Оказаки, происходящие из рёпликативных, вилок, продукты репарации ДНК и т. д.
Следующий этап очистки - ультрацентрифугирование в равновесном градиенте CsCl, ведущее к разделению ДНК по плотности. При этом удаляется большинство неспецифических фрагментов ДНК, ибо они имеют промежуточную плотность между обычной ДНК (1,7 г/см3) и ДНК, в которой тимидин замещен на БДУ (1,80 г/см3). Только небольшие фрагменты, включающие начала репликации, полностью замещены БДУ. Наконец, чтобы удалить одноцепочечные ДНК и РНК (тоже имеющие высокую плотность), препараты обрабатываются РНКазой и нуклеазой S1. После этого для окончательной очистки проводится еще два ультрацентрифугирования в CsCl и, наконец, разделение фрагментов, содержащих начала репликации, на фракции определенных размеров путем электрофореза в агарозном геле с последующей элюцией из него.
Работа велась на клетках культуры эритробластов кур. Поскольку клетки не синхронизированы по циклу и одновременно инициируется лишь небольшое число репликонов (единиц репликации), то выход ДНК, содержащей все начала репликации, крайне невелик. Приходится работать с несколькими литрами суспензии клеток. Однако отсутствие синхронизации позволяет получить в изолированном препарате фрагменты, содержащие все начала репликации, используемые в данном типе клеток. Тем не менее даже то небольшое количество ДНК, которое удается получить, можно использовать для клонирования и для изготовления высокомеченой гибридизационной пробы.
Выделение ямДНК в наших опытах вели стандартным методом (с экстракцией 1-2 М NaCl) из двух типов клеток кур: эритробластов (культура клеток) и эритроцитов (у птиц они содержат ядра).
Дальнейший анализ полученных фракций ДНК велся двумя методами (см. рис. 23). Первый метод, коренатурация следовых количеств меченой ДНК с избытком немеченой ДНК, позволял сравнивать разные препараты ДНК в целом. Поскольку повторяющиеся последовательности могут встречаться в любых участках генома, то их исключали из анализа и сравнивали между собою только уникальные последовательности ДНК, ренатурирующие в интервале C0t от 102 до 104. Чтобы этих последовательностей было достаточно, работали с фракциями ДНК размером ~ 5 т. п. н. Если ренатурировать любую меченую ДНК с избытком немеченой тотальной ДНК, то происходит, естественно, ее полная ренатурация, так как в тотальной ДНК представлены все последовательности генома. Если, наоборот, ренатурировать меченую тотальную ДНК с избытком немеченой ямДНК, то связываются лишь около 25 % тотальной ДНК в случае, если ямДНК получена из эритробластов, и менее 10 %, если она получена из эритроцитов. Следовательно, ямДНК представлена лишь фракцией всей ДНК, причем в активных эритробластах эта фракция относительно велика (при размерах фрагментов около 5 т. п. н.), а в неактивных как в отношении репликации, так и в отношении транскрипции эритроцитах она существенно меньше. Этого можно было ожидать, ибо, как отмечалось выше, ассоциация транскрибируемой ДНК с ядерным матриксом в неактивных эритроцитах исчезает. Действительно, меченая ямДНК эритроцитов полностью коренатурировала с ямДНК эритробластов. В обратной постановке ренатурация меченой ДНК шла лишь на 25 %.
Центральным экспериментом было проведение ренатурации меченых фрагментов, содержащих начала репликации с избытком ямДНК. Оказалось, что в отличие от тотальной ДНК меченые фрагменты ДНК, содержащей начала репликации, полностью ренатурировали с ямДНК не только эритробластов, но и эритроцитов. Таким образом, даже при полном выключении репликации и почти полном выключении транскрипции начала репликации ДНК оставались связанными с ядерным скелетом. Иными словами, эти контакты являются одними из наиболее устойчивых.
Другой тип анализа заключался в исследовании гибридизации ~ 2 т. п. н. фрагментов ДНК, содержащей начала репликации, с рестриктными фрагментами домена α-глобиновых генов. Оказалось, что метку связывают те же две области, что и при гибридизации с ямДНК эритроцитов, т. е. на конкретной области генома получен тот же результат, что и при работе с тотальной ДНК.
Возникает вопрос, все ли места связывания ДНК с ядерным скелетом в неактивных клетках идут через начала репликации. К сожалению, прямой опыт с использованием ренатурации в избытке ДНК, содержащей начала репликации, технически затруднен из-за невозможности получить достаточные количества материала. Однако был предпринят опыт другого типа. Из ямДНК эритроцитов получены клоны, из них отобраны те, которые содержат только уникальные последовательности ДНК, и ДНК этих клонов прогибридизована с мечеными фрагментами, содержащими начала репликаций. Не менее половины всех клонов дали положительный ответ и: следовательно, не менее половины всех мест прикрепления ДНК к ядерному скелету, сохраняющихся в ядрах эритроцитов, идут через начала репликации. Пока не известны белки, через которые начала репликации связываются с ядерным скелетом. Очевидно только, что это не ПСБ, так как их комплексы с ДНК в эритроцитах отсоединяются от ядерного матрикса.
Простые расчеты показывают, что если фрагменты 5 т. п. н. мДНК эритроцитов составляют менее 10 % от всей ДНК, то расстояния между точками прикрепления должны быть больше 50 т. п. н. Если половина из них соответствует началам репликации, то средняя дистанция между последними - больше 100 т. п. н., что не отличается сильно от известных из литературы величин. Прикрепление начал репликации к ядерному скелету функционально выгодно, так как оно позволяет начинать репликацию с легко находимого и фиксированного участка ДНК. Можно думать, что затем репликация идет с помощью продергивания всего репликона через репликативный аппарат, расположенный в том же месте ядерного скелета, где находится начало репликации. Наличие топоизомеразы II в ядерном скелете в этом случае весьма осмысленно, ибо известно, что она участвует в репликации и, в частности, осуществляет разделение двух сцепленных молекул ДНК, образующихся в ходе последней.
Степень компактности ДНК, достигаемая за счет образования петель. Средний размер ДНК, входящей в состав петли у млекопитающих, составляет 50-100 т. п. н., или 1700-3400 нм. Это в 600-1000 раз превышает диаметр соленоида (30 нм). Если допустить плотную упаковку соленоидных петель на скелетной нити, то общий уровень компактизации ДНК составит примерно 103 (из них ~ 25-кратная редукция линейных размеров придется на 3-й уровень укладки). Эта степень компактизации отражает, вероятно, ситуацию в интерфазном ядре. Однако в метафазной хромосоме достигается примерно еще десятикратное снижение линейных размеров.
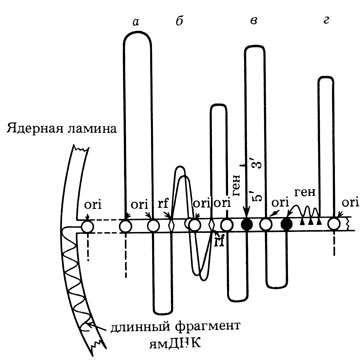
Рис. 24. Схема, иллюстрирующая разные типы прикрепления ДНК к ядерному матриксу. а - неактивная петля ДНК, прикрепленная через начала репликации (ori); б - реплицирующаяся петля с дополнительными контактами через репликационные вилки (rf); в - петля с потенциально активным геном, прикрепленным за 5'-область; г - петля, содержащая работающий ген с дополнительными контактами по всей длине гена. Слева - прикрепление хромосомы к ядерной ламине через длинный фрагмент сателлитной ДНК
Следует подчеркнуть, что в отличие от нуклеосомного и соленоидного, петельный уровень организации хроматина носит уже не чисто структурный, но и функциональный характер. Прикрепления ДНК к скелету ядра идет не по случайным последовательностям, но по участкам, играющим роль в репликации (начала репликации) и транскрипции. Каждая петля поэтому представляет отдельный геномный домен. Наиболее крупными и стабильными структурными доменами являются, вероятно, репликоны: не исключено, что и области терминации репликации присоединены к ядерному скелету. В пределах этих доменов могут возникать вторичные, временные, связанные с транскрипцией контакты. Однако для построения окончательных моделей требуются дополнительные исследования. Ситуация, существующая в настоящее время, схематически представлена на рис. 24. В табл. 3 приведены разные методы изоляции ядерного матрикса и те типы контактов с ДНК, которые выявляются при использовании данных методов.
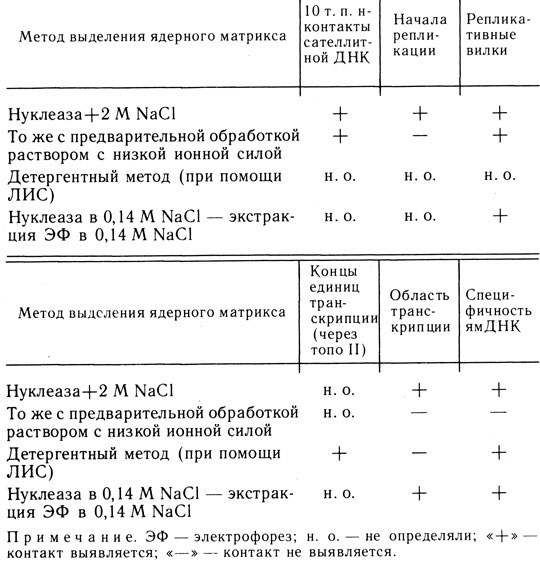
Таблица 3. Зависимость природы выявляемых контактов между ядерным скелетом и ДНК от метода выделения ядерного матрикса
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'