
4.5.1* Упругие торзионные напряжения в ДНК в составе активного хроматина и их возможная роль в регуляции транскрипции
Еще одной особенностью транскрипционно активного хроматина, возможно объясняющей ряд его свойств, является наличие в его ДНК эластических торзионных, или вращательных, напряжений. Мы остановимся на этом вопросе несколько подробнее.
Понятие торзионного напряжения в ДНК [187]. Если ДНК имеет ковалентно замкнутую структуру, будь то кольцевая ДНК в случае эукариотических вирусов (например, SV40) или ДНК с концами, фиксированными на ядерном скелете (хромосомная ДНК эукариот), в ней легко могут возникать торзионные напряжения. Уже упоминалось, что ДНК образует по два негативных витка на нуклеосомный повтор. Если убрать гистоны, то двуспиральная положительно закрученная ДНК окажется дополнительно негативно суперспирализованной (левые супервитки). Возникновение суперспирализации связано с возрастанием свободной энергии, пропорционально квадрату числа супервитков, а значит, система будет стремиться к уменьшению их числа. Это в принципе может произойти одним из двух способов. Первый способ - небольшое раскручивание двойной спирали ДНК по всей ее длине. Так, для удаления одного левого супервитка на 200 п. н. надо, чтобы угол между соседними основаниями в двойной спирали ДНК уменьшился на 1,8°. Однако тот же эффект может быть достигнут и другим способом - за счет перехода ДНК в другую конформацию на каком-то коротком участке.
За последние годы показано, что ДНК может иметь разные конформации, помимо классических правозакрученных B и A форм (B-форма ~10 п. н. на виток; A ~11 п. н. на виток). Наиболее сильно отличается от них Z-форма, левозакрученная двойная спираль, легко возникающая в последовательностях с чередующимися пуриновыми и пиримидиновыми основаниями (CGCGCG. . . и GTGTGT. ..). На шаг спирали в Z-ДНК приходится ~8 п. н. Поэтому при переходе В- формы в Z-форму на один нуклеотид закрутка ДНК меняется от +36° до -45°, т. е. примерно на -80°. Следовательно, переход 10-нуклеотидной последовательности из A-формы в Z-форму приведет к исчезновению двух негативных (левых) суперспиральных витков. Переход их B-формы в A-форму (изменение угла между основаниями примерно на 3°) на участке в 100 п. н. поглотит один супервиток и т. д.
Экспериментальные данные подтверждают существование таких переходов. В неперекрученной ("релаксированной") кольцевой молекуле ДНК, скажем SV40, Z-форма отсутствует. Однако после внесения в нее негативных супервитков она появляется в областях, где есть чередующиеся пуриновые и пиримидиновые основания, в частности, в регуляторной области.
В клетке есть специальные ферменты, влияющие на топологию ДНК: топоизомераза I и топоизомераза II. Механизм действия топоизомеразы I описан выше (см. раздел 4.2). Она обратимо разрывает одну из цепей ДНК.
Топоизомераза II (топо II) при своем действии разрывает обе цепи ДНК и протаскивает одну ветвь двух-цепочечной ДНК через разрыв в другой. В результате также происходит сбрасывание супервитков в молекуле ДНК. Топоизомераза II играет важную роль в репликации, обусловливая, в частности, разъединение реплицировавших дочерних ДНК, которые при инактивации этого фермента остаются сцепленными.
Используя обработку топо I в присутствии бромистого этидия, можно получать негативно суперспирализованную ДНК. Дело в том, что бромистый этидий внедряется плоскостью своего кольца между основаниями ДНК, в результате чего происходит уменьшение угла сдвига между соседними основаниями и в результате - раскручивание двойной спирали ДНК. Топо I фиксирует эту равновесную ситуацию. Когда топо I и бромистый этидий удаляют, кольцевая ДНК восстанавливает, хотя и не полностью, свою исходную структуру, и одновременно в ней появляются негативные супервитки. Меняя концентрацию бромистого этидия при обработке топо I, можно получить разную степень суперспирализации. Финальная равновесная структура ДНК будет включать определенное число супервитков плюс вызванные суперспирализацией конформационные изменения в разных участках молекулы.
Торзионное напряжение ДНК в транскрипционно активном хроматине1* [188, 189]. При депротеинизации I ДНК мини-хромосом вируса SV40 она негативно супер-спирализована. То же самое справедливо и для ДНК петель хроматина. Это не удивительно, поскольку в хроматине ДНК намотана на нуклеосомы, давая около двух негативных витков на нуклеосому (т. е. ~ на 200 п. н.). Однако, как показали исследования лабораторий Б. Хирта (Швейцария) и П. Шамбона (Франция), ДНК в составе хроматина находится в релаксированном состоянии, она не имеет упругих напряжений. Это связано именно с ее намоткой на нуклеосомы, где взаимодействия с гистонами полностью компенсируют ее напряжение.
Основной эксперимент заключался в следующем. Выделенные мини-хромосомы вируса SV40 обрабатывали топо I, затем выделяли из контрольных и обработанных ферментом мини-хромосом ДНК и сравнивали их с помощью высокоразрешающего электрофореза в агарозном геле, при проведении которого происходит разрешение топоизомеров ДНК, т. е. две одинаковые ДНК, различающиеся всего на один супервиток, видны как две разные дискретные полосы. Оказалось, что ДНК, выделенные из обработанных топо I и контрольных мини-хромосом, содержат одинаковые наборы топоизомеров, обе негативно закручены и вообще неразличимы между собою. Следовательно, топо I не вносила изменений в ДНК, когда последняя была в составе мини-хромосомы. Отсюда вытекает, что ДНК в составе хроматина находится в равновесном, энергетически наиболее выгодном состоянии, и упругие торзионные напряжения в ней отсутствуют.
Однако, исходя из ряда косвенных теоретических соображений, можно было предполагать, что в транскрипционно активном хроматине ситуация иная. Поэтому А. Н. Лучником из лаборатории И. Б. Збарского и В. В. Бакаевым предприняты опыты по ревизии вышеописанных данных (рис. 32).
![Рис.32. Торзионные напряжения в ДНК транскрипционно активных мини-хромосом вируса SV40. а - седиментация в сахарозном градиенте мини-хромосом вируса SV40, меченных ><sup>3</sup>Н]-тимидином (1). В разных фракциях определяли эндогенную активность РНК-полимеразы II после лизиса в саркозиле (2). Видно, что тяжелое плечо пика обогащено транскрибирующимися молекулами. Мини-хромосомы экстрагировали 0,4 М NaCl и наслаивали на сахарозный градиент в 0,2 М NaCl; б - высокоразрешающий гелевый электрофорез ДНК мини-хромосом до и после обработки топоизомеразой I; 1 - ДНК из необработанных мини-хромосом; 2 - ДНК мини-хромосом, инкубированных в 0,2 М NaCl 2 ч при 37°; 3, 4 - ДНК мини-хромосом, обработанных топоизомеразой I в 0,2 М NaCl при 37° и 4° соответственно; 5,6 - ДНК мини-хромосом, обработанная топоизомеразой I после выделения, при 37° и 4° соответственно. Видно, что ДНК небольшой части мини-хромосом (2-5 %) полностью релаксирует при обработке топо I, так же как и вся свободная ДНК- Электрофорез вели в присутствии этидийбромида, в результате чего релаксированная ковалентно замкнутая ДНК приобретала положительные (правые) супервитки. в - реседиментация в сахарозном градиенте материала из тяжелой зоны пика (см. а) после его обработки топоизомеразой I. Видно появление небольшого медленно седиментирующего пика 2. Столбики указывают эндогенную активность РНК-полимеразы в пиках 1 и 2, измеренные в присутствии саркозила. В нижней части рисунка приведены электрофореграммы ДНК из пиков 1 к 2. Вся ДНК пика 1 суперспирализована, а пика 2 - релаксирована. Из этого следует, что релаксируемые мини-хромосомы обогащены транскрибирующимися молекулами. Материал пика 2 существенно обеднен белками по сравнению с пиком 1, т. е. релаксация ДНК в мини-хромосомах сопровождается потерей значительной части белка; г - электронная микроскопия мини-хромосом SV40 из (Б). Кроме обычных структур типа бусин на нити (0,7-0,9 мкм длиной), видны гладкие фибриллы длиной в ~1-2 мкм. После обработки топоизомеразой они исчезают и вместо них появляется свободная ДНК (~1,7 мкм длиной) (по результатам, полученным А. Н. Лучником и В. В. Бакаевым)](pic/000041.jpg)
Рис.32. Торзионные напряжения в ДНК транскрипционно активных мини-хромосом вируса SV40. а - седиментация в сахарозном градиенте мини-хромосом вируса SV40, меченных 3Н]-тимидином (1). В разных фракциях определяли эндогенную активность РНК-полимеразы II после лизиса в саркозиле (2). Видно, что тяжелое плечо пика обогащено транскрибирующимися молекулами. Мини-хромосомы экстрагировали 0,4 М NaCl и наслаивали на сахарозный градиент в 0,2 М NaCl; б - высокоразрешающий гелевый электрофорез ДНК мини-хромосом до и после обработки топоизомеразой I; 1 - ДНК из необработанных мини-хромосом; 2 - ДНК мини-хромосом, инкубированных в 0,2 М NaCl 2 ч при 37°; 3, 4 - ДНК мини-хромосом, обработанных топоизомеразой I в 0,2 М NaCl при 37° и 4° соответственно; 5,6 - ДНК мини-хромосом, обработанная топоизомеразой I после выделения, при 37° и 4° соответственно. Видно, что ДНК небольшой части мини-хромосом (2-5 %) полностью релаксирует при обработке топо I, так же как и вся свободная ДНК- Электрофорез вели в присутствии этидийбромида, в результате чего релаксированная ковалентно замкнутая ДНК приобретала положительные (правые) супервитки. в - реседиментация в сахарозном градиенте материала из тяжелой зоны пика (см. а) после его обработки топоизомеразой I. Видно появление небольшого медленно седиментирующего пика 2. Столбики указывают эндогенную активность РНК-полимеразы в пиках 1 и 2, измеренные в присутствии саркозила. В нижней части рисунка приведены электрофореграммы ДНК из пиков 1 к 2. Вся ДНК пика 1 суперспирализована, а пика 2 - релаксирована. Из этого следует, что релаксируемые мини-хромосомы обогащены транскрибирующимися молекулами. Материал пика 2 существенно обеднен белками по сравнению с пиком 1, т. е. релаксация ДНК в мини-хромосомах сопровождается потерей значительной части белка; г - электронная микроскопия мини-хромосом SV40 из (Б). Кроме обычных структур типа бусин на нити (0,7-0,9 мкм длиной), видны гладкие фибриллы длиной в ~1-2 мкм. После обработки топоизомеразой они исчезают и вместо них появляется свободная ДНК (~1,7 мкм длиной) (по результатам, полученным А. Н. Лучником и В. В. Бакаевым)
Из клеток, инфицированных вирусом SV40, выделяли клеточные ядра и из них экстрагировали мини-хромосомы 0,4 М NaCl. Условия экстракции (0,4 М NaCl) были выбраны таким образом, чтобы в раствор хотя бы частично перешли транскрибирующиеся мини-хромосомы, которые при экстракции 0,14 М NaCl остаются практически полностью связанными с ядрами (вероятно, за счет прикрепления к ядерному матриксу). Мини-хромосомы очищали ультрацентрифугированием через сахарозный градиент и либо сразу выделяли из них ДНК, либо предварительно обрабатывали их топо I. В контрольном опыте обрабатывали топо I уже выделенную ДНК- После этого все препараты подвергали высокоразрешающему электрофорезу и сравнивали их между собою. В необработанных мини-хромосомах ДНК представлена серией суперспирализованных топоизомеров. После обработки свободной ДНК топо I она полностью релаксировалась, сохраняя ковалентную замкнутость. Поскольку электрофорез велся в присутствии бромистого этидия, ДНК приобретала положительные супервитки - наиболее верхнее положение занимает ДНК с разрывом в одной цепи, которая релаксирована в любых условиях. Если мини-хромосомы предварительно обрабатывали топо I, то с основной частью ДНК ничего не происходило - она оставалась суперспирализованной (в соответствии с данными других авторов). Однако ДНК небольшой фракции мини-хромосом полностью релаксировалась (оставаясь ковалентно замкнутой), подобно свободной ДНК SV40. Эта фракция составляла от 2 до 5 % от всей ДНК. Очевидно, что ДНК в этой фракции мини-хромосом находилась в состоянии эластического торзионного напряжения уже в составе хроматина.
При повторном ультрацентрифугировании обработанных топо I мини-хромосом в сахарозном градиенте появляется небольшой дополнительный более медленно седиментирующий пик. Оказалось, что в нем сосредоточена вся релаксировавшая ДНК мини-хромосом. Материалы этого пика и основного компонента были собраны, обработаны саркозилом, чтобы убрать гистоны и не связанную с ДНК РНК полимеразу, и помещены в среду для синтеза РНК-В этих условиях молекулы РНК-полимеразы II, уже начавшие в клетке синтез РНК, продолжают его. Оказалось, что удельная активность РНК-полимеразы II, рассчитанная на единицу ДНК, в минорном пике значительно выше, чем в главном. Следовательно, упругие торзионные напряжения - это свойство транскрипционно активных мини-хромосом. При релаксации торзионно напряженных мини-хромосом они теряют значительную часть белка, с чем и связано уменьшение их седиментации при ультрацентрифугировании.
Каким образом в транскрипционно-активных мини-хромосомах генерируются упругие торзионные напряжения? Вопрос этот остается открытым, но можно рассмотреть некоторые возможные механизмы. Один из них - это уже обсуждавшееся выше (см. разд. 4.2) разворачивание нуклеосом в тяж или в полунуклеосомы. При этом легко можно представить возникновение упругих напряжений в развернутой структуре. Поскольку суперспиральные витки проявиться при этом не могут, то напряжение может быть полностью поглощено вторичной структурой ДНК (переходы B→Z, B→A или др.).
Другая возможность - это ослабление взаимодействий между ДНК и октамером, например, за счет модификации гистонов и уменьшения положительного заряда. Число супервитков ДНК при этом не изменится, но появятся эластические напряжения, в связи с которыми структура станет менее устойчивой и будет релаксировать при снятии топологических запретов.
Третья возможность - это утрата гистонов из мини-хромосомы, например, за счет вытеснения другими белковыми факторами или "сталкивании" нуклеосом РНК-полимеразой. Хотя нам эта возможность представляется менее вероятной, поскольку уровень транскрипции на мини-хромосомах SV40 невысок, ее нельзя сбрасывать со счетов.
В пользу первой возможности говорят данные о "полунуклеосомах" (см. разд. 4.2). В наших препаратах мини-хромосом SV40 при электронной микроскопии можно было видеть небольшое число кольцевых молекул, которые по длине (1,2 мкм) занимали промежуточное положение между свободной ДНК SV40 (1,7 мкм) и обычными мини-хромосомами типа бусинок на нити (0,7 мкм). Они выглядели как тяжи более толстые, чем свободная ДНК, и лишенные нуклеосомной структуры. После обработки топо I они исчезали, но при этом появлялась свободная ДНК. Весьма вероятно, что эти молекулы содержали развернутые нуклеосомы и обладали торзионными напряжениями.
Очевидно, в целом вопрос требует дальнейшего изучения. Наши данные о существовании торзионных напряжений в активном хроматине нашли подтверждение в последующих работах ряда других авторов. А. Ворсел и сотр. (США) показали, что ДНК транскрипционно активных мини-хромосом в овоцитах лягушки находится в состоянии торзионного напряжения. Авторы установили, что введенные в ядра овоцитов лягушки мини-хромосомы далее выявляются либо в форме, связанной с ядерным остовом (предположительно транскрипционно активные мини-хромосомы), или в растворимой форме. После микроинъекции топо I ДНК связанных мини-хромосом релаксировала, а в растворимых мини-хромосомах она оставалась супер-спирализованной. Таким образом, благодаря микроинъекциям удалось преодолеть технический барьер, связанный с трудностями экстракции транскрипционно активного материала из ядер (см. разд. 4.2), и вести опыт в условиях более близких к условиям in vivo, чем в наших экспериментах.
Опыты {. Вайнтрауба (США) по чувствительности активных генов к нуклеазе S1 (см. разд. 4.3) можно интерпретировать как косвенное указание на наличие торзионных напряжений в ДНК. Действительно, в модельных опытах на свободной ДНК чувствительность к нуклеазе S1 появляется в результате связанных с суперспирализацией локальных изменений в конформации ДНК. Наконец, связь между степенью суперспирализации ДНК и транскрипционной активностью была получена в опытах с плазмидами дрожжей.
Следует упомянуть, что некоторые авторы выступили с данными, противоречащими изложенным выше. Однако в их опытах были использованы условия эксперимента, не позволяющие извлечь истинные транскрибирующиеся мини-хромосомы из комплекса с ядерным матриксом.
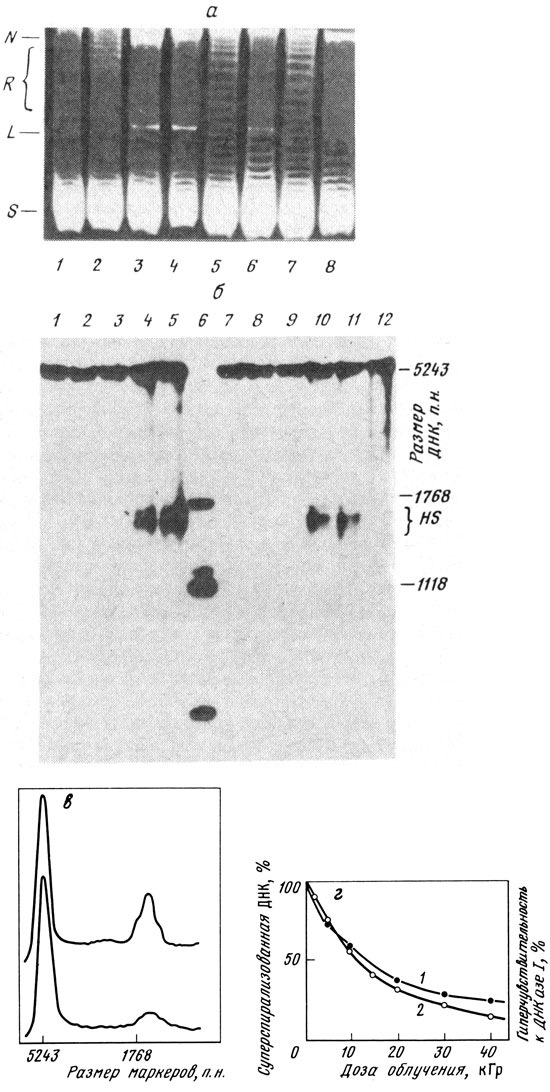
Рис. 33. Зависимость гиперчувствительности мини-хромосом к ДНКазе I от торзионных напряжений в ДНК. а - опыты с последовательной обработкой мини-хромосом топо I и ДНКазой I Высокоразрешающий электрофорез ДНК из мини-хромосом вели в 1,6%-ном агарозном геле в присутствии бромистого зтидия (0.01 мкг/мл). 1 - ДНК из исходных мини-хромосом; 2 - обработка мини-хромосом топо I; 3 - обработка ДНКазой (малые дозы); 4, 6 - обработка ДНКазой I, добавление ЭДТА (иигибирует ДНКазу I) и затем обработка топо I; 5, 7 - обработка топо I и затем ДНКазой I; 8 - обработка свободной ДНК SV40 ДНКазой I (та же доза); S - суперспирализованная ДНК; L - линейная ДНК; возникает в результате гиперчувствительности мини-хромосом к ДНКазе I (разрыв обеих цепей ДНК в одном и том же месте); R - релаксированкая ковалентио замкнутая ДНК (в присутствии бромистого зтидия она приобретает некоторую правую суперспиралнзацию; N - ДНК с одно непочечиым разрывом или разрывами; она становится кольцевой релаксироваииой молекулой, но не способна закручиваться в присутствии бромистого зтидия (основная часть ее возникает под действием ДНКазы I). Видно, что после обработки мини-хромосома топо I исчезает гиперчувствительность к ДНКазе I, и, наоборот, мягкая ДНКазная обработка удаляет релаксируемые мини-хромосомы; б - ннгибирующее действие рентгеновского облучения изолированных ядер из инфицированные вирусом SV40 клеток обезьяны (CV-1) на гинерчувствительность мини-хромосом к ДНКазе I. Ядра в физиологической концентрации солей обрабатывали ДНКазой I, выделяли ДНК, обрабатывали рестриктазой EcoRI и после электрофореза и переноса на фильтр гибридизовали с EcoRI-MspI фрагментом ДНК SV40. Фрагмент c hfpvthjv ∼1700 п. н. образуется при этом за счет двухцепочечных разрывов, внесенных в ДНК ДНКазой I, т. е. его наличие отражает гиперчувствительность мини-хромосом к ДНКазе I. 1-5 - гидролиз необлученных ядер возрастающими дозами ДНКазы I; 7-11 - то же, но после рентгеновского облучения ядер; 6 - маркеры; 12 - ДНК SV40; в - сканирование образной 5 и 11. Видно примерно четырехкратное снижение гиперчувствительности к ДНКазе I под влиянием рентгеновского облучения; г - зависимость гиперчувствительности ДНК (1) SV40 от дозы рентгеновского облучения изолированных ядер. Дана также кривая внесения одноточечных разрывов в ДНК SV40, которые определяли по появлению кольцевой релаксированной ДНК (2) (по результатам, полученным А. Н. Лучником и В. В. Бакаевым.)
Ряд свойств активного хроматина может зависеть от торзионного напряжения ДНК1* [189-194]. Одним из важных свойств активного хроматина является наличие сайтов гиперчувствительности к ДНКазе I (см. разд. 4.3). А. Н. Лучник и В. В. Бакаев исследовали вопрос, каково соотношение между торзионно напряженными мини-хромосомами SV40 и мини-хромосомами, гиперчувствительными к ДНКазе I (рис. 33). Гиперчувствительные мини-хромосомы выявляли по образованию линейной ДНК после обработки малыми дозами ДНКазы I. Оказалось, что если обработать мини-хромосомы сначала ДНКазой I (в условиях, когда большая часть ДНК не получала даже одноцепочечных разрывов, но гиперчувствительные к ДНКазе I молекулы становились линейными), то при последующей обработке топо I релаксированная ДНК не образовывалась. Если же вначале обработать мини-хромосомы топо I, то полностью исчезали мини-хромосомы, гиперчувствительные к ДНКазе I. Отсюда вытекает, что релаксируемые, или торзионно напряженные, мини-хромосомы и мини-хромосомы, гиперчувствительные к ДНКазе I, представляют собою одну и ту же фракцию мини-хромосом в препаратах, полученных с помощью 0,4 М NaCl. Можно было также предположить, что гиперчувствительность к ДНКазе I зависит от торзионных напряжений в ДНК, так как она утрачивалась после релаксации.
Недостатком описанных опытов явилось то, что в них мини-хромосомы изолировали с помощью 0,4 М NaCl, который мог удалять из них ряд белков. Поэтому в следующей серии опытов релаксацию ДНК мини-хромосом SV40 вели непосредственно в изолированных ядрах при физиологических концентрациях солей. Агентом, вызывающим появление в ДНК одноцепочечных разрывов, служило рентегеновское облучение. После облучения ядра обрабатывали ДНКазой I, выделяли из них ДНК, обрабатывали ее рестриктазой EcoRI и разделяли электрофоретически. После переноса на фильтр выявляли путем гибридизации с соответствующей пробой из генома SV40 двухцепочечные разрывы в регуляторной зоне мини-хромосомы SV40, сделанные ДНКазой I.
Оказалось, что рентгеновское облучение ядер в 3- 4 раза подавляет гиперчувствительность регуляторной зоны мини-хромосомы SV40 к ДНКазе I (см. рис. 33). С увеличением дозы облучения снижается содержание суперспирализованной ДНК SV40 в ядрах и пропорционально идет падение гиперчувствительности к ДНКазе I. Не вся гиперчувствительность исчезает при внесении одноцепочечного разрыва в ДНК. Около одной четверти ее сохраняется до конца. Ясно, однако, что основная часть гиперчувствительности к ДНКазе I требует сохранения суперспиральной ДНК, т. е., очевидно, является функцией от торзионных напряжений в мини-хромосоме.
Зависимость от торзионных напряжений другого характерного свойства активного хроматина, а именно повышенной чувствительности к ДНКазе I, было показано в опытах Г. Мартинсона (США). Он использовал уоблучение живых клеток и показал, что чувствительность к ДНКазе I глобинового гена при этом резко падает. Для эффекта было достаточно внести один одноцепочечный разрыв на отрезок ДНК длиной примерно 20-30 т. п. н. Эта величина совпадает с размерами областей ДНК, которые становятся чувствительными к ДНКазе I при активации гена (см. разд. 4.3).
Таким образом, мы видим, что ряд свойств транскрипционно активного хроматина теряется, если индуцировать тем или иным способом релаксацию ДНК, входящей в его состав.
Необходимо ли торзионное напряжение ДНК для поддержания транскрипции?1* [195-197]. Возникает круциальный вопрос, необходимо ли поддержание торзионных напряжений в хроматине для того, чтобы в нем протекала транскрипция. Некоторые ранние данные М. Бирнстила (Швейцария) и специальные опыты Х. Вайнтрауба (США) показали, что, по крайней мере в случае плазмид, несущих гистоновый ген или ген тимидинкиназы, для активной транскрипции после инъекции в овоциты лягушки необходимо, чтобы они были ковалентно замкнуты. Рестрикция таких мини-хромосом блокировала их транскрипцию. Чтобы перебросить мост к клеточному хроматину, А. Н. Лучник провел эксперименты по влиянию рентгеновского облучения на транскрипцию. Облучение проводилось в таких дозовых интервалах (обычно от 5 до 100 крад), чтобы вызвать редкие одноцепочечные разрывы в ДНК (в среднем один разрыв на участок от 10 до 250 т. п. н.). Оказалось, что в клетках культуры тканей разного происхождения пропорционально увеличению дозы облучения происходило почти полное (до 95 %) подавление включения метки в РНК (рис. 34). Подавлялся синтез как гетерогенной ядерной РНК (про-мРНК), так и рибосомной РНК. Существенно, что размер транскриптов под влиянием облучения практически не изменялся опять-таки в случае как рРНК, так и про-мРНК. Следовательно, блок синтеза РНК шел по закону все или ничего: или транскрипция в данной транскрипционной единице шла нормально, или она полностью блокировалась.
![Рис. 34. Действие рентгеновского облучения на транскрипцию. а - подавление синтеза РНК в клетках CV-1 после облучения при 0° (1), 37° (2) и при облучении при 0° с последующей двухчасовой инкубацией при 37° (3). После описанных процедур клетки инкубировали с [><sup>3</sup>Н]-уридином в течение 5 мин; б - ингибирование синтеза общей (в основном рибосомной) РНК (1) и гяРНК (2). Синтез последней измерялся в присутствии актиномицина D (0,05 мкг/мл); в - отсутствие ингибирования рентгеновским облучением синтеза РНК в изолированных ядрах в присутствии сульфата аммония (1) или саркозила (2); г - определение размеров РНК, синтезированной в течение 4 мин после облучения клеток CV-1. РНК подвергали ультрацентрифугированию в градиенте сахарозы в денатурирующем растворе; 1 - РНК из контрольных клеток; 2 - РНК из клеток, облученных дозой 50 крад. Видно, что облучение не сказывается на размерах синтезированной после этого РНК; д - определение числа одноцепочечных разрывов в ДНК после облучения клеток. Использовался тот же метод, что и в г; 1 - ДНК из контрольных клеток; 2 - ДНК из клеток, облученных дозой 20 крад при 37°; 3 - то же, но после дополнительной инкубации в течение 40 мин при 37° (репарация разрывов); T4 и Т7 - положение маркеров ДНК фагов T4 и Т7. Видно, что число одноцепочечных разрывов в ДНК после облучения весьма невелико и уменьшается в ходе репарации, е - нечувствительность синтеза РНК у Е. coli к рентгеновскому облучению. Приведены кривые зависимости от дозы облучения синтеза РНК в клетках куриных эритробластов (У) и Е. coli {2). Облучение вели при 0°, включение [<sup>3</sup>Н]-уридина - 4 мин при 37° (по результатам, полученным A. H. Лучником и соавт.)](pic/000043.jpg)
Рис. 34. Действие рентгеновского облучения на транскрипцию. а - подавление синтеза РНК в клетках CV-1 после облучения при 0° (1), 37° (2) и при облучении при 0° с последующей двухчасовой инкубацией при 37° (3). После описанных процедур клетки инкубировали с [3Н]-уридином в течение 5 мин; б - ингибирование синтеза общей (в основном рибосомной) РНК (1) и гяРНК (2). Синтез последней измерялся в присутствии актиномицина D (0,05 мкг/мл); в - отсутствие ингибирования рентгеновским облучением синтеза РНК в изолированных ядрах в присутствии сульфата аммония (1) или саркозила (2); г - определение размеров РНК, синтезированной в течение 4 мин после облучения клеток CV-1. РНК подвергали ультрацентрифугированию в градиенте сахарозы в денатурирующем растворе; 1 - РНК из контрольных клеток; 2 - РНК из клеток, облученных дозой 50 крад. Видно, что облучение не сказывается на размерах синтезированной после этого РНК; д - определение числа одноцепочечных разрывов в ДНК после облучения клеток. Использовался тот же метод, что и в г; 1 - ДНК из контрольных клеток; 2 - ДНК из клеток, облученных дозой 20 крад при 37°; 3 - то же, но после дополнительной инкубации в течение 40 мин при 37° (репарация разрывов); T4 и Т7 - положение маркеров ДНК фагов T4 и Т7. Видно, что число одноцепочечных разрывов в ДНК после облучения весьма невелико и уменьшается в ходе репарации, е - нечувствительность синтеза РНК у Е. coli к рентгеновскому облучению. Приведены кривые зависимости от дозы облучения синтеза РНК в клетках куриных эритробластов (У) и Е. coli {2). Облучение вели при 0°, включение [3Н]-уридина - 4 мин при 37° (по результатам, полученным A. H. Лучником и соавт.)
Чтобы проверить состояние самой "транскрипционной машины", выделяли ядра и после частичного или полного удаления гистонов экстракцией 0,25 М сульфатом аммония или саркозилом определяли в них уровень транскрипции. Оказалось, что в этих условиях транскрипция вообще не изменялась под влиянием облучения. Следовательно, транскрипционная машина была в порядке, в самой ДНК-матрице никаких препятствий не возникало, и, скорее всего, транскрипция подавлялась в результате структурных перестроек в хроматине под влиянием одноцепочечных разрывов в ДНК, ведущих к релаксации торзионно напряженного активного хроматина. Можно предположить, что при этом происходит замена развернутых нуклеосом "нормальными" неактивными хромосомами. Однако пока это чисто гипотетическое предположение.
Измеряя молекулярную массу денатурированной ДНК из исходных и облученных клеток, можно определить число однонитевых разрывов в ДНК и приближенно рассчитать средний размер мишени, одноцепочечный разрыв в которой инактивирует в ней транскрипцию. Оказалось, что для клеток млекопитающих он составляет 100-200 т. п. н. Эти величины несколько выше, чем определяемые биохимическими методами размеры петли (см. разд. 3.4), но довольно хорошо соответствуют размерам репликонов. В то же время можно вспомнить, что именно начала репликации формируют наиболее устойчивые участки прикрепления ДНК к ядерному скелету (см. разд. 3.4). Весьма вероятно, что именно репликоны и представляют собою независимые топологические домены ДНК.
Интересно, что чувствительность транскрипции к рентгеновскому облучению у данного вида хорошо коррелирует со средними размерами репликонов, а также с размерами петель, определенными разными методами. Соответствующие результаты приведены в табл. 6. Корреляция между размерами топологических доменов и чувствительностью процесса транскрипции хорошо согласуется с постулируемым механизмом действия рентгеновского облучения. Более того, недавно на клетках культуры дрозофилы была установлена разная чувствительность к рентгеновскому облучению для разных генов, коррелирующая не с размерами самих генов, а с размерами доменов, в состав которых входят эти гены.

Таблица 6. Обратная корреляция между дозой облучения, необходимой для блока транскрипции, и предположительными размерами петли (по результатам, полученным А. Н. Лучником и соавт.)
Одноцепочечные разрывы, вызванные облучением, репарируются, причем скорость репарации в клетках разных типов различна. В описываемых опытах была обнаружена взаимосвязь между ходом репарации одноцепочечных разрывов и восстановлением транскрипции, что служит дополнительным подтверждением зависимости последней от топологии ДНК в составе петли.
Наконец, было изучено влияние рентгеновского облучения на синтез РНК в бактериальных клетках. При тех же дозах облучения в них накапливалось такое же число одноцепочечных разрывов, но это никак не сказывалось на уровне транскрипции. Известно, что у бактерий, где нет гистонов, вся ДНК в клетке находится в суперспирализованном состоянии. При этом релаксация активирует примерно 15 % генов и ингибирует другие 15 % генов. Остальные гены не чувствительны к релаксации. Поэтому неудивительно, что релаксация ДНК практически не сказывается на общем уровне транскрипции в клетках бактерий. Опыты на бактериях служат дополнительным контролем, ибо они указывают на нечувствительность транскрипции, как таковой, к рентгеновскому облучению.
Резюмируя полученные результаты, можно с большой долей вероятности предположить, что релаксация ДНК в транскрипционно активном хроматине сразу останавливает процесс транскрипции, причем РНК-полимеразы, уже начавшие транскрипцию, тем не менее останавливаются. Очевидно, это связано с перестройками хроматиновой матрицы при снятии торзионных напряжений.
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'