
2.3.3. Тонкая структура генов человека: "Новая генетика"
Казалось бы, что на рубеже 70-х гг. молекулярная биология достигла определенной степени завершенности: были установлены структура [1347] и механизмы репликации ДНК, провозглашена "центральная догма" экспрессии гена (транскрипция, трансляция), выяснены основные аспекты регуляции активности гена. В этот период главным объектом молекулярно-генетических исследований были микроорганизмы. Переход к эукариотам (включая человека) встретился с дополнительными проблемами и трудностями, и кроме того, существовавшие в то время методы не позволяли рассчитывать на получение принципиально новых результатов. Стремительный прорыв в развитии молекулярной генетики в начале 70-х гг. стал возможен благодаря появлению нового экспериментального инструмента - рестрикционных эндонуклеаз. Был открыт путь для широкомасштабного получения генных продуктов (физиологически значимых белков) и для генетического манипулирования с различными организмами. Наши знания о структуре и функции генетического материала у эукариот, включая человека, заметно пополнились. Новые, совершенно неожиданные факты, имеющие как теоретическое, так и практическое значение, были открыты в разных областях, таких, как действие гена, популяционная генетика, эволюция и генетическая консультация, включая пренатальную диагностику (разд. 4.3 и 9.1). Достигнутые успехи заставили ученых задуматься об этической стороне манипулирования с человеческим зародышем, об опасности возникновения возбудителей в процессе генно-инженерных исследований. Многие из этих вопросов были подняты самими учеными, активно работающими в данной области. В настоящее время большинство исследователей считает, что опасения, касающиеся генной инженерии, не имеют достаточных оснований, но многие этические проблемы остаются нерешенными и продолжают возникать новые.
В прошлом генетика человека и медицинская генетика развивались как относительно независимые отрасли науки, теперь многие их разделы оказались вовлеченными в общее русло молекулярно-генетических исследований, и провести между ними грань - трудно. В рамках учебника невозможно описать в деталях все молекулярно-биологические методы, которые привели к столь внушительному прогрессу генетики человека, поэтому следует обратиться к более специальным источникам [366; 493; 60]. Однако принципы новых подходов должны быть понятны всем исследователям, даже тем, кто изучает эволюцию или генетику поведения. В следующем разделе в качестве примера описывается анализ β-глобинового генного кластера человека (разд. 4.3). Кроме методов, основанных на использовании рестрикционных ферментов, обсуждаются также методы гибридизации нуклеиновых кислот, секвенирования ДНК и сортировки хромосом при помощи цитофлуорометрии.
2.3.3.1. Анализ гена человека
β-глобиновый ген. Молекула гемоглобина, а также клинические и биохимические последствия ее изменений будут детально описаны в разделе 4.3. Гемоглобин взрослого человека HbA1 состоит из четырех полипептидных цепей - двух α и двух β. И раньше было известно, что ген β-цепи тесно сцеплен с некоторыми другими генами гемоглобина, в частности с геном у-цепи, входящей в состав фетального гемоглобина, и геном γ-цепи гемоглобина HbA2, в небольших количествах обнаруживаемого у взрослого человека. β-Глобиновый кластер генов в настоящее время полностью идентифицирован и проанализирован молекулярными методами. Каковы основные этапы этого анализа и какие при этом используются методы?
Этапы анализа. Анализ глобинового белка, входящего в состав гемоглобина (разд. 4.3.1 и 4.3.2), был завершен к началу 60-х г. Цепь β состоит из 146 аминокислот. Вся транскрибируемая часть этого гена должна содержать поэтому 438 нуклеотидов (3×146=438). Длина такой нуклеотидной цепочки равна 1500 Å. Этот маленький кусочек нужно идентифицировать в нити ДНК общей длиной 2 м. Чтобы оценить трудность такой задачи, представим себе эти величины в другом масштабе: в нити длиной 20 км необходимо отыскать кусочек размером в 1,5 мм. В идеале необходимо расшифровать весь β-глобиновый кластер генов. Чтобы получить полную характеристику структуры, экспериментальная стратегия должна соответствовать следующим условиям:
- соответствующие фрагменты ДНК должны быть идентифицированы однозначно;
- они должны быть выделены и накоплены в количестве, достаточном для биохимического анализа;
- должна быть определена вся нуклеотидная последовательность. Принципы, на которых основаны эти три метода, кратко будут описаны ниже. Мы начнем с описания второго, поскольку прогресс в выделении и клонировании генов был решающим для развития новой генетики.
2.3.3.2. Рестрикционные эндонуклеазы
Первые наблюдения. Заражая фагом λ различные штаммы E. coli, Арбер [296] обнаружил, что ДНК этого фага при пассаже через бактерию разрезается и теряет свою инфекционность. Оказалось, что ни классические рекомбинационные процессы, ни мутации в этом не участвуют. Более того, такая судьба постигала не только фаговую, но и любую чужеродную ДНК, попадающую в бактерию. Такое разрезание (рестрикцию) следует рассматривать как защитный механизм клетки. Как было показано в дальнейшем, рестрикция чужеродной ДНК осуществляется ферментами, называемыми рестрикционными эндонуклеазами (рестриктазами). Встает вопрос, почему рестриктазы не разрезают ДНК собственной клетки. Ответ был найден Арбером и состоял в следующем. Эти ферменты вступают в реакцию с определенными участками в ДНК, так называемыми сайтами узнавания, которые в клетке защищены метальными группами (метилированы). Правда, первые из открытых эндонуклеаз не были специфическими, а действовали случайным образом. Первой рестриктазой, которая расщепляла ДНК в строго определенном месте, была Hind, открытая Смитом в конце 60-х гг. [496]. Этот фермент впервые использован Натансом и соавт. для создания рестрикционной карты генома вируса SU40 [457]. Берг уловил особое свойство двухцепочечной ДНК формировать при обработке рестриктазами так называемые "липкие концы". После разрезания одна из цепей оказывается длиннее другой на несколько нуклеотидов. Эти нуклеотиды могут свободно спариваться с другими, например с комплементарными нуклеотидами другого фрагмента ДНК с липкими концами [299]. Благодаря этому ДНК из различных источников может объединяться, образуя рекомбинантные молекулы.
Принципы технологии рекомбинантных ДНК [2397; 60; 493]. Было выделено много рестриктаз (более 150), расщепляющих ДНК в специфических сайтах [117]. Например, эндонуклеаза RI рестрицирует двухцепочечную ДНК по двум сайтам таким образом, что образуются два липких конца:
Липкие концы различных молекул ДНК, расщепленных этим ферментом, могут вступать в комплементарное взаимодействие по четырем А-Т-парам. Рестрикционные эндонуклеазы различаются по тем сайтам в ДНК, которые они распознают и разрезают. Их можно использовать для различных целей. Однако наиболее распространенным этапом является их применение для амплификации специфической ДНК, что необходимо для определения нуклеотидных последовательностей фрагментов ДНК или для изучения механизмов экспрессии генов. Последняя проблема наиболее важна в практическом аспекте: гены, контролирующие образование функционально активных белков, теперь можно вводить в бактерии и размножать (амплифицировать). Эта процедура называется клонированием генов. Благодаря ей появилась возможность нарабатывать в больших количествах белки, которые раньше удавалось получить ничтожно мало. Эта технология основана на следующем принципе: помимо своей собственной кольцевой хромосомы бактерии часто содержат дополнительные маленькие кольцевые молекулы двухцепочечной ДНК, называемые плазмидами. Плазмиды реплицируются автономно и сами могут содержать гены, определяющие устойчивость бактерий к антибиотикам и/или контролирующие синтез веществ, например, колицинов, убивающих другие бактерии (рис. 2.83). Плазмидную ДНК можно выделить и расщепить подходящей рестриктазой только в одном сайте, превратив кольцевую молекулу в линейную с липкими концами. Фрагменты любой чужеродной ДНК с такими же липкими концами (полученными после разрезания аналогичной рестриктазой) можно сшить с плазмидной ДНК с помощью лигазы.
![Рис. 2.83. Клетка E. coli с хромосомой и плазмидой [2327]](pic/000104.jpg)
Рис. 2.83. Клетка E. coli с хромосомой и плазмидой [2327]
Рекомбинантную конструкцию вводят затем в бактерию, где она реплицируется (рис. 2.84). Источник экзогенной ДНК не имеет значения. ДНК может быть получена, например, из клеток человека, но можно сшивать и искусственно синтезированные гены. Кроме бактериальных плазмид в качестве векторов (носителей) ДНК используют фаги λ (объект исследований Арбера). Часть генома этого фага не обязательна для его размножения в бактерии. Вместо него можно ввести чужеродную ДНК, которая будет размножаться вместе с фаговой после инфицирования бактерий.
![Рис. 2.84. Принцип введения чужеродной ДНК в бактериальную плазмиду с использованием эндонуклеазы RI [2397]](pic/000105.jpg)
Рис. 2.84. Принцип введения чужеродной ДНК в бактериальную плазмиду с использованием эндонуклеазы RI [2397]
Добиться репликации и амплификации в составе плазмидной (или фаговой) ДНК после трансформации (или соответственно трансфекции) бактериальной клетки еще не значит решить все проблемы. Прежде всего возникают два вопроса:
- Как распознать клоны, содержащие гибридную ДНК, среди потомства трансформированных клеток или живых бактериофагов?
- Как идентифицировать необходимые фрагменты ДНК среди многих клонированных неизвестных фрагментов?
Например, можно отбирать бактериальные клетки, если они несут плазмиду с фактором устойчивости к антибиотику, выращивая их на среде, содержащей этот антибиотик. Нетрансформированные клетки без плазмид (и, следовательно, без гена устойчивости к антибиотику) просто не будут расти на такой среде. В последние годы разработано много специальных методов селекции, которые позволяют отбирать только рекомбинантные клетки, но мы пока не будем их здесь подробно описывать.
Для генной инженерии белков недостаточно отобрать и размножить определенные фрагменты ДНК, необходимо еще индуцировать их экспрессию в клетке. Для этого необходимо "подключить" рекомбинантную молекулу к "машине", которая обеспечивает транскрипцию ДНК, последующую трансляцию матричной РНК и процессинг как на транскрипционном, так и на трансляционных уровнях.
Идентификация и анализ генов. Еще одна область применения рестриктаз - идентификация и определение числа генов [332]. Эти задачи решаются с помощью метода, разработанного Саузерном (1975; [492]).
Тотальную ДНК из клеток человека гидролизуют эндонуклеазой примерно на 500000 фрагментов длиной от 102 до 105 нуклеотидных пар. Затем фрагменты разделяют по молекулярной массе с помощью гель-электрофореза в агарозе, после чего ДНК денатурируют щелочью прямо в геле, чтобы получить одноцепочечные фрагменты. Их переносят на нитроцеллюлозный фильтр и фиксируют высушиванием при 80°С. В результате получается отпечаток (реплика) картины разделения фрагментов ДНК по их размеру. Эти фрагменты можно идентифицировать методом гибридизации с радиоактивными ДНК-зондами, специфичными для определенных генов или хромосом. Любой фрагмент, содержащий всю последовательность зондируемого гена или его часть, будет выглядеть на радиоавтографе в виде темной полосы (рис. 4.60).
Зонды и генные библиотеки. Главное условие такого анализа - наличие подходящего геноспецифического радиоактивного ДНК-зонда, который можно использовать для гибридизации (табл. 2.13). В тех случаях, когда имеется в распоряжении матричная РНК, например для β-глобина, специфический зонд можно получить при помощи фермента обратной транскриптазы. Этот фермент катализирует считывание нуклеотидной последовательности мРНК в комплементарную последовательность ДНК, так называемую кДНК (сама мРНК для гибридизации обычно не используется, поскольку трудно получить ее препараты с достаточно высокой радиоактивной меткой). Для создания библиотеки кДНК может быть использована мРНК из разных источников. Такие библиотеки содержат в основном уникальные нуклеотидные последовательности активно транскрибирующихся структурных генов или их частей, а также последовательности ДНК из их ближайшего окружения. Эти библиотеки используют в основном для обнаружения и характеристики таких генов. Находят свое применение и геномные библиотеки. Их получают путем фрагментирования ДНК рестрикционными эндонуклеазами и последующего клонирования отдельных рестриктов в векторах. Такие библиотеки удобно использовать, например, для обнаружения в геноме комплементарных участков. Нередко в пределах определенной последовательности ДНК обнаруживается рестрикционный полиморфизм. Это значит, что сайты рестрикции могут варьировать у разных индивидов (разд. 2.3.2.7). В таких случаях зонды можно использовать для классических исследований сцепления в семьях с помощью методов, описанных в разд. 3.4.2.
![Таблица 2.13. ДНК-зонды, имеющие потенциальное значение для медицины (см. также [328а])](pic/000106.jpg)
Таблица 2.13. ДНК-зонды, имеющие потенциальное значение для медицины (см. также [328а])
Работа с геномной библиотекой весьма трудоемка, учитывая размеры генома человека и количество фрагментов, из которых необходимо отобрать один-единственный, "интересующий" исследователя. Для решения многих вопросов предпочтительнее располагать хромосомо-специфической библиотекой. Её создание требует выделения отдельных хромосом. В настоящее время это стало возможным благодаря сортировке хромосом цитофлуорометрическим методом (разд. 2.3.2.5). Для синтеза кДНК используется также такое мощное средство, как синтетические олигонуклеотиды, особенно в тех случаях, когда мРНК недоступна [390; 476; 527; 539]. Зная генетический код, можно сконструировать, например, кДНК структурного гена определенного белка, аминокислотная последовательность которого известна. В настоящее время существуют автоматические устройства для синтеза любых нуклеотидных последовательностей желаемой длины.
Если ген идентифицирован и особенно если доступен его первичный продукт в виде мРНК, то анализ тонкой структуры гена можно осуществить на основе комплекса методов, часть из которых описана ниже более детально. Конечной целью таких исследований являются расшифровка полной нуклеотидной последовательности определенного генетического района и установление присущих конкретным группам нуклеотидов специфических функций в транскрипции и ее контроле.
2.3.3.3. Гибридизация нуклеиновых кислот
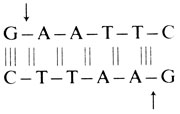
Принцип. В разд. 2.3.1.1 мы уже упоминали метод идентификации ДНК-повторов, основанный на разделении двойных цепей при повышении температуры и их реассоциации при быстром снижении температуры. Таким образом, в этом методе используется способность комплементарных цепей нуклеиновых кислот гибридизоваться одна с другой и образовывать двойную спираль. То же свойство используется для идентификации разделенных гель-электрофорезом фрагментов ДНК в методе Саузерна (Southern blotting, разд. 2.3.2.2). Способность к гибридизации цепей ДНК лежит в основе многих методических приемов молекулярной биологии, поэтому более подробное описание принципа гибридизации будет полезным. Большинство природных ДНК встречается в виде двухцепочечных молекул. Их устойчивость поддерживается благодаря тому, что пиримидиновое основание цитозин (C) спаривается с пуриновым основанием гуанином (G), в то время как пиримидиновое основание тимин (T) спаривается с пуриновым основанием аденином (A). Эти комплементарные пары оснований удерживаются водородными связями (тремя в паре G-C и двумя в паре A-T), которые относительно легко разрываются, но и быстро восстанавливаются, при этом одноцепочечные фрагменты ДНК, присутствующие в растворе, снова формируют двойную спираль. Для реассоциации не имеет значения происхождение одноцепочечной ДНК, не требуется даже полной комплементарности отдельных цепей. Реассоциация происходит даже тогда, когда какая-то часть оснований в каждой цепи не комплементарна (рис. 2.85).
Рис. 2.85. Принцип ДНК или РНК гибридизации. А. Нуклеотидные цепи в растворе. Б. Гибридизация цепей в соответствии с правилами спаривания: тимин образует пару с аденином, цитозин с гуанином. В. Гибридизация может происходить даже при неполной гомологии, важно, чтобы различия не были слишком велики
Одноцепочечная ДНК может спариваться (гибридизоваться) даже с РНК, если у них есть комплементарные основания.
"Прогулка по хромосоме". Метод гибридизации полезно использовать, например, для анализа очень протяженного гена. При этом с помощью подходящего зонда из геномной библиотеки ДНК извлекается первоначально какая-то часть такого гена. Нуклеотидная последовательность этой части гена будет, как правило, длиннее зонда, и ее концы будут перекрываться с другими фрагментами данного гена в этой библиотеке, т. е. будут по крайней мере частично гибридизоваться с ними. Свободные концы этих фрагментов будут гибридизоваться со следующими и т. д., пока весь структурный ген не будет полностью идентифицирован серией перекрывающихся фрагментов. Именно таким образом был реконструирован структурный ген фактора свертывания крови VIII человека, необычно длинный, состоящий из 180000 пар нуклеотидов. Реконструкцию начинали с олигонуклеотидного зонда длиной всего в 36 нуклеотидов. Описанный ранее метод, когда сначала выделяется специфическая мРНК, а затем с помощью обратной транскриптазы на ней синтезируется кДНК, в данном случае оказался непригоден из-за низкой концентрации мРНК. Олигонуклеотидный зонд был синтезирован на основе аминокислотной последовательности фрагмента белка фактора VIII, и ее комплементарность оказалась достаточной для эффективной гибридизации. Полный анализ гена фактора VIII описан в разд. 2.3.7.
Гибридизация in situ. Метод гибридизации in situ особенно удобен для анализа эукариотических геномов методами молекулярной цитогенетики. Препарат метафазных хромосом обрабатывают радиоактивным ДНК-зондом в условиях, позволяющих этому зонду гибридизоваться с хромосомной ДНК. Таким образом исследуемый ген можно локализовать в специфическом хромосомном сегменте. На первых этапах применение этого метода ограничивалось идентификацией в хромосомах только высокоповторяющихся нуклеотидных последовательностей, в частности сателлитной ДНК. Но даже только эти данные позволили сделать важные выводы относительно эволюции человека (разд. 7.2.2). Позже метод гибридизации in situ был усовершенствован настолько, что теперь с его помощью можно локализовать в хромосомах даже уникальные гены, такие, например, как ген инсулина ([377] гл. 3). Для этого используют статистический анализ распределения радиоактивной метки по длине отдельных хромосом во многих метафазных препаратах.
В качестве примера рассмотрим теперь основные этапы анализа гена тяжелой цепи миозина [482]. Вначале был получен кДНК-зонд для гена тяжелой цепи миозина кролика. Поскольку гомологичные гены различных млекопитающих в общем сходны, их гибридизация проходит без затруднений. Зонд клонировали в плазмиде и выделенную затем ДНК метили тритием (3H) с помощью ник-трансляции (nick translation). Для этого ДНК инкубировали с небольшим количеством ДНКазы-1, которая вносит несколько одноцепочечных разрывов в двухцепочечную ДНК. Затем добавляли радиоактивно меченные нуклеотиды и ДНК-полимеразу, при этом меченые нуклеотиды встраивались в ДНК-зонд.
Препараты митотических хромосом получали из культуры лимфоцитов, подвергали специальной обработке с целью денатурации хромосомной ДНК и затем проводили гибридизацию с меченным тритием ДНК-зондом в течение 16-18 ч при 40°С.
После отмывания препаратов с целью удаления несвязавшейся или неспецифически адсорбированной ДНК их экспонировали в течение 3 недель для получения радиоавтографов. После окрашивания акрихин-ипритом (Q-метод) препараты сфотографировали. На рис. 2.86 показана типичная метафазная пластинка, а на рис. 2.87 - распределение метки по отдельным сегментам всех хромосом человека. Как видно, основная масса метки обнаруживается на коротком плече хромосомы 17 в сегменте 17pl.2 → pter. На основании этого был сделан вывод, что ген тяжелой цепи миозина расположен в хромосоме 17. Поскольку данный эксперимент был проведен с зондом кДНК, мы не вправе утверждать, что идентифицированный миозиновый ген является действительно активным. Он может быть и "псевдогеном", т. е. такой последовательностью ДНК, которая структурно гомологична активному гену миозина, но сама не транскрибируется, т. е. не детерминирует синтез миозина, поскольку лишена каких-то важных фланкирующих последовательностей вне транскрибируемой части. Такие псевдогены были обнаружены, например, в пределах кластеров α- и β-глобиновых генов (разд. 4.3). Все большее число генов человека успешно локализуется в хромосомах с помощью этого метода (разд. 3.4, табл. 2.14).
![Рис. 2.86. Гибридизация in situ гена тяжелой цепи миозина. Фотография в фазовом контрасте метафазы после гибридизации с 3H-меченным кДНК-зондом и экспонирования в радиоавтографической эмульсии в течение 20 дней. Стрелка указывает на зерно серебра в теломерном участке короткого плеча хромосомы 17.(По [482].)](pic/000108.jpg)
Рис. 2.86. Гибридизация in situ гена тяжелой цепи миозина. Фотография в фазовом контрасте метафазы после гибридизации с 3H-меченным кДНК-зондом и экспонирования в радиоавтографической эмульсии в течение 20 дней. Стрелка указывает на зерно серебра в теломерном участке короткого плеча хромосомы 17.(По [482].)
![Рис. 2.87.Распределение зерен серебра в 36 метафазах после гибридизации с кДНК-зондом тяжелой цепи миозина. Гистограмма построена по результатам анализа, основанного на разделении гаплоидного кариотипа человека на 110 равных отрезков (хромосомы изображены как одна квазинепрерывная последовательность). Число меченых участков указано для каждого сегмента. Обнаружен кластер зерен в коротком плече хромосомы 17. (По [482].)](pic/000109.jpg)
Рис. 2.87.Распределение зерен серебра в 36 метафазах после гибридизации с кДНК-зондом тяжелой цепи миозина. Гистограмма построена по результатам анализа, основанного на разделении гаплоидного кариотипа человека на 110 равных отрезков (хромосомы изображены как одна квазинепрерывная последовательность). Число меченых участков указано для каждого сегмента. Обнаружен кластер зерен в коротком плече хромосомы 17. (По [482].)

Таблица 2.14. Некоторые гены человека, идентифицированные с помощью гибридизации
2.3.3.4. Секвенирование ДНК [117; 122; 381]
Последовательность нуклеотидов и генетический код. Методы определения последовательности аминокислот в полипептидной цепи были известны еще в 50-х гг. Теоретически это относительно легкая проблема, поскольку все 20 аминокислот, встречающиеся в природных белках, имеют разные свойства. С другой стороны, нуклеотидная последовательность ДНК относительно однородна по составу элементарных звеньев, так как содержит только четыре типа азотистых оснований - гуанин, цитозин, аденин и тимин. Когда еще в 60-х г. был расшифрован генетический код, появилась возможность восстанавливать (дедуцировать) нуклеотидную последовательность транскрибируемой ДНК по аминокислотной последовательности соответствующего белка. Однако генетический код является вырожденным, то есть одной и той же аминокислоте соответствуют несколько разных нуклеотидных триплетов. Следовательно, суждения о нуклеотидной последовательности, основанные на последовательности аминокислот в белке, не однозначны. Кроме того, последовательности аминокислот не содержат никакой информации о последовательности некодирующих участков ДНК. В настоящее время разработаны методы непосредственного секвенирования ДНК [117]. Принцип состоит в следующем: длинную молекулу ДНК фрагментируют при помощи агентов, расщепляющих ее в специфических сайтах. Затем определяют последовательность нуклеотидов в каждом из этих фрагментов. Очередность фрагментов в целой молекуле восстанавливают, используя перекрывающиеся концы: идентичные цепи разрезают повторно другой рестриктазой, а затем последовательности перекрывающихся фрагментов, образующихся при обработке двумя рестриктазами разной специфичности, сравнивают. Так может быть реконструирована полная последовательность. В пределах отдельных фрагментов порядок нуклеотидов определяют с помощью специальных методов. Раньше секвенирование ДНК было весьма трудным делом, теперь же оно осуществляется довольно легко и быстро. Для этого необходимо длинную молекулу ДНК с помощью рестриктазы разделить на фрагменты удобного размера, а затем, если нужно, размножить их путем клонирования (разд. 2.3.2.2). В настоящее время секвенируют очень длинные молекулы ДНК. Например, определены уже последовательности всей митохондриальной ДНК человека (разд. 2.3.5) и семейства β-глобиновых генов (разд. 4.3). С помощью секвенирования ДНК можно получить более точные сведения и о нетранскрибируемых участках ДНК, важных для контроля транскрипции (так называемые операторы и промоторы).
2.3.3.5. Сортировка хромосом при помощи цитофлуорометрии
Зачем нужны сортировка хромосом и препараты отдельных хромосом? Сортировка хромосом методом цитофлуорометрии используется в двух разных целях: 1) для идентификации и количественного анализа рисунка флуоресценции большого числа хромосом в течение очень короткого времени; 2) для препаративного разделения хромосом. Этот метод имеет два преимущества перед стандартными методами анализа хромосом: он автоматический, благодаря чему исключается элемент субъективности, и он намного быстрее. Например, некоторые хромосомные аберрации настолько малы, что их невозможно обнаружить обычными методами, но при определенных условиях они идентифицируются с помощью цитофлуорометрии.
Однако важнее, что этот метод позволяет препаративно разделять хромосомы, и при наличии специфических зондов исследовать структуру и функцию отдельных генов становится относительно просто. В этом случае ген можно локализовать в хромосоме с помощью гибридизации in situ, размножить его ДНК путем клонирования и секвенировать. Можно исследовать таким же образом и генетический материал некодирующих участков гена. Основой для такого рода исследований являются геномные библиотеки ДНК. Однако их неудобство состоит в том, что обычно трудно или невозможно отобрать из огромного количества фрагментов интересующие нас последовательности. Кроме того, изучение распределения ДНК по различным хромосомам нередко само по себе является важным предметом исследования. Для такого рода работ необходимы библиотеки ДНК отдельных хромосом или даже их отдельных фрагментов.
Физический принцип [364] становится ясен из рис. 2.88. На нем изображена однолучевая система, но используют также и двулучевые системы, в которых применяются два разных пучка света. Для анализа с помощью двулучевой системы хромосомы окрашивают двумя красителями с максимумом флуоресценции при разных длинах волн. Затем митотические хромосомы отделяют от остального клеточного материала и помещают в систему. Их "прогоняют" одну за другой через заполненную водой измерительную часть устройства, где они последовательно освещаются двумя лазерными пучками (например, одним ультрафиолетовым, а другим - видимым светом с длиной волны 459 нм). Два типа флуоресценции, возникающей в точке пересечения потока хромосом и лазерного пучка, собираются линзой и проецируются на отдельные фотоумножители, благодаря чему можно построить двумерное изображение (рис. 2.89) по двум одномерным для каждого красителя и длины волны. В опыте, представленном на рис. 2.89, были подобраны два таких красителя: один из них окрашивал районы, представленные в основном A-T-парами, а другой - районы с преимущественным содержанием G-C-пар. Система может включать приспособление, которое позволяет менять направление потока хромосом в зависимости от рисунка флуоресценции. С помощью такого метода получают относительно чистые препараты отдельных групп морфологически сходных хромосом и даже отдельных хромосом.
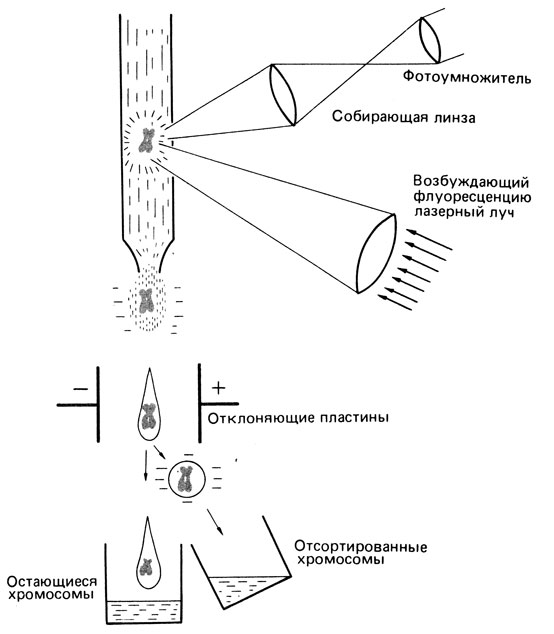
Рис. 2.88. Принцип сортировки хромосом с помощью лазера. Хромосомы окрашены флуоресцирующим красителем. Флуоресценция возбуждается лазерным лучом и измеряется для каждой хромосомы отдельно. Данные измерений используют для сортировки хромосом. (Courtesy of Dr.C. Gremer.)
![Рис. 2.89. Контурный график (интенсивность флуоресценции) двумерной лазерной сортировки хромосом из гибридных клеток 'китайский хомячок × человек', в которых осталась только человеческая Y-хромосома. Буквы А-К относятся к разным хромосомам хомячка; буква L указывает на Y-хромосому человека. А. Все хромосомы; Б. Только маленькие хромосомы. (По [330].)](pic/000112.jpg)
Рис. 2.89. Контурный график (интенсивность флуоресценции) двумерной лазерной сортировки хромосом из гибридных клеток 'китайский хомячок × человек', в которых осталась только человеческая Y-хромосома. Буквы А-К относятся к разным хромосомам хомячка; буква L указывает на Y-хромосому человека. А. Все хромосомы; Б. Только маленькие хромосомы. (По [330].)
Сортировка X- и Y-хромосом. В работе [333, 330] осуществлена препаративная проточная цитофотометрия X- и Y-хромосом человека. X-хромосома была выделена из клеточной линии с кариотипом 48,XXXX с помощью о дно лучевой сортировки. Этот материал был использован для приготовления библиотеки хромосомной ДНК после обработки рестриктазой EcoRI и клонирования в фаге λ (см. разд. 2.3.2.2). Y-хромосома отобрана с помощью двулучевого сортера из материала гибридной клеточной линии "китайский хомячок × человек". Получение клеточных гибридов будет описано в разд. 3.4.3 в связи с локализацией генов в хромосомах. Важная особенность гибридных клеток человек × мышь или человек × хомячок состоит в том, что при их размножении утрачиваются преимущественно хромосомы человека. Таким путем была получена клеточная линия, которая имела полный набор хромосом хомячка и только Y-хромосому человека. Поскольку все хромосомы хомячка отличаются от хромосомы человека в большей степени, чем сами хромосомы человека между собой, такие клеточные гибриды особенно подходят для сортировки. На рис. 2.89 показаны пики на двумерной картине: хромосома, помеченная буквой L - это Y-хромосома человека. Она отделена от остальных настолько четко, что из этого материала можно получить библиотеку ДНК этой хромосомы.
2.3.3.6. Анализ β-глобинового гена и обобщение опыта исследования одного гена
β-глобиновый ген. Разд. 2.3.2.1 начинался с анализа структуры β-глобинового гена, которая была раскрыта благодаря использованию новых методов и подходов. Наиболее важные из них описаны в предыдущем разделе, однако теперь мы снова вернемся к анализу данного гена.
Как уже говорилось, первым этапом является идентификация этого гена в необозримом "море" человеческой ДНК. Для этого ее выделяют из клеток, затем рестрицируют. Образовавшиеся фрагменты разделяют по длине с помощью агарозного гель-электрофореза. Фракционированные фрагменты денатурируют и переносят на нитроцеллюлозные фильтры методом блотинга (промакивания) по Саузерну, в результате чего на фильтре ДНК представлена уже в одноцепочечной форме и фиксирована. Следующий шаг состоит в идентификации фрагмента ДНК, содержащего β-глобиновый ген. Для этого необходим радиоактивный ДНК-зонд, который синтезируется на β-глобиновой мРНК с помощью обратной транскриптазы (мРНК → кДНК). Этот кДНК-зонд можно использовать теперь для гибридизации с геномной ДНК прямо на фильтре. Радиоавтография позволяет обнаружить фрагменты, содержащие глобиновый ген.
Данный метод пригоден и для локализации β-глобинового гена с помощью гибридизации in situ, как описано в разд. 2.3.2.3 на примере гена тяжелой цепи миозина. Ген Hbβ был локализован таким способом в коротком плече хромосомы 11 (11p; см. разд. 4.3). Для более подробной характеристики β-глобинового гена необходимо получить большое количество его ДНК, что достигается с помощью клонирования кДНК в каком-нибудь векторе, например в бактериальной плазмиде (см. разд. 2.3.2.2). Анализ семейства β-глобиновых генов проводили, сравнивая последовательности геномной ДНК в транскрибируемой области с кДНК методами электронной микроскопии; по данным секвенирования геномной ДНК внутри и вне транскрибируемых последовательностей; с помощью идентификации сигнальных последовательностей. Первый и наиболее впечатляющий результат состоял в обнаружении с помощью электронной микроскопии того факта, что геномная β-глобиновая ДНК и кДНК не совпадают по длине и при гибридизации образуют характерные петли [1329]. Последние формируются за счет тех участков геномной ДНК, которые отсутствуют в кДНК и, следовательно, не транскрибируются, поскольку кДНК является точной копией мРНК. В гене Hbβ были выявлены две такие вставочные последовательности (интроны), которые разделяют три разные кодирующие области (экзоны). Исследования, проведенные на многих других эукариотических генах, показали, что наличие интронов является скорее правилом, чем исключением. Этим гены эукариот существенно отличаются от бактериальных и вирусных генов, у которых транскрипция по всей длине одного гена не прерывается. Часто экзоны представляют собой функциональные субъединицы гена. Они могут возникать в ходе эволюции (разд. 7.2.3) как результат объединения нескольких самостоятельных генов.
Эти и более поздние исследования подтвердили выводы, сделанные на основании семейных данных об аномальных гемоглобинах (разд. 4.3.2), согласно которым имеется только один функциональный ген Hbβ, тогда как, например, гены α и γ-глобинов дуплицированы. Однако молекулярные исследования позволили выявить еще и псевдогены, они сходны с последовательностями ДНК функциональных генов, но не транскрибируются вследствие мутаций в кодирующих или фланкирующих участках. На рис. 4.44 показана область Hbβ. Кроме этого гена и его псевдогена имеются два γ-гена, один δ-ген (для δ-полипептидной цепи, входящей в состав HbA2) и гены ранних эмбриональных глобинов. Молекулярный анализ подтвердил выводы относительно структуры этой генной области, полученные на основании формально-генетического анализа и биохимии гемоглобинов (разд. 4.3), но одновременно дал много совершенно новой информации о структуре и функциональной организации эукариотических генов как таковых.
Специальные исследования помогли ответить и на вопрос о том, как происходит транскрипция и как образуется зрелая мРНК (рис. 2.90). Выяснилось, что сначала транскрибируется весь ген, включая нитроны и фланкирующие последовательности, расположенные дистальнее кодирующей области. Затем участки транскрипта, соответствующие интронам, вырезаются, 5′-конец "кэпируется" (блокируется 5-метилцитозином), а 3′-конец защищается poly А-последовательностью. Наконец, мРНК, претерпевшая такой процессинг (созревание), покидает ядро, переходит в рибосомы и используется как матрица для биосинтеза белка. Сейчас известны последовательности ДНК различных глобиновых генов. Изучение этих генов позволило решить много общих проблем, касающихся организации и экспрессии генетического материала в клетке. Вопросы, связанные с полиморфизмом глобиновых генов на генетическом, клиническом, белковом уровнях и на уровне ДНК, рассматриваются в разд. 4.3. Ряд аспектов мутационного процесса будет обсуждаться в разд. 5.1.4.3, а эволюционные аспекты - в разд. 7.2.3.
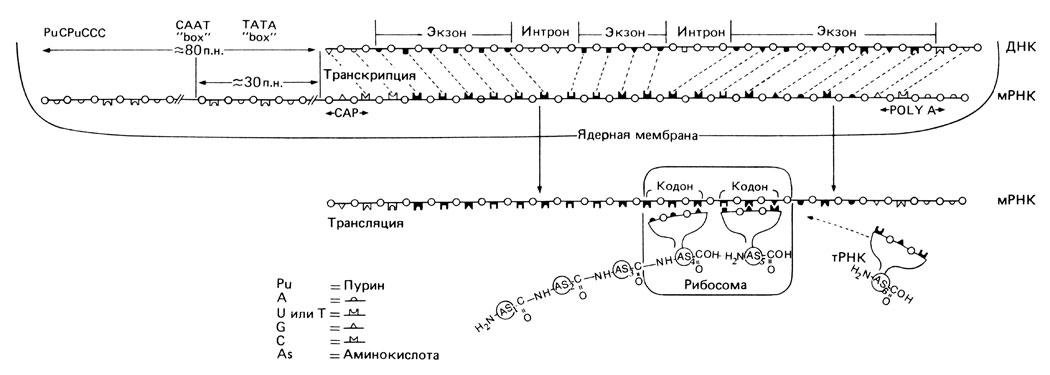
Рис. 2.90. Единичная нуклеотидная цепь ДНК с характерной специфической последовательностью оснований. На 5′-конце, где начинается транскрипция, обозначены два характерных участка: CAAT и TATA (80 и 30 п. н.). По аналогии с бактериальным геномом предполагают, что последовательность CAAT служит сайтом узнавания для РНК-полимеразы, а участок TATA является промоторным для индуцируемой полимеразой транскрипции. ДНК транскрибируется в комплементарную последовательность РНК, включая интроны. Затем РНК подвергается процессингу, интроны удаляются, 5′-конец 'кэпируется', а 3′-конец закрывается последовательностью poly А. После этого созревшая мРНК проходит через ядерную мембрану и прикрепляется к рибосоме, где генетическая информация транслируется в белковую последовательность
2.3.3.7. Структура гена фактора VIII (антигемофилический фактор)
Антигемофилический фактор (фактор VIII). Гемофилия А - "классическая" наследственная болезнь с Х-сцепленным типом наследования (разд. 3.1.4). Анализ процесса свертывания крови позволил в 50-х гг. идентифицировать белок плазмы - антигемофилический фактор (фактор VIII). Этот белок отсутствует в крови больных гемофилией А. Фактор VIII необходим для первого этапа свертывания крови-образования тромбопластина (см. разд. 4.2.2.9). В настоящее время гемофилию лечат заместительной терапией, вводя концентрат фактора VIII, что позволяет больным гемофилией вести почти нормальный образ жизни. Белковая молекула этого фактора - большая и сложная, и синтезировать ее поэтому очень трудно. Однако в настоящее время появилась надежда получать этот белок с помощью генной инженерии; расшифрована структура фактора VIII, и экспрессию соответствующего гена удалось выявить в культуре ткани [361, 362, 531, 536].
Исследовательская стратегия в изучении гена фактора VIII. Успехи в расшифровке структуры этого гена были достигнуты независимо исследовательскими группами из Сан-Франциско и из Института генетики в Бостоне. Группа из Сан-Франциско действовала следующим образом.
Был синтезирован олигонуклеотидный зонд (длиной в 36 нуклеотидов), соответствующий одному из пептидов, полученных после обработки фактора VIII трипсином. Этот очень короткий ДНК-зонд использовали для скринирования λ-фаговой библиотеки геномной ДНК человека с кариотипом 49,XXXXY. Следовательно, высокая концентрация X-специфических фрагментов ДНК была получена не при помощи сортировки хромосом, как описано ранее (разд. 2.3.2.5), а благодаря природной аномалии. Клоны, выявленные с помощью гибридизации с ДНК-зондом (разд. 2.3), имели перекрывающиеся концы, благодаря чему оказалось возможной первичная идентификация какой-то части природного гена (рис. 2.91).
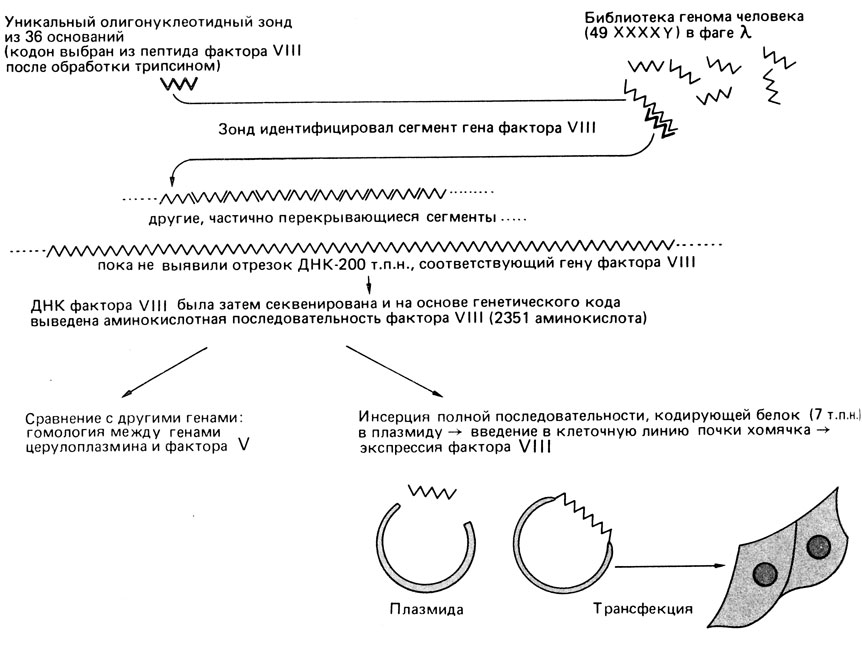
Рис. 2.91. Анализ гена фактора VIII человека, начинающийся с получения олигонуклеотидного зонда длиной в 36 оснований
Ее использовали затем для идентификации и обогащения фракции мРНК фактора VIII с помощью клеточной линии Т-гибридомы. Обогащенная фракция мРНК была нужна для получения кДНК всей кодирующей части гена (9 т. п. н.), которую затем секвенировали (разд. 2.3.2.4). Сравнивая кДНК с геномной ДНК, установили границы экзонов. Оказалось, что полный ген состоит из 186000 пар нуклеотидов. В нем было обнаружено 26 экзонов длиной от 69 до 3106 п. н., один из интронов имел длину в 32,4 т. п. н. Белок фактора VIII состоит из 2351 аминокислоты (рис. 2.92).
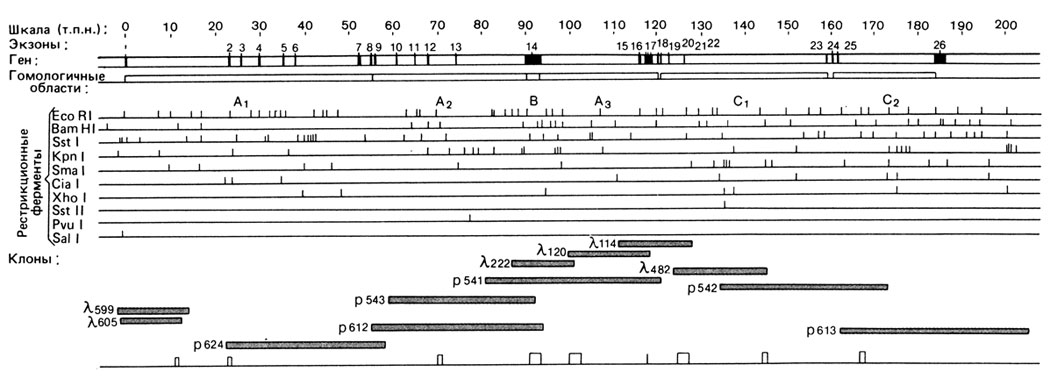
Рис. 2.92. Ген фактора VIII. Открытая полоса: ген, внутри полосы закрашены 26 экзонов. Нижний ряд линий: расположение сайтов узнавания 10 рестрикционных эндонуклеаз, использованных для идентификации. Серые прямоугольники представляют длину ДНК человека, содержащейся в каждом клоне космиды (p) и λ-фага (По Gitshier et al., Nature 312, p. 327, 1984.)
Чтобы добиться экспрессии гена в клетках млекопитающих, его кодирующую часть (∼7 т. п. н.) "сшили" с частью перекрывающейся ДНК и встроили в плазмиду между промоторами и polyA-последовательностью вирусного происхождения. Полученную рекомбинантную конструкцию с помощью метода кальций-фосфатной преципитации ввели в клетки хомячка. Для выявления экспрессии гена использовали моноклональные антитела к части белка фактора VIII. В опытных клетках по сравнению с контрольными было обнаружено 300-кратное увеличение количества перекрестно-реагирующего материала.
Важно отметить, что группа из Института генетики, работавшая в том же направлении, получила аналогичные результаты.
Значение этих исследований. В работах, суть которых мы изложили здесь весьма кратко и упрощенно, для анализа необычно сложного гена авторы изобретательно использовали многие методы молекулярной биологии. Их результаты важны по нескольким причинам.
- Впервые был проанализирован ген такой длины и сложности у человека (да и вообще у эукариот). Весьма вероятно, что многие другие гены, кодирующие длинные и сложные белки, имеют такую же длину и структуру.
- Результаты структурного анализа позволяют сделать новые выводы относительно эволюции этого гена [361], учитывая неожиданную гомологию (примерно на 35%) аминокислотной последовательности белка фактора VIII с церулоплазмином (белком, связывающим медь) (см. раздел 7.2.3).
- Есть основание надеяться, что благодаря генной инженерии лечение гемофилии А станет более безопасным и дешевым. Заместительная терапия препаратами фактора VIII представляет собой один из примеров успешной корректировки наследственного дефекта: продолжительность жизни больных гемофилией резко увеличилась, и многие из них ведут почти нормальный образ жизни. Однако это лечение не свободно от серьезных недостатков. Во-первых, оно очень дорого, поскольку фактор VIII получают из крови человека. Во-вторых, возникает серьезная опасность заразиться гепатитом или вирусом СПИД [314]. В настоящее время, чтобы избежать инфекции, препараты фактора VIII подвергают тщательному вирусологическому скринингу и прогревают. Мы полагаем, что пройдет несколько лет, прежде чем будет получен безопасный, эффективный и клинически испытанный препарат фактора VIII. Впрочем, это может случиться и к моменту выхода в свет нашей книги.
Экскурс в социологию науки. Анализ гена, о котором шла речь, был проведен двумя очень большими группами, о чем свидетельствует список авторов каждой статьи. Массированное наступление "большой науки" до недавнего времени было более типично для некоторых отраслей физики, например физики высоких энергий. Необходимость такого подхода теперь осознана и молекулярными биологами [428], однако здесь все чаще "батальоны" формируются не университетами или исследовательскими группами, а частными компаниями, поставившими перед собой конечную цель - получить продукт, пользующийся спросом. Должно ли такое развитие стать предметом серьезной озабоченности? Существует ли опасность, что коммерческие интересы слишком сильно будут влиять на развитие науки, отвлекая силы и ресурсы от научно значимых проблем и привлекая их к другим, которые сулят немедленные прибыли? Мы полагаем, что опасность не так велика. Тесные связи между фундаментальными исследованиями и промышленным использованием результатов характерны для техники и для химии. Насколько мы знаем, это не снижает качество фундаментальных исследований в этих областях науки. Для биологов, однако, эта ситуация является новой и потому требует тщательного анализа.
2.3.3.8. Семейства генов
Примеры семейства генов. Под семейством генов мы понимаем группу функционально родственных генов, имеющих сходную структуру и общее происхождение. Ярким примером генного семейства являются две глобиновые области (α- и β-глобиновые гены). Другое семейство генов включает, например, иммуноглобулиновые гены (разд. 7.4); гены рибосомной РНК (разд. 2.3.1.1); компоненты главного комплекса гистосовместимости (МНС) (разд. 3.5.5, см. также [307]). По-видимому, не существует общего правила в расположении семейств генов на хромосомах. Некоторые из них образуют кластеры, обнаруживая тесное сцепление (причем неравновесие по сцеплению может быть существенным, а может и отсутствовать). Семейство глобиновых генов формирует два кластера: Hbα на хромосоме 16 и Hbβ на хромосоме 11. Другие семейства генов, такие, например, как гены мышечных белков, рассеяны по многим различным хромосомам.
Гены актина и миозина. Биологическая функция мышц состоит в осуществлении механической работы путем сокращения. Проблема трансформации химической энергии в механическую была решена природой путем создания крайне длинных, многоядерных клеток, большая часть которых занята сократительными элементами-миофибриллами, расположенными параллельными пучками вдоль оси сокращения [120]. Механическая работа совершается благодаря взаимодействию двух видов белковых молекул - миозина и актина. Кроме мышечного сокращения актины участвуют во многих других клеточных функциях, таких, как поддержание структуры цитоскелета, движение клеток и митоз.
В настоящее время гены, детерминирующие оба типа белков - актины и миозины, подробно изучены. В одном из исследований были получены зонды кДНК для актиновых генов цыпленка и дрозофилы [344]. Их использовали для гибридизации с ядерной ДНК человека, полученной от одного индивида. ДНК была обработана рестриктазой, дающей относительно длинные фрагменты (разд. 2.3.2.2). В опытах блотинг-гибридизации было обнаружено не менее 20-30 полос. В геномной библиотеке удалось обнаружить по крайней мере 12 клонов, содержащих неперекрывающиеся рестрикционные фрагменты. Девять из них хорошо гибридизовались с мРНК актина человека, а остальные три, как оказалось, кодируют слегка отличающийся актин гладких мышц. Хотя генетический анализ сцепления не был проведен, авторы, основываясь на разных фактах, пришли к выводу, что у человека существует по крайней мере десять различных актиновых генов, тесное сцепление между которыми отсутствует и которые, возможно, локализованы в разных хромосомах. Например, каждый из исследованных клонов содержал уникальный набор фрагментов. Другие исследователи [388; 403] оценивают количество актиновых генов у человека в пределах 9-20. Актиновые гены оказались высокостабильными в эволюции. Кроме млекопитающих и дрозофилы они найдены также у дрожжей и слизневых грибов. Обнаружено, что α-актины мышц человека, кролика и крысы идентичны, хотя нетранслируемые районы гена оказались идентичными только частично. Дивергенция между генами актина скелетных мышц и актина сердечной мышцы произошла, по-видимому, задолго до эволюционной дивергенции указанных видов млекопитающих [375]. Подобно актинам, миозины существуют у человека как множественные изоферменты. Эти изоферменты появляются в ходе индивидуального развития в определенном порядке [295]. Молекулярные исследования генома привели к выводу о наличии мультигенного семейства миозинов, которое состоит из многих (возможно, более десяти) генов, расположенных далеко друг от друга.
Новый принцип генетического анализа. Обнаружение мультигенных семейств мышечных белков дало в руки исследователей новый принцип генетического анализа. До недавнего времени анализ генов начинался с выявления генетической изменчивости. Ее можно констатировать на фенотипическом уровне, например благодаря наличию наследственной болезни, или на некотором промежуточном уровне - по отсутствию функционального белка, по электрофоретическим вариантам белка или по разным антигенным детерминантам на клеточной поверхности. Фенотипическую изменчивость затем связывали с соответствующим полиморфизмом на генном уровне. Генетические варианты часто служат экспериментальным инструментом для раскрытия основных механизмов действия гена. Однако для семейства актиновых или миозиновых генов неизвестны ни нормальные, ни патологические генетические варианты. Генетический анализ начинается с белка и генов как таковых безотносительно к межиндивидуальным различиям. Это стало возможным благодаря тому, что теперь в распоряжении исследователей имеется, если нужно, большое количество матричной РНК для этих белков. В настоящее время перед медицинскими генетиками стоит задача выявить наследственные заболевания, которые могут быть вызваны генетическими изменениями актиновых или миозиновых генов. Возможно, однако (хотя и вряд ли), что такие болезни просто не существуют - либо потому что любой генетический дефект актина или миозина летален, либо потому что экспрессия гена в мультигенном семействе настолько "эластична", что мутации в одном локусе компенсируются активностью других локусов, так что отсутствует основа для каких-либо фенотипических отклонений. Анализ результатов в картировании генома человека (разд. 3.4.2) показывает, что многие гены идентифицированы и локализованы, хотя изменчивость по ним у человека так и не обнаружена. К таким генам относятся гены гистонов, рРНК и гены чувствительности к бактериальным токсинам и вирусам. Анализ структуры и действия таких генов несомненно важен.
2.3.3.9. Полиморфизм сайтов рестрикции [548; 507; 508]
Генетическая изменчивость ДНК вне кодирующих генов. При классическом анализе (1978) Кан и Дози [115] обнаружили полиморфизм ДНК, тесно сцепленный с β-глобиновым геном. Благодаря этому открытию стала возможной пренатальная диагностика серповидноклеточной анемии. Впоследствии было обнаружено много типов полиморфизма ДНК (см. разд. 6.1.3).
В публикациях по полиморфизму ДНК часто отсутствует такая важная информация, как количество обследованных индивидов. Вероятно, это обусловлено тем, что многие молекулярные биологи плохо разбираются в вопросах популяционной генетики человека. Часто авторы указывают фермент(ы), с помощью которого(ых) был открыт тот или иной полиморфизм, но не указывают те ферменты, по сайтам которых не выявлен полиморфизм. Такие данные однако необходимы для оценки как общего числа изученных сайтов, так и доли среди них полиморфных сайтов (раздел 6.1).
В чем польза изучения полиморфизма ДНК для генетики человека? Генетическая изменчивость молекул ДНК, и особенно нетранскрибируемых ее районов, по-видимому, явление намного более обычное, чем предполагалось на основе данных по белкам (разд. 6.1.2). Анализ полиморфизма ДНК проливает свет на историю популяции. Он важен также для понимания генетических механизмов эволюции, например для решения постоянно обсуждаемого вопроса о том, какая доля генетических различий между видами и между популяционными группами в пределах вида определяется естественным отбором, а какая - случайным дрейфом (разд. 7.2.3). Кроме того, анализ рестрикционного полиморфизма необходим для понимания молекулярных механизмов мутаций (разд. 5.1.4); важен он и для выяснения роли некодирующей ДНК в регуляции активности гена (разд. 4.7). По предварительным данным полиморфизм ДНК X-хромосомы отмечается реже, чем для ДНК аутосом [328]. Это соответствует выводу Оно [156] о том, что X-хромосома намного более консервативна в эволюции. Возможно, что функциональные ограничения, касающиеся структуры X-хромосомы, приложимы не только к кодирующим генам, но и ко всему генетическому материалу этой хромосомы.
Данные о рестрикционном полиморфизме оказались очень важными и для картирования генома человека. Количество генов, которые уже локализованы в специфических районах хромосом человека на основе их тесного сцепления с полиморфными сайтами ДНК, быстро увеличивается. Такое стремительное развитие открывает возможности в отношении генетического консультирования и пренатальной диагностики (разд. 9.1, о других применениях см. разд. 6.1.3). Полное картирование генома человека, когда каждую вновь выявленную мутацию можно немедленно локализовать в определенном хромосомном сегменте на основании сцепления с известным полиморфным сайтом, в настоящее время является уже вполне реальной задачей (разд. 3.4).
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'