
3.7.2. Ассоциация заболеваний с группами крови
3.7.2.1. Система ABO
Вскоре после открытия групп крови ABO были высказаны предположения об ассоциации этих антигенов с определенными заболеваниями. Первый этап исследований подобного рода достиг своей кульминации в 20-е гг. В это время некоторые авторы считали, что почти все широко распространенные заболевания ассоциируют с группами крови. Однако большинство этих исследований осуществлялось на относительно малом материале с применением неадекватных методов. Результаты оказались крайне противоречивыми. В последующие годы многие специалисты разочаровались в этой гипотезе, но в своей критике (в основном оправданной) они выплеснули "ребенка вместе с водой": долгое время считалось, что группы крови не ассоциируют с заболеваниями.
Ошибочная гипотеза ведет к важному открытию. Открытие Rh-несовместимости матери и плода впервые продемонстрировало возможность ассоциации групп крови с заболеваниями. Спустя короткое время такая связь была обнаружена и для других распространенных заболеваний.
В 1953 г. была описана ассоциация между группой крови A и раком желудка [552]. Еще раньше, в 1950 г., Стоке показал, что смертность от рака желудка в городах северной Англии в среднем выше, чем в южной Англии. По его мнению, такой эффект мог объясняться присутствием на севере некоторого вещества, являющегося раздражающим агентом для слизистой оболочки желудка. Он обнаружил слабую корреляцию уровня заболеваемости с жесткостью воды (содержанием кальция): в городах со слабокальцинированной водой больных раком желудка было меньше.
Другой группе исследователей (Aird et al, 1953; [552]) показалось более реальным, что различие в заболеваемости раком желудка на севере и юге Англии детерминировано генетически. В то время были описаны линии мышей с высокой и низкой частотой рака. В поиске возможного генетического маркера они использовали аналогию с распределением антигенов ABO. В северной Англии чаще встречается группа O, а в южной - группа A. Рабочая гипотеза авторов состояла в том, что группа О, вероятно, ассоциирует с предрасположенностью к раку желудка, что и определяет его более высокую частоту на севере Англии. Чтобы проверить эту гипотезу, они собрали сведения о больных раком в различных городах Англии и Шотландии и сравнили распределение групп крови ABO среди больных с распределением этих же антигенов в тщательно отобранных контрольных группах (как правило, это были больные, лечившиеся в тех же больницах, но по другому поводу).
В табл. 3.22 представлены результаты этого исследования. В противоположность рабочей гипотезе была обнаружена значимая ассоциация с группой крови A, а не O. Это исследование вызвало поток работ по ассоциациям групп крови с различными заболеваниями.
![Таблица 3.22. Различия в относительных частотах групп крови A и 0 у больных раком желудка и в контрольной группе (Aird et al, 1953 [552])](pic/000273.jpg)
Таблица 3.22. Различия в относительных частотах групп крови A и 0 у больных раком желудка и в контрольной группе (Aird et al, 1953 [552])
Стандартный статистический метод [959]. Прежде чем описывать наиболее важные результаты, уместно объяснить суть стандартного статистического метода, используемого в этом анализе. В двух выборках - больных и контрольной - сравниваются частоты двух признаков (или групп признаков, например, A против 0 или A+B+AB против 0). Отношение
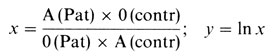
(3.10)
должно быть равно 1, если отношение A/0 одинаково в обеих выборках, т. е. если нет ассоциации. [A (Pat) - абсолютное количество индивидов с группой А в выборке больных и A(contr) - абсолютное количество индивидов с группой A в контрольной выборке]. В противном случае отношение x будет больше или меньше 1. Это отношение x обычно называют "относительной частотой". В нашем примере оно означает, что частота рака желудка у лиц с группой A в x раз выше, чем у лиц с группой 0. Значимость отклонения x от 1 можно тестировать следующим образом:
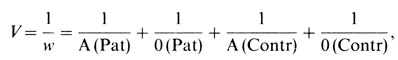
χ2 отклонения = y2w (с одной степенью свободы). Несколько оценок x можно объединить в общую оценку:

χ2 отклонения = Y2∑w (с одной степенью свободы), χ2 гетерогенности = ∑wy2 - Y2∑w (число степеней свободы = числу единичных сравнений - 1).
Стандартное отклонение
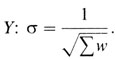
Поток исследований и их результаты [211, 145]. Приблизительно за 15 лет был выявлен ряд ассоциаций для широко распространенных заболеваний (табл. 3.23). Помимо рака желудка, который исследовали по крайней мере в 101 выборке, еще для нескольких злокачественных новообразований было показано, что риск оказаться пораженным был несколько выше для больных с группой крови A. Такая же тенденция была установлена для ряда неопухолевых заболеваний, в частности для ревматических, пернициозной анемии и в очень большой степени для тромботических и тромбоэмболических заболеваний. С другой стороны, ассоциация с группой 0 была установлена для язвенной болезни двенадцатиперстной кишки. Эти данные показывают, что группа крови A определяет хотя и малый, но значимый вклад в предрасположение ее носителей к некоторым тяжелым заболеваниям, тогда как среди здоровых стариков по сравнению с общей популяцией чаще следует ожидать носителей группы 0. Такой вывод был подтвержден в исследовании лиц старше 70 лет, которые на момент обследования обладали все еще завидным здоровьем. Различие было особенно сильным, когда контрольная выборка состояла из пожилых людей, подвергавшихся хирургическим операциям [728].
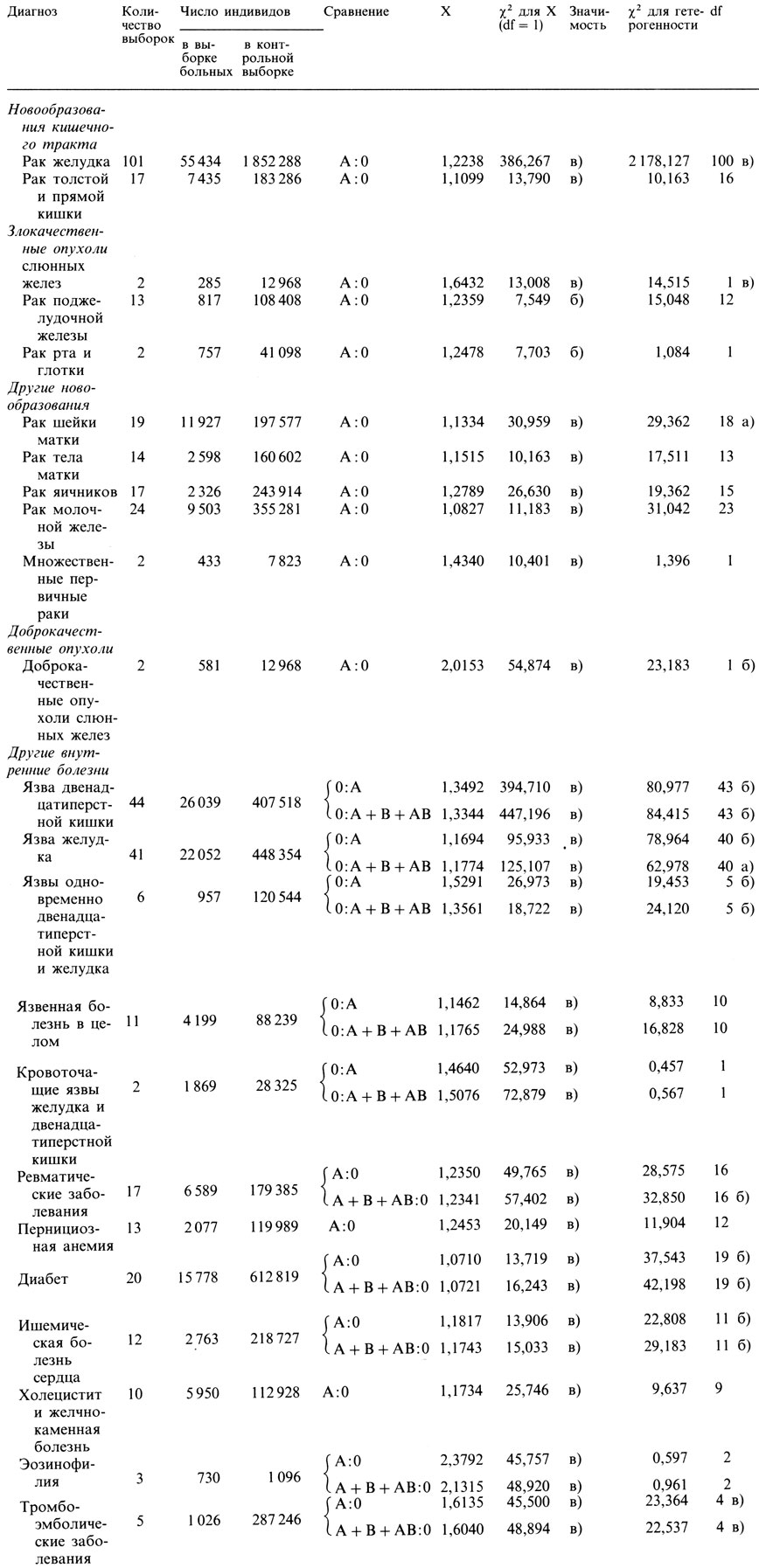
Таблица 3.23. Значимые ассоциации между группами крови и неинфекционными заболеваниями
а) - P≤0,05; б) - P≤0,01; в) - P≤0,0027; если различие незначимо, то буква не ставится.
Возможные смещения. В широкомасштабных статистических исследованиях возможны определенные смещения.
- Выбор подходящего контроля. Распределение популяций людей по группам крови неравномерно. Несмотря на соответствие данных ожидаемым пропорциям Харди - Вайнберга, популяция может случайно подразделяться на группы с разными частотами изучаемых генов. Если контроль взят из другой, нежели больные, группы, то в результате можно установить ложную ассоциацию. Например, если группа крови 0 "дарует" особо хорошее здоровье ее обладателям, то в выборках доноров, среди которых с большей вероятностью можно ожидать лиц с хорошим здоровьем, частота аллеля 0 может оказаться слишком высокой.
- Публикация только положительных результатов. Вполне понятно желание исследователей вознаградить себя "положительными" результатами, т. е. в нашем случае открытием ассоциации. Вот почему свои данные скорее всего опубликуют только те, кто нашел (возможно, случайно) значимую ассоциацию. Исследователи, которые оказались менее "удачливыми", могут не публиковать свои данные. Таким образом, накопление положительных публикаций ведет к ложной ассоциации.
Было показано, что перечисленные смещения отсутствуют в случае установленных ассоциаций [211]. Успокаивает также то обстоятельство, что данные, собранные для многих других заболеваний, дают отрицательные результаты, хотя и в этих случаях выборки больных и контрольных индивидов собирались сходным образом, а вычисления проводились так, что, если и были смещения, то одинаковые. Примером могут служить врожденные пороки. Целая группа заболеваний, включающая врожденный порок сердца, расщепление губы и неба, поражение почек и мочевой системы, гидроцефалию и другие, не обнаружила никаких ассоциаций с группами крови, хотя было обследовано 4762 больных и 156 716 контрольных лиц [211].
Неудачная попытка найти механизм ассоциации. В первые годы исследований ассоциаций групп крови и заболеваний многие авторы пытались спекулировать на биологических причинах ассоциаций и отводили эту роль веществам групп крови, например, в секретах желудка и двенадцатиперстной кишки. Более общая гипотеза пыталась объяснить ассоциации более сильным иммунным ответом носителей группы крови 0 по сравнению с носителями группы крови
А. Эта гипотеза стимулировала популяционно-генетические исследования, но экспериментальная ее проверка для таких широко распространенных заболеваний, как язва двенадцатиперстной кишки и рак желудка (разд. 6.2.1.8), не была проведена. Чтобы понять механизм ассоциаций, необходимо более детальное знание роли клеточной поверхности, особенно ее гликопротеинов, во взаимодействии с другими клетками и со средой. Тот факт, что до сих пор все попытки продемонстрировать убедительный механизм ассоциаций остались безуспешными, принес разочарование многим ученым. В последние годы поток работ по ассоциациям групп крови с заболеваниями почти полностью иссяк.
Стало ясно также, что общий вклад генов ABO в генетическую этиологию этих болезней, вероятно, мал, как показано, например, при изучении язвенной болезни [637]. Таким образом, результаты этих исследований, хотя и являются статистически значимыми, в частности, в случае язвенной болезни, рака желудка и некоторых других заболеваний, но они мало что прибавляют к пониманию генетических и средовых причин этих форм патологии.
3.7.2.2. Kell-система
Мутации системы Kell, акантоцитоз и хронический грануломатоз. Помимо ассоциаций ряда заболеваний с распространенными группами крови известны некоторые примеры наследственных аномалий, связанных с редкими генами или с генами-модификаторами генов "групп крови". В разделе 3.1.7 мы упоминали гены-модификаторы системы групп крови ABO, они известны лучше других и не влияют существенно на здоровье своих носителей. Примером прямой ассоциации между аллелями редкой группы крови и заболеванием может служить система групп крови Kell. Она особенно интересна, поскольку известно, что "вещество" Kell включено в структуру клеточных мембран. Для более глубокого понимания природы других ассоциаций заболеваний крови и, например, системы HLA важно знать мембранные функции, а для этого особенно полезными могут оказаться именно такие редкие аллели, как Kell.
В популяциях европейского происхождения обнаруживаются два аллеля аутосомного локуса Kell: K и k. более редкий из них K имеет частоту 0,05. С другой стороны, у 14-20% американских негров найден аллель Kell-системы Js, крайне редкий в других популяциях. Этот аллель служит превосходным маркером для лиц африканского происхождения. Гемолитическая анемия новорожденных редко вызывается анти-Kell антителами, но когда это случается, основной механизм сходен с таковым при резус-конфликте.
Кроме аутосомного локуса антигена Kell идентифицирован X-сцепленный локус, который кодирует вещество-предшественник Kell, известное как Кх. В норме все люди имеют Kx-антигенную детерминанту как на эритроцитах, так и на лейкоцитах. Некоторые индивиды гомозиготны по нулевому ("немому") аллелю (Ко) [609] того же локуса Kell. В этом случае нет обычных антигенов Kell, но можно выявить сильную Kx-реакцию [777]. Данный результат не противоречит предположению о том, что нормальная Kx-детерминанта, контролируемая X-сцепленным локусом, является единственной связанной с Kell-антигеном у гомозиготных носителей Ko- (или немого) аллеля. Такие лица клинически и гематологически нормальны. Были идентифицированы мутации по локусу Kx, которые проявляются или в эритроцитах, или в лейкоцитах, или в обоих типах клеток [776].
Маклеодовский фенотип эритроцитов [957] обусловлен X-сцепленной рецессивной мутацией, вызывающей отсутствие Kx-детерминанты. Это приводит к аномалии мембраны эритроцитов - акантоцитозу ("колючие" эритроциты) и их разрушению. Тяжесть гемолиза может меняться от компенсируемого разрушения небольшого числа клеток до тяжелой гемолитической анемии [776]. A-β-липопротеинемия [592] - обычная причина акантоцитоза (14595) - в этих случаях отсутствует. Ясно, что аномалии эритроцитов вызваны отсутствием Kx-антигенов, поскольку клетки, в которых отсутствуют все Kell-антигены, за исключением Kx (Ko), морфологически нормальны. Так как речь идет об X-сцепленном рецессивном признаке, экспрессия маклеодовского фенотипа выявляется только у мужчин.
Матери мужчин с маклеодовским (т. е. мутантным Kx-фенотипом) гетерозиготны как по нормальному Kx(+)-, так и по мутантному Kx(-)-аллелю. В соответствии с принципом инактивации X-хромосомы (разд. 2.2.3.3) такие гетерозиготные женщины должны быть функциональными мозаиками, у которых в части клеток экспрессируется нормальный Kx(+)-, а в других - мутантный Kx(-)-аллель. Действительно, в популяции эритроцитов у них обнаруживаются и нормальные, и аномальные клетки [890]. Такой мозаицизм можно продемонстрировать с помощью иммунологических и морфологических методик, поскольку Kx(-)-клетки являются акантоцитами. Нормальные клетки превышают по численности аномальные, что объясняется укорочением жизни Kx(-)-эритроцитов по сравнению с Kx(+)-клетками. X-сцепленная Kx-детерминанта предположительно связана с мембранным белком, мутации в этом локусе приводят к патологически мембранным перестройкам, что вызывает морфологические аномалии эритроцитов и гемолиз.
Эффекты мутаций, нарушающих Kx-антигены, часто проявляются и в лейкоцитах. Например, у нескольких мальчиков с хроническим грануломатозом (CGD) были идентифицированы Kell-типы [682]. Позже было показано, что это тоже мутации Kx-локуса. Больные с CGD характеризуются повышенной восприимчивостью к относительно слабым бактериальным патогенам. Развитие болезни выражается в инфекционном поражении кожи, лимфатических узлов и легких, часто наблюдаются лимфаденопатия, гепатоспленомегалия и гипергаммаглобулинемия. Еще до выявления ассоциации с группой крови Kell было установлено, что во многих случаях это X-сцепленная аномалия. Лейкоциты при этом заболевании обнаруживают снижение способности убивать многие бактерии, но фагоцитарная и лизосомальная активности сохраняются [715]. Истинная связь мутантного Kx-гена с пониженной бактерицидной активностью лейкоцитов еще не выяснена, но возможно, что Kx-мембранный антиген вовлечен в активацию NADH-дегидрогеназы, необходимой для проявления бактерицидной активности [776]. Все другие лейкоцитарные антигены нормальны. У некоторых больных с грануломатозом было снижено содержание Kx-вещества как в лейкоцитах, так и в эритроцитах. В этих случаях наряду с грануломатозом обнаруживались акантоцитоз и гемолиз [776]. Большинство больных с Kx-ассоциированным CGD имели нормальные эритроциты, хотя выявлено несколько больных с X-сцепленным акантоцитозом (маклеодовский фенотип) и нормальными лейкоцитами. Известны по крайней мере шесть X-сцепленных и три аутосомно-рецессивных типа CGD. При этом обнаруживаются разные ферментативные дефекты: нарушение инициации окислительного фосфорилирования, дефекты в обеспечении NADPH и недостаточность цитохрома b. Таким образом, описанный синдром весьма гетерогенен, а Kx-недостаточность является лишь одним из нескольких типов [714].
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'