
3.2. Трансдукция
Трансдукция - способ переноса генетического материала из донорной клетки в реципиентную с помощью бактериофага. Различают два типа трансдукции - общую и специфическую. Фаги, осуществляющие общую трансдукцию, могут переносить любой ген хромосомы донора, профаг и плазмиду, в то время как фаги, вызывающие специфическую трансдукцию, переносят только определенную группу генов, расположенных по соседству с сайтом прикрепления фага на хромосоме. Таким образом, специфическая трансдукция наблюдается только тогда, когда фаговые лизаты получены при спонтанном или индуцированном освобождении фага из лизогенизированного донора. Фаги в этих лизатах являются рекомбинантами, содержащими фаговую и хромосомную ДНК. Однако известны случаи, когда фаги, вызывающие общую трансдукцию, могут в некоторых случаях осуществлять специфическую трансдукцию. Например, фаг Р22 у сальмонелл осуществляет в основном общую трансдукцию, хотя может также переносить область pro. Таким же образом фаг Р1 кишечной палочки может переносить область lac. Фаги, вызывающие общую трансдукцию, полностью дефектны, так как содержат только ДНК хромосомы, ошибочно включенной в фаг системой упаковки головки.
Принципы картирования при общей трансдукции включают понятие котрансдукции. Только тесносцепленные гены фрагмента бактериальной хромосомы, равного по размеру геному ДНК фага, могут быть совместно перенесены тем же трансдуцирующим фагом. Следовательно, котрансдукция - это критерий тесного сцепления генов. Котрансдукцию можно наблюдать при внесении фага, выращенного на донорном штамме с удобным для селекции маркером, в реципиентный штамм, несущий соответствующую контрселективную аллель. У выделенных трансдуктантов проверяют наличие неселективных маркеров донора. В опытах трансдукции необходимо определить четыре параметра (в мл): число внесенных фаговых частичек; число реципиентных клеток; число трансдуктантов и число котрансдуктантов. Частота котрансдукции определяется путем перепечатывания выделенных трансдуктантов на разные диагностические среды с целью идентификации неселективных маркеров донора. Относительное положение на карте трех генетических маркеров может быть определено с помощью анализа наследования неселективных маркеров.
Пример картирования маркеров Е. coli К-12 с помощью трансдукции приведен в табл. 3.3. Аллель pdxJ20 наследуется совместно с purI+ в 46 % случаев, в то время как аллель nadB+ - в 26 %. Поскольку множественность инфекции 0,17, вероятность попадания нескольких фагов в клетку была только в 1 % случаев. Поэтому можно сделать заключение о расположении обоих генов на одном и том же фрагменте ДНК. Локус pdxJ теснее примыкает к локусу purl, чем к локусу nadB.
![Таблица 3.3. Анализ данных трансдукции с помощью фага Р1 [9]](pic/000050.jpg)
Таблица 3.3. Анализ данных трансдукции с помощью фага Р1 [9]
Можно предположить две последовательности локусов: purl-pdxJ-nadB или pdxJ-purl-nadB. Выбор между этими последовательностями можно сделать на основании критерия минимума множественных кроссинговеров, необходимых для образования выделенных генотипов (табл. 3.4). Порядок локусов согласно модели А предпочтителен, так как генотип purI+ nadB+ pdxJ+ представлен наименьшим числом рекомбинантов вследствие необходимости в четырех перекрестках, в то время как по модели Б данный генотип может возникнуть в результате только двух обменов.
Частоты контрансдукции у Е. coli можно преобразовать в минуты с помощью уравнения Wu, которое было использовано в работе Bachmann и соавт. [10, 11]1. Частота котрансдукции равна (1 - d/L)3 , где d - расстояние между селективным и неселективным маркерами, мин, L - размер фрагмента трансдуцирующей ДНК, мин (1 мин. равна 39 тпн). Фаг Р1 теоретически несет фрагмент ДНК, равный 2,2 мин, однако в практике принято значение 2,0 мин. Таким образом, расстояние между purI и pdxJ - 0,46, а между purI и nadB - 0,72 мин.
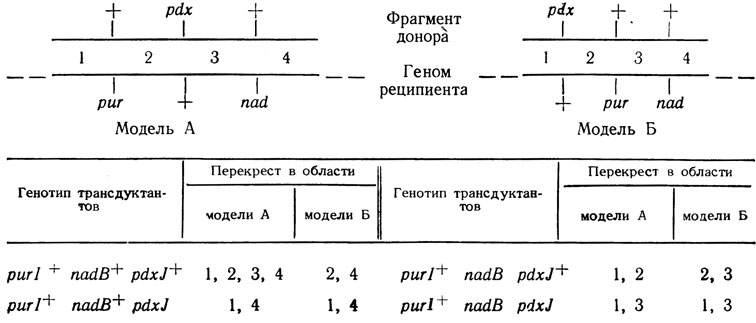
Таблица 3.4. Генотипы рекомбинантов и число кроссинговеров
Частота котрансдукции зависит от расстояния между маркерами. Однако известны случаи, когда в реципрокных скрещиваниях частоты котрансдукции были неодинаковы. Одна из причин этого - неслучайное включение маркеров донора в трансдуцирующие фрагменты. Предположим, что частота фрагментов, несущих один локус thi и два локуса thi arg, вместе значительно больше частоты фрагментов, несущих один локус arg. Тогда частота котрансдукции при селекции рекомбинантов по локусу thi будет меньше таковой при селекции рекомбинантов по локусу arg.
Влияние неслучайного распределения концов трансдуцирующих фрагментов на рекомбинацию показано на рис. 3.3. Трансдуцирующие фрагменты имеют фиксированные концы в областях 1 и 3, расположенных по обе стороны от пары локусов и отличающихся разными длинами. При селекции аллели донора arg+ (рис. 3.3, а) кроссинговер в интервале 1 обязателен, в то время как второй кроссинговер может происходить в области 2 или 3. Только перекрест в области 3 ведет к котрансдукции неселективной аллели thi с селектируемой аллелью arg+. При селекции аллели thi+ (рис. 3.3, б) обязателен кроссинговер области 3 и не обязателен в области 1 или 2, из которых только перекрест в области 1 приведет к котрансдукции. Если области 1 и 3 различны по длине, то частоты котрансдукции тех же маркеров при реципрокных скрещиваниях будут различны, что может привести к ошибкам в определении сцепления.
![Рис. 3.3. Влияние трансдуцирующего фрагмента с фиксированными концами на включение неселективных маркеров в рекомбинантные геномы [23]: а и б - реципрокные скрещивания; а - селекция рекомбинантов по маркеру донора arg+; перекрест в области 1 обязателен, в то время как второй перекрест может происходить в области 2 или 3; перекрест в об-ласти 3 ведет к котрансдукции аллели донора thi с селектируемой аллелью arg+, в то время как перекрест в области 2 к включению thi+ вместо thi и, таким образом, к отсутствию котрансдукции; б - селекция рекомбинантов по маркеру thi+ с обязательным перекрестом в области 3 и вторым перекрестом в области 1 или 2; в последнем случае котрансдукция отсутствует](pic/000052.jpg)
Рис. 3.3. Влияние трансдуцирующего фрагмента с фиксированными концами на включение неселективных маркеров в рекомбинантные геномы [23]: а и б - реципрокные скрещивания; а - селекция рекомбинантов по маркеру донора arg+; перекрест в области 1 обязателен, в то время как второй перекрест может происходить в области 2 или 3; перекрест в области 3 ведет к котрансдукции аллели донора thi с селектируемой аллелью arg+, в то время как перекрест в области 2 к включению thi+ вместо thi и, таким образом, к отсутствию котрансдукции; б - селекция рекомбинантов по маркеру thi+ с обязательным перекрестом в области 3 и вторым перекрестом в области 1 или 2; в последнем случае котрансдукция отсутствует
Известен метод трансдукции, когда с помощью двухфакторных скрещиваний можно установить сцепление между мутациями, вызывающими ауксотрофность по тому же самому фактору роста и используемыми в качестве селектируемых маркеров. Фаг, выращенный на одном ауксотрофном мутанте, применяется для трансдукции второго ауксотрофного мутанта. Частота трансдукции данного опыта сравнивается с частотой трансдукции второго опыта, где фаг выращивался на штамме дикого типа и использовался для трансдукции того же самого ауксотрофного реципиента. Если частота трансдукции в первом опыте значительно ниже таковой во втором, то исследуемые мутации сцеплены.
На рис. 3.4 приведено схематическое объяснение возникновения рекомбинантов в обоих опытах. Для образования прототрофных рекомбинантов в первом опыте необходим первый кроссинговер в интервале 1 и второй перекрест в коротком интервале 2 между мутациями ml+ и m2+. Во втором опыте второй кроссинговер может происходить в любом участке длинного интервала 2 и приводить к образованию большего числа прототрофных рекомбинантов по сравнению с первым опытом.
![Рис. 3.4. Выявление сцепления между мутациями m1 и m2 с помощью трансдукции [23]: а - ауксотрофный реципиент с мутацией m1 трансдуцируют фагом, выращенным на втором ауксотрофе m2; для образования прототрофных рекомбинантов перекрест в области 1 сопровождается перекрестом в коротком интервале 2 между двумя мутациями; б - фаг выращен на штамме дикого типа; второй перекрест может происходить в любом месте длинного интервала 2 между m1 и правым плечом фрагмента. Частота прототрофов значительно больше в б чем в а](pic/000053.jpg)
Рис. 3.4. Выявление сцепления между мутациями m1 и m2 с помощью трансдукции [23]: а - ауксотрофный реципиент с мутацией m1 трансдуцируют фагом, выращенным на втором ауксотрофе m2; для образования прототрофных рекомбинантов перекрест в области 1 сопровождается перекрестом в коротком интервале 2 между двумя мутациями; б - фаг выращен на штамме дикого типа; второй перекрест может происходить в любом месте длинного интервала 2 между m1 и правым плечом фрагмента. Частота прототрофов значительно больше в б чем в а
Приведем пример котрансдукции (табл. 3.5). Каждая цифра в табл. 3.5 представляет отношение числа cys+ - транедуктантов, полученных после выращивания фага на cys-доноре, к числу cys+ -трансдуктантов, полученных после выращивания фага на доноре дикого типа, умноженное на 100.
Анализ нелизогенных трансдуктантов, полученных при специфической трансдукции, проводят так же, как и при общей трансдукции. Лизогенные трансдуктанты скорее представляют дупликацию генов, чем рекомбинацию, и поэтому не дают информации о нормальном расположении генов.
![Таблица 3.5. Дзухфакторные скрещивания между мутациями cys при трансдукции у Salmonella typhimurium [14]](pic/000054.jpg)
Таблица 3.5. Дзухфакторные скрещивания между мутациями cys при трансдукции у Salmonella typhimurium [14]
(Примечание. Цифры, выделенные полужирным шрифтом, обозначают котрансдукцию cys-мутаций у донора и реципиента Мутации в том же гене более сцеплены (например, А3ХА200, B4XB10), чем мутации в разных соседних генах, отмеченных звездочками (cysC и и cysD))
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'