
3.3. Трансформация
Генетическая трансформация - способ передачи генетической информации от донорных клеток реципиентным с помощью очищенной ДНК, которая поглощается из среды компетентными клетками и вступает во взаимодействие с хромосомой с образованием рекомбинантных клонов. Донор и реципиент должны обладать легко различимыми генетическими признаками. Например, реципиент может нести мутации, нарушающие способность клетки синтезировать определенные метаболиты (аминокислоты, витамины, полисахариды и т. д.), или использовать некоторые источники углерода, или обладать фенотипом дикого типа по указанным признакам, будучи чувствительным к антибиотикам, ядам или фагу. Штамм донора должен обладать противоположными аллелями, которые можно использовать в качестве селектируемых при выделении трансформантов.
Основные требования, предъявляемые к трансформирующей ДНК,- ее нативность (двуспиральность) и высокополимерное состояние (молекулярная масса от десяти и выше мегадальтон), а также чистота. Указанным требованиям удовлетворяют препараты ДНК микроорганизмов, полученные по методу Мармура [1]. Не обязательно применять высокоочищенные препараты ДНК, свободные от РНК и других макромолекул, и поэтому отработка препаратов РНКазой может быть опущена. Трансформирующая ДНК растворяется в стерильных буферных растворах, содержащих цитрат натрия или натриевую соль этилендиаминтетраацетата (ЭДТА) с целью связывания дивалентных катионов, и прежде всего ионов магния, активирующих ДНКазу. Обычно готовят растворы хромосомной ДНК в 0,15 M NaCl и 0,015 М цитрате натрия рН 7,0, а фаговой и плазмидной суперспирализованной ДНК - в 10 мМ трис (гидроксиметил) аминометан (Трис) и 1 мМ ЭДТА рН 8,0.
Концентрацию ДНК в растворе можно определить спектрофотометрически: коэффициент абсорбции А260 50 мкг ДНК в 1 мл в кювете 1 см равен 1,0. О степени чистоты препаратов ДНК судят на основании показателей А234, А270 и А280, отнесенных к А260. Наиболее чувствительный показатель - А234/А260. Так как максимум поглощения фенола наблюдается при 270 нм, А270/А260 свидетельствует о степени загрязнения препаратов ДНК фенолом, что отрицательно сказывается на результатах трансформации.
Наиболее эффективно поглощают трансформирующую ДНК компетентные клетки, которые появляются в логарифмической фазе роста культуры. На состояние компетентности влияет ряд факторов: структура клеточной поверхности, образование фактора компетентности, способность клеток подвергаться автолизу и присутствие профагов в геноме клетки. Компетентные клетки в популяции сенной палочки составляют 1-15 %, в то время как у пневмококков и гемофильной палочки инфлюэнцы почти все клетки популяции компетентны. Компетентные клетки отличаются от обычных рядом морфологических, биохимических и физиологических свойств. На клеточной поверхности появляются новые полипептиды, или так называемые факторы компетентности, и изменяется положительный заряд, который способствует связыванию негативно заряженных молекул трансформирующей ДНК. Увеличивается количество мезосом, играющих роль транспортного механизма. Клеточные стенки компетентных клеток более пористы, что приводит к вытеканию некоторых ферментов из цитоплазмы вереду и повышает чувствительность клеток к осмотическому шоку. В клетках активируются автолитические ферменты, снижается репарация и синтез ДНК и белка. В состоянии компетентности клетки образуют метилазы, рестриктазы и белок, связывающийся с однонитевой ДНК.
Двуспиральная ДНК донора адсорбируется необратимо в течение нескольких секунд на рецепторах клеточной поверхности компетентных клеток реципиента свободным концом. Число рецепторов - 30-50 на одну клетку. Рецепторы пневмококков и сенной палочки не специфичны и связывают ДНК разного происхождения. Рецепторам гемофильной палочки инфлюэнцы присуща высокая специфичность - они связывают последовательность ДНК из 11 пар оснований: 5'-AAGTGCGGTCA-3'. Этот 11-членный олигомер представлен в геноме 600 раз. Количество ДНК, поглощенной одной компетентной клеткой, равно размеру ее собственного генома. В периплазматическом пространстве клеток сенной палочки и пневмококков ДНК донора фрагментируется до размеров 1 ⋅ 107 Д, после чего одна нить разрушается ферментами, а вторая ориентированно проникает через цитоплазматическую мембрану в зоне роста клеточной оболочки (около экваториальной плоскости клетки) и образует синапс с гомологичной областью частично денатурированной ДНК реципиента о помощью водородных связей. У гемофильной палочки инфлюэнцы однонитевая ДНК донора не обнаружена и трансформирующая ДНК, по-видимому, проникает в клетку в двуспиральном состоянии.
В области гетеродуплекса возникает нарушение комплементарного спаривания оснований, которое устраняется ферментами коррекции. Коррекции подвергаются LE-маркеры донора, НЕ-маркеры не корректируются и после репликации рекомбинантных молекул претерпевают сегрегацию.
У мутантов типа hex с нарушенной активностью фермента коррекции LE-маркеры ведут себя подобно НЕ-маркерам, т. е. не устраняются.
Размер однонитевого фрагмента ДНК донора, интегрированного в геном реципиента, в среднем составляет 2,8 ⋅ 106 Д у В. subtilis, 0,6 МД - у Н. influenzae и 0,3-5,0 МД - у S. pneumoniae. Таким образом, размер фрагмента ДНК донора, встроенного в хромосому реципиента, составляет в среднем около 2 МД, т. е. 0,1 % всей хромосомы, или 3 тпн*. Отсюда очевидно, что маркеры на одном фрагменте ДНК, включенном в хромосому реципиента, образуют одну группу сцепления генов. Сцепленная или совместная передача генов с помощью трансформирующей ДНК называется котрансформацией. Котрансформация выступает главным критерием сцепленности маркеров при трансформации. Однако двойные трансформанты могут также возникать вследствие попадания в клетку реципиента двух фрагментов ДНК донора, несущих несцепленные гены. Поэтому для преодоления указанной трудности измеряют частоту совместной трансформации по двум маркерам в зависимости от разных концентраций ДНК в области ненасыщения
* (тпн - тысяча пар нуклеотидов.)
Генетический анализ при трансформации подобен таковому при трансдукции: один маркер донора используется как селектируемый, а второй - как неселективный маркер для определения частоты котрансформации. Определяют следующие параметры: число живых клеток реципиента, концентрацию ДНК донора, число трансформантов по селектируемому маркеру и число трансформантов, унаследовавших неселективные маркеры.
На рис. 3.6 приведен пример котрансформации по сцепленным и несцепленным маркерам. Все трансформанты, унаследовавшие маркер донора ind+ (селектируемый), проверяют на наличие неселективного маркера met+ или tyr+. При сцеплении маркеров доля двойных трансформантов ind+met+ почти не зависит от концентрации трансформирующей ДНК, в то время как частота двойных трансформантов по несцепленным маркерам ind+ и tyr+ резко уменьшается со снижением концентрации ДНК.
![Рис. 3.6. Выявление сцепления с помощью котрансформации [26]. Трансформанты, унаследовавшие селектируемый маркер донора ind+, проверяли на наследование неселективного маркера донора met+ (1) или tyr+ (2). В случае сцепления маркеров частота двойных трансформантов ind+ met+ почти не зависит от концентрации ДНК, в то время как для несцепленных маркеров ind+ и tyr+ число двойных трансформантов быстро уменьшается с понижением концентрации ДНК](pic/000056.jpg)
Рис. 3.6. Выявление сцепления с помощью котрансформации [26]. Трансформанты, унаследовавшие селектируемый маркер донора ind+, проверяли на наследование неселективного маркера донора met+ (1) или tyr+ (2). В случае сцепления маркеров частота двойных трансформантов ind+ met+ почти не зависит от концентрации ДНК, в то время как для несцепленных маркеров ind+ и tyr+ число двойных трансформантов быстро уменьшается с понижением концентрации ДНК
Метод трансформации, механизм которой обеспечивает перенос неболь-ших фрагментов молекулы ДНК донора в клетку реципиента, определяет сущность картирования хромосомы - установление частоты рекомбинации (двойных или четных кроссинговеров) и степени сцепления генетических маркеров на очень малых участках хромосомы - от 2 до 6 тпн, т. е. в пределах расположения нескольких соседних генов. Он дает возможность изучать тонкое строение отдельных генетических локусов, так как внутригенная рекомбинация не зависит от размеров фрагмента трансформирующей ДНК. Ряд особенностей генетической рекомбинации при трансформации у микроорганизмов - эффект маркера, расхождение результатов реципрокных скрещиваний, состояние компетентности клеток реципиента, молекулярная структура ДНК донора и др.- затрудняют построение генетических карт и нужно стараться их преодолеть. Трансформация не требует половой дифференциации микроорганизмов, как при конъюгации. Она предоставляет возможность проводить реципрокные скрещивания по одной, двум и трем точкам. Реципрокность генетической рекомбинации легко может быть достигнута при перестановке местами донора и реципиента.
С помощью одноточечного скрещивания можно определить эффективность, с которой исследуемый маркер интегрируется в хромосому реципиента. Для стандартизации результатов повторных опытов, зависящих от свойств культуры реципиента и качества препаратов ДНК донора, при данном и всех остальных типах скрещивания параллельно проводится учет частоты трансформантов по так называемому несцепленному стандартному маркеру, расположенному далеко на том же или на другом фрагменте трансформирующей ДНК. Эффективность интеграции изучаемого маркера выражается отношением частоты рекомбинации к частоте трансформантов по стандартному гену.
Дифакториальные скрещивания проводятся с донором и реципиентом, несущими разные маркеры одинакового или различного фенотипа. Если две ауксотрофные мутации расположены в разных сайтах одного генетического локуса, то в результате рекомбинации появляются трансформанты дикого типа (прототрофы). Их частота нормируется по стандартному маркеру. Процент рекомбинации равен числу рекомбинантов дикого типа, отнесенному к общему числу трансформантов и умноженному на 100. При скрещивании маркеров различного фенотипа Леке и Хочкис предложили использовать для картирования рекомбинационный индекс RI, основанный на сравнении результатов трансформации одного и того же реципиента под действием ДНК двух доноров - мутантного и дикого типа. Дважды меченный реципиент - по сайту a1 и не сцепленному стандартному маркеру б - обрабатывают ДНК, несущей мутацию в другом сайте а2 того же локуса а и определяют отношение числа трансформантов а+/б+(х). Такое же отношение двух типов трансформантов а+/б+ измеряют параллельно в опыте с использованием ДНК дикого типа (у). При этом RI = х/у. Наличие мутации в ДНК донора ограничивает вероятность генетических обменов на участке между мутантными сайтами. Чем ближе донорный сайт расположен к мутантному сайту реципиента, тем меньше выход прототрофных рекомбинатов. Реципрокное дифакториальное скрещивание дает возможность определить эффективность интеграции разных маркеров и влияние на нее соседних маркеров.
Скрещивание по трем точкам между одинарным и двойным мутантами, имеющими повреждения в одной сцепленной группе локусов,- единственный критерий для правильного размещений маркеров на карте хромосомы. Применение скрещивания по трем точкам можно показать на примере установления порядка маркеров gua-dnaH-pac (табл. 3.6). Как видно из данных табл. 3.6, для образования почти всех генотипов рекомбинантов необходимо два перекреста и лишь для возникновения одного генотипа dnaH 151 рас-4 требуется четыре перекреста между нитями ДНК донора и реципиента. В последнем случае выделен только один рекомбинант, что свидетельствует о соблюдении критерия минимума множественных кроссинговеров. Необходимо уточнить, что под перекрестом, или кроссинговером, в пределах гетеродуплекса, образованного одиночными нитями ДНК донора и реципиента, нужно понимать сохранение водородных связей между комплементарными основаниями на определенных участках (т. е. двуспиральной структуры ДНК) при наличии брешей на обеих нитях ДНК вследствие коррекции неспаренных оснований, принадлежащих LE-маркерам. Размеры участков ДНК, подвергающихся коррекции, равны 1-2 цистронам. На более длинных расстояниях генетические маркеры корректируются независимо друг от друга.[13]. Главным критерием сцепления генов является частота котрансформапии, на основании которой можно сделать вывод о порядке расположения генетических локусов.
![Таблица 3.6. Скрещивания при трансформации В. subtilis [38]](pic/000057.jpg)
Таблица 3.6. Скрещивания при трансформации В. subtilis [38]
Рассмотрим второй пример картирования мутаций в пределах оперона gut у В. subtilis с помощью трансформации [181. Оперон катаболизма D-глюцитола состоит из генов gutA и gutB, контролирующих соответственно D-глюцитолпермеазу и D-глюцитолдегидрогеназу, а также регуляторного гена gutR. Трехфакторные скрещивания включали мутации gutR1, gut1 (или gutB1) и мутацию pha1, сообщающую устойчивость к фагу SPО1. Клетки дикого типа имеют фенотип Gut+Xyl-, т. е. не используют ксилитол. Мутация gutR приводит к конститутивному синтезу обоих ферментов оперона и делает возможным использование клетками ксилитола (фенотип Gut+Xyl+). Мутация gut вызывает потерю способности синтезировать оба фермента оперона и поэтому сообщает клеткам фенотип Gut-Xyl-. В свою очередь мутации gutA (или gutB) нарушают синтез соответствующих ферментов, определяя фенотип Gut-Xyl-. Результаты скрещивания, полученные Gay и соавт. [18] и дополненные нашей схемой и частотой кроссинговеров, приведены в табл. 3.7. Как видно из данных таблицы, при определении тонкой структуры gut-оперона также соблюдается критерий минимума множественных кроссинговеров. Рекомбинат Xyl-Phar, требующий четверного кроссинговера, представлен только в одном опыте минимальным числом 3. Расстояние между маркерами gutR1 и gut1 определялось на основании числа кроссинговеров между данными маркерами (область 3), отнесенного к общему числу рекомбинантов: (67 : 292) ⋅ 100 = 22,9. Расстояние между gutR1 и gutB1 (229 : 430) ⋅ 100 = 53.
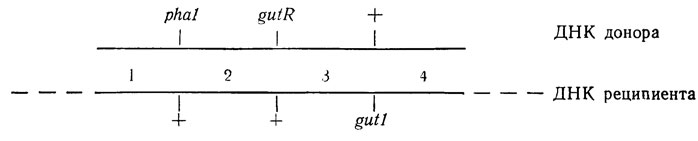
Таблица 3.7. Картирование генов оперона gut с помощью трансформации у В. subtilis
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'