
Глава 4. Как генные инженеры разрезают, склеивают, клонируют гены
Разрезать и склеивать гены помогают ферменты. В наши дни идея С. Коена и Г. Бойера выглядит очень простой. Разрежем плазмиду одной из рестриктаз, образующих у фрагмента ДНК однотяжевые ("липкие") концы. Той же рестриктазой разрежем на фрагменты ДНК, в одном из которых содержится интересующий нас ген. Если смешать эти фрагменты с разрезанной плазмидой, то с некоторой вероятностью они склеятся с плазмидой благодаря "липким" (комплементарным) концам. Далее чужеродную ДНК ковалентно пришивают к вектору ДНК-лигазой. В итоге получается созданная по заранее разработанному плану рекомбинантная ДНК, а весь план этого замечательного эксперимента умещается на небольшом чертеже (рис. 23).
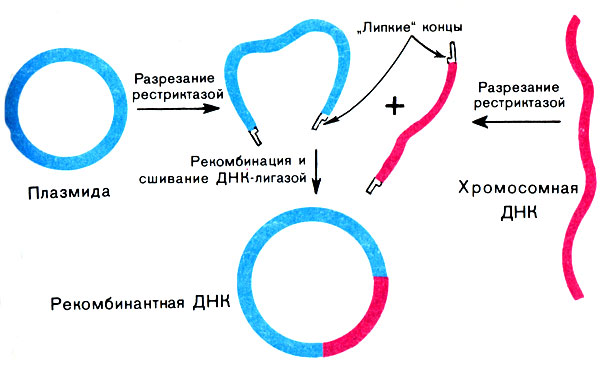
Рис. 23. Схема получения рекомбинантной ДНК по Коену -Бойеру
Следующий шаг к схеме Коена - Бойера заключался в переносе рекомбинантной плазмиды в бактериальную клетку: только в клетке она может размножиться. Более того, как видно из рисунка, наряду с рекомбинантными ДНК в опыте Коена - Бойера всегда будет восстанавливаться (замыкаться) исходный вектор. И только после переноса в клетку эти молекулы ДНК можно легко отличить друг от друга. В то же время все подходящие на роль вектора плазмиды, которыми располагали С. Коен и Г. Бойер, оказались нетрансмиссивными, т. е. неспособными переходить из клетки в клетку. Тогда ученые предложили простую процедуру переноса плазмид в бактериальные клетки: клетки необходимо предварительно обработать хлористым кальцием.
Теперь С. Коен и Г. Боейр могли приступить к экспериментальной проверке своей идеи. В их коллекции оказалась пара плазмид, у которых было всего по одному участку узнавания рестриктазой, - Eco RI. К тому же эти плазмиды несли гены устойчивости к разным антибиотикам: одна - к тетрациклину, а другая - к канамицину.
Эксперимент был осуществлен по приведенной выше схеме. Полученные плазмиды перенесли в бактериальные клетки (использовали специальный штамм кишечной палочки, лишенный тех рестриктаз, которые могли бы разрушить вектор) и высеяли на среду, содержавшую оба антибиотика. Ни исходная культура, ни клетки, в которые попали исходные векторы, на такой среде расти не могли. Росли на ней клетки, получившие гены устойчивости к обоим антибиотикам, т. е. содержавшие рекомбинантную плазмиду. Впервые по заранее разработанному плану удалось сконструировать ДНК с заданными свойствами. Работа С. Коена и Г. Бойера напоминала конструкторскую разработку, Да и оперировали они рестрикционными картами плазмид, а их можно сравнить с чертежами, которыми пользуется инженер-конструктор. Генетика вступила в новую эру - эру генной инженерии!
Если строго следовать историческому ходу научных событий, нужно признать, что еще за год до С. Коена и Г. Бойера в том же Стэнфордском университете (недаром его называют родиной генной инженерии) П. Лобан и П. Берг первыми получили рекомбинантные ДНК, встроив в вектор фрагменты чужеродной ДНК. Однако схема их экспериментов была иной.
На концы векторной молекулы (в виде линейной ДНК) с помощью специального фермента терминальной (концевой) нуклеотидтрансферазы нарастили короткие поли нуклеотидные последовательности, состоящие из одного и того же нуклеотида - А (такие последовательности, в данном случае поли-А, называют гомополинуклеотидными):
АААА векторная ДНК АААА
Концы фрагментов ДНК, среди которых был и фрагмент, содержавший искомый ген, таким же способом нарастили, но уже полинуклеотидом, комплементарным поли-А, т. е. поли-Т-последовательностями.
Дальше, смешав вектор с фрагментами, ученые получили их гибрид - рекомбинантную ДНК вследствие комплементарного спаривания поли-А и поли-Т-последовательностей. Затем фрагмент ДНК и вектор сшили ДНК-лигазой (рис. 24).
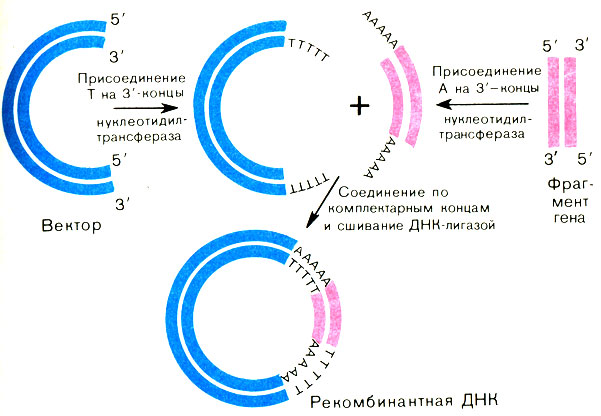
Рис. 24. Конструирование рекомбинантной ДНК по Лобану -Бергу
Недостаток такого подхода очевиден: П. Лобан и П. Берг использовали фрагменты ДНК, полученные при ее расщеплении случайным образом. Тем не менее их метод нашел дальнейшее развитие: во многих случаях оказалось удобным, расщепив рестриктазами вектор и ДНК с искомым геном, наращивать полученные концы комплементарными последовательностями. В 1980 г. П. Берг был одним из тех, кто получил Нобелевскую премию за работы, приведшие к созданию генной инженерии. П. Лобан же, завершив свою работу, вообще покинул биологию. Почему это произошло, мы расскажем в конце этой главы.
Векторы. Рассмотрим векторные системы, которыми пользуются современные генные инженеры. Сформулируем требования, которым должны удовлетворять векторные молекулы ДНК:
- они должны обладать способностью реплицироваться (размножаться) в клетке-реципиенте; для этого в вектор вводят специальный участок, с которого начинается репликация ДНК (в нем находятся нуклеотидные последовательности, служащие сигналами начала репликации);
- они должны содержать один или несколько маркерных генов (от слова "маркировать" - метить, обозначать), которые придают клетке-реципиенту новые признаки, позволяющие отличить клетки с вектором от исходных клеток; этим признаком бывает устойчивость к какому-либо антибиотику;
- они должны содержать по одному или самое большее по два участка, разрезаемые той или иной рестриктазой; эти участки используются для встраивания в векторы чужеродной ДНК; поэтому они могут находиться в любых районах вектора (в том числе и в составе маркерного гена), но не в области, ответственной за начало репликации вектора (иначе после встраивания чужеродной ДНК этот участок будет "испорчен" и вектор не сможет размножаться в клетке).
Вы, вероятно, поняли, что плазмиды и ДНК бактериофагов - прекрасные кандидаты в векторы. Но пока еще только кандидаты, а не сами векторы. Первому требованию они удовлетворяют полностью (как вы знаете, они прекрасно реплицируются в клетках независимо от хромосомы). Но для того чтобы они удовлетворяли второму и третьему требованию, над ними нужно еще поработать, довести до кондиции. Во-первых, ввести в них дополнительные маркерные гены (ДНК бактериофагов сама по себе, как правило, таких генов вообще не содержит). Во-вторых, природные плазмиды и фаговые ДНК порой содержат слишком много участков разрезания данной рестриктазой, к тому же в участках, ответственных за репликацию ДНК. Отмечаются случаи, когда, напротив, в ДНК нет нужного участка узнавания рестриктазой. Вот почему генный инженер перестраивает вектор.
Решить названные проблемы помогают те же рестриктазы и другие ферменты, применяемые для встраивания ДНК в векторы. Мы уже описали случай, когда слиянием двух плазмид, каждая из которых несла по одному гену устойчивости к антибиотику, был получен вектор с двумя маркерными генами. Кроме генов, делающих клетку устойчивой к воздействию антибиотика, используются и другие маркерные гены. Очень популярным оказался первый ген лактозного оперона кишечной палочки (см. главу 2), в котором закодирован фермент β-галактозидаза. Мы уже рассказывали, что этот фермент расщепляет дисахарид лактозу и ее аналоги. В качестве аналога можно взять вещество 5-бром-4-хлор-3-индолил-β-галактозид, которое генетики назвали Х-гал. β-Галактозидаза отщепляет от него бромхлориндол - краситель ярко-голубого цвета. Теперь представьте себе, что в клетку кишечной палочки (или какой-то другой бактерии), лишенной нормального гена 6-галактозидазы, ввели вектор с этим геном. Если в твердую среду, на которой растут клетки, добавить "Х-гал", то клетки с вектором будут давать колонии, окрашенные в голубой цвет. Их очень легко отличить от исходных, бесцветных колоний.
На этом достоинства "голубого" вектора не кончаются: если встроить в векторный ген β-галактозидазы интересующий нас ген А, расчленив его на две части геном А, лишив возможности продуцировать активный фермент, и полученной рекомбинантной ДНК вновь трансформировать клетки кишечной палочки, то клетки с рекомбинантной ДНК дадут светлые колонии; их теперь легко отличить от клеток (голубых) с исходным вектором (рис. 25).
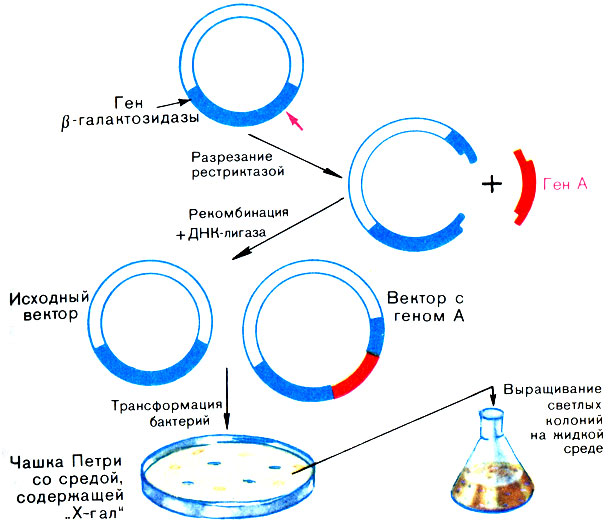
Рис. 25. Использование гена β-галактозидазы для клонирования генов
Лишние рестриктазные участки из векторов убирают с помощью делеций. Делеция - это удаление одной, нескольких или даже очень большого числа нуклеотидных пар (т. е. целого протяженного участка) из молекулы ДНК. Существует множество способов вызвать делецию, и задача уменьшения числа участков, разрезаемых рестриктазами, большой трудности не представляет.
А что делать, если в нужном районе вектора нет необходимого участка узнавания рестриктазой, дающей "липкие" концы? Для этого химическим синтезом получают короткий фрагмент ДНК, содержащий необходимую последовательность. Подбирают рестриктазу, которая разрезает вектор в нужном районе, и ДНК-лигазой вшивают туда синтетическую ДНК. Ее называют линкером - связкой (от английского слова - связывать). Часто линкер делают таким, чтобы в нем содержались последовательности сразу для нескольких разных рестриктаз (его называют полилинкером).
Итак, вектор создан. В него встроены фрагменты ДНК, среди которых находится интересующий нас ген. Клетки, в которые попал вектор, теперь можно легко отличить от исходных клеток. Более того, в некоторых случаях можно отличить клетки с векторами, в которые встроены фрагменты ДНК (т. е. рекомбинантные ДНК), от клеток с исходным вектором.
"Библиотеки" генов. Важно иметь в виду, что генные инженеры векторами всегда трансформируют клетки так, чтобы в одну клетку попала только одна молекула вектора. Поэтому дальше речь пойдет о поиске в сложной популяции клеток с рекомбинантными ДНК одной клетки с нужным геном.
Рассмотрим конкретный пример.
Как только возникла генная инженерия, генетики поспешили осуществить свою давнюю мечту: иметь в распоряжении так называемые библиотеки генов различных организмов. В современном понимании "библиотека" генов (генотека) означает набор одинаковых векторов, в которые встррены фрагменты хромосом некоего организма, в совокупности представляющие весь геном этого организма.
Оказалось, что удобнее всего создавать такие библиотеки с помощью векторов, полученных из ДНК фага λ. Мы не напрасно в предыдущей главе подробно рассказали об этом умеренном фаге (его ДНК способна встраиваться в хромосому хозяйской клетки). Сначала в ДНК λ-фага выявили область, которую можно видоизменять и даже целиком заменять на совсем другую ДНК, не нарушая ее репликацию. Эта область расположена в центре линейной формы фаговой ДНК и составляет примерно треть длины всей молекулы. Затем из левой и правой частей фаговой ДНК удалили места, по которым действуют наиболее часто употребляемые рестриктазы. Например, из пяти мест для рестриктазы Есо RI было оставлено всего два, но таких, которые позволяют вырезать из ДНК центральный район. Теперь, соединив концы ДНК, получим ее циклическую форму. Вектор готов к работе.
Предположим, что перед нами стоит задача получить библиотеку генов мыши. Для этого нужно выделить суммарную ДНК из любого органа мыши, например из печени (обычно любая соматическая клетка несет весь набор генов данного организма, исключения редки), и обработать ее рестриктазой EcoRI в условиях частичного расщепления.
О том, что такое частичное расщепление, мы рассказали в главе 3. Почему именно частично, а не полностью следует расщеплять ДНК при получении "библиотеки" генов? Рассмотрим сегмент ДНК, в котором есть три места для рестриктазы EcoRI. Некий ген А может быть расположен в ДНК так, что один из рестриктазных разрывов расчленит его на две части. Следовательно, если полностью расщепить этот сегмент ДНК, то невозможно будет получить целый ген А. В условиях же частичного расщепления, когда образовываются, например, фрагменты 1-2, 2-3, 3-4, 1-2-3, 2-3-4, в двух фрагментах 1-2 и 1-2-3 этот ген сохранится полностью (рис. 26).
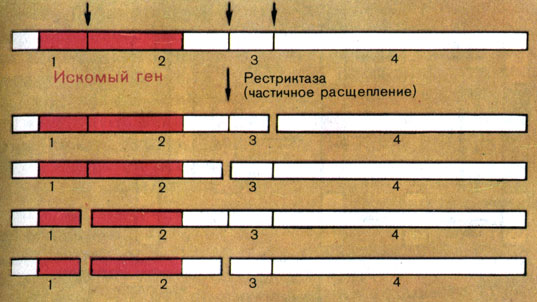
Рис. 26. Схема частичного расщепления ДНК с тремя участками, специфичными к рестриктазе (показаны стрелками)
На следующем этапе из векторной ДНК фага ? вырезают центральный район (разумеется, той же рестриктазой EcoRI) и смешивают ее с EcoRI - фрагментами ДНК мыши так, чтобы липкие концы склеились. Фрагменты сшивают с вектором и такими рекомбинантными ДНК трансформируют клетки кишечной палочки (в этом случае вместо термина "трансформация" обычно употребляют термин "трансфекция" - гибрид трансформации и инфекции: ведь речь идет о заражении клетки геномом бактериофага).
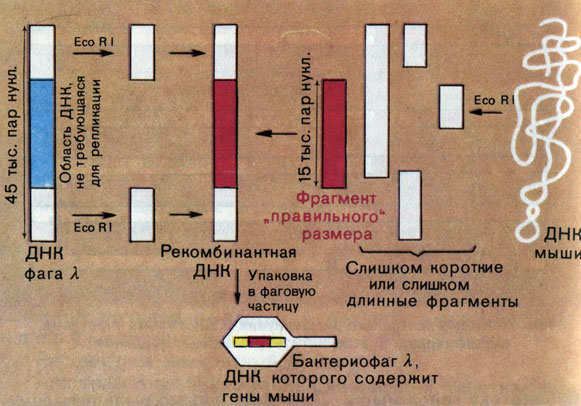
Рис. 27. Схема конструирования 'библиотеки' генов мыши на базе бактериофага X
Так проводят частичное расщепление ДНК мыши рестриктазой, то встроенные в ДНК фага λ фрагменты будут иметь самые различные размеры: от нескольких сот до нескольких десятков тысяч пар оснований. Выбрать из такого широкого набора фрагменты оптимальной длины такие, которые наверняка содержали бы неповрежденный ген и одновременно не были бы слишком большими (иначе их трудно будет анализировать), помогает сам бактериофаг λ. Как видно из рисунка 27, размер ДНК, которая попадает в фаговые частицы, не может быть произвольным: он не должен быть намного короче или заметно длиннее, чем ДНК обычного фага λ. Значит, если размер удаляемого из вектора центрального района составляет около 14 тыс. пар оснований, то примерно такую же длину будут иметь фрагменты чужеродной ДНК в фаговых частицах (чтобы общая длина рекомбинантного генома в них была равна примерно 45 тыс. пар оснований).
Исходя из этого, можно рассчитать, сколько нужно иметь в "библиотеке" фаговых частиц, чтобы в ней с высокой вероятностью (~99%) был представлен весь геном мыши. Для генома млекопитающих, общая длина которого составляет ~3⋅ 109 пар оснований, эта величина составляет примерно 1 млн. фаговых частиц. Если нас интересует какой-то определенный ген, в этом миллионе нужно суметь найти одну частицу, в ДНК которой нужный ген встроен.
Как из миллионов генов выбрать единственный. Генные инженеры не оперируют с отдельными генами и отдельными фаговыми частицами. Они манипулируют с миллионными популяциями, преследуя цель выявить потом нужную комбинацию из ненужных.
Главное, что нужно иметь для такого поиска (теперь часто пользуются словом "скрининг"), это зонд - молекула РНК или ДНК (обязательно меченная радиоактивным изотопом, обычно фосфором 32Р), комплементарная нуклеотидной последовательности искомого гена.
Зонд можно синтезировать, если известна нуклеотидная последовательность (здесь надо вспомнить, что один ген отличается от другого прежде всего последовательностью нуклеотидных остатков) хотя бы небольшого участка гена или белка, который в нем закодирован. По аминокислотной последовательности с помощью генетического кода можно, казалось бы, легко воспроизвести нуклеотидную последовательность, ее кодирующую. Но нужно помнить, что код вырожден, и потому вместо одной последовательности получаются несколько ее вариантов. Поэтому из известной последовательности белка выбирают такой участок, где есть метионин и триптофан (у них только по одному кодону), и такие аминокислоты, для которых код вырожден в наименьшей степени. Если это сделать не удается, то приходится синтезировать серию зондов. Ведь вырожденность кода может привести к тому, что один и тот же аминокислотный текст оказывается закодированным в ДНК совершенно несходными нуклеотидными последовательностями. Например, сер-сер-сер-арг-ала в ДНК может читаться как AGTAGAGCACGA и как TCATCGTCTCGC.
Зондом может быть и РНК, выделенная тем или иным способом из клетки. Это зонд, который "дарит" генным инженерам сама природа: ведь иРНК комплементарна гену. Часто оказывается полезным получить ДНК - копию (кДНК) этой иРНК с помощью образной транскриптазы.
Остановимся на операции получения ДНК-копий несколько подробнее: при клонировании генов к ней приходится прибегать не только для получения зондов, но и во многих других случаях.
Любая информационная РНК эукариот на 3′-конце содержит поли-А-последовательность - участок из нескольких десятков монотонно повторяющихся остатков адениловой кислоты. Эта последовательность не закодирована в ДНК, а присоединяется к иРНК после окончания ее синтеза с помощью специального фермента, напоминающего 3′-терминальную полинуклеотидтрансферазу. И хотя роль поли-А-последовательности в функционировании иРНК еще не вполне ясна (по некоторым данным, она делает иРНК устойчивой к нуклеазам цитоплазмы), ее присутствие именно на 3′-конце этих молекул оказалось как никогда кстати.
Во-первых, с помощью поли-А-последовательности иРНК можно отделить от остальных клеточных РНК (рибосомных, транспортных и прочих, составляющих более 90% всей РНК клетки), у которых такой последовательности нет. Для этого раствор суммарной клеточной РНК пропускают через колонку, заполненную целлюлозой, с пришитым к ней полимером из тимидиловых Т-остатков. Информационные РНК связываются с носителем, а все другие РНК, не имеющие "хвоста" из поли-А, остаются в растворе. Колонку тщательно промывают растворителем, а затем связи А-Т разрушают нагреванием или повышением рН и вымывают фракцию иРНК.
Во-вторых, именно поли-А-последовательность на 3′-конце иРНК позволяет легко получить ее ДНК-копию. Для этого поли-А-конец иРНК гибридизируют с олиго(Т)-затравкой (см. рис. 28) и с помощью обратной транскриптазы (ревертазы) на РНК как на матрице получают ДНК-нить. Далее уже с помощью обычной ДНК-полимеразы (после разрушения РНК-цепи) получают вторую цепь ДНК. В качестве затравки ДНК- полимераза использует образующуюся на 3′-конце первой ДНК-цепи шпильку, т. е. двуспиральный участок. Поэтому у двуцепочечной кДНК обе цепи оказываются связанными друг с другом. Их разрезают с помощью нуклеазы, специфичной к однотяжевой ДНК.
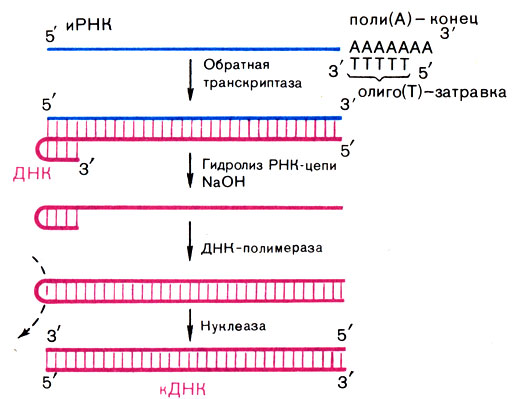
Рис. 28. Получение ДНК с помощью обратной транскриптазы
Обычно таким способом удается скопировать только часть иРНК (даже если обратная транскриптаза "прочтет" всю иРНК, часть кДНК будет потеряна при образовании шпильки). Однако в качестве зонда такая укороченная кДНК вполне пригодна.
Из очень небольшого количества иРНК можно получить большие количества кДНК-зонда. Для этого к кДНК пришивают линкерные участки, переносят ее в векторную плазмиду, которую размножают в соответствующих клетках в нужном количестве.
Имея зонд, можно приступать к анализу рекомбинантных фаговых частиц. Для этого бактерии, среди которых есть зараженные фагом, выращивают на твердой среде в чашках Петри, как говорят микробиологи, получают газон бактерий. В тех местах, где проявилась фаговая инфекция на газоне, будут наблюдаться прозрачные бляшки. Напомним, что в том месте, где образовалась бляшка, клетки кишечной палочки разрушены и вся ее площадь заполнена остатками клеток, фаговыми частицами и свободной ДНК бактериофага. Эта ДНК синтезировалась в клетке хозяина, но не успела одеться фаговыми белками. Именно за ней и пойдет охота.
Давно замечено, что ДНК очень хорошо сорбируется на нитроцеллюлозе (бездымном порохе). Если из этого материала изготовить фильтр (похожий на обычный бумажный фильтр) и пропустить через него раствор ДНК, то ДНК задержится на фильтре так, словно была не в растворенном виде, а в виде осадка. Такие нитроцеллюлозные фильтры широко используют для поиска рекомбинантных ДНК с необходимыми генами.
Если нитроцеллюлозным фильтром прикоснуться к газону бактерий с бляшками, то молекулы ДНК как бы прилипнут к фильтру (сорбируются на нем). Необходимо с большой точностью отметить положение фильтра относительно газона (например, иглой проткнуть фильтр и находящийся под ним агар с газоном в нескольких местах). Далее фильтр быстро обрабатывают 0,5 н NaOH, затем нейтрализуют. Такая обработка приводит к тому, что цепи двуспиральной ДНК разделяются и она переходит в денатурированное состояние, в котором крепче связывается с нитроцеллюлозой. Остается только "навечно" закрепить такую ДНК на фильтре. Для этого фильтр вместе с ДНК прогревают при 80° С.
Отметьте, что положение зоны с молекулами ДНК на фильтре (маленькое пятнышко) точно соответствует положению определенной фаговой бляшки на газоне, т. е. на поверхности твердой среды с проросшими колониями.
Следующий шаг: обработка фильтра раствором радиоактивного зонда - полинуклеотида, комплементарного искомому гену. В основе этой процедуры лежит образование ДНК - ДНК или ДНК - РНК гибрида. Поэтому зонд должен быть в однотяжевой форме, а условия обработки оптимальными для гибридизации: повышенная температура (но не слишком высокая, чтобы образовавшиеся гибриды снова не разрушались), длительное время (чтобы зонд успел найти свою ДНК). По окончании процедуры гибридизации фильтр отмывают от избытка зонда (иначе лишняя кДНК или иРНК, "прилипнув" к фильтру, образуют сильный радиоактивный фон, скрывающий результаты). Теперь та ДНК, в которой находится искомый ген, связавшись с зондом, несет на себе метку в виде радиоактивного фосфата. Выявить положение ее зоны сравнительно просто: фильтр в темноте накладывают на обычную рентгеновскую фотопленку, после необходимой экспозиции (ее время определяется величиной радиоактивности) фотопленку проявляют. Зона с радиоактивной ДНК выглядит на пленке как маленькое темное пятнышко. Эта процедура называется радиоавтографией. Зная, где это пятнышко находится на фильтре, можно найти на газоне бляшку, в которой находится фаг с искомой рекомбинантной ДНК (рис. 29). Остается только размножить его в культуре клеток кишечной палочки, выделить из него ДНК и из этой ДНК вырезать вставку той же рестриктазой EcoRI. Эта вставка - индивидуальный фрагмент одной из хромосом мыши, содержащий нужный ген! Еще недавно этот фрагмент был спрятан среди миллиона, казалось бы, ничем не отличающихся друг от друга фаговых частиц, и вот теперь он в руках исследователей.
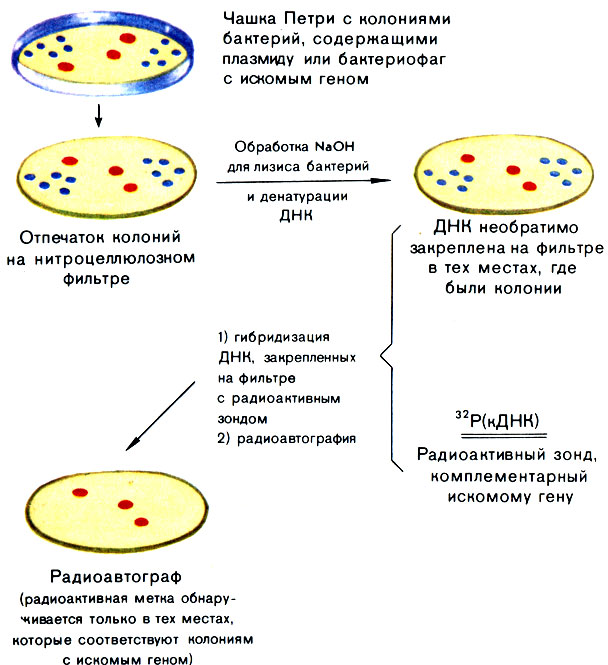
Рис. 29. Схема опыта по обнаружению колоний бактерий, несущих искомый ген, с помощью радиоактивного зонда
Сегмент ДНК с интересующим нас геном обычно по длине в несколько раз больше самого гена (помните, фаговый вектор сконструирован так, чтобы величина клонируемой ДНК была 15-20 тыс. пар нуклеотидов, а средняя длина гена - 1-2 тыс. пар нуклеотидов). Вот почему работа по получению индивидуального гена на этом не заканчивается. Помогут изолировать ген все те же рестриктазы и тот же зонд, который был использован для скрининга "библиотеки" генов.
Сегмент ДНК, извлеченный из "библиотеки" генов, расщепляют различными рестриктазами, получающиеся фрагменты разделяют электрофорезом в агарозном геле. Дальнейшая задача состоит в том, чтобы определить, в какой из электрофоретических зон находится нужный ген. Перенесем ДНК из этих зон на нитроцеллюлозный фильтр. Для этого сразу после окончания электрофореза на пластинку агарозного геля, еще пропитанного раствором электролита, накладывают нитроцеллюлозный фильтр, а сверху на него кладут несколько листов толстой фильтровальной бумаги, и все это помещают под пресс. Фильтровальная бумага будет всасывать в себя раствор из геля, но по дороге он проходит через фильтр, и ДНК, увлекаемая растворителем и вымывающаяся из электрофоретических зон, задержится на фильтре. Ее положение на фильтре точно соответствует положению на электрофоретическоь пластинке. Таким образом получен отпечаток картины электрофореза на нитроцеллюлозном фильтре. Эту операцию называют блоттингом (от английского слова - промокательная бумага).
Все остальные операции осуществляются так же, как и при скрининге "библиотеки" генов: ДНК на фильтре денатурируют, затем на нем необратимо закрепляют прогревом и гибридизуют ее с зондом. Те зоны ДНК, которые содержат искомый ген (или его фрагменты), свяжутся с радиоактивной меткой. Их обнаруживают радиоавтографией. Легко сообразить, что радиоактивно меченными могут оказаться сразу несколько зон ДНК, а не одна, хотя мы имеем дело с индивидуальным геном: рестриктазы могут разрезать этот ген на части и он попадет в разные фрагменты ДНК, отличающиеся по размеру. Совмещая радиоавтограф с электрофореграммой, теперь точно можно установить, в какой части "библиотечного" сегмента ДНК находится интересующий нас ген.
Остается только этот ген размножить. (Многие из вас могут сообразить, как это сделать.) Однако доведем объяснение до конца. Воспользуемся плазмидным вектором, который носит название pBR322. Наверное, это самый популярный вектор у генных инженеров. Он содержит сразу два гена устойчивости к антибиотикам - тетрациклину и ампициллину (родственнику обычного пенициллина). В составе этих генов есть по нескольку участков узнавания различными рестриктазами, причем каждый из таких участков уникален, т. е. встречается в векторе только один раз.
Теперь из рестрикционных фрагментов ген выберем такой, в котором нужный ген содержится целиком, но размеры которого не слишком превышают длину самого гена. Такой выбор помогает сделать вдумчивый анализ картины гидролиза "библиотечного" сегмента ДНК различными рестриктазами, полученной на предыдущем этапе. Допустим, что подходящий фрагмент есть и он получается при расщеплении сегмента из "библиотеки" генов рестриктазой BAmHI. В плазмиде pBR322 участок разрезания (последовательность GGATCC) этой рестриктазой находится в гене устойчивости к тетрациклину. Разрежем плазмиду BamHI, встроим в нее выбранный фрагмент и трансформируем такой рекомбинантной ДНК кишечную палочку. Последующий путь отбора клеток с рекомбинантной ДНК ясен: исходные клетки (без вектора) чувствительны как к тетрациклину, так и к ампициллину, клетки с неизменным вектором растут в присутствии обоих антибиотиков, а клетки с рекомбинантным вектором (т. е. с нашим геном) только в присутствии ампициллина. Замечательное свойство плазмиды pBR322 заключается в том, что она, как говорят, мультикопийна, т. е. в каждой клетке можно получить несколько десятков (а в специальных условиях и несколько сот) молекул рекомбинантной ДНК. Обычно отклонированный этим способом ген так и хранят в составе плазмиды, которая в любой момент может быть размножена в клетке. Плазмида стабильна, и ее даже можно послать письмом по почте своему коллеге, запечатав в маленький пластиковый пакетик.
Как заставить ген работать на новом месте. На примере поиса нужного гена в "библиотеке" генов мы познакомились со многими основными приемами генной инженерии. Однако картина была бы далеко не полной, если бы мы не рассказали о том, как при клонировании генов используется способность этих генов экспрессироваться (выражаться, т. е. синтезировать иРНК и белок) в чужеродной клетке.
Сама проблема синтеза белков с помощью чужеродных генов, например генов человека в кишечной палочке, далеко не простая. И важна она не столько для отбора клеточных клонов с нужным геном, сколько, как вы увидите дальше, для получения необходимых человеку белков в быстрорастущих клетках микроорганизмов.
Вспомним, что под экспрессией гена понимается синтез на этом гене предшественника иРНК (т. е. полноценная его транскрипция), процессинг иРНК (т. е. превращение ее в зрелую иРНК) и трансляция этой иРНК (синтез белка с помощью РНК-матрицы на рибосомах). К этому нужно добавить, что образующийся белок должен быть устойчив в чужеродной клетке. Кроме того, часто требуется, чтобы белок после образования в цитоплазме клетки был транспортирован (или, как говорят, секретирован) через клеточные мембраны наружу клетки. Для этого на его N-конце должна содержаться специальная последовательность, обладающая сродством к клеточным мембранам. А ведь клетки прокариот и эукариот (в нашем случае кишечной палочки и человека) используют совершенно разные сигналы транскрипции, трансляции, процессинга и транспорта белков.
Многие белки эукариот после завершения синтеза полигликозилируются: к белку пришивается короткая цепочка полисахарида, что сказывается на их активности и на их транспорте внутри клетки. Более того, не забывайте, что многие гены эукариот в отличие от прокариотических генов состоят из экзонов и интронов, а системы ферментов сплайсинга, которые бы удалили интроны и правильным образом сшили друг с другом экзоны, в кишечной палочке нет.
Отметим, что последняя трудность разрешается сравнительно легко: достаточно получить полноразмерную ДНК-копию (кДНК) зрелой информационной РНК, из которой уже удалены интроны. Что же касается различных сигнальных последовательностей, то здесь можно пойти двумя путями.
Во-первых, можно снабдить эукариотический ген всеми необходимыми сигналами прокариотической клетки. Эти сигналы (промоторы, терминаторы, сигналы транспорта) в виде фрагментов ДНК генные инженеры всегда держат под рукой. Единственное, что сделать пока не удается, это гликозилировать белки в бактериальной клетке. К счастью, многие белки (например, интерферон) обладают активностью и без полисахаридной привески. Если же такая модификация все же необходима, то вместо бактериальной клетки придется поместить ген в клетки животных, о чем речь пойдет дальше.
Во-вторых, чтобы обеспечить экспрессию чужого гена в клетках кишечной палочки, можно сшить его с каким-нибудь геном этой клетки. Создавая генетические конструкции этим способом, генные инженеры предпочитают использовать ген β-галактозидазы, о котором не раз уже говорилось. Вот, например, как был получен продуцент белка, из которого можно наработать один из гормонов человека - соматостатин1 (Подробнее об этом гормоне расскажем в следующей главе.)
Соматостатин - это даже не белок, а полипептид: он состоит всего из 14 аминокислотных остатков. Это значит, что его ген имеет длину 42 нуклеотидных остатка. На самом деле был получен более длинный двутяжевой полинуклеотид, состоящий из 52 нуклеотидных остатков, так как к гену нужно было присоединить "липкие" рестриктазные концы. Кроме того, как видно на рисунке, в начало этого гена был вставлен также кодон AUG (на языке ДНК-ТАС). Этот кодон соответствует аминокислоте метионину. Синтетический ген соматостатина был встроен в плазмидный вектор так, чтобы он оказался "в хвосте" гена β-галактозидазы (который заранее был помещен в тот же вектор вместе со всеми необходимыми сигналами). Такой рекомбинантный ген β-галактозидазы после трансформации вектором кишечной палочки прекрасно в ней экспрессировался: ведь он был в своей родной стихии, а белок, который при этом получался, представлял собой гибрид, или химеру, β-галактозидазы и соматостатина. Его выделили, и теперь предстояло отделить гормон от фермента (рис. 30). Вот здесь и был использован остаток метионина, дополнительно вставленный в химеру при конструировании ее гена. Простое химическое соединение - бромциан (BrCN) - расщепляет белки по метионину. А так как в самом соматостатине метионина нет, то гормон после обработки химеры бромцианом получается в неповрежденном виде.
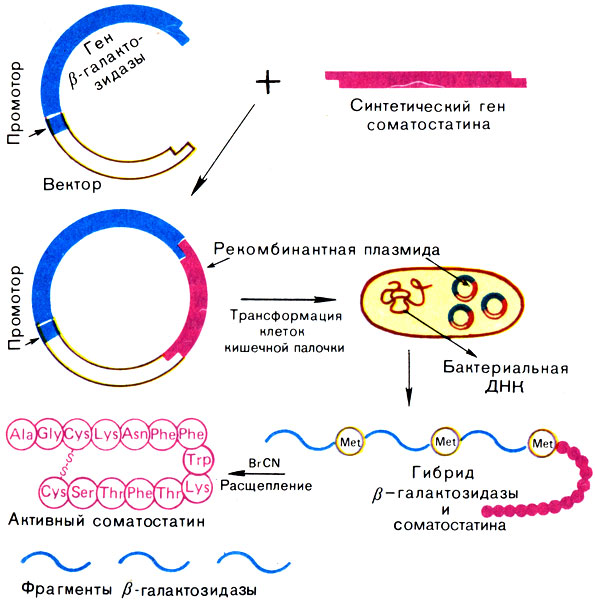
Рис. 30. Получение человеческого гормона соматостатина в клетках кишечной палочки
Есть и другие варианты получения химер. Модно, например, из хозяйского белка оставить только несколько первых (N-концевых) аминокислотных остатков, зато использовать все его сигнальные последовательности. Такой небольшой привесок, как правило, на активности белка не сказывается.
Итак, теперь мы знаем, как добиться того, чтобы клетка, получив чужеродный ген, производила закодированный в нем белок. Вернемся же к технике клонирования генов и посмотрим, как это обстоятельство может быть использовано для селекции клеток, несущих интересующий нас ген.
Самый простой случай - это когда ген кодирует белок, который сама клетка не производит, но без этого белка расти не может. Например, если белок - продукт нашего гена - участвует в биосинтезе аминокислоты гистидина, нужно взять клетки - ауксотрофы - по гистидину. Трансформируем эти клетки вектором с нашим геном и будем выращивать их на среде без гистидина. Вырастут на такой среде только те клетки, которые содержат вектор с искомым геном. Они и станут источником для его получения.
Удобно отбирать клоны с неким индивидуальным геном, когда продукт этого гена имеет ярко выраженную биологическую активность. Например, фермент, активность которого может быть определена с помощью какого-либо чувствительного метода. Выше мы говорили об отборе голубых колоний кишечной палочки, синтезирующей ?-галактозидазу, с помощью "Х-гал". А вот другой пример. Вам, наверное, приходилось наблюдать летней южной ночью светлячков. Светятся они благодаря специальному органу, в котором вырабатывается фермент люциферин-люцифераза. Этот фермент в присутствии универсального аккумулятора энергии - аденозинтрифосфата (АТФ) - образует вещество с сильной люминисценцией (кстати, благодаря такой активности люциферин-люциферазу широко используют для определения концентрации АТФ в биологических объектах). Ген люциферин-люциферазы удалось недавно отклонировать в клетках кишечной палочки, причем колонии бактерий с этим ферментом светились как светлячки и их отбирали по этому признаку.
Еще один очень эффективный способ отбора колоний основан на иммунологических тестах. Обычно его применяют тогда, когда клонируют ген уже достаточно хорошо известного белка, на который можно выработать антитела. Впервые этот метод был применен для отбора клонов кишечной палочки, содержащих ген инсулина (точнее гены: ведь инсулин, хотя и маленький белок, состоит из двух полипептидных цепей, соединенных S-S-связями). Почему гены инсулина пришлось переносить в бактериальную клетку, вы узнаете в другой главе. А сейчас на этом примере давайте рассмотрим суть иммунологического метода отбора клонов.
Векторы с генами инсулина были сконструированы уже знакомыми нам методами. После того как бактерии, трансформированные этими векторами, вырастили на чашках Петри, с них получили реплики. Однако на этот раз нитроцеллюлозные фильтры заменили на пластинки из поливинилхлорида, к которым были пришиты антитела к инсулину. Клетки, содержавшие векторы с геном инсулина, не только синтезировали этот гормон, но и секретировали его. Поэтому в тех местах, где находились такие колонии, был и свободный инсулин. Он прилипал к антителам, закрепленным на полимере. Обнаруживали положение этих прилипших молекул инсулина вновь с помощью антител, но уже меченных радиоактивным иодом 125J так, как это изображено на рисунке 31. Так же, как и 32Р, радиоактивную йодную метку можно обнаружить на рентгеновской пленке посредством радиоавтографии. По положению радиоактивных зон на полимерной пластинке можно установить местоположение колоний бактерий с активным геном инсулина. Эти клетки стали затем прародителями промышленных продуцентов инсулина.
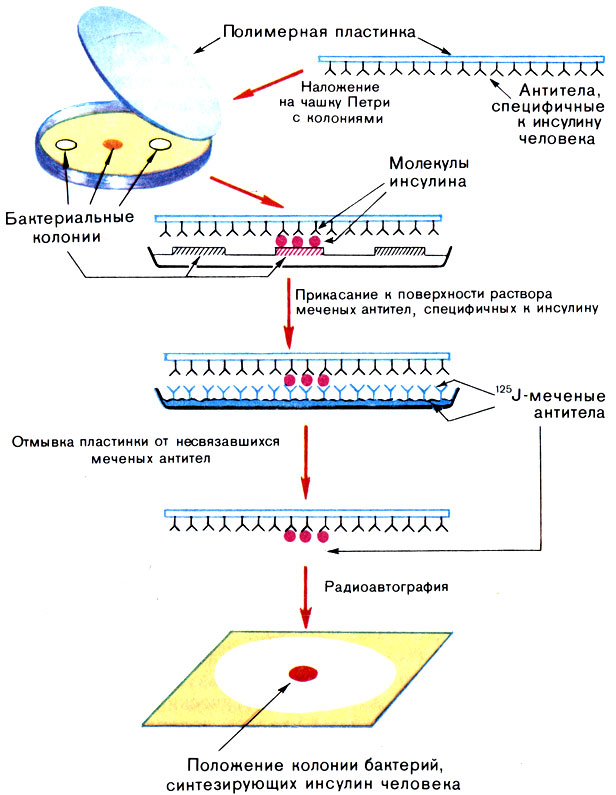
Рис. 31. Схема поиска бактериальных клеток, синтезирующих инсулин человека, с помощью антител
Клонирование генов в клетках эукариот. До сих пор мы рассматривали клонирование генов в бактериальных клетках, в том числе и тех генов, которые были извлечены из хромосом эукариот. А нельзя ли научиться переносить рекомбинантные ДНК прямо в эукариотические клетки и там заставить их экспрессироваться?
Вопрос этот имеет огромное практическое значение: ведь если мы действительно рассчитываем направленно создавать новые виды растений и животных, если хотим активно бороться с генетическими заболеваниями человека, то должны уметь включать в геном высших организмов гены, сконструированные вне клетки. В последующих главах вы познакомитесь с первыми успехами генной инженерии растений и животных. А сейчас коротко рассмотрим векторные системы, которые удалось создать для переноса рекомбинантной ДНК в эукариотические клетки.
Техника встраивания генов в эукариотические векторы и их клонирования в принципе та же, что и в случае бактериальных клеток. Однако сами эукариотические векторы отличаются от бактериальных. Конечно, они также имеют удобные участки для разрезания рестриктазами и маркерные гены. Но создают их на базе геномов плазмид и вирусов эукариот: им предстоит реплицироваться в эукариотической клетке и они должны быть приспособлены к ферментам и факторам, управляющим репликацией ДНК в таких клетках. Кроме того, в случае эукариот часто нужно стремиться к тому, чтобы чужеродный ген встроился (интегрировал) в хромосому клетки - реципиента. Тогда эукариотические векторы приходится снабжать элементами, обеспечивающими такое встраивание.
Начнем с простейшего эукариота - дрожжей. Дрожжи - это низшие одноклеточные грибы. По всем признакам это настоящие эукариоты: у них есть ядро, отделенное от цитоплазмы ядерной оболочкой, а весь ферментативный аппарат репликации ДНК, транскрипции и трансляции у них практически такой же, как и у остальных эукариот. У дрожжей работают ферменты - гликозилирующие белки. В то же время дрожжи быстро растут, используя даже такие субстраты, как парафин и метиловый спирт. Они уже давно стали промышленными микроорганизмами, их умеют прекрасно выращивать в заводских условиях. Они безопасны для человека и растут на дешевой среде. Следовательно, дрожжи очень перспективный объект для промышленного производства ценных продуктов любых эукариотических генов. Кроме того, геном дрожжей не так уж велик - 1,7×107 пар нуклеотидов на гаплоидную клетку (сравните с 3×109 пар нуклеотидов в геноме человека). А главное, он досконально изучен генетиками.
Правда, один недостаток у дрожжевых клеток есть: они покрыты очень плотной клеточной оболочкой, совершенно непроницаемой для молекул ДНК. Но здесь на помощь приходит обыкновенная виноградная улитка. Она вырабатывает ферменты - β-глюконазы, разрушающие полисахариды, из которых построена клеточная стенка дрожжей. β-глюконазы превращают дрожжи в "раздетые клетки" - так называемые протопласты, у которых цитоплазма окружена уже только тонкой, легкопроницаемой мембраной. Их обычно и трансформируют рекомбинантными ДНК. Важно, что через некоторое время стенка у дрожжевой клетки восстанавливается и рекомбинантная ДНК оказывается включенной в полноценную клетку.
Многие штаммы дрожжей содержат плазмиду - циклическую ДНК длиной 2 мкм (6300 пар нуклеотидов). Ее так обычно и называют - "плазмида 2 мкм". Она мультикопийна: клетка дрожжей может иметь до 100 ее копий. Однако, чтобы превратить ее в вектор, пришлось изрядно потрудиться: вставить в нее маркерные гены (в самой плазмиде 2 мкм их нет), убрать лишние рестрикционные участки и сохранить при этом ее способность реплицироваться в клетках дрожжей.
Из плазмиды 2 мкм получено уже множество векторов. Пожалуй, самые интересные из них получили название челночных векторов. Эти векторы могут реплицироваться не только в клетках дрожжей, но и в клетках кишечной палочки благодаря тому, что в них встроили фрагменты плазмид бактерий, содержащие бактериальные маркеры, а главное - участки, ответственные за их репликацию. С помощью таких "челноков" можно конструкции, созданные в бактериальной клетке, переносить в дрожжи и наоборот. Более того, некоторые "челноки" устроены так, что вместе с содержащимися в них генами могут включаться в хромосомы дрожжей. Таким образом, гены, отклонированные в кишечной палочке, удается не только размножать в дрожжах, но и "навечно" встраивать в дрожжевой геном.
Понятно, что для нормальной экспрессии чужеродных генов в дрожжах они должны быть снабжены дрожжевыми (эукариотическими) сигналами транскрипции и трансляции. Эту задачу также научились решать; сейчас получены дрожжи, продуцирующие интерфероны человека, необходимый для сыроварения химозин, инсулин и многие другие полезные белки.
Рассмотрим теперь более сложный пример - перенос рекомбинантных ДНК в клетки высших эукариот. Пока исследования здесь ведут, как правило, не на целых организмах, а на культурах клеток животных. Сейчас такие клетки, например клетки тканей человека, успешно размножают в жидкой и твердой среде, почти так же как бактерии и грибки. Правда, в культуре они гораздо капризнее. Лучше всего они растут, если в среду добавлять сыворотку крови теленка, богатую белком фетуином (?-глобулином). Лишь недавно разработаны почти полностью синтетические среды, содержащие полный набор аминокислот, витамины, ростовые факторы, соли и глюкозу. Белки - сывороточный альбумин и фетуин - все же приходится добавлять.
В таких средах удается выращивать клоны клеток, полученных из эмбриональных тканей и органов человека (из кожи, мышц, легких, почек, сердца, тимуса и других желез), 5-8 месяцев. За это время они проделывают до 50 делений, а затем по еще неясным причинам перерождаются и дегенерируют. Исключение составляют клетки злокачественных, раковых опухолей. Они обладают секретом "вечной молодости", и большинство их клонов существует годами. Раковые клетки отличаются от нормальных еще и тем, что на поверхности твердой среды они образуют скопления в несколько слоев. Нормальные клетки на поверхности среды образуют слой в одну клетку (монослой). Это свойство опухолевых клеток "клеточные инженеры" научились использовать при создании так называемых гибридом, о которых еще пойдет речь.
Самый популярный объект для изготовления векторов для клеток животных - вирус SV40. Это маленький вирус с кольцевой ДНК, длиной примерно в 5250 пар нуклеотидов, который был выделен из почки мартышки (отсюда название simian virus(SV) - обезьяний). Для человека он неопасен, он может вызывать раковые заболевания у обезьян. Кроме того, в определенных условиях вирус SV40 вызывает онкогенную трансформацию (т. е. превращение нормальных клеток в раковые) многих культивируемых клеток животных, например золотистого хомячка. Как источник для конструирования векторов геном вируса SV40 привлек внимание потому, что он прекрасно реплицируется в ядре клетки. Кроме того, подобно бактериофагу λ он может встраиваться в хромосомы хозяйской клетки (такое встраивание и вызывает онкогенную трансформацию клетки).
Из ДНК вируса SV40 удалось сконструировать целую серию полезных векторов, в том числе и "челноковые" векторы, с помощью которых переносят в клетки животных гены, отклонированные в бактериях. Такой перенос особенно важен, если ген состоит из интронов и экзонов: ведь даже система сплайсинга дрожжей неспособна обеспечить образование нормальных белков животных.
Немало трудностей пришлось преодолеть, прежде чем научились переносить рекомбинантные ДНК в эукариотические клетки. Самый простой прием основан на способности многих клеток поглощать с ДНК комплекс микрокристаллов фосфата кальция. Этим путем обычно проводят трансфекцию клеток векторами, полученными из ДНК вируса SV40. Более утонченный прием состоит в том, что ДНК заключают в так называемую липоcому, т. е. в микрокапельку водного раствора ДНК, окруженную фосфолипидной оболочкой. Стенки клеток эукариот также содержат фосфолипидные слои. Поэтому липосомы сливаются с клетками, а их содержимое переходит вовнутрь клетки.
Благодаря тому что эукариотические клетки достаточно велики, иногда удается тончайшим микрокапилляром, соединенным со шприцем, раствор ДНК впрыснуть прямо в их ядро или цитоплазму. Особенно хорошо техника микроинъекций разработана на яйцеклетках лягушек.
И наконец, переносить рекомбинантные ДНК, созданные из вирусных ДНК, можно с помощью самих вирусов. Вирусы давно приспособились проникать из клетки в клетку, поражая большие участки тканей, целые органы или организмы. И как бы сложно ни был устроен вирус, после его проникновения в клетку вирусная ДНК освобождается от вирусной оболочки и реплицируется в клетке. Вот тогда и можно подумать о том, как использовать вирусы для переноса полезных генов в многоклеточные организмы, вплоть до растений, животных и человека.
Сейчас обнаружены ДНК-содержащие вирусы (геном подавляющего большинства вирусов растений представлен РНК), паразитирующие на растительных клетках. Правда, они еще плохо изучены, и поэтому в генной инженерии растений используют векторы другого типа, о которых мы специально расскажем, когда будем рассматривать проблему переноса азотфиксирующих генов (глава 8).
Конечно, далеко не все вирусы животных и человека пригодны для переноса генов в эти организмы. Следует помнить, что речь идет о возбудителях болезней, наших злейших врагах, многие из которых стимулируют раковые заболевания. Здесь вспомнили о вирусе осповакцины - живой вакцине, которая, казалось бы, уже отслужила свое, избавив человечество от одной из самых страшных болезней.
Вирус осповакцины имеет очень сложное строение. Его геном огромен по обычным вирусным масштабам: его длина 187 тыс. пар нуклеотидов. Создать векторы из такой огромной ДНК невозможно, да и нет особого смысла, так как сама ДНК этого вируса не инфекционна. Оказалось, однако, что в клетке ДНК вируса осповакцины охотно рекомбинируется с любой другой ДНК, но обязательно несущей фрагменты вирусной ДНК. Эта чужеродная ДНК вместе с остальным вирусным геномом включается затем в вирусные частицы. При этом замещаться может очень большой сегмент вирусной ДНК - до 25000 пар нуклеотидов. Вот здесь и возникла замечательная возможность на основе вируса осповакцины (совершенно безопасного для человека и животных, технология производства которого отлаживалась десятилетиями) создать живую поливакцину, способную избавить человечество от многих инфекционных заболеваний. О первых успехах в этом направлении вы узнаете из следующих глав.
В завершение главы расскажем, почему один из творцов генной инженерии П. Лобан оставил микробиологию.
Историки науки сходятся во мнении, что П. Лобан был первым, кто теоретически создал полную схему получения рекомбинантных ДНК и клонирования генов. Произошло это так.
Во многих американских университетах аспиранты обязательно сдают своеобразный экзамен. Они должны разработать проект научного исследования, которое прямо не связано с темой их диссертационной работы. Но все в этом проекте: и его цель, и способы реализации - должно быть хорошо обосновано. Смысл такого экзамена - выявление творческих способностей будущего ученого.
В качестве проекта П. Лобан предложил ту схему, которую мы подробно рассмотрели в этой главе (см. рис. 24). Его экзаменаторами были выдающиеся ученые, а председателем экзаменационной комиссии - сам А. Корнберг, расшифровавший механизм биосинтеза ДНК и открывший ДНК-полимеразу. А. Корнберг был изумлен, выслушав идею П. Лобана, и настоял на том, чтобы П. Лобан бросил прежнюю работу и принялся за реализацию своей идеи. Питер Лобан последовал совету знаменитого ученого.
Через несколько месяцев работы П. Лобан обнаружил, что в соседней лаборатории П. Берг и его сотрудники работают над совершенно таким же проектом. Никакого плагиата здесь не было: П. Берг на экзамене П. Лобана не был и идея искусственного создания "липких" концов пришла ему независимо. Группа (или, как любят говорить американцы, команда) П. Берга завершила работу раньше. Статья П. Берга также вышла на год раньше статьи П. Лобана. В ней П. Берг отдал должное своему младшему коллеге. Но кто первым финишировал, тот и победитель.
П. Лобан тяжело переживал случившееся. Он решил оставить молекулярную биологию и заняться микропроцессорами.
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'