
Глава 6. Генная инженерия - первые успехи
Есть отрасль человеческой деятельности, в которую генная инженерия вторглась в самые первые годы своего существования, - это медицина.
Болезни и наследственность. Медицина сталкивается с множеством неполадок в человеческом организме. Наиболее известны инфекционные заболевания, вызываемые бактериями (чума, холера, дизентерия, туберкулез, дифтерия и др.) и вирусами (грипп, бешенство, оспа, корь, гепатит, полиомиелит и т. д.). Сюда попадают болезни, возбудители которых низшие эукариоты, т. е. грибки и простейшие (малярия, сонная болезнь, амебная дизентерия, стригущий лишай). Иногда считают, что причина, вызывающая заболевание, внешняя - попадание в организм возбудителя, а наследственность здесь роли не играет.
Это далеко не так, вернее, совсем не так. Известно, что предрасположение к какой-либо болезни может варьировать у разных представителей рода человеческого, и это свойство наследственное. Наш замечательный этнограф и путешественник Н. Н. Миклухо-Маклай, страдавший в тропиках от тропической малярии, поражался тем, что коренные жители - папуасы - ею практически не болеют. Мы теперь знаем причину этого: у аборигенов низких широт часто встречаются аномальные гемоглобины, ядовитые для малярийного плазмодия. Следовательно, малярия, вернее способность болеть ею, - наследственная болезнь.
Вот другой пример. Вы знаете, что существуют четыре группы крови: I, II, III, IV (или 0, А, В и АВ в современном обозначении). Оказалось, что люди с группой крови 0 (универсальные доноры) - первые жертвы в чумной эпидемии, носители группы А чаще заболевают гриппом, АВ наиболее устойчивы к оспе. Известно, что туберкулез вызывается внешним, фактором - палочкой Коха. Это так, но... Однояйцевые близнецы имеют одинаковый генотип, и если один заболевает туберкулезом, то и другой тоже (в 87% случаев). А у генетически разнородных двуяйцевых близнецов, развивающихся из разных яйцеклеток, совпадение лишь в 25%. Муж может заразить жену (или наоборот) лишь в 7% случаев. Что же, туберкулез - наследственное или инфекционное заболевание? Пожалуй, и то и другое. Палочка Коха может развиваться в организме человека, если он к этому наследственно предрасположен.
К инфекционным заболеваниям примыкают болезни, вызываемые однократным или хроническим воздействием на организм какого-нибудь неблагоприятного внешнего фактора. Это разнообразная категория: и лучевая болезнь, и силикоз (болезнь шахтеров), и наркомания. Их объединяет то, что причина болезни вне организма, в воздействии среды. Но они не заразны.
Наоборот, есть такие болезни, которые вызываются не действием неблагоприятного фактора, а отсутствием нужного для жизни фактора. Это разнообразные авитаминозы: цинга, рахит, бери-бери и др. И здесь граница между наследственными и ненаследственными заболеваниями условна. Цинга - авитаминоз, возникающий от нехватки в организме аскорбиновой кислоты (витамина С). У человека (и у всех обезьян, а также морских свинок) не работает ген фермента α-гулонолактоноксидазы, превращающего глюкозу в аскорбиновую кислоту. С точки зрения собаки, мыши, крысы цинга - наследственная болезнь, которой болеют все приматы.
Все перечисленные заболевания медики относят к числу таких, которые "определяются средой, а не наследственностью". Но существуют и такие болезни, которые полностью наследуются от родителей. Обычно это генетические дефекты, мутации какого-либо гена, унаследованные от обоих родителей. К ним же относят потомки хромосом. Примерами могут быть серповидноклеточная анемия (мутантные гемоглобины не только защищают от малярии, но, к сожалению, в гомозиготном состоянии приводят к смерти в раннем возрасте); гемофилия, при которой кровь не свертывается (гемофилик может погибнуть от царапины), и многие другие (всего известно свыше трех тысяч наследственных болезней). Генетический механизм расшифрован только у 10% заболеваний.
К какой категории отнести наиболее распространенные болезни, такие, как коронарная недостаточность, инфаркт, атеросклероз, инсульт, гипертония, диабет, наконец, рак? К какой категории отнести эпилепсию, нервно-психические заболевания? Их не принято считать наследственными, кроме наследственного диабета, который проявляется уже в детском возрасте. И это ошибка. Однояйцевые близнецы - точные генетические копии друг друга - отличаются удивительным совпадением (конкордантностью) в болезнях: если один из них заболевает шизофренией, то и другой в 69% случаев тоже. Конкордантность для эпилепсии у близнецов - 67%, для сахарного диабета - 65%. Дело в том, что наследственными медицина привыкла считать болезни с монофакторным наследованием, определяемые одним аллелем. Предрасположенность к инфаркту миокарда и гипертонии, нервно-психическим заболеваниям и раку также генетически определена (детерминирована), но определяется многими генами. Неудачное сочетание этих генов вызывает повышение предрасположенности, и достаточно легкого толчка извне, чтобы болезнь возникла. Все вы, наверное, знаете о случаях, когда инфаркты и приступы гипертонии возникали от "нервов", от сильных нервных потрясений. Но "порог болезни" у разных людей разный.
Старые прививки и новые вакцины. Рассмотрим на ряде примеров, что может дать (и уже дает) генная инженерная медицина. Рассмотрим инфекционные заболевания, вызываемые бактериями и вирусами. Ушли в прошлое мировые эпидемии (пандемии) чумы, холеры, оспы, от которых в средние века вымирали целые народы. Туберкулезный больной раньше редко мог надеяться на исцеление. Сейчас туберкулез и дизентерия, малярия и даже сонная болезнь, вызывавшая в Африке поголовную смертность, отступают.
Лечение и предупреждение инфекций до недавнего времени имели две основы - антибиотики и направленное стимулирование защитных сил самого организма, выработка у него иммунитета.
О действии антибиотиков вы уже знаете. Рассмотрим проблемы иммунологии. Если бы люди не имели до рождения системы иммунного ответа, они умирали бы в раннем детстве от любой бактерии, как марсиане в книге Г. Уэллса "Борьба миров".
На деле любой чужеродный белок или полисахарид с молекулярной массой 10000 и выше (такие полисахариды слагают оболочки бактерий) и некоторые другие вещества, попадая в организм позвоночного животного, вызывают иммунный ответ. Такие вещества называют антигенами. В ответ на введение антигена организм начинает синтезировать сложные белки - иммуноглобулины (более привычное их название - антитела). Эти белки соединяются с молекулами антигенов и выводят их из организма. Синтезируются антитела иммунной системой - клетками костного мозга, тимуса и лимфатической системы. Существует несколько типов иммунных клеток - иммуноцитов. Одни из них - А-клетки - только "обрабатывают" антигены для того, чтобы их "узнавали" другие, в первую очередь Т-клетки, или Т-лимфоциты, размножающиеся в вилочковой железе - тимусе (рис. 38). Различают еще В-лимфоциты - производные костного мозга. Они главные "герои" иммунного ответа и иммунологической памяти. Различают еще К-клетки (от английского killer - убийца), которые находят, в организме опухолевые и зараженные вирусами клетки и растворяют их. К-клетки активируются специальным белком - интерфероном.
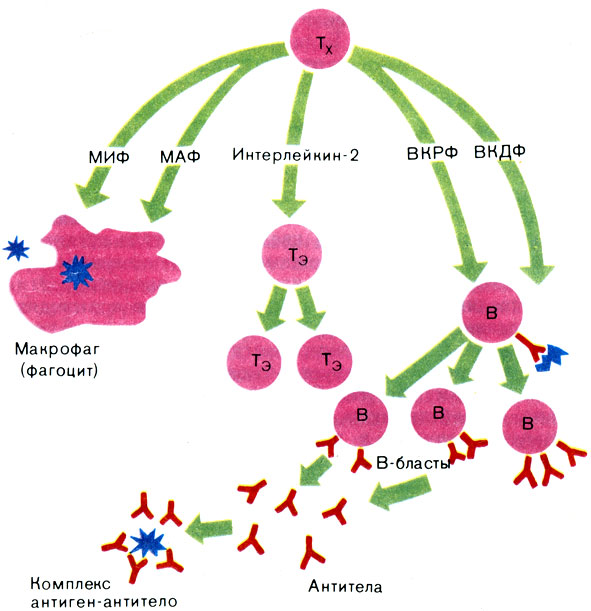
Рис. 38. Упрощенная схема работы системы иммунного ответа. Командное положение в ней занимают 'клетки-помощники' - лимфоциты - 'хелперы' (Тх), размножающиеся в тимусной железе - органе иммунитета. Именно эти клетки вырабатывают вещества, стимулирующие деятельность других лейкоцитов. Одни вещества - интерлейкины - активируют макрофаги, которые захватывают бактерии и опухолевые клетки (сокращенно МИФ и МАФ: один фактор подавляет миграцию макрофагов, второй - усиливает). Другие интерлейкины активируют тимусные эффекторные лейкоциты (Тэ), непосредственно присоединяющиеся к антигенам. Наконец, внеклеточные ростовые и дифференцирующие факторы (ВКРФ и ВКДФ) запускают в действие лимфоциты, синтезируемые в костном мозгу из предшественников В-бластов. В-клетки поставляют в кровь антитела - защитные белки- иммуноглобулины
Как только антиген выведен из организма, концентрация антител в крови быстро начинает снижаться до минимума. Повторное введение антигена вызывает быстрый, "без раскачки", ответ. Концентрация антител стремительно возрастает, организм борется с чужими молекулами и истребляет их. Создается впечатление, что организм "помнит" старое введение антигена. Точнее, "помнят" его лимфоциты, приобретшие способность синтезировать соответствующий иммуноглобулин. Они долго могут проживать в иммунной системе, и пока они живы, организм устойчив к данному антигену.
Эта "память" приводит к тому, что человек, переболевший один раз какой-либо болезнью, вторично ею не заболевает, или она проходит у него легко, без осложнений. Иммунная система - величайшее достижение эволюции. К сожалению, не на все болезни организм приобретает устойчивый иммунитет. Малярией и амебной дизентерией, гриппом можно заражаться и болеть многократно. Эта система уязвима. С возрастом тимус рассасывается, и пожилые люди становятся более уязвимыми к инфекциям. Развивается она медленно, и потому грудные дети к инфекциям так же уязвимы, как и старики. Есть и вирусы, разрушающие иммунную систему, прежде всего приобретший печальную известность СПИД (синдром приобретенного иммунного дефицита, т. е. иммунной недостаточности).
Эта система "слепа" и считает антигеном и оболочку бактерии, и пересаженную почку или сердце. В таких случаях приходится подавлять иммунный ответ. Медики возлагают большие надежды на вновь открытый антибиотик циклоспорин. К сожалению, циклоспорин подавляет отторжение не только пересаженного органа, но и открывает организм для инфекций. И так действуют все подобные вещества - иммунодепрессанты.
Порой иммунная система атакует и организм ребенка, развивающегося в теле матери, и даже собственные белки организма. Это так называемая аутоаллергия. И тем не менее без этой системы жизнь была бы невозможна.
Активировать иммунную систему, не зная еще о ее существовании, впервые смог в 1798 г. английский медик Э. Дженнер. В то время черная оспа была опасной болезнью, уродовавшей и часто убивавшей людей. Известна была и сравнительно безобидная болезнь - коровья оспа, вызывавшая язвочки на вымени у коров. Доярки часто заражались ею, и Дженнер подметил, что после этого они оказывались устойчивыми к черной оспе.
Э. Дженнер предложил через царапины на предплечье заражать людей коровьей оспой. После первичного иммунного ответа человек оказывался неуязвимым к оспе человеческой, черной. Позже узнали, что аналогичную прививку на Востоке люди практиковали с незапамятных времен, но Э. Дженнер этого не знал и по праву первооткрывателя назвал эту процедуру вакцинацией (в переводе с латинского - окоровливание). Оспенные прививки быстро распространились по свету. Однако вакцина Э. Дженнера считалась хотя и выдающимся, но все же частным достижением медицины. Ни один медик не догадывался распространить этот принцип на другие инфекции. Понадобился гений великого французского химика и микробиолога Луи Пастера, чтобы увидеть в прививках чудодейственное, общее для многих болезней средство. Л. Пастер понял, что введение в организм сильно ослабленных или убитых болезнетворных факторов сделает его устойчивым и к повторному заражению живыми.
Теперь это понятно: даже у убитых бактерий или вирусов сохранялись оболочечные антигены, стимулировавшие размножение лимфоцитов, синтезирующих антитела к ним. На весь мир прославило Л. Пастера изобретение прививок против бешенства. А ведь Л. Пастер не знал еще о существовании мира вирусов.
Так как вирус бешенства развивается в организме очень медленно, как и большинство вирусов, поражающих нервную систему, Л. Пастер предложил вакцинировать ослабленным вирусом людей, уже укушенных бешеным животным. Тогда антитела успевали возникнуть раньше и подавляли массовое размножение другого вируса, уже убийственного.
Впоследствии этот метод получил дальнейшее развитие. Медики научились получать концентрированные антитела на соответствующие антигены (например, на дифтерийный токсин или змеиный яд) и вводить их в кровь человеку, заболевшему дифтерией или укушенному змеей. Так появились, например, противокоревые гаммаглобулины. Их получают из донорской крови.
Донорская кровь - дорогой и малодоступный источник антител, поэтому многие из них сейчас получают из сыворотки крови животных. Начало этому положили в 1890 г. Э. фон Беринг и Т. Китасато, получив таким образом противостолбнячную сыворотку. Особенно удачно использовать для этой цели лошадей: ведь у лошади без особого вреда для нее кровь можно брать литрами. Так были получены сыворотки против дифтерийного токсина и змеиного яда. В наше время к этому старому методу добавлены лишь тонкие методы выделения нужных антител в чистом виде.
Итак, вакцинация предохраняет от болезни: в организм вводится антиген, на который вырабатывается антитело. При введение сыворотки мы лечим заболевшего, связывая попавшие в его организм антигены соответствующим антителом, заимствованным у другого человека или животного, перед тем переболевшего этой болезнью или вакцинированного против нее.
Получение вакцин и иммуноглобулинов в медицине сейчас хорошо отлажено. Но генная инженерия внесла сюда свои революционные идеи.
Вакцина, вводимая в организм для выработки иммунитета, может быть мертвой или живой, т. е. содержать убитый (но сохранивший антигенные свойства) или живой, но ослабленный вирус. Живые вакцины считаются более эффективными. Недаром полученная в СССР живая вакцина детского полиомиелита завоевала весь мир, вытеснив американскую мертвую вакцину Солка. Но живые вакцины таят в себе опасность: ведь вирус в результате обратной мутации может перейти снова в активную форму. Возникла идея: получить в больших количествах чистый вирусный белок-антиген и вводить его в организм. Без нуклеиновой кислоты вирус не размножается, а мутировать чистый антиген, конечно, не может. Например, вирус бешенства содержит пять белков: большую вирусную полимеразу, белок, образующий оболочку вируса, - нуклеокапсид, матричные белки М1 и М2 и гликопротеин G. Антигенной активностью обладает гликопротеин G.
Такая же ситуация наблюдается и для многих других вирусов, вызывающих опасные болезни человека. Среди многих белков, образующих оболочку этих вирусов, только один или два обладают антигенной активностью. Следовательно, для иммунизации действительно не нужен целый вирус, можно обойтись отдельными белками - субъединицами вируса. Такие вакцины так теперь и называют - субъединичными. Генная инженерия открыла простой и дешевый способ получения субъединичных вакцин. Достаточно из генома вируса (если это РНК-содержащий вирус, то используют его ДНК- копию) вырезать ген белка с антигенной активностью, встроить его в вектор и размножить этот белок в бактериальной клетке. Производство такого белка в отличие от получения вируса не только дешево, но и безопасно, а сама вакцина и безопасна, и не содержит ничего лишнего.
Субъединичные генноинженерные вакцины получены сейчас для вируса бешенства (гликопротеин G), вирусов гепатита А и ящура (так называемый белок VP1) и некоторых других. Хотя эти вакцины, несомненно, найдут применение в медицине, они, как правило, менее эффективны, чем целый вирус.
Вот почему генные инженеры вспомнили о вирусе осповакцины (вирусе коровьей оспы). Этот вирус сделал огромное дело: оспа полностью ликвидирована на земном шаре и многие годы оспу перестали прививать. Однако во многих странах мира существует хорошо налаженное производство осповакцины. Поэтому были разработаны методы введения в геном вируса осповакцины любого необходимого гена и получения живых осповакцин, несущих антигены многих вирусов (о том, как это делается, мы рассказали в главе 4). Более того, в одном геноме удается объединить антигены многих вирусов, например вирусов гриппа и бешенства или вирусов герпеса и гепатита В. Вирус герпеса в латентном (неактивном) состоянии имеется в организме многих людей и часто проявляется при простуде и переохлаждении, вызывая "лихорадку на губах". Но он бывает значительно более опасным, если переселяется на слизистую оболочку глаз, к тому же считается потенциально канцерогенным, способным вызвать рак. Еще более опасен вирус гепатита. Инфекционный гепатит (болезнь Боткина) часто переходит в неизлечимый церроз, а то и рак печени. Антиген вируса гепатита В (так называемый Nbs Ag) уже получен, но вакцинация им обходится дорого. Гораздо более перспективна вакцинация вирусом коровьей оспы, в которой встроен ген Nbs Ag. Тогда антиген не надо выделять и очищать - он сам размножается в организме, создавая активный иммунитет: ведь сыворотка крови вакцинированного содержит антитела и может быть применена для лечения гепатита.
Великое достижение современной иммунологии - гибридомы (рис. 39). Лимфоциты иммунной системы человека могут размножаться в культуре и синтезировать тот иммуноглобулин, который они синтезировали в организме. Однако срок их жизни невелик. Разработаны способы слияния лимфоцитов с хорошо размножающимися в культуре раковыми клетками определенных штаммов. Продукт такого слияния - гибридома - наследует от "родителей" способности неограниченно размножаться в культуре и синтезировать строго индивидуальные антитела. Такие гибридомы - источники моноклональных антител - разводятся биотехнологическими методами. Это один из нечастых примеров, когда в биотехнологии как источник продукта используют не быстрорастущие клетки микроорганизмов (бактерий и низших грибков вроде дрожжевых), а клетки млекопитающих. Моноклональные антитела гибридом сейчас используются как очень чувствительное средство диагностики. В сочетании с радиоактивными изотопами они позволяют выявить ничтожные количества антигенов. А чем раньше поставлен диагноз, тем больше шансов на быстрое излечение болезни. Гибридомы, вернее синтезируемые ими моноклональные антитела, используются для ранней диагностики не только заразных болезней. Широко известна тяжелая болезнь сердца - инфаркт, при которой повреждается сердечная мышца. Сократительный белок мышечных волокон - миозин - при этом выходит из клеток на поверхность сердца и становится доступным для антител. В США исследователи, используя гибридомы, получили моноклональные антитела на миозин, меченные изотопом индия. Это гамма-излучатель; поэтому можно получить на экране счетчика изображение поврежденной части сердца, которую "облепляют" молекулы антитела. Так появилась возможность диагностировать инфаркт у человека с сердечным приступом раньше и точнее, чем любым другим способом.
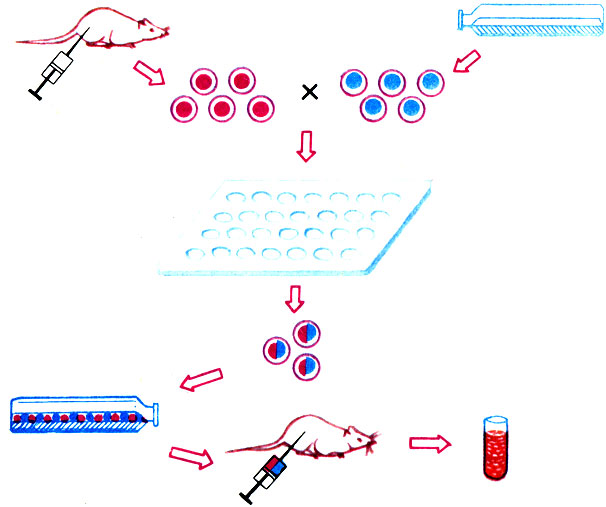
Рис. 39. Получение гибридомы. Мышь иммунизируют смесью белков, содержащих нужный антиген. Затем смесь лимфоцитов мыши, в которой должны быть клетки, вырабатывающие иммуноглобулин на этот антиген, смешивают со стабильными в культуре опухолевыми клетками. Под действием полиэтиленгликоля или высокочастотного электрического поля часть клеток сливается (соматическая гибридизация). Затем из массы гибридных клеток отбирают те, которые синтезируют нужный нам иммуноглобулин и клонируют их в культуре или в организме мыши- донора для получения неограниченного количества чистого, моноклонального антитела. По прогнозам, капитал 'гибридомных' фирм через 5 лет достигнет 8 млрд. долларов и в медицине произойдет небывалая по масштабам революция
Моноклональные антитела на белки раковых опухолей, например рака прямой кишки и яичников, позволяют выявлять метастазы задолго до того, как они могут быть обнаружены по привычным для врачей клиническими симптомам. Не удивительно, что слово "гибридома" не сходит сейчас с уст медиков, разрабатывающих новые способы лечения и диагностики болезней.
Моноклональные антитела гибридом по всей вероятности обещают революцию в пересадке органов (почек, сердца, кожи, в будущем, возможно, печени) от человека к человеку. Иммунная система "слепа" - она накидывается и на болезнетворную бактерию, и на пересаженный орган, что становится причиной его отторжения. Врачи разработали немало иммунодепрессантов, подавляющих отторжение. Беда в том, что все время, пока они вводятся пациенту, он беззащитен от любой инфекции. Только эмбрионы млекопитающих неспособны к иммунному ответу (иначе они отторгали бы белки матери), и введенный им антиген считают "своим", даже когда у них полностью развивается система лимфоцитов. Вот если бы это явление, так называемую иммунологическую толерантность, воспроизвести у взрослого человека, которому предстоит пересадка органа!
Английским ученым Р. Бенджамену и X. Вальдманну из Кембриджа удалось это сделать пока на мышах. Методом гибридом они получили моноклональное антитело на разновидность лимфоцитов, называемых Т-хелперами. Именно они "узнают" в организме чужие белки и клетки и наводят на них другие лимфоциты и антитела, они же - мишень для вируса СПИД. У мышей с введенным антителом Т-хелперы на 12 дней исчезли из крови на 90%, и им можно было вводить любой антиген.
Через 12 дней численность Т-хелперов возрастала до нормы, но организм уже считал введенный антиген "своим", не отторгал его! Дальше уже можно было не прибегать к средствам подавления иммуного ответа. Видимо, в будущем врачи вместе с пересадкой органа будут вводить больному антитело на Т-лимфоциты. После этого, конечно, недели две ему придется полежать в стерильном боксе, но это приходится делать и сейчас, после введения циклоспорина. А вновь появившиеся в крови лимфоциты пересаженного органа не заметят. Для них он "свой". В перспективе возможна пересадка человеку органа от животного другого вида.
Малярия - изнуряющая болезнь, до сих пор отравляющая жизнь большой части человечества, особенно в тропиках. Медики успешно лечат ее хинином и его производными. К сожалению, возбудитель малярии - малярийный плазмодий, хозяином и переносчиком которого являются комары из рода Anopheles, успел образовать штаммы, устойчивые к хинину. Против таких форм малярии химическая терапия бессильна. Вот если бы найти противомалярийную вакцину!
Ясно, что антигеном этой вакцины должны быть белки оболочки спорозоитов той стадии развития паразита, которая скапливается в слюнных железах комара и при укусе попадает в кровь человека. Но как получить их в достаточных количествах?
Американские исследователи из Национального института аллергологии и инфекций пошли по такому пути. Гены белка оболочки спорозоитов должны быть в составе генома и той формы паразита, которая разрушает эритроциты человека. Ее уже научились наращивать in vitro ("в стекле"). Нарастив достаточное количество массы плазмодия, исследователи выделили из нее ДНК, а из той - ген, кодирующий белок с антигенными свойствами. Белок очень своеобразный: он состоит из 41 четверки (тетрапептидов) аминокислотных остатков, соединенных последовательно, причем 37 четверок одинаковы. Антигенную активность проявляет даже короткая последовательность - всего из 12 аминокислот. Клонировать ген такой последовательности (36 нуклеотидов) элементарно, легко и получить большие количества антигена. Осталось лишь проверить эффективность такой вакцины. Возможно, когда эта книга попадет к вам в руки, последний этап работы будет уже проделан: поступили сведения о первых успешных опытах.
Гораздо более "твердым орешком" оказалась сонная болезнь. Ее возбудитель - жгутиковое простейшее трипаносома - переносится в Экваториальной Африке кровососущей мухой цеце. Химические препараты для лечения сонной болезни уже разработаны. Эффективен, в частности, этидий бромид, о котором мы писали в главе 3. Однако ни вакцины, ни сыворотки против сонной болезни получить не удается, и сейчас стало ясно почему. Клеточная оболочка трипаносомы слагается из белковых молекул, обладающих антигенными свойствами. Естественно, иммунная система больного синтезирует антитела, облепляющие паразитов, обитающих в крови. Но трипаносомы сбрасывают свои оболочечные антигены вместе с налипшими молекулами иммуноглобулинов и синтезируют новые, но уже другие. Новое поколение трипаносом, появляющееся в крови больного каждую неделю, имеет уже другую антигенную систему, против которой нужно заново вырабатывать иммунитет. Всего трипаносома имеет более 100 оболочечных антигенов, 100 недель она может размножаться в крови, не боясь иммуноглобулинов. За этот срок из одной трипаносомы может получиться 2100 клеток - это цифра с 30 нулями. Ясно, что больной погибает раньше, если не применить химиотерапию.
Интерфероны и вирусы. До сих пор мы говорили о синтезе антител - противобактериальных и противовирусных факторов, которые действуют строго специфично. Иммуноглобулин против кори не действует на вирус бешенства и наоборот. Но защитные системы наших организмов в принципе могут синтезировать и факторы широкого действия, блокирующие развитие многих вирусов.
Примером может быть интерферон (точнее, интерфероны). Давно подмечено, что клетки, зараженные одним вирусом, приобретают временный иммунитет к заражению другим вирусом. Это явление назвали интерференцией. Оказалось, что интерференция - сложный процесс, определяемый многими факторами, в том числе синтезом в клетке специального белка - интерферона.
Теперь известны три типа интерферонов, обозначаемые первыми буквами греческого алфавита- α, β, γ. Их соответственно называют лейкоцитарными, фибробластными и иммунными. Первые два образуются в клетках при заражении вирусами и каким-то образом подавляют их развитие. Третий, γ-интерферон может блокировать рост некоторых типов злокачественных опухолей. Синтез интерферонов в организме стимулируется не только вирусами и опухолевыми клетками, но и токсинами некоторых бактерий, например стафилококков.
Интерфероны, очевидно, мощное защитное средство организма. К сожалению, они не всесильны. У многих людей, в первую очередь детей и пожилых, синтез этих защитных белков недостаточен, а это открывает ворота инфекции. Поэтому их приходится вводить в кровь больных с помощью инъекций. В аптеках бывают препараты α- и γ-интерферонов, получаемых из донорской крови (β-интерферон вырабатывается клетками соединительной ткани). Но всех обеспечить защитными белками таким путем невозможно. Слишком дорогой и дефицитный источник - человеческая кровь. Никакой другой заменить ее невозможно. Интерфероны видоспецифичны. Впрочем, как это ни странно, свиной интерферон по структуре похож на человеческий и в некоторых случаях может его заменить.
Второй источник, на этот раз фибробластного, β-интерферона, - клетки человеческой плаценты. При рождении человека отторгается плацента - те оболочки, в которых развивался зародыш в теле матери. Плацента слагается соединительной тканью. Выделенный из нее препарат с интерферонной активностью получил название плаферон; его выделили в Тбилиси и планируют внедрение в производство. Отличные стимуляторы синтеза интерферона - синтетические полинуклеотиды, образующие двойные спирали, например поли-G и поли-С. Их можно вводить в организм вместе с вакциной против вируса.
Однако самый многообещающий путь - получение генноинженерных интерферонов, для чего следует клонировать их гены в плазмидных векторах. К счастью, интерфероны не очень большие белки. Они состоят из одной полипептидной цепи длиной в 140-170 аминокислотных остатков. Кроме того, гены некоторых интерферонов просто устроены. Например, ген ?-интерферона не содержит интронов. К тому же ?-интерферон - негликози- лированный белок. Поэтому работы по клонированию генов интерферонов, проводившиеся как в нашей стране, так и в ряде зарубежных стран, очень быстро привели к замечательным результатам.
Расскажем об одной из таких работ. Она была выполнена в лаборатории Е. Д. Свердлова в Институте биоорганической химии АН СССР.
Клетки селезенки человека обрабатывали токсином стафилококка, чтобы активировать гены интерферона. Синтез в клетках начинался, естественно, с процесса транскрипции - синтеза мРНК. Далее из клеток выделяли суммарную мРНК, в которой матрица для синтеза интерферона составляла едва ли десятитысячную долю.
Затем в ход пускали обратную транскриптазу (ревертазу), способную на нити РНК синтезировать комплементарную ей ДНК (кДНК). Ее и встраивали в плазмиду кишечной палочки. Так получили тысячи клонов комплементарных ДНК, из которых требовалось отобрать нужный.
Бактерии, содержащие клоны, высевали на чашки Петри с твердой питательной средой, и после нескольких часов роста они образовывали колонии. Затем на каждую поверхность среды накладывали нитроцеллюлозный фильтр. Часть бактерий прилипала к нему, сохраняя точное расположение колоний. Теперь, если обработать фильтр раствором щелочи, клетки разрушаются, а денатурированная ДНК сорбируется на нитроцеллюлозе.
Дальнейшую работу сильно облегчило то обстоятельство, что последовательность гена ?-интерферона была уже известна. Поэтому было возможно синтезировать зонд - небольшой фрагмент этого гена - простым химическим синтезом. Этот фрагмент синтезировали "горячим", т. е. сильнорадиоактивным. Оставалось выдержать фильтры в растворе меченого фрагмента: кДНК интерферона, содержащаяся в некоторых клонах, образовывала двойные спирали с меченым фрагментом. Отмытые от лишней метки фильтры экспонировались на рентгеновской фотопленке, и везде, где имелась нужная ДНК, появлялось черное, засвеченное пятно. Зная, где расположено пятно на фильтре, нетрудно найти нужную колонию бактерий на агаре и размножить этот клон - размножить ген интерферона. На этом работа еще далеко не закончена. Следует помнить, что ген интерферона вырван из родного эукариотного генома и находится в чужом окружении бактериальной клетки. К счастью, в нем уже нет интронов, с которыми "не умеют" работать бактерии: ведь он синтезирован по мРНК, из которой интроны удалены еще в клетке селезенки. Но зато к последовательности "зрелого" интерферона к нему присоединен фрагмент, в совокупности с которым он образует ген белка-предшественника. Только предшественник может выйти из клетки в плазму крови. При этом фрагмент отщепляется и белок становится активным. Этой системы созревания в кишечной палочке нет. Поэтому она может синтезировать в лучшем случае лишь неактивный предшественник, а вернее всего, транскрипции не будет: регуляторные системы, включающие гены, у бактерий другие.
К счастью, теперь уже можно наращивать клонированный ген и иметь дело не со следовыми количествами, а с целыми микрограммами (для генных инженеров такое количество считается большим).
Пришлось отщепить фрагмент, кодирующий сигнальный пептид предшественника рестриктазой Ava II, разрывающей последовательность
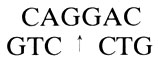
Правда, при этом отщепляется и часть, кодирующая "зрелый" интерферон, именно последовательность цис- тир-цис-глу. Эту последовательность из 12 нуклеотидов пришлось синтезировать химическим путем и пришить к поврежденному гену лигазой. Заодно к началу добавили кодон ATG, кодирующий метионин. Ведь у бакте рий начало синтеза идет с метионинового кодона, играющего роль "заглавной буквы". Затем ДНК-лигазой присоединили элемент Р (бактериальный промотор) плюс ту коротенькую последовательность, по которой бактериальные рибосомы узнают мРНК и начинают трансляцию.
В результате всех этих сверхтонких манипуляций получился ген с липкими концами, пригодный для встройки в вектор. Результатом работы явился штамм кишечной палочки, который синтезирует человеческий интерферон до 30% суммарного белка клетки. С учетом потерь при выделении и очистке 1 л донорской крови дает примерно 1 мкг интерферона, а 1 л бактериальной взвеси - в сотни раз больше! Это большая удача. Такая работа осуществлена в нашей стране и с геном ?-интерферона. Его уже получают в заводских условиях под названием реоферона. Рекомбинантные интерфероны сейчас проходят клинические испытания, и будем надеяться, скоро появятся в нужном количестве в аптеках.
Интерфероны, вероятно, принесут еще немало нового. Пока неизвестно, каким образом эти чудо-белки останавливают вирусную инфекцию. Выявлено, что они стимулируют в клетках синтез непонятных олигонуклеотидов из остатков аденина, но со связями не 3'-5', как в обычных нуклеиновых кислотах, а 2'-5'! Может быть, эти олигоаденилаты "сбивают с толку" вирусные ДНК и РНК, присоединяясь к ним и блокируя дальнейшую репликацию вируса?
Интерфероны активны внутри вида (видоспецифичны). Оказалось, что человеческий интерферон подавляет рост вирусов многих растений: вируса табачной мозаики и других, и даже миковирусов шампиньонов! Сомнительно, однако, чтобы опрыскивание растений раствором интерферона, пусть даже рекомбинантного или свиного, было экономически выгодным. Но может быть, удастся встроить ген интерферона прямо в геном растения? Или для защиты растений пригодятся эти загадочные олигоаденилаты? Их относительно легко синтезировать химическими методами. Может быть, они найдут применение и в медицине? Мы об этом скоро узнаем.
Болезни, по-настоящему наследственные. Теперь перейдем к тем болезням, которые полностью, как полагают медики, определяются наследственностью.
Практически неизлечимы в наше время случаи, связанные с "поломками" хромосомного аппарата, потерей одной из хромосом в наборе (нуллисомики) или приобретением лишней (трисомики). Носители таких хромосомных мутаций нежизнеспособны или не оставляют потомства, поэтому эти мутации не накапливаются в популяциях.
Иное дело - генные мутации, затрагивающие последовательность нуклеотидов в гене. В результате возникает новый аллель, продуцирующий белок с измененными свойствами.
Разные мутации приводят к возникновению различных аллельных форм белков. Большинство из них аномальны: фермент плохо ускоряет реакцию, гемоглобин хуже переносит кислород, регуляторный белок хуже выполняет свои функции. Однако сразу проявляются в фенотипе только доминантные мутации. Большинство же мутации рецессивно, а так как мы получаем от отца и матери не меньше двух одинаковых генов, они могут накапливаться в популяциях, передаваясь в скрытом виде.
Лишь когда в результате перемешивания генов в популяции человек получает и от отца, и от матери одинаково измененные гены, действие их сказывается на развитии фенотипа. Так возникают наследственные болезни. У них своя специфика. Они не принимают характера эпидемий, ими заболевают в единичных случаях. Но в государственном масштабе вред, наносимый ими, велик. В США, например, свыше 20 млн. человек (каждый десятый!) страдают унаследованными от родителей расстройствами здоровья.
Следует сказать, что некоторые наследственные болезни таковыми не считаются. Так, способность или неспособность чувствовать вкус органического соединения - фенилтиомочевины - долгое время считалась безобидной, нейтральной генетической вариацией. Теперь установлено, что у людей, которым фенилтиомочевина кажется безвкусной, чаще наблюдаются случаи зоба и кретинизма.
Первые попытки излечить наследственный дефект относились к важному гормону, управляющему углеводным обменом, - инсулину, который синтезируется поджелудочной железой. Наследственный или приобретенный дефицит инсулина приводит к тяжелой болезни - диабету, в старину называвшемуся "сахарной болезнью".
Инсулин - небольшой белок, состоящий из двух полипептидных цепочек, соединенных мостиками из двух атомов серы. Он практически не вызывает у нормальных людей реакцию отторжения, не является антигеном. Поэтому еще в начале нашего века лечили впрыскиванием раствора инсулина, выделенного из поджелудочных желез рогатого скота и свиней. Тем не менее ген инсулина теперь клонирован в кишечной палочке, и в ряде стран в продаже появился человеческий инсулин. Ведь свиной и коровий инсулин несколько отличается по составу от человеческого и у некоторых больных вызывает аллергическую реакцию.
С другими гормонами белковой природы дело обстояло хуже, все они оказались видоспецифичными.
Чужим гормоном роста - соматотропином, например, нельзя лечить гипофизарный карликовый рост человека: возникает антигенная реакция.
В настоящее время клонированы гены не только человеческого соматотропина, но и его антагониста - соматостатина, который регулирует рост и управляет синтезом гормонов поджелудочной железы - инсулина и его антагониста - глюкагона. Теперь возможно не только лечить карликовый рост, но при необходимости и тормозить избыточный рост. Такие случаи отмечаются, например, при аденоме - доброкачественной опухоли передней доли гипофиза. У человека тогда начинается акромегалия: непропорционально разрастаются хрящевые концы длинных костей и челюсти. Причина акромегалии - избыточный синтез гормона роста у взрослого человека.
У нас получен человеческий соматотропин, клонированный в кишечной палочке. Он будет использоваться только для лечения карликовости, а не просто невысокого роста, что болезнью не является (рис. 40).
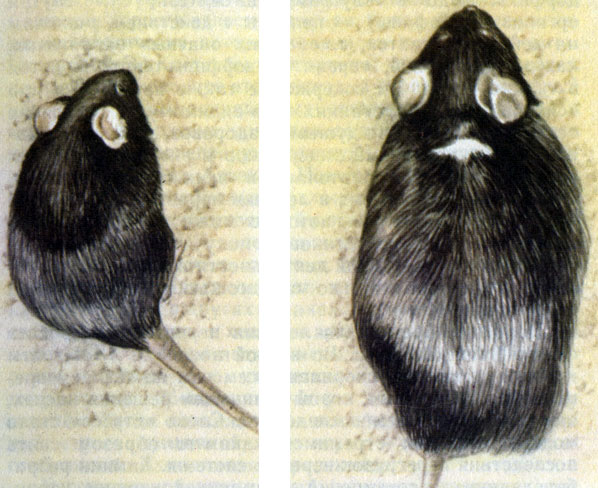
Рис. 40. Нормальная мышь (слева) и мышь, которой ввели гормон роста крысы. Гормон роста ввели следующим образом: нужный фрагмент ДНК крысы присоединили к регуляторным мышиным последовательностям и поместили в яйцеклетку мыши. Мыши с рекомбинантным геном на 20-80% крупнее обычных мышей; их называют супермышами
Один из авторов этой книги в 1982 г. получил письмо от девушки невысокого роста. Чувствуя себя не очень уютно среди современного поколения акселератов, она хотела подрасти с помощью гормонов. Напрасно я писал ей, что малый рост отнюдь не уродство, даже цитировал Р. Бернс*. Корреспондентку мою, кажется, убедили не стихи великого шотландского поэта, а опасность вместе с высоким ростом получить признаки акромегалии - патологически длинные руки и ноги и "лошадиную" челюсть.
* (Девушке маленького роста: На то и меньше мой алмаз Гранитной темной глыбы, Чтобы дороже в сотни раз Его ценить могли бы!)
Наоборот, сейчас ученые, например в ГДР, ставят вопрос о необходимости как-то притормозить акселерацию подрастающего поколения, хотя бы инъекциями соматостатина. Ведь двухметровые акселераты, которых становится все больше, нередко оказываются болезненными, менее устойчивыми к неблагоприятным факторам внешней среды. По-видимому, предел оптимального роста для мужчин около 180 см, а у женщин существенно меньше. Это только один из примеров, когда клонированные гены гормонов находят применение в медицине. Но в организме немало и других белков-регуляторов, роль которых мы только еще начинаем открывать.
Не менее интересны недавно открытые энкефалины - крошечные, всего из пяти аминокислотных остатков пептиды, по-видимому, обломки более крупных белков. К примеру у подопытных крыс эти пентапептиды улучшают память. Концентрация энкефалинов в спинномозговой жидкости у людей с нарушениями психики изменяется.
Интерес невропатологов и психиатров вызывают эндорфины (эндо - "внутри", т. е. синтезируемые внутри организма морфины) - пептиды с действием, похожим на действие опиатов, т. е. таких опасных наркотиков, как морфин, опий, героин. Эндорфины синтезируются в тканях мозга. Их содержание также изменяется при психических заболеваниях. По-видимому, состояние психики человека, его душевное здоровье, зависит от равновесия концентраций эндорфинов и энкефалинов и их антагонистов. Невропатологи и психиатры полагают, что в ближайшее время в лечении нервных заболеваний произойдет революция, которую можно сравнить лишь с началом эры антибиотиков. А получить белковые факторы регуляции нервной деятельности в достаточных количествах можно только с помощью методов генной инженерии.
Новые лекарства для лечения нервных расстройств имеют большой спрос. Во второй половине XX в. ритм жизни чудовищно ускорился. Всем нам не хватаем времени, все мы спешим, порой принимаем решения наспех, а затем переживаем последствия. Слово "стресс" стало модным, все мы стремимся каким-то образом снять последствия перегрузок нервной системы. Химики разработали немало соединений, снимающих нервное напряжение, - транквилизаторов, в частности широко известный тазепам. К сожалению, транквилизаторы небезвредны, да и перестают действовать, когда организм к ним привыкает.
Физиологи нашли на оболочках нервных клеток особые белки-рецепторы, к которым присоединяются молекулы тазепама. Оказалось, что транквилизатор активирует рецептор, и в клетке начинается синтез гамма-аминомасляной кислоты, которая снимает возбуждение нервной системы. Отсюда следовало, что имеются какие- то природные аналоги транквилизаторов со сходным действием. Человек перевозбуждается просто потому, что их ему не хватает.
Американские исследователи во главе с Э. Коста попытались их найти и в конце концов получили из мозговой ткани крыс довольно крупный (105 аминокислот) пептид, практически маленький белок, который присоединялся к клеточному рецептору. Однако действие его было противоположным: он усиливал нервное возбуждение, за что получил выразительное прозвище "пептид страха".
Сам по себе "пептид страха" обещает многое: ведь медицине хорошо известны случаи, когда нервная система патологически заторможена и ее нужно возбудить. Но группа Э. Коста была огорчена: они искали совсем не то. Стало ясно, что этот пептид, а вернее его активный центр из 18 аминокислотных остатков, конкурирует с искомым природным транквилизатором, присоединяясь к клеточному рецептору. Структура желанного пептида должна была быть близкой. Поэтому сотрудники Э. Коста по уже известной аминокислотной последовательности синтезировали искусственный ген "пептида страха". Гибридизуя его с ДНК человека и крысы, они "выловили" несколько генов очень сходных пептидов, которые оказались активными, способными к транскрипции, не только в мозгу, но и в других органах. Теперь дело упрощается. Можно пустить в ход весь арсенал генной инженерии и получить пептиды-антагонисты, действие которых обратно действию того, что выделен первым, т. е. "пептиду страха". Можно получить и антитело к "пептиду страха". Тогда появилась бы возможность лечить нервный стресс прививкой, как корь - коревым гамма-глобулином. Заманчивая перспектива!
Расскажем об аномальных ферментах, вызывающих унаследованные от родителей заболевания. Есть тяжелая наследственная болезнь - фенилкетонурия, при которой организм больного неспособен превращать одну из аминокислот - фенилаланин в другую - тирозин. Избыток фенилаланина приводит к ослаблению пигментации кожи и волос (тормозится синтез пигментов - меланинов). Однако не это главное. При фенилкетонурии производные фенилаланина - органические кислоты с ароматическим ядром - отравляют мозговую ткань, приводя к слабоумию. Аллель гена, вызывающий фенилкетонурию, встречается по подсчетам ученых у 0,5% населения.
Единственно надежный в настоящее время способ предотвращения фенилкетонурии - диета с предельно низким содержанием фенилаланина (полностью исключить его нельзя, так как это незаменимая для человека аминокислота). Для детей с этим наследственным дефектом ядовито даже материнское молоко - их нужно вскармливать на искусственной смеси с низким содержанием фенилаланина. Диагностировать фенилкетонурию сразу после рождения ребенка очень просто: достаточно приложить к мокрой пеленке бумажку, пропитанную раствором хлористого железа - моча ребенка даст зеленую окраску.
Изготовление искусственных смесей в массовом масштабе обходится дорого. Но несравненно дороже содержание больных с тяжелыми психическими и физическими нарушениями. А если недостающий фермент вводить в кровь больному? К сожалению, инъекции малоэффективны: слишком быстро фермент разрушается в крови. Разработан иной прием. Известно, что ферменты, закрепленные на твердом носителе (иммобилизованные), более устойчивы. Исследователи предложили нужный фермент закреплять на внутренней поверхности нейлоновых трубок. Система таких трубок (реакторов) присоединяется между бедренной артерией и веной; кровь, проходящая через нее, освобождается от избыточного фенилаланина. Такие реакторы были бы очень полезны для лечения в период резкого обострения болезни. На собаках они уже испытаны. По этому пути пойдет, очевидно, медицина - до тех пор, пока генные инженеры не разработают безопасный способ включения "здоровых" генов в геном человека, т. е. пока не создадут генную хирургию.
Другой пример "больного" гена и кодируемого им "больного" фермента - ген одного из ключевых ферментов пуринового обмена у человека. Он имеет длиннейшее название: гипоксантингуанинфосфорибозилтрансфераза (сокращенно ГГФРТ). В человеческих популяциях встречаются разные аллели этого гена, продуцирующие фермент большей или меньшей активности. Чем хуже работает ГГФРТ, тем больше мочевой кислоты накапливается в организме. Наиболее "безобидный" аллель вызывает подагру (соли мочевой кислоты плохо растворимы; кристаллы их, накапливаясь в суставах, вызывают мучительные боли). Если аллель продуцирует фермент худшего качества, возникает почечно-каменная болезнь, а затем сильнейшее отравление мочевой кислотой - гиперуринемия.
Если фермент не работает совсем или ген заблокирован, наступает тяжелая болезнь. У детей, пораженных этой болезнью, сильная умственная отсталость, спинномозговые параличи. До недавнего времени такие дети были обречены. Лишь сейчас появилась надежда: Д. Миллер (США) встроил нормальный ген ГГФРТ в PHK-содержащий вирус (ретровирус) и ввел в спинной мозг мышей. И там стал синтезироваться человеческий ГГФРТ! Д. Миллер предполагает приспособить вирус со встроенным геном для размножения в организме больных; к сожалению, трудность в том, что многие ретровирусы потенциально канцерогенны: встраиваясь в геном, они могут стать причиной роста злокачественной опухоли. Это уже попытка генной хирургии, попытка вставить "здоровый" ген в организм наследственно больного человека.
Больший успех пока имеют те исследователи, которые пошли по проторенному пути лечения чужим белком (т. е. человеческим, но выращенным в микроорганизме с клонированным геном). Но есть и другие пути. Мы упоминали о тяжелой наследственной болезни гемофилии, при которой у человека кровь плохо свертывается. Причина этого - отсутствие в крови полноценного белка свертываемости, так называемого фактора VIII. Это огромный белок из 2351 аминокислотного остатка, синтезируемый клетками печени. Сейчас больных гемофилией лечат введением крови доноров. Но таким путем их можно заразить вирусом гепатита или, того хуже, вирусом СПИД, о котором мы еще будем говорить. Надежнее нарабатывать в микроорганизмах чистый фактор VIII.
Недавно ген фактора VIII был отклонирован и изучен. Это самый большой из известных индивидуальных генов. Его длина - 180 тыс. пар нуклеотидов! Напомним для сравнения, что в гене интерферона всего 600 пар нуклеотидов. И тем не менее уже через 3-4 года ученые надеются создать доступный каждому больному препарат чистого фактора VIII. Особенно важно это для развивающихся стран, где продолжительность жизни больных гемофилией не превышает 20 лет. Можно и вообще избежать появления на свет больного ребенка.
Медицинские генетики дают консультации обратившимся к ним будущим матерям. В роду матери (или отца) наблюдались случаи гемофилии (или иной тяжелой наследственной болезни). Какова вероятность рождения больного ребенка в данном случае? Генетик сейчас производит нехитрые расчеты, основанные на менделевской формуле 3:1, и говорит: вероятность рождения больного, например, 25%. Слишком многое зависит от этой генетической лотереи, и воля родителей: смириться с риском или прервать беременность.
Однако методы генной инженерии позволяют со 100%-ной вероятностью сказать, будет ли еще неродившийся ребенок больным или здоровым. Разработан метод дородовой диагностики. Допустим, нужно решить, несет ли в себе развивающийся в организме матери зародыш ген гемофилии. Врач берет шприцем пробу околоплодной (амниотической) жидкости, в которой до момента рождения плавает развивающийся эмбрион. В ней всегда имеются отдельные клетки зародыша, как бы "слущенные" с его поверхности. Их можно размножить на питательной среде, выделить из них ДНК и гибридизовать ее с клонированной ДНК генов "больного" и нормального. И вывод будет не вероятностным, а точным. Конечно, такой сложный анализ сейчас большинству клиник недоступен. Не хватает оборудования, реактивов, квалифицированных сотрудников, владеющих методами генной инженерии.
Генная инженерия и рак. Рассмотрим теперь, что дала генная инженерия онкологии, той отрасли медицины, которая занимается лечением больных раком, злокачественными опухолями. Этот страшный недуг, так же как и сердечно-сосудистые заболевания, сейчас вышел на первое место.
И хотя скальпель хирурга, радиоактивное излучение, химиотерапия позволяют существенно продлить жизнь больного, а в некоторых случаях практически вылечить его, окончательная победа над раком еще далека.
Что происходит в организме больного раком? Вопрос этот можно сформулировать иначе: чем клетки злокачественной опухоли отличаются от нормальных, здоровых клеток? Начнем с того, что каждая здоровая клетка может делиться строго определенное количество раз, а потом теряет способность к митозу и погибает. Опухолевые клетки обладают способностью к неограниченному росту. Именно поэтому они растут в ущерб организму больного, в конце концов приводят его к гибели и часто переживают его, разводимые в культуре, на питательной среде. Вторая особенность опухолевого роста - метастазирование: образование множественных вторичных очагов поражения - метастазов. Объясняется это тем, что отдельные клетки, отделясь от опухоли, могут мигрировать по лимфатической и кровеносной системе и размножаться в других местах, вдали от первичной опухоли.
Практически все клетки организма, способные к митозу, способны и к злокачественному перерождению. Многого мы еще не знаем. Почему, например, рак молочной железы дает метастазы чаще в костную ткань? Почему селезенка, источник рака крови - лейкозов, довольно редко метастазируется сама?
Сейчас все исследователи пришли к выводу, что рак - это нарушение регуляции работы генов. К сожалению, это положение выглядит очень общим. Какой же фактор, внутренний или внешний, вызывает это нарушение регуляции? В чем заключается это нарушение?
По одной теории рак может вызываться самыми разными факторами - и внешними, и внутренними. Как проверить такую теорию экспериментом? Дело не в факторе, а в природе самой делящейся клетки. Так и пожар может возникнуть и от небрежно брошенного окурка, и от удара молнии, и самовозгорания.
По другой теории, мутагенной, рак - это соматическая мутация, не передающаяся по наследству, возникающая в соматических клетках организма. Она казалась очень вероятной, так как прием многих мутагенов вызывал у подопытных животных рост опухолей.
Еще одна, канцерогенная, теория утверждала, что разлад регуляции работы генов обусловливается канцерогенами - факторами, способными вызывать рак. Чаще всего ароматическими углеводородами и их производными, содержащимися, например, в каменноугольной смоле, асфальте, выхлопе автомобилей и табачном дыму. Она одна из первых получила подтверждение на практике: еще в старину рак кожи считался профессиональной болезнью лондонских трубочистов (камины тогда топили каменным углем). В дальнейшем оказалось, что канцерогены активно взаимодействуют с ДНК клеток, и канцерогенная теория начала сливаться с мутагенной.
Самую оригинальную, вирусно-генетическую теорию выдвинул Л. А. Зильбер, о котором мы уже писали, чей опыт, выполненный в 20-е годы, лежит в истоках генной инженерии. Согласно Л. А. Зильберу, нуклеиновая кислота вируса, включаясь в геном клетки, изменяет регуляцию генов в ней и делает клетку способной к неограниченному злокачественному росту.
Долгое время никто не верил в существование опухолеродных вирусов, хотя первые сообщения о них появились еще в начале нашего века. Оригинальная гипотеза Л. А. Зильбера была подтверждена в 50-х годах американским вирусологом Р. Дальбекко, который трансформировал опухолевые клетки грызунов, заражая их обезьяньим вирусом SV-40. Многие опухоли и лейкозы оказались связанными с вирусами. Затрудняло исследователей то, что большинство этих вирусов были РНК-содержащими. Что же, РНК включается в геном, состоящий из ДНК?
Только в 1970 г. Г. Темин и Д. Балтимор открыли фермент - обратную транскриптазу (ревертазу), синтезируемый РНК-содержащими вирусами. Такие вирусы назвали ретровирусами. Ревертаза синтезирует ДНК на матрице РНК, которая может включаться в геном. За это открытие в 1975 г. оба этих ученых вместе с Р. Дальбекко были удостоены Нобелевской премии.
Вирус в РНК-вой форме может долго размножаться в клетках, не делая их злокачественными; но переходя в ДНК-содержащую форму, он может интегрироваться в геном - и последствия для организма могут быть печальными. А ДНК-вые вирусы для интеграции в геном не нуждаются в помощи ревертазы. Потенциально канцерогенными считаются многие вирусы; среди них такие распространенные, как аденовирусы. Размножаясь в клетках слизистой носоглотки, аденовирусы вызывают разнообразные болезни, которые медики называют острыми респираторными заболеваниями (ОРЗ). По крайней мере, один из четырех вирусов, вызывающих у человека бородавки, обладает онкогенной, или канцерогенной, активностью.
Все дальнейшие успехи в изучении механизма злокачественного роста неразрывно связаны с генноинженерными методами. Именно благодаря им онкология совершила блестящий прорыв в область неведомого.
Оказалось, что онковирусы содержат последовательности РНК (или соответственно ДНК), кодирующие белок, который трансформирует нормальную клетку в злокачественную. Таких последовательностей известно много. Их назвали онкогенами, а продукты их трансляции - онкобелками. Активные онкогены обнаружены во многих опухолях. Сокращенно их называют ras, myc, Blym, myb, fos и т. д. - всего более 20.
Онкоген вируса активен у саркомных вирусов, только если на концах генома имеются особые длинные повторы. Их назвали LTR (long terminal repeats). Сами они белков не кодируют, но без них онкоген "молчит". Чистыми онкогенами или ДНК, выделенной из опухолевых клеток, можно трансформировать нормальные клетки в злокачественные, и вероятность перерождения резко возрастает при добавке LTR (рис. 41).
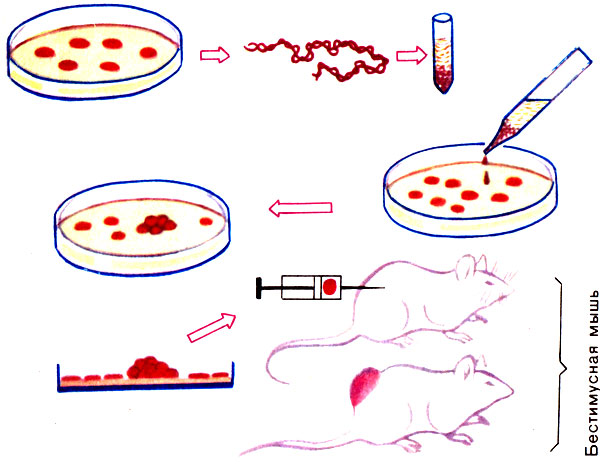
Рис. 41. Схема выделения онкогена. Из разводимых в культуре опухолевых клеток человека выделяют ДНК, которую затем, связанную с кристаллами гидроксиапатита, наносят на слой нормальных мышиных клеток. Если активный онкоген трансформирует клетку, в культуре возникает очаг многослойного роста. Трансформированные клетки прививают бестимусным мышам (чтобы не было отторжения), а затем выделяют онкоген из образовавшейся опухоли
Онкологи-экспериментаторы были изумлены методом молекулярной гибридизации ДНК, обнаружив онкогены в нормальных клетках всех животных - от низших червей до человека. Они получили название протоонкогенов, т. е. первичных генов рака. Название в общем бессмысленное, ведь не для вызывания рака они существуют в геноме. Что же делают протоонкогены в нормальных клетках?
Оказалось, что в норме они активны лишь на определенных стадиях развития. Это было показано на эмбрионах мышей. Например, протоонкоген fos работает до стадии восьмидневного зародыша, затем его сменяет протоонкоген raski, а за ним abl. Это регуляторные гены, которые, когда не нужны, "молчат", а в период активности нарабатывают не более 20-30 молекул мРНК на клетку. Любопытно, что некоторые онкобелки по структуре похожи на факторы роста клеток. Например, онкоген вируса саркомы обезьян кодирует белок, очень похожий на фактор роста, синтезируемый в нормальных тромбоцитах, тех клетках, которые "заделывают бреши" в кровеносных сосудах.
В каких случаях протоонкоген теряет приставку "прото"? Это случается прежде всего, если к протоонкогену присоединяется сильный промотор - вирусный LTR. Мутация самого протоонкогена также делает его сверхактивным, и это уже доказано. Одна мутация в протоонкогене ras приводит к тому, что двенадцатая аминокислота в онкобелке - лейцин - заменяется на валин, что приводит к возникновению карциномы мочевого пузыря. Хромосомные мутации, возникающие вследствие транслокации (обмен участками между негомологичными хромосомами), также приводят к тому же результату. Иногда подобные структурные перестройки внутри самого протоонкогена также его активируют. Наконец, возможна и амплификация - умножение копий онкогена.
Любопытно, что продукты разных протоонкогенов в нормальных клетках выполняют разные функции: онкобелки могут быть и ядерными, и связанными с клеточной мембраной; среди них есть и факторы роста, и ферменты. А результат их активации один: клетка приобретает способность к злокачественному, беспредельному размножению.
Новые данные имеются и о природе клеток, слагающих метастазы. По-видимому, это не простые клетки-мигранты, оторвавшиеся от первичной опухоли и приплывшие с током крови или лимфы в другое место. Иногда они разные. Например, протоонкогены myb и sis в первичных опухолях "молчат", но активируются довольно часто в метастазах.
Какая же теория происхождения рака подтвердилась? Все они оказались верными! Действительно, рак может вызываться разными внутренними факторами - протоонкогенами. Активируются они в результате разных мутаций, в том числе и вызываемых внешними факторами - канцерогенами. И наконец, сверхактивный, "одичавший" онкоген может быть внесен в геном в составе вируса. Такие случаи, когда разные теории мирно сосуществуют, объединенные одной концепцией, в науке редки. Просто раньше ученые затрагивали разные стороны одной большой проблемы и полемизировали, как в восточной притче слепцы спорили, на что похож слон: на колонну, змею, хлопушку от мух или одеяло (один ощупал ногу, другой - хобот, третий - хвост, четвертый - ухо). И все были правы, но ни один до конца.
Остановимся особо на одной из форм злокачественного роста - лейкозах, когда в крови появляются в изобилии недозревшие лейкоциты, не выполняющие своих функций. Теперь описано много форм лейкозов и вирусов, которые могут их вызывать. Наиболее хорошо изучен вирус T-клеточного лейкоза, поражающий T-лимфоциты человека. Он известен под названием HTLV-1 (human T-ceel leucaemia virus). Впервые его обнаружили в Японии, и он сразу заинтересовал исследователей тем, что поражал тимусные лимфоциты той разновидности, которые называют T-хелперы (от английского to help - помогать). Эти лимфоциты вырабатывают особые вещества - переносчики иммунного сигнала к другим разновидностям лимфоцитов. Эти клетки - "главный штаб" иммунной системы; их и выводит из строя вирус, вызывая злокачественное белокровие.
Похожее заболевание вскоре было обнаружено в США. Сходные ретровирусы обнаружены у обезьян Старого Света, очень близок к ним вирус лейкоза крупного рогатого скота, приносящий немалые убытки во многих странах. По-видимому, все эти вирусы - родственники. Их коварство заключается в том, что инкубационный период может длиться очень долго (десятки лет!).
К счастью, сейчас разработаны очень чувствительные иммунологические методы, позволяющие обнаружить одну молекулу вирусного антигена в 1 мл сыворотки крови. Широкое использование их в клинике позволит выявить носителей вируса и приступить к лечению. К сожалению, самая страшная история впереди.
К той же группе ретровирусов относятся вирус анемии лошадей и близкий к нему вирус, вызывающий печально известный СПИД - синдром приобретенного иммунодефицита. Впервые он выявлен в США. В 1985 г. численность обнаруженных больных в этой стране превысила 13 тыс. Теперь случаи заболевания описаны для более чем 40 стран. За четыре года после диагноза 50% больных погибли от самых разных болезней. Ведь вирус СПИД, или, как его называют медики, HTLV-3, вызывает не злокачественное перерождение лимфоцитов-хелперов, а разрушает, убивает их, нанося удар в "сердце" иммунной системы. Вот почему больной беззащитен от любой инфекции и развития любой злокачественной опухоли. Люди со СПИДом болеют болезнями, совершенно не свойственными здоровому человеку, и формами опухолей, присущих ранее лишь очень пожилым людям. В строгом смысле слова СПИД нельзя назвать раком. Но вирусы Т-кле- точного лейкоза и иммунодефицита крайне близки. Посмотрите на схемы строения их геномов (рис. 42). У обоих в начале и конце расположены длинные повторы - LTR. Дальше идут ген gag, кодирующий внутренние белки вирусной частицы, pol - ген ревертазы и env - ген белков оболочки (рис. 42). Различие в том, что у вируса лейкоза за env идет ген X-IV, вызывающий злокачественное перерождение лимфоцита, а у вируса СПИД после pol и env - гены Q, F, ответственные за гибель и разрушение хозяйской клетки.
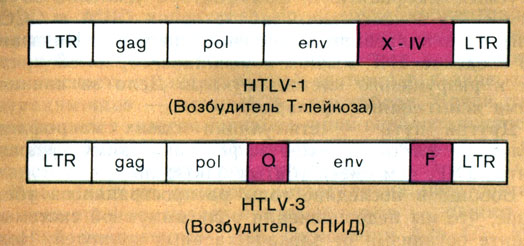
Рис. 42. Схема строения геномов вирусов Т-клеточного лейкоза и иммунодефицита
Передается СПИД беспорядочными половыми связями. Наркоманы заражаются им через шприцы. А так как в США донорство платное и невыявленные носители СПИДа зарабатывают им себе на жизнь, заразиться можно и в клинике при переливании крови или введении сыворотки.
HTLV-3 - странный вирус: ведь в Центральной Африке близкий штамм его поражает и мужчин, и женщин, и детей. Там СПИД ограничен и никогда не приобретал характер эпидемии.
Перейдем к практической стороне изучения злокачественных опухолей.
Врачи давно подметили, что заражение некоторыми болезнетворными бактериями тормозит развитие раковых клеток, вызывая иногда даже ремиссию (рассасывание) опухолей. На этом наблюдении был разработан метод лечения: больному вводили смесь убитых бактерий, например синегнойной палочки. Однако о нем забыли, когда в практику медицины вошли облучение и химиотерапия - методы гораздо более эффективные.
О старом методе вспомнили, когда выяснили, что вещества убитых бактерий не прямо действуют на клетки опухоли, а каким-то образом стимулируют клетки иммунной системы - макрофаги. Эти амебообразные клетки, образующиеся в красном костном мозге, еще И. И. Мечников называл фагоцитами. Они заглатывают в крови и соединительной ткани, альвеолах легких и брюшной полости чужеродные клетки. Кроме того, липополисахариды убитых бактерий стимулируют в макрофагах синтез фактора, вызывающего некроз опухолей. Его и назвали по-английски TNF (tumor necrosis factor).
TNF оказался белком из 157 аминокислотных остатков. Он видоспецифичен: лишь 80% последовательности мышиного TNF гомологично человеческому. В макроцитах он синтезируется в виде белка-предшественника в 233 остатка и, лишь выходя из клетки, обретает активность.
Нашелся и другой белок сходного действия, синтезируемый лимфоцитами. Оба фактора усиленно изучаются сразу в нескольких лабораториях США и СССР. Гены их клонированы в кишечной палочке. Показано, что введение TNF мышам с мышиной саркомой приводит к разрушению клеток опухоли. Дело за клиническими испытаниями препаратов.
Другой путь - стимуляция самих макрофагов. Получены факторы, более эффективно стимулирующие синтез TNF, чем смесь убитых бактерий.
Вообще в последние годы распространилось убеждение, что мы недооценивали роль иммунной системы в защите организма от злокачественных опухолей. Недаром в условиях, когда эта система ослаблена, вероятность заболеть разными формами рака возрастает. К примеру, среди 18 тыс. жителей Хиросимы, оставшихся в живых, но облученных, резко возросла заболеваемость лейкозом. Опухоли чаще наблюдаются у пожилых и у людей с врожденным иммунодефицитом. Наконец, люди с пересаженными почками и сердцами, у которых иммунное отторжение подавляется искусственно, заболевают раком значительно чаще здоровых людей.
К сожалению, как мы видим, иммунный ответ часто дает осечку и не только у пожилых людей. Опухолевые антигены обычно слабые и сильного иммунного ответа не вызывают. Мы уже говорили, что антитела на опухолевые клетки часто облепляют их и потому, меченные изотопом, используются для диагностики. Но убить вышедшую из повиновения организма клетку они не в состоянии. Поэтому в тех случаях, когда бессилен хирург и облучение не дает результатов, а также нет надежды на иммунный ответ, врачи прибегают к химиотерапии. Известны многие десятки веществ, тормозящих рост опухолей. Обычно это реактивы, подавляющие синтез нуклеиновых кислот, реже белков и других веществ, необходимых для роста клеток, в том числе и опухолевых. Современный арсенал средств химиотерапии настолько обширен, что при разумном их употреблении можно подавить рост большинства форм злокачественных опухолей и продлить жизнь больного на 5-10 лет, а то и больше.
Однако и химия не всесильна. Все разработанные ею средства отличаются малой избирательностью. Любой яд, убивающий раковую клетку, опасен и для нормальной. Клетки опухоли просто более уязвимы, потому что растут и делятся быстрее. Но высокие концентрации химиотерапевтических средств применять нельзя: они будут убивать нормальные клетки - и в первую очередь опасность грозит иммунной системе! А низкие концентрации ядов - мощный фактор отбора. Среди размножающихся клеток опухоли врач-онколог попросту проводит отбор на устойчивость к применяемому им лекарству, и, как правило, с успехом.
Много надежд онкологи возлагали на метотрексат. Это вещество подавляет синтез пуринов - одного из основных компонентов ДНК (основания А и G). Метотрексат - специфический отравитель одного из ферментов, участвующих в этом процессе. В результате лечения этим препаратом опухоль прекращает рост, рассасывается. Но победу праздновать рано. Допустимые в клинике дозы метотрексата отбирают в опухоли устойчивые клетки. Лекарство теряет эффективность, а устойчивая опухоль опять начинает расти. Повысить дозу метотрексата нельзя, она и так на пределе допустимого.
Получается, что мы имеем два метода воздействия на опухоль. Один из них - активация клеток иммунной системы интерфероном или другими агентами. Лимфоциты и синтезируемые ими антитела обладают идеальной точностью наведения, специфичностью. Они атакуют только опухолевые антигены. К сожалению, их сил не хватает, чтобы расправиться с раковыми клетками.
Второй - химиотерапевтический. Вещества, применяемые в нем, могут убить раковые клетки, но они не обладают специфичностью. Вот если бы объединить оба метода, чтобы достоинства их слагались, а недостатки взаимно компенсировались! И такие методы успешно разрабатываются. Здесь снова придется вернуться к гибридомам.
Допустим, получено достаточное количество моноклонального антитела на поверхностный антиген раковой клетки. С помощью химической модификации присоединим к молекулам антитела сильный яд и введем больному. Антитела найдут злокачественные клетки, облепят их, а яд поразит цель. Нормальные клетки останутся нетронутыми, зато средство поразит все мельчайшие метастазы, притаившиеся в организме. Такие гибридные молекулы можно сравнить с боевой ракетой точного индивидуального наведения, где роль боеголовки играет токсин.
Перспективен для этой цели сильный белковый яд - токсин клещевины - рицин (той самой клещевины, из которой добывают всем известную касторку). Есть и другие вещества, не менее пригодные. В принципе, используя массированную атаку моноклональным антителом, можно подавить раковые клетки и без помощи токсина. Схема такого лечения одной из форм рака показана на рисунке 43.
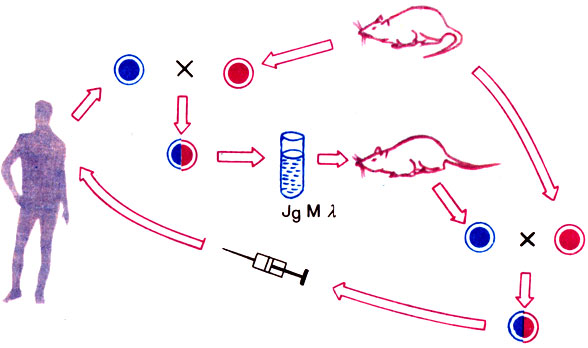
Рис. 43. Схема лечения человека, больного нодулярной лимфомой. При этой форме рака злокачественными становятся лимфоциты, размножающиеся в лимфатических узлах. Они вырабатывают опухолевый, дефектный иммуноглобулин Jg Mλ. Получили гибридомы опухолевых человеческих и мышиных клеток, синтезирующие в больших количествах Jg Mλ, и этим антигеном иммунизировали мышей. Из их селезенок получали уже гибридомы, вырабатывающие моноклональное антитело против Jg Mλ (иммуноглобулин против иммуноглобулина!), который вводили больному. В результате наступило длительное и стойкое улучшение (ремиссия) - практическое выздоровление
Не очень трудно наладить производство гибридом для целей диагностики. Но для лечения тех же болезней моноклональных антител потребуется в тысячи раз больше! Требуется создание мощной отрасли медицинских препаратов, причем она должна не "гнать вал", а практически выполнять индивидуальные заказы - делать антитела на разнообразнейшие белковые антигены. Сложнейшая задача!
Дело в том, что мышиные гибридомы (т. е. гибриды клеток миеломы мыши и лимфоцитов той же мыши или человека) получить легко, а сохранить трудно. Они генетически нестабильны и легко теряют хромосомы, в том числе и с геном нужного антитела. Были бы гораздо устойчивее гибридомы типа человек × человек. Но для этого необходимо найти легко гибридизующиеся и устойчивые в культуре злокачественные клетки человека. Поиски таких клеток человека (и кролика, он тоже удобнее мыши) ведутся, и получены уже первые успехи.
Онкологи и генные инженеры, вероятно, не оставят разгадку эффективного лечения рака в XXI в. Сейчас большинство сил в этой области разрабатывает "золотую жилу" онкогенов. Направление перспективное, но не следует забывать и о других подходах. Сейчас в Гарвардском университете (США) сделано важное открытие. Оказалось, что опухоль активно синтезирует регуляторный белок - ангиогенин, стимулирующий рост мелких кровеносных сосудов - капилляров. В результате опухолевые клетки пользуются интенсивным кровоснабжением, именно поэтому быстро растут!
Когда ген ангиогенина будет клонирован (а этот белок, как и всякий регулятор, эффективен при ничтожных концентрациях - до миллиономиллиардной доли грамма!), его можно будет использовать для лечения болезней, вызванных недостаточным кровоснабжением (последствия инфаркта, инсульта, ишемической болезни сердца, заживление трофических язв, язв желудка и кишечника). Еще перспективнее найти ингибитор, подавляющий синтез ангиогенина или его деятельность. Вводя такой ингибитор в опухоль, можно быстро подавить ее кровоснабжение; тогда она перестанет расти и начнет рассасываться. Сам ангиогенин - белок небольшой (123 аминокислотных остатка), его можно присоединить к моноклональному антителу и послать в нужное место организма (например, к сердцу, пораженному инфарктом). Добавим, что есть и другие оригинальные подходы к лечению злокачественных опухолей. Мы уже писали о разновидности Т-лимфоцитов - клетках-"убийцах" - киллерах. Их можно активировать и размножить в культуре. Сотрудники Национального института рака (США) выделяли киллеры из ткани опухоли, удаленной во время операции, и обрабатывали иммунным гормоном - интерлейкином-2, который, как вы помните, вырабатывается клетками - хелперапи. Затем размноженные в культуре киллеры вводили в организм. Через 15 дней рассасывались опухоли толстого кишечника, метастазы в печени и легких; организм приобретал стойкий иммунитет к клеткам собственной опухоли. Правда, пока все это проделано на мышах.
По другому методу подавлялась способность опухолевых клеток перемещаться в организме, образуя метастазы. В том же институте удалось выделить из клеток меланомы человека белок - фактор миграции, повышающий подвижность клеток. В норме он полезен: под его действием клетки соединительной ткани, "сползаясь", закрывают раны (в том числе и на сердце при инфаркте миокарда). У раковых больных концентрация этого белка в крови резко повышается. Уже разрабатываются методы применения антител к фактору миграции как для ранней диагностики рака, так и для подавления способности опухоли к метастазированию. А нарощенный биотехнологическими методами этот белок обещает стать хорошим средством для быстрого заживления ран и инфарктов миокарда.
Наш обзор далеко не полный. Но мы надеемся, что читатели поймут: генноинженерные методы произвели революцию в медицине. Чтобы мы могли воспользоваться плодами этой революции, нужно активно внедрять их в практику. И не вам ли в будущем предстоит это сделать?
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'