
Глава 1. Ученые создают "химеры"
И то, что носится в туманных очертаниях, закрепляется в прочных мыслях.
Нет химического соединения более важного, чем ДНК". Эти слова принадлежат Джеймсу Уотсону - американскому ученому, получившему в 1962 году вместе с англичанами Френсисом Криком и Морисом Уилкинсом Нобелевскую премию по физиологии и медицине за установление молекулярной структуры ДНК и за определение ее роли в передаче наследственной информации в живой материи.
Действительно, теперь каждый (прилежный, конечно) школьник знает, что ДНК, или дезоксирибонуклеиновая кислота, и является тем веществом, из которого состоят таинственные некогда гены, определяющие все наследуемые в потомстве признаки любого живого организма от наиболее примитивных внеклеточных вирусов, видимых лишь под электронным микроскопом, до "венца природы", как мы привыкли о себе думать, - Человека. Под властью генов находятся два важнейших свойства жизни - наследственность и изменчивость. Наука, изучающая эту область биологии, была названа генетикой (от греческого geneticos - относящийся к происхождению, рождению) выдающимся английским биологом Уильямом Бэтсоном. Это произошло в 1906 году, почти через 40 лет после того, как чешский исследователь-любитель, монах монастыря католиков-августинцев в небольшом австрийском городе Брюнне, известном теперь как Брно в Чехословакии, Грегор Иоганн Мендель открыл основные законы наследственности, сформулировал и экспериментально обосновал результатами своих блестящих опытов по скрещиванию разных сортов гороха идею о существовании наследственных задатков или факторов. Позже, в 1909 году, датчанин Вильгельм Иогансен, много сделавший для изучения закономерностей наследственности, предложил называть менделевские "наследственные задатки" генами (от греческого genos - род, рождение, происхождение) и ввел в научный обиход общепризнанные теперь термины генотип и фенотип. Первый обозначает совокупность всех генов, проявляющихся в признаках организма. Второй - сумму признаков, определяемых всем генотипом, или какой-то один признак, определяемый одним или группой генов.
Наблюдения Менделя, в свое время недооцененные и забытые, позже были полностью подтверждены и оценены по достоинству. В самом начале нашего века сразу трое ученых - Хуго Де Фриз в Голландии, Карл Корренс в Германии и Эрих Чермак в Австрии - на различных объектах практически одновременно "переоткрыли" законы Менделя и восстановили приоритет их автора. Пророческий смысл приобрели слова Менделя: "Если мне и приходилось переживать горькие часы, то прекрасных, хороших часов выпало гораздо больше. Мои научные труды доставили мне много удовольствия, и я убежден, что не пройдет много времени - и весь мир признает результаты этих трудов".
Следующее десятилетие (после вторичного открытия законов Менделя) в истории генетики было периодом подлинного торжества менделизма. В эти и последующие годы менделизм стал теорией, универсальной для всех видов животных, растений, микроорганизмов. Особую убедительность законы Менделя, выведенные на основе чисто количественного подхода к оценке наследования в потомстве контрастирующих признаков родителей (например, формы семян у гороха - гладкой или морщинистой либо окраски зерен в початках кукурузы - темной или светлой), получили при исследовании поведения хромосом - нитевидных структур, образующих клеточное ядро. Изучение хромосом (это слово буквально означает "цветное тело"), обнаруженных в ядрах клеток растений и животных еще в 80-х годах прошлого столетия, навело ученых на мысль о том, как могут наследственные факторы - гены - передаваться от родителей к потомству.
Было установлено, что животные и растения имеют для каждого вида строго определенное, характерное число хромосом. Скажем, у овса их 42, у ячменя - 14, у человека - 46. Каждая хромосома представлена в клетке дважды, то есть хромосомы "живут" парами. Смысл этого "излишества" стал ясен, когда в 1883 году бельгийский биолог Эдуард Ван Бенеден заметил, что в половых клетках число хромосом в два раза меньше, чем в других, называемых соматическими (от латинского слова "сома" - тело). При слиянии отцовской и материнской клеток получается обычный двойной набор хромосом, характерный для данного вида организма. Примерно в эти же годы были открыты процессы митоза и мейоза. Первый из них обеспечивает удвоение числа парных хромосом и их правильное расхождение между делящимися клетками. Второй необходим для образования половых клеток с уменьшенным вдвое числом хромосом. Поэтому мейоз называют еще редукционным (уменьшающим) делением. Эти работы заложили необходимый фундамент под все последующие исследования материальных основ наследственности.

Рис. 4
В начале XX века ученые сумели соединить менделевские законы наследования признаков в потомстве с закономерностями распределения хромосом при делении клеток. Первыми цитологическое (то есть основанное на изучении строения клеток и поведения хромосом) объяснение законам Менделя дали Уолтер Сэттон и Теодор Бовери. В 1902 году У. Сэттон писал: "Я хочу привлечь внимание к вероятности, что соединение в пары отцовских и материнских хромосом и их последующее разделение во время редукционного деления может представить физическую основу закона наследственности Менделя". Так зарождалась хромосомная теория наследственности. Ее подлинным создателем стал профессор экспериментальной экологии Колумбийского университета в Нью-Йорке Томас Хант Морган. Морган и его сотрудники, начиная с 1910 года, примерно за 15 лет получили неопровержимые доказательства того, что гены линейно расположены в хромосомах; установили факты сцепления генов, то есть их совместного наследования в случае локализации в одной хромосоме; открыли принцип независимого расхождения каждой из хромосом пары в дочерние, в том числе и половые клетки.
Удача сопутствовала ученым во многом потому, что они сумели найти для своих опытов живое существо, способное быстро размножаться в ограниченном пространстве и не требующее больших затрат на свое содержание. Этим условиям полностью соответствовала многим хорошо знакомая и широко распространенная плодовая мушка - дрозофила. Ее научное латинское название "дрозофила меланогастер" - "чернобрюшная". У дрозофил всего 4 пары хромосом и много варьирующих признаков. Например, они могут различаться и окраской туловища, и формой крыльев, и цветом глаз. И что не менее важно - за каких-нибудь 12 дней пара мух может принести примерно тысячу "мушинят". Для того чтобы узнать, какие признаки родителей унаследовали потомки, их усыпляют, дав немного подышать эфиром. Теперь ничто не мешает разглядеть под лупой, какого цвета у мушек глаза, спинка, какой формы крылья или брюшко. Когда мушки проснутся, от них можно получать новые поколения и следить за наследованием признаков дальше. Сравнивая число признаков, наследуемых совместно друг с другом, Морган обнаружил, что каждая хромосома содержит группу сцепленных между собой генов. Так было установлено, что гены действительно находятся в хромосомах. Однако этим заслуги Моргана и его школы не ограничиваются. Ученые обнаружили многочисленные отклонения от правила "одна хромосома - одна группа совместно наследующихся признаков". Часто признаки, о которых было известно, что они определяются генами, принадлежащими к одной группе, оказывались в следующих поколениях в новой, необычной для себя "компании" других признаков. Для объяснения этого "непорядка" Морган сделал совершенно новаторский по тому времени вывод: хромосомы одной пары способны обмениваться между собой частями. Наблюдения за поведением хромосом дрозофил под микроскопом подтвердили: на определенной стадии мейоза две хромосомы сближаются, перекрещиваются и обмениваются фрагментами. Именно перекресту хромосом, или кроссинговеру, приводящему к нарушению сцепленности генов, и дрозофилы, и мы с вами обязаны тем, что представляем собой не простой набор признаков, определяемых хромосомами, доставшимися от папы или мамы, а их сложную смесь.

Рис. 5
Морган и его сотрудники представляли себе хромосомы в виде ожерелий, на которых упорядочение расположены бусинки - гены. Эта вроде бы и примитивная, особенно с высоты наших сегодняшних знаний, схема оказалась очень продуктивной. Ведь дело можно представить себе так: чем дальше друг от друга расположены гены, тем вероятнее обрывы нити хромосомы между ними и, следовательно, получение новых сочетаний. Относительное расстояние между генами в хромосоме стали определять путем простого подсчета частоты "кроссоверных мух". Так называют мушиное потомство с признаками, появление которых можно объяснить только обменом соответствующими участками между хромосомами одной пары. Эти расчеты легли в основу построения первых генетических карт-схем взаимного расположения на хромосоме отдельных генов.
Уже к началу 20-х годов Морганом и его учениками были открыты и картированы (локализованы на хромосомах) сотни генов дрозофилы. Ныне у этой мушки известно около 7000 генов, распределенных по четырем хромосомам. Принципы, открытые Морганом, легли в основу составления генетических карт у всех животных организмов. И еще одно важное обстоятельство: кроссинговер - это придуманный самой природой механизм получения рекомбинантных (то есть соединенных в новой комбинации) генетических структур. Ниже мы узнаем, как уже в наше время, всего каких-нибудь 15 лет назад, ученые научились блестяще подражать природе, создавая рекомбинантные молекулы, и даже пошли дальше, сумев связать в одной молекуле гены из совершенно различных, очень далеких друг от друга видов живых организмов. Эти работы и легли в основу генной инженерии. Пока же лишь отметим, что, несмотря на заслуги Моргана, по-прежнему оставалось неясным, что же представляют собой гены и какова их материальная сущность.
Между тем вещество, из которого построены гены, - дезоксирибонуклеиновая кислота, было открыто в те же годы, когда Грегор Мендель тщетно пытался добиться признания значения своих выводов среди профессиональных ученых. В конце 1868 года, всего через три года после публикации данных Менделя, швейцарский врач и химик Фридрих Мишер выделил из ядер клеток лейкоцитов, накапливающихся в гное больных, вещество, которое он назвал нуклеином (от латинского слова "нуклеус" - ядро). Это и было то самое соединение, известное сегодня как дезоксирибонуклеиновая кислота, или ДНК. Примечательное в истории науки совпадение: открытия Мишера так же, как и открытия Менделя, оставались в забвении почти 40 лет, до начала XX века.
Рис. 6
К 20-м годам нашего века вроде бы многое стало известным: и то, что наследственность определяется генами, и то, что гены находятся в хромосомах, и даже то, что ДНК является компонентом ядра и тоже локализована в хромосомах. Тем не менее, чтобы доказать, что именно ДНК - то самое вещество, из которого состоят гены, понадобилась еще почти четверть века. Причина здесь в том, что ДНК долгое время считали слишком монотонной по всей структуре молекулой, неспособной претендовать на роль главного носителя наследственной информации, кодирующей разнообразные признаки организма.
Имеющиеся в то время факты показывали, что такой взгляд на ДНК не лишен оснований. Было известно, что ДНК построена из множества соединенных между собой "кирпичиков" - нуклеотидов. Каждый из них состоит из одной молекулы, называемой азотистым основанием. Таких оснований в ДНК четыре. Два из них - аденин (А) и гуанин (Г), образованные двумя сомкнутыми кольцами, состоящими из атомов углерода и азота, - называют пиримидинами. Два других - тимин (Т) и цитозин (Ц), состоящие лишь из одного кольца, - пуринами. Кроме основания, каждый нуклеотид содержит остаток фосфорной кислоты (вот откуда у нуклеина кислые свойства) и пятиуглеродный сахар, называемый дезоксирибозой (отсюда и название "дезоксирибонуклеиновая кислота"). Примерно такой же состав имеет и другая нуклеиновая кислота, обнаруженная в клетках еще в конце прошлого века. В отличие от ДНК она сосредоточена преимущественно не в ядре, а в цитоплазме. У нее есть и другие отличия от ДНК: вместо тимина в ней находится близкое к нему по структуре основание урацил (У), а вместо дезоксирибозы - другой пятичленный сахар - рибоза, давший название всей молекуле, - рибонуклеиновая кислота, или РНК. Нуклеотиды объединены между собой химическими связями между фосфатной группой одного и сахаром другого. Основания присоединены к молекулам сахара. При связывании большого числа нуклеотидов между собой образуются длинные цепочки - полинуклеотиды.
Вплоть до 40-х годов считалось, что четыре "кирпичика" нуклеотидов монотонно повторяются в структуре ДНК либо РНК множество раз, образуя полинуклеотиды. Ясно, что записать богатый по смыслу текст (бесконечное разнообразие признаков организма) с помощью строго повторяющихся четверок букв невозможно. Вот почему большинство ученых в то время придерживались мнения, что более подходящими претендентами на роль вещества наследственности являются белки. Хоть и мало их содержание в хромосомах по сравнению с ДНК, зато структура поразнообразнее - все же они состоят из 20 "букв" - аминокислот, а не из четырех.
Следует заметить, что, даже заблуждаясь насчет материальной природы гена, некоторые ученые довольно точно предсказывали, как они должны осуществлять свои функции. Таким подлинным провидцем был крупнейший русский биолог Николай Константинович Кольцов. Задолго до раскрытия подлинной структуры генов он утверждал, что общим свойством наследственных молекул должна быть способность к точной репродукции, то есть созданию своих копий. Идея Н. К. Кольцова о способности генов к самокопированию оказалась совершенно правильной и через несколько десятилетий полностью подтвердилась при изучении структуры и функций нуклеиновых кислот, прежде всего ДНК.

Рис. 7
Заслуга открытия роли ДНК как материальной основы наследственности, вещества, из которого и состоят гены, принадлежит профессору Освальду Эйвери и его коллегам К. Мак-Леоду и М. Маккарти, работавшим в Рокфеллеровском институте в Нью-Йорке. В 1944 году эти ученые первыми показали, что ДНК отвечает за наследуемые признаки. Это было сделано на бактериях - микроорганизмах, лишенных в отличие от растений и животных настоящего, отделенного мембраной от цитоплазмы ядра. Аналог ядра у бактерий - нуклеоид - представляет собой длинную скрученную хромосому, плавающую в цитоплазме. Эйвери с сотрудниками решили разобраться в сути одного остававшегося почти 15 лет загадочным по своему смыслу наблюдения, сделанного английским микробиологом Фредериком Гриффитом, работавшим с бактериями, - возбудителями пневмонии у животных и человека. Неожиданно для себя Гриффит обнаружил, что если вирулентные пневмококки убить кипячением и смешать с живыми неболезнетворными, то эти последние по непонятной причине приобретают вирулентность. Зараженные смесью убитых и живых бактерий мыши погибали от пневмонии. Эйвери и его сотрудники повторили опыты Гриффита, только они смешивали живых невирулентных пневмококков не с целыми убитыми клетками вирулентных бактерий, а с выделенной из них ДНК. Результат оказался тем же, что и у Гриффита, - мыши гибли от пневмонии. И вот что важно: чем лучше очищали препарат ДНК от примесей белка, тем более активно он превращал безвредные бактерии в болезнетворные. Это сопровождалось явным изменением одного из признаков бактерий, смешанных с препаратом ДНК: они приобретали толстую внешнюю оболочку - капсулу, предохраняющую их от уничтожения при попадании в организм животного. Это означало, что именно в ДНК вирулентных бактерий содержатся гены, ответственные за их важнейший признак - наличие капсулы, и что перенос этой ДНК в невирулентные бактерии передает им новый признак - способность образовывать капсулу. Так впервые была выявлена взаимосвязь между молекулой ДНК и признаками организма. Прошло еще немного времени - и роль ДНК как главного носителя наследственной информации была доказана окончательно. В 1948 году, том самом, когда в Москве "мичуринцы" во главе с Т. Лысенко обрушивались на "формальных генетиков", "вейсманистов-морганистов", обвиняя их во всех смертных грехах, походя отметая и законы Менделя, и сами гены на том основании, что их "никто не видел", американский биохимик Эдвин Чаргафф заложил "бомбу" под фундамент представления о "монотонности" ДНК. Он количественно проанализировал нуклеотидный состав ДНК и показал, что общее количество пуринов (аденина и гуанина) в молекуле ДНК равно количеству пиримидинов (тимина и цитозина), содержание А равно содержанию Т, а Г=Ц. Это означало, что отношение А к Т и Г к Ц равняется 1, а сумма Г+Т=А+Ц. Смысл этих соотношений оставался непонятен. Ясно было одно: существует устойчивая зависимость содержания А и Т с одной стороны и Г и Ц - с другой. И еще одно важное обстоятельство открыли работы Чаргаффа и советских ученых А. Н. Белозерского и А. С. Спирина - отношение А+Т к Г+Ц может заметно различаться у различных видов организмов. Например, у некоторых вирусов и бактерий оно равно 0,36 - 0,39, у пекарских дрожжей (сахаромицетов) - 1,8, у кукурузы - 1,04, у табака - 1,5, у человека - в среднем 1,1 и т. д. Значит, это какой-то очень существенный показатель, отражающий неодинаковость нуклеотидного состава ДНК у различных организмов.

Рис. 8
Понять подлинное строение ДНК и объяснить "правила Чаргаффа" сумели Дж. Уотсон и Ф. Крик. Уотсону к началу работы, принесшей ему впоследствии Нобелевскую премию и всемирную славу, было всего 23 года, его коллеге Крику - 35 лет. Открытие ими "двойной спирали" - структуры ДНК - относится к наиболее волнующим событиям в истории естествознания XX века. Общение со специалистами из различных областей науки - химиками и кристаллографами, в особенности М. Уилкинсом и Розалиндой Франклин, изучавшими рентгенограммы кристаллов ДНК, исключительно высокий уровень исследований и благоприятный "дух науки", царившие в знаменитой Кавендишской лаборатории в Кембриджском университете в Лондоне, наблюдательность и молодой задор Уотсона, помноженные на опыт и глубокий аналитический ум Крика, дали замечательный результат. Немногим более года понадобилось этим ученым, чтобы понять, что ДНК состоит из двух полинуклеотидных цепей, причем пурины и пиримидины, нерегулярно распределяющиеся в одной цепи, соединены водородными связями и пиримидинами и пуринами в другой. Эта связь между основаниями в противоположных цепях поддерживает спиральную конфигурацию молекул ДНК. Цепи ДНК закручиваются вокруг общей оси в двойную спираль, витки которой, если смотреть вдоль оси спирали, идут слева направо, то есть по часовой стрелке. Спаренные основания, уложенные плоскостями друг на друга, располагаются между двумя цепями перпендикулярно их оси. Вся структура ДНК напоминает винтовую лестницу: перила образованы регулярно повторяющимися сахарфосфатными группами отдельных нуклеотидов, соединенными между собой, а ступеньками служат спаренные основания. Важнейший элемент строения ДНК - принцип комплементарности, или взаимодополнения, благодаря которому основания соединяются строго специфично: А всегда связывается с Т, а Ц - с Г. В результате каждая пара оснований состоит из одного пурина и одного пиримидина. Таким образом открылся смысл "магических единиц" Чаргаффа: количества пуриновых и пиримидиновых оснований равны между собой.
Модель "двойной спирали" быстро получила признание еще и потому, что она объясняла, как может происходить процесс самокопирования, или репликации, ДНК. По мысли Уотсона и Крика, подтвержденной позднее тщательными биохимическими исследованиями, для того чтобы ДНК воспроизвела себе подобную структуру, ее цепи должны быть способны к раскручиванию и последующему частичному разделению вследствие разрыва водородных связей в каждой комплементарной паре оснований. Образовавшиеся одноцепочечные участки родительской молекулы служат шаблоном (матрицей), к которому на основе комплементарности оснований присоединяются новые нуклеотиды. Они скрепляются между собой вдоль оси сахарофосфатными мостиками. В результате около старой, родительской, цепи образуется новая, дочерняя. Поскольку процесс самокопирования происходит на каждой из разделившихся цепей исходной молекулы, в результате образуются две двухцепочечные структуры, идентичные родительской ДНК, в каждой из которых одна цепь старая, а другая - новая. Открытие, действительно, замечательное: впервые была найдена структура, способная к самовоспроизведению, а значит, к наследованию в потомстве. Этой структурой оказалась ДНК - главное вещество хромосом всех живых организмов. В дальнейшем были обнаружены белки, обеспечивающие процесс репликации ДНК, и установлено, на какой стадии клеточного цикла она осуществляется и как самокопирующиеся молекулы ДНК распределяются в дочерние клетки при их делении.
Как же осуществляется способность ДНК кодировать признаки организма? Еще много раньше открытия генетической роли ДНК ученым стало ясно, что любой признак организма, будь то окраска цветка, форма зерна или длина стебля, - результат работы белков-ферментов, а информация об их синтезе записана в генах. Как же могут 4 нуклеотида - 4 "буквы" ДНК, даже если, как оказалось, они расположены вдоль ее молекулы вовсе не монотонно, а в определенном порядке, кодировать структуру белков, построенных из полипептидов, представляющих собой чередование 20 аминокислот?
Для того чтобы понять, как это происходит, вспомним, что генетика - это наука не только о наследственности, но и об изменчивости живых организмов. Основная причина изменчивости - способность генетического материала претерпевать изменения, наследуемые в потомстве. Главными из них являются мутации.
Сам этот термин, обозначающий по латыни "изменение", "перемена", был предложен в 1901 году голландским ботаником X. Де Фризом - одним из трех "переоткрывателей" законов Менделя. Де Фриз, проводивший многолетние скрещивания и наблюдения над растением энотерой (ослинником), открыл, что даже совершенно однородные линии дают в потомстве, хотя и очень редко, примерно в двух-трех случаях на десятки тысяч, растения с небольшими, однако стойко наследующимися изменениями признаков - мутациями. Возникают они как бы внезапно, иногда без видимых причин, много чаще как результат внешних воздействий на организм. Большой вклад в изучение природы и причин возникновения мутаций внесли работы Моргана на дрозофиле. Они показали, что причиной мутации служат какие-то химические изменения в генетическом веществе хромосом. Ученик Моргана, Герман Меллер, работавший, кстати, несколько лет в Советском Союзе по личному приглашению Н. И. Вавилова, решил добиться увеличения частоты образования мутаций, подвергая дрозофил различным воздействиям. Самым эффективным мутагеном оказалось рентгеновское облучение. С помощью радиации Меллер сумел 1000-кратно повысить частоту мутаций у мух по сравнению с той, что наблюдалась спонтанно, то есть в естественных условиях. Нужно заметить, что первая успешная попытка изменить наследственность под действием радиации была предпринята в Ленинграде академиком Г. А. Надсоном и его сотрудником Г. С. Филипповым в 1925 году, незадолго до работы Меллера. Метод получения искусственных мутаций немедленно подхватили селекционеры. Уже в 1928 году Л. Стадлер сумел успешно использовать рентгеновское излучение для получения мутаций кукурузы и ячменя. Эксперименты на дрозофиле и растениях положили начало радиобиологии. В 30-е годы Н. В. Тимофеев-Ресовский, Карл Циммер и Макс Дельбрюк открыли законы радиационного мутагенеза, создали теорию мишени излучения, сыгравшую значительную роль в развитии радиационной генетики. В эти же годы советскими учеными В. В. Сахаровым, М. Е. Лобашевым и другими было открыто мутагенное действие некоторых химических соединений. Позднее, сразу после войны, И. А. Рапопорт обнаружил сверхмощные химические мутагены - нитрозосоединения.
С помощью вызывающих мутации физических и химических воздействий удалось установить два краеугольных постулата современной генетики и молекулярной биологии. Первый из них (в немного приближенной форме) звучит так: "один ген - один фермент". Второй - "генетический код триплетен", то есть аминокислоты в белках кодируются группами из трех нуклеотидов, локализующихся в цепи ДНК.
Открывателями первого постулата были Джордж Бидл и Эдуард Татум, изучавшие в конце 30-х годов в Стэнфордском университете в США биохимические мутации у плесневого гриба - нейроспоры. Этот гриб оказался очень подходящим объектом для исследования генов, контролирующих синтез нужных клетке веществ - аминокислот, азотистых оснований, витаминов. Все эти соединения нейроспора может производить сама. Поэтому она не очень разборчива в питании и может расти на бедных средах, содержащих только самое необходимое - неорганические соли и какой-нибудь сахар, чтобы было откуда взять углерод. Под действием радиации Бидл и Татум получили у нейроспоры множество мутантов, ставших намного более требовательными к пище. Каждый из выделенных мутантов нуждался в каком-то одном, необходимом ему веществе, например в какой-то определенной аминокислоте, витамине, либо азотистом основании. Скрещивая такие мутанты между собой, Бидл и Татум убедились, что в каждом отобранном случае мутация затронула лишь один ген. Это могло означать только одно - гены кодируют биохимические функции организма, то есть отвечают за синтез ферментов. Возникла формула: "один ген - один фермент". Так с помощью мутации выяснилось, что гены непосредственно отвечают за синтез ферментов, участвующих в выработке необходимых для жизнедеятельности клетки веществ.
Позднее, когда стало известно, что многие белки-ферменты построены из нескольких цепочек аминокислот - полипептидов, формула была немного изменена: "один ген - одна полипептидная цепь". Теперь появилась возможность ответить на вопрос - как закодированы в ДНК эти белки? На этот раз помогли мутации у одного из вирусов бактерий - бактериофага Т4, "пожирающего" клетки еще одного излюбленного объекта генетиков - кишечной палочки, названной по имени ее открывателя Теодора Эшериха - Escherichia coli (эшерихиа коли).
Обдумывая вопрос, каким образом четыре азотистых основания в ДНК определяют состав полипептидных цепей, состоящих из 20 аминокислот, Уотсон и Крик высказали замечательную догадку. Они предположили, что на пути между геном (ДНК) и его продуктом (белком) находится посредник. Им служит РНК. Генетическая информация переписывается с гена на РНК, а с РНК передается на белок. Первая часть этого пути называется транскрипцией, вторая - трансляцией. Оба эти процесса обеспечивают проявление гена - его экспрессию. Гипотеза Уотсона и Крика полностью подтвердилась. РНК-посредник, действительно, была обнаружена. Она получила название информационной (потому что на нее переписана генетическая информация), или матричной (потому что строится по ДНК, как по матрице, на основе принципа комплементарности). У дрожжей, грибов, растений и животных, то есть у всех живых организмов, имеющих истинное, отделенное мембраной от цитоплазмы ядро (такие организмы называют эукариотами, от греческого "эу" - истинный, "карион" - ядро), матричная РНК (мРНК) синтезируется в ядре, а затем переходит в цитоплазму. Здесь на специальных "фабриках белка" - рибосомах по матрице мРНК происходит сборка аминокислот в полипептидную цепь. Такой механизм означает, что генетический код, записанный в ДНК, должен переписаться на мРНК. Текст, зашифрованный в мРНК с помощью 4 "букв" - оснований (А, Г, Ц, У), должен быть прочитан осмысленно, так, чтобы вместо фермента, осуществляющего какую-то определенную, нужную клетке работу, не получилась абракадабра из аминокислот, как попало соседствующих друг с другом в молекуле белка.
Рис. 9
Какие же комбинации 4 нуклеотидов будут соответствовать 20 аминокислотам белка? Вначале этот вопрос решался чисто количественно. В 1961 году Ф. Крик, на этот раз не с Уотсоном, а с Сидни Бреннером и другими на основании результатов тщательного генетического исследования множества мутантов у вируса кишечной палочки - бактериофага Т4 - пришли к выводу о том, что каждая аминокислота кодируется тройкой нуклеотидов. В ДНК такую тройку называют триплетом. Будучи переписанной на мРНК, она получает новое имя - кодон. Именно он определяет, какая из аминокислот будет встраиваться в синтезирующуюся молекулу белка. Решив количественную сторону вопроса доказательством формулы "тройка нуклеотидов - одна аминокислота", необходимо было решить и его качественную сторону. В 1961 году собравшиеся со всего мира в Москву на биохимический конгресс ученые услышали доклад мало кому известных молодых американцев Маршалла Ниренберга и Генриха Маттеи. Они искусственно синтезировали РНК, состоящие только из одного многократно повторенного уридинового нуклеотида. Когда такую РНК добавляли к экстрактам клеток кишечной палочки, содержащим рибосомы, но лишенным собственных мРНК, то в системе начинал синтезироваться полипептид, состоящий только из одной аминокислоты - фенилаланина. Это означало, что у природы удалось получить первый ответ на вопрос о том, что означают определенные сочетания нуклеотидов в кодонах в переводе на язык аминокислот. Ясно, что сочетание УУУ означало фенилаланин. А ведь тройки из 4 нуклеотидов могут дать 43=64 сочетания, то есть существенно больше, чем нужно для 20 аминокислот. Работа закипела. Теперь расшифровка кода стала делом техники и упорства. Последнего ученым было не занимать. В работу включились биохимики Севере Очоа и Гобинд Корана. Заслугой Кораны стало создание методов синтеза различных молекул ДНК и РНК с определенными последовательностями троек нуклеотидов. С их помощью к 1966 году удалось раскрыть тайну всех 64 комбинаций. Как и ожидалось, генетический код оказался избыточным: многие аминокислоты кодируются не одним, а несколькими кодами. Три кодона УАА, УАГ и УГА не соответствовали никакой аминокислоте и получили название "нонсенс" (бессмысленные), что, впрочем, несправедливо, ведь эти кодоны играют очень важную роль - они стоят в конце мРНК и посылают "стоп-сигнал" рибосомам, оповещая о месте, где синтез полипептидной цепи должен закончиться. Два кодона АУГ и ГУГ работают "по совместительству". Они одновременно контролируют включение в белковую цепь определенных аминокислот, соответственно метионина и валина, и служат "старт-сигналами", обозначая, от какого знака (нуклеотида) нужно отсчитывать тройки, чтобы записанный в мРНК текст прочитывался правильно.
Важнейшее свойство генетического кода - его универсальность. Один и тот же шифр используется для записи аминокислотного состава ферментов, ответственных за различные признаки очень далеких организмов - от эукариот до лишенных истинного ядра бактерий и синезеленых водорослей, объединенных общим термином "прокариоты", и вовсе бесклеточных вирусов и бактериофагов. Правда, благодаря избыточности кода разные виды организмов имеют свои излюбленные тройки букв, которыми зашифровывают ту или иную аминокислоту. Можно сказать, что ДНК пользуется различными "диалектами". Небольшие обнаруженные сравнительно недавно отклонения от принципа универсальности кода дела не меняют. Именно благодаря ему информация, зашифрованная в гене одного организма, может быть правильно прочитана в другом, даже далеком виде, получившим этот ген по воле человека. На этом основана вся практика генной инженерии.
Молекулярные биологи имеют теперь возможность секвенировать индивидуальные гены, то есть определять порядок расположения в них отдельных нуклеотидов и сравнивать его с порядком расположения аминокислот в белке - продукте данного гена. Такие сравнения, проводимые обычно с помощью компьютеров, не только дали многочисленные подтверждения правильности расшифрованного ранее кода, но и помогли освоить его "диалекты", характерные для того или иного организма. Это оказалось очень полезным в работах по искусственному синтезу генов, начало которым было положено почти 20 лет назад Г. Корана с сотрудниками. Первый из созданных путем химического синтеза ген состоял всего из 77 пар нуклеотидов и нормально работать в клетке не мог. Теперь имеется возможность синтезировать куда более длинные последовательности. Например, японским ученым удалось синтезировать ген гормона роста человека, состоящий из почти 600 пар нуклеотидов. Перенесенной в клетки бактерий, он неплохо себя чувствует в "новом доме" и направляет синтез нескольких миллионов молекул, не отличимых от человеческого гормона.
В чем же здесь дело? Чего не хватало первому гену и что позволяло второму гену нормально функционировать (экспрессироваться) в бактериальном хозяине? Чтобы ответить на этот вопрос, нужно знать, как устроены гены и что регулирует их работу. Оказалось, что в любом гене имеются структурная часть и регуляторные элементы. Структурная часть образована кодирующей последовательностью нуклеотидов. Именно с них списывается РНК, по которой на рибосомах строится белок. Важнейший из регуляторных элементов - промотор. Слово это в переводе с английского означает активатор. И вправду, без промотора ген "молчит". Этот состоящий из нескольких десятков пар нуклеотидов участок распознается ферментом РНК-полимеразой, обеспечивающей синтез мРНК по матрице гена. Промоторы прокариот и эукариот различаются между собой по некоторым особенностям строения. Их учитывают, когда хотят, чтобы гены, например, бактерий могли работать в растениях или в млекопитающих. Нам еще предстоит разобраться в этом чуть подробнее в других главах книги, а здесь только заметим, что "маленький" ген не был активен, потому что не содержал регуляторной части. Ген же гормона роста смогли присоединить к промотору одного из собственных генов E. coli, что дало возможность "чужому" гену проявить себя в новом хозяине.
Да, многое из того, что было установлено молекулярными биологами и молекулярными генетиками в 50 - 60-х годах, стало основой будущей генной инженерии. Она открыла новую страницу в изучении генов различных организмов и такие возможности для улучшения их наследственных признаков, которые еще совсем недавно могли предполагать лишь писатели-фантасты. Воображение ученых оказалось не беднее. Они решили на деле доказать, что им по силам создание сочетаний генов, невозможных в природе. Путь к их созданию лежал через конструирование гибридных, или, как их еще называют, рекомбинантных ДНК.
Формальной датой рождения генной инженерии считают 1972 год. В этот год группа исследователей во главе с Полом Бергом, работавших в Стэндфордеком университете в США, сообщила о создании in vitro первой рекомбинантной молекулы ДНК. Она состояла из фрагмента ДНК бактериофага лямбда кишечной палочки, группы генов самой этой бактерии, ответственных за сбраживание сахара галактозы, и полной ДНК вируса SV 40, вызывающего развитие опухолей у обезьян. Как же удалось создать такой удивительный гибрид? Это было бы невозможно без одного открытия в области генетики микроорганизмов, сделанного задолго до работы П. Берга. Стоит немного рассказать об этом открытии, чтобы убедиться еще раз, как важны фундаментальные исследования в науке для будущих судеб человечества, для его практической деятельности.
Еще в начале 50-х годов ряд авторов, в том числе известный американский вирусолог Сальвадор Лурия, один из основателей современной молекулярной генетики, обнаружили интересное явление: вирусы бактерий - бактериофаги (это слово буквально значит "пожиратели бактерий"), выращенные на одном штамме кишечной палочки (E. coli), значительно хуже росли на других штаммах той же бактерии. Стоит напомнить, что понятие штамм, относящееся не только к бактериям, но также и к вирусам, и к любым клеточным культурам, означает группу клеток или вирусных частиц, имеющих общее происхождение и характеризующихся одинаковыми устойчивыми признаками. Штамм грубо можно сравнить с семьей, все члены которой имеют одного общего предка. Правда, в отличие от человеческой семьи члены штамма замуж не выходят, не женятся, а детей плодят только делением, поэтому и потомки клеток, образующие штамм, похожи на своих родителей, как две капли воды. Так вот, если немногие фаговые частички, выросшие все же на другом штамме бактерий, продолжать и дальше на нем выращивать, то все фаговое потомство окажется способно "пожирать" своего нового хозяина, зато прежний хозяин большинству частиц этого потомства окажется уже "не по зубам". Такой круг можно повторять многократно, и каждый раз более "съедобным" оказывается тот штамм-хозяин, на котором фаги размножались последними. Разобраться, почему так капризны фаги, сумел швейцарский ученый Вернер Арбер. Оказалось, что при вхождении в бактерию фаг становится жертвой атаки клеточных ферментов, разрезающих его ДНК, и способность фага размножаться в клетках таких бактерий резко ограничивается. В этом суть явления, получившего название рестрикции, то есть ограничения (английский термин). Но рестрикция - лишь часть описываемых событий. Ведь не все же фаги становятся жертвами ферментов рестриктаз, разрушающих ДНК. Некоторые все же приспосабливаются, выживают и дают потомство. Почему? Арбер сумел ответить и на этот вопрос. Он установил, что в бактериях имеется другой фермент, химически изменяющий определенные участки ДНК. Такая измененная, или модифицированная, ДНК становится устойчивой к действию фермента рестрикции и не разрушается. Ферменты рестрикции-модификации могут немного отличаться в различных штаммах. Поэтому "бедный" фаг должен все время приспосабливаться. Фермент модификации ведет себя как предатель: даже немногие фаговые частицы, выжившие с его помощью, могут дать потомство и погубить клетку. Однако без такого фермента клетка обойтись не может. Способность к модификации нужна ей самой для защиты своей ДНК от разрушающего действия собственных рестриктаз.
Вообще способность клетки распознавать "свое" и "чужое" и, защищая "свое", от этого "чужого" избавляться очень важна, поскольку служит одним из барьеров, созданных природой для сохранения генетического постоянства, или, как иногда говорят, генетического гомеостаза видов живых организмов. Да, исследования Арбера вскрыли интереснейший феномен общебиологического значения, но мало кто мог предполагать, что в недалеком будущем они будут иметь огромное практическое значение.
Вслед за Арбером явлением рестрикции-модификации ДНК заинтересовались многие ученые. Не только в кишечной палочке, но и в других бактериях стали обнаруживать ферменты, разрезающие на куски ДНК фагов и тем самым защищающие клетку от разрушения. В 1980 году американец Гамильтон Смит из университета имени Джона Гопкинса в Балтиморе обнаружил рестриктазу в одном из видов бактерий, называемых гемофильными. Эта рестриктаза разрезала ДНК в строго определенных местах - точно там, где фермент прикреплялся. Уже в следующие несколько лет и в нашей стране, и за рубежом было выделено несколько сотен подобных рестриктаз из различных бактерий. Обычно эти ферменты распознают в ДНК очень короткие, но строго специфичные для каждой рестриктазы участки длиной в 4 - 6 пар нуклеотидов и разрезают обе цепи ДНК посредине этих участков или с некоторым смещением. В первом случае образуются обрывы с ровными (их называют "тупыми") концами, во втором - стороны оборванных цепочек ДНК чуть-чуть заходят одна за другую. Такие одноцепочечные концы называют "липкими", потому что они могут как бы слипаться между собой в силу комплементарности. Рестриктазам безразлично, чью ДНК резать - бактерий ли, вирусов, растений или человека, лишь бы в ней были распознаваемые участки. Это значит, что две совершенно не схожих между собой последовательности ДНК, предположим, из клеток слона и лягушки, образуют одинаковые "липкие" концы, если эти ДНК обработать одной и той же рестриктазой.
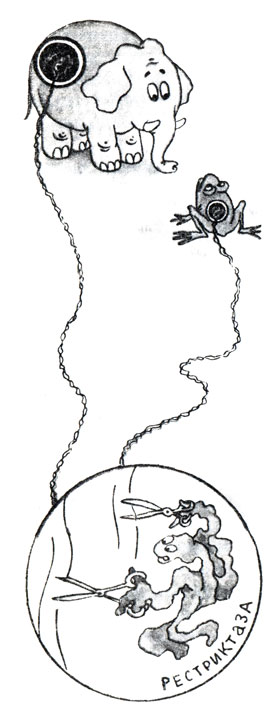
Рис. 10
В настоящее время известно более 500 рестриктаз, способных "рубить" ДНК примерно в 120 различных последовательностях из нескольких пар нуклеотидов. Это разнообразие дало ученым возможность получать фрагменты ДНК, содержащие желаемые гены. Метод выделения таких фрагментов был разработан Даниэлем Натансом, работавшим в том же университете, что и Г. Смит. Натане работал с уже знакомым нам вирусом обезьян SV 40 и исследовал фрагменты, образующиеся при расщеплении его ДНК различными рестриктазами. Участки, разрезаемые рестриктазами, различаются по размерам и распределяются в любой ДНК случайным образом, на неодинаковом расстоянии друг от друга. Оказалось, что фрагменты несложно разделить с помощью электрофореза. ДНК, обработанную какой-либо одной или сразу несколькими рестриктазами, помещают в специальную камеру в лунку, проделанную в застывшем геле агарозы. Это вещество получают из морских водорослей, а его охлажденный раствор имеет характерную консистенцию мармелада. В камере создается электрическое поле, под действием которого фрагменты ДНК начинают перемещаться в пористом геле. Скорость продвижения фрагментов зависит от их длины. Короткие фрагменты движутся быстрее, чем длинные. Это позволяет фрагментам разной величины отделиться друг от друга. Важно, что при этом фрагменты не повреждаются, их можно выделить из геля без утраты ими биологических свойств.
Если окрасить гель особым красителем, связывающимся с ДНК, и посмотреть на него в ультрафиолетовом свете, можно увидеть окрашенные в красный цвет святящиеся полоски, расположенные вдоль геля на различном расстоянии друг от друга. Каждая такая полоска соответствует одному фрагменту. Естественно, что разные рестриктазы дают разную картину расщепления одной и той же ДНК. Сравнивая между собой размеры фрагментов, наблюдая за исчезновением одних и появлением других под действием разных рестриктаз, Д. Натане составил полную физическую карту расположения участков для 14 рестриктаз в ДНК вируса SV 40. Электрофорез в агарозном геле стал стандартным методом разделения рестрикциозных фрагментов ДНК. Он позволяет выделить эти фрагменты в чистом виде, чтобы изучить находящиеся в них гены. За открытие ферментов рестрикции и работы по использованию этих ферментов в молекулярной генетике исследования Г. Смита, Д. Натанса и В. Арбера были отмечены Нобелевской премией.
Теперь, когда мы подробнее узнали о фундаментальных открытиях, которым генная инженерия обязана своим рождением, вернемся к работе одного из ее "отцов-основателей" П. Берга. При создании своего необычного гибрида Берг использовал рестриктазу, открытую незадолго до этого в одном из штаммов кишечной палочки Гербертом Бойером из Калифорнийского университета в Сан-Франциско (США). Бойер показал, что эта рест-риктаза, названная EcoRI, всегда разрезает обе цепи ДНК точно в одной и той же последовательности оснований
Стрелочки на этой "формуле" указывают места, по которым фермент режет каждую цепь. В результате место разреза в одной цепи смещено по отношению к другой на 4 пары оснований. При таком асимметричном разрезе образуются два выступающих конца. Они притягиваются друг к другу, желая восстановить свои "старые связи" и "скрепиться", как им и положено, водородными мостиками. Если с помощью той же EcoRI получить фрагменты из ДНК различных организмов, то все они будут иметь одинаковые, подходящие друг к другу "липкие концы". Скрепить сцепившиеся этими концами фрагменты помогает другой фермент - ДНК-лигаза. Он лигирует, то есть "сшивает" между собой сахарофосфатные остовы фрагментов с образованием полной структуры двойной спирали ДНК. Внешне она ничем не отличается от обычной, и только ее создатель - генный инженер знает, что это гибрид, да еще такой, какого не смогла сотворить даже неистощимая на выдумки природа. С помощью этих и некоторых других ферментов П. Берг, а вскоре и многие другие исследователи начали конструировать разнообразные по своим составным частям рекомбинантные ДНК.
Уже созданная П. Бергом рекомбинантная структура теоретически могла обладать функциональной активностью в клетках как кишечной палочки, так и обезьяны, ведь в нее входила часть ДНК фага лямбда, обеспечивающая ее способность реплицироваться (то есть самокопироваться, размножаться) в E. coli, и вся ДНК SV 40, реплицирующаяся в клетках обезьяны. Фактически это была первая гибридная ДНК, которая могла бы, как челнок, ходить между бактерией и животным. Но вот именно это не пожелали экспериментально проверить Берг и его коллеги. Дело в том, что подобные гибриды с генами, вызывающими рак у обезьян, могли попасть в человека через бактерии, поскольку E. coli - обычный обитатель кишечника у человека и многих животных. П. Берг не захотел, чтобы его исследования были связаны с риском для человечества, непредсказуемым по своим последствиям. Его не прельщали сомнительные лавры Роберта Оппенгеймера и других "отцов атомной бомбы", даже если считать, что в конечном счете их достижения пригодились для будущей атомной энергетики. В дальнейшем оказалось, что молекулы типа той, что создал П. Берг, вряд ли представляют опасность, так как обычные лабораторные штаммы E. coli, способные инфицироваться фагом лямбда, не обитают в кишечнике человека. И все же внимание не только ученых, но и мировой общественности было привлечено к проблеме оценки потенциальной опасности только что родившегося дитяти молекулярной биологии и генетики - генной инженерии. Наиболее представительная дискуссия развернулась на международной конференции, состоявшейся в 1975 году в небольшом американском городке Асиломаре в Калифорнии. К ней мы еще вернемся, а теперь посмотрим, как ученые из разных стран развили идеи П. Берга и сконструировали in vitro первые функционально активные гибридные ДНК.

Рис. 11
Первыми эту задачу решили американцы Стенли Коэн, Герберт Бойер и Дэвид Хелински с сотрудниками. В их работах появился новый и очень важный элемент всех последующих генно-инженерных работ - вектор.
Вектор - это молекула ДНК (много реже -РНК), способная самостоятельно реплицироваться в клетках различных организмов и обеспечивать размножение и работу встроенного в нее искусственно какого-либо гена, не имеющего обычно собственных регуляторных элементов. Если говорить проще, то вектор - это устройство для доставки чужеродных генов в различные организмы. Поэтому в английской литературе вектор часто обозначается словом vehicle - повозка. Но вектор больше, чем просто повозка. Часто в векторы специально вводят промоторы и другие регуляторные участки генов. Это дает возможность включить в состав вектора лишь кодирующую часть какого-либо гена, лишенную собственных промоторов. Присоединив ее к уже присутствующему в векторе промотору, можно обеспечить экспрессию гена в том хозяине, где данный вектор может стабильно существовать. Организм, в который вектор переносит вшитый в него природный ген, называют реципиентом. У вектора должно быть еще несколько нужных для получения гибридных ДНК свойств. Он должен нести участок, разрезаемый рестриктазой, причем этот участок должен располагаться в части вектора, не связанной с его способностью размножаться в реципиенте. Желательно, чтобы он нес гены, контролирующие какой-нибудь признак, легко различимый в реципиенте. Неплохо, если бы в одном из таких генов находился участок для рестриктазы. Вставка чужеродной ДНК в это место нарушила бы работу гена, и по исчезновению признака можно было бы судить, что в клетках действительно присутствует не сам вектор, а уже гибридная структура из вектора и вшитой в него ДНК.
Иногда в вектор встраивают искусственно синтезированную последовательность, содержащую по одному участку для разных рестриктаз. Ее называют полилинкер. Полилинкер дает возможность включать в вектор различные фрагменты ДНК, нарезанные этими рестриктазами. Хорошо, если вектор может образовывать в реципиенте много копий. Это дает возможность размножить встроенный ген и получить много его продукта.
Первым "домом" для рекомбинантных ДНК, созданным генными инженерами, стали бактерии, а первыми векторами-повозками, с помощью которых эти рекомбинантные молекулы доставлялись в бактериальные клетки, стали плазмиды.
О плазмидах теперь пишут очень много. Это слово то и дело мелькает и на страницах научных журналов, и в солидных газетах, освещающих достижения биологии, и в многочисленных научно-популярных книгах, рассказывающих о биотехнологии и генной инженерии. Плазмидный бум совпал с рождением генной инженерии, но о самих плазмидах ученые узнали лет на двадцать раньше. В 1952 году американский исследователь Джошуа Ледерберг применил термин "плазмиды" для обозначения генетических элементов бактерий, обитающих в их цитоплазме и несущественных для жизни клетки-хозяина. Главное свойство плазмид состоит в их способности автономно, независимо от хромосомы, реплицироваться в клетке. Это означает, что хромосома и плазмида могут соседствовать в бактериях. Каждая из них представляет самостоятельный репликон, то есть структуру, способную к самокопированию, а значит, и самоподдержанию в ряде поколений.
В начале 50-х годов считалось, что плазмиды присутствуют лишь в особых клетках бактерий, способных скрещиваться с другими клетками и переносить в них полностью или частично свою хромосомную ДНК. Клетки первого типа рассматривают как "мужские", второго - как "женские". Первой подверглась всестороннему изучению плазмида, обусловливающая "мужские" свойства бактерий, то есть их фертильность - способность давать потомство и потому обозначенная символом F (от английского fertility - плодовитость). Интересно, что многие сведения о плазмиде F вначале были добыты чисто генетическими методами. Воочию ее, как говорится, никто не видел. К 1961 году положение изменилось. Выяснилось, что она представляет собой замкнутую в кольцо да еще и сверхзакрученную молекулу ДНК (про подобные ДНК говорят, что они имеют твистовую форму - как видите, модные словечки проникли и в такую серьезную науку, как молекулярная биология). По размеру эта ДНК раз в 100 меньше, чем ДНК бактериальной хромосомы. В плазмиде таких размеров все же может разместиться до сотни генов, если считать, что для кодирования среднего белка из 400 аминокислот нужен участок ДНК длиной в 1200 пар нуклеотидов. Примерно 20 генов плазмиды F, называемых генами переноса, нужны для того, чтобы на поверхности несущей плазмиду "мужской" клетки образовались специальные половые ворсинки, которыми они притягивают к себе "женскую" клетку. Благодаря этому "мужская" клетка-"донор" получает возможность переносить в "партнершу" - реципиента свою ДНК. Некоторые типы ворсинок представляют собой полые цилиндры, по которым, как по каналу, переходит из клетки в клетку генетический материал. Плазмида F может находиться в клетке в свободном состоянии в цитоплазме, а может внедриться в ее хромосому. В первом случае плазмида получает возможность сама передаваться от донора к реципиенту, во втором - она обеспечивает перенос хромосомы. Плазмиды типа F, способные передаваться из клетки в клетку при прямом контакте между ними, либо включаться в хромосому и обеспечивать ее перенос, называют конъюгативными, или половыми, факторами.

Рис. 12
Вслед за плазмидой F были обнаружены и другие. Некоторые из них также оказались конъюгативными, другие, более мелкие, не содержали гены переноса и не могли сами передаваться при скрещиваниях. Оказалось, что плазмиды могут помогать друг другу: конъюгативные плазмиды могут сосуществовать в одной клетке с неконъюгативными и обеспечивать перенос не только самих себя, но и своих "неполноценных" собратьев. В главе 3 мы узнаем подробнее, что такая взаимопомощь плазмид оказалась очень полезным свойством, используемым в генной инженерии растений.
Признаки, которыми плазмиды наделяют клетки, чрезвычайно многообразны. Некоторые плазмиды несут гены, кодирующие синтез бактериоцинов веществ, позволяющих одним бактериям победить других в борьбе за существование. Другие отвечают за патогенность бактерий, их способность вызывать различные заболевания у человека, животных и, как мы узнаем из следующей главы, у многих растений. Третьи, и это, быть может, наиболее многочисленная группа плазмид, защищают клетку от различных неблагоприятных воздействий извне. Клетки, содержащие такие плазмиды, намного успешнее противостоят губительному действию антибиотиков, радиации, солей различных металлов, чем их бесплазмидные братья. В этом отношении бактерии неплохо приспособились.
Наличие плазмид не всегда желательно для клетки. Действительно, зачем держать "нахлебника", если ничего не угрожает. И бактерии избавляются от плазмид. Но не все - какая-то часть бактериального сообщества все же держит их, так сказать "на всякий случай". Как только происходит встреча с грозным врагом, тем же антибиотиком, просыпается механизм, обеспечивающий быстрое распространение плазмид между бактериями. Этот механизм - скрещивание. Конъюгативные плазмиды очень часто содержат гены антибиотикоустойчивости да еще, как уже говорилось, могут прихватить в клетку и своего "ущербного" собрата, который сам переноситься не может, но зато также несет гены устойчивости. Кстати говоря, мелкие плазмиды часто размножаются намного интенсивнее, чем крупные, а значит, число генов устойчивости таких плазмид в клетках накапливается. В итоге бактерии могут выжить, даже если организм-хозяин лечат весьма большими дозами антибиотиков. И еще одно обстоятельство - часто плазмиды несут не один, а несколько генов, каждый из которых отвечает за устойчивость к "своему" антимикробному препарату. Многие из этих генов умеют "прыгать" с плазмиды на плазмиду, с плазмиды в хромосому и обратно, так как входят в состав так называемых транспозонов, или Tn-элементов (от латинского transpositio - перемещение).
Стоит, пожалуй, на время отвлечься от плазмид, с тем чтобы немного подробнее рассказать об этих подвижных (иногда их еще называют мобильными, мигрирующими) генетических элементах, или МГЭ. Об МГЭ теперь пишут довольно много, хотя еще лет 20 назад о них мало кто слышал даже среди биологов. Преобладало мнение, что характерной чертой геномов различных организмов является их стабильность. Однако еще в начале века Роллинс Эмерсон описал у кукурузы, а позже, уже в 30 - 40-х годах, Милислав Демерец обнаружил у цветковых растений и у дрозофилы явление, вызванное автономной мутабильностью. Суть его в том, что некоторые гены вдруг, без видимых причин, спонтанно начинают мутировать в тысячи раз чаще, чем их соседи. Природа такой нестабильности генов была открыта в конце 40-х - начале 50-х годов американским генетиком Барбарой Мак-Клинток. Всю свою научную жизнь эта исследовательница отдала кукурузе. Мак-Клинток решила выяснить, с чем связаны различия в цвете зерен кукурузного початка. Чисто генетическими методами еще до появления в руках генетиков физических методов исследования ДНК с помощью рестриктаз, секвенирования, гибридизации и другой новейшей техники она пришла к выводу, что в геноме кукурузы имеются подвижные элементы, способные "прыгать" из одного места хромосомы в другое.

Рис. 13
Эти элементы были обозначены как активатор (Ac) и диссоциатор (Ds). Оба они могут перемещаться по хромосоме, но Ac умеет делать это самостоятельно, a Ds - только в присутствии Ac. Мак-Клинток установила, что внедрение Ds в ген, ответственный за синтез пурпурного пигмента, от которого зависит окраска зерна, ведет к инактивации этого гена, и зерно обесцвечивается. Окраска зерна может быть стабильной и нестабильной в зависимости от того, сможет ли ген избавиться от непрошеного гостя. Помочь в этом гену должен элемент Ac. В присутствии Ac, по крайней мере в некоторых клетках, Ds вырезается из гена окраски, что дает начало пигментированному участку в алейроновом слое зерен.
Открытие Мак-Клинток перемещающихся элементов хотя и вызвало определенный интерес специалистов, но все же не было оценено в должной степени. Лишь в середине 70-х годов МГЭ как бы заново открыли. Советские ученые академик Г. П. Георгиев, профессор В. А. Гвоздев и их сотрудники, американец Девид Хогнесс уже на молекулярном уровне представили доказательства наличия "прыгающих" генов у плодовой мушки-дрозофилы. Причем гены с нестабильной локализацией оказались рассеянными по всему геному, составляя почти треть всех входящих в его состав генов. Такие "прыгающие" или "кочующие" генетические элементы названы мобильными диспергированными (то есть разбросанными) генами (МДГ). Сейчас подобных генетических элементов открыто уже много и у животных, и у растений, и у микроорганизмов. Их присутствие - не исключение, а обычное явление. Оно обусловливает фундаментальное свойство любого организма, названное советским генетиком Р. Б. Хесиным непостоянством генома. Через 35 лет после своего открытия Б. Мак-Клинток была удостоена за него Нобелевской премии по медицине и физиологии.
МГЭ играют, по-видимому, важнейшую роль в процессе эволюции живых организмов, поскольку служат мощным фактором изменчивости, вызывая разнообразные мутации в индивидуальных генах и в структуре всего генома. Между прочим, именно с перемещениями МГЭ связаны многие так называемые спонтанные мутации, которые раньше, до открытия МГЭ, считали беспричинными. А вот с помощью МГЭ, открытых у бактерий, мутации стали вызывать искусственно.
Известно два типа МГЭ. Об одном - транспозонах - уже упоминалось. Другой получил название "вставочных" последовательностей, или IS-элементов (от английского insertion sequences). И IS и Tn при перемещениях могут внедряться в различные гены, нарушая их работу. Однако есть между этими элементами и отличие. Первые сравнительно невелики - длиной от нескольких сотен до примерно полутора тысяч пар нуклеотидов. В них нет ничего лишнего, не связанного непосредственно с основным свойством - "прыгать" по геному. Транспозоны - более сложные структуры: помимо генов, обеспечивающих возможность перемещения, в них часто входят различные структурные гены, кодирующие устойчивость к разным антибиотикам, солям металлов, синтез токсинов и другие. Один и тот же транспозон иногда может содержать целый набор генов устойчивости. С обеих сторон транспозоны окружены повторами IS-элементов либо еще более коротких последовательностей. Транспозоны часто включаются в состав плазмид, используя их как тележку, для того чтобы быстро перебираться из одной клетки в другую. Между прочим, именно благодаря быстрому распространению транспозонов бактерии эффективно защищаются от антибиотиков, создавая немалые проблемы для медицины и ветеринарии. С другой стороны, введение транспозонов в плазмиды, как и в любые другие участки геномной ДНК, стало наиболее эффективным способом индукции в них мутации. Транспозоновые вставки в кодирующие последовательности ДНК прерывают целостность хромосомных либо плазмидных генов. Часто это могут быть мутации типа делеций, выбрасывающие большие куски плазмидной ДНК. Для получения мутаций используют чаще всего несколько транспозонов, обозначаемых номерами. Например, Tnl и Tn3 кодируют устойчивость к антибиотикам пенициллинового ряда, Tn5 - к так называемым аминогликозидным антибиотикам (канамицину, неомицину и др.).
В составе подобных транспозонов гены антибиотикоустойчивости распространяются среди бактерий. Носители таких транспозонов - плазмиды множественной лекарственной устойчивости, обозначаемые символом R (от английского resistance - устойчивость), доставляют немало страданий больным и хлопот врачам. С ними связано быстрое распространение у человека и животных болезнетворных бактерий, которых "не берут" никакие лекарства. Впервые на это обратили внимание еще на рубеже 50 - 60-х годов японские микробиологи, немало сделавшие для выявления R-плазмид и изучения их свойств.
И все же долгое время к плазмидам относились, как к чему-то не очень важному, несущественному для бактерий, и поэтому исследованиями плазмид занимались лишь те ученые, которые могли позволить себе роскошь заниматься "чистой" фундаментальной наукой либо занимались исключительно вопросами лекарственной устойчивости бактерий. Все изменилось к 1973 году, когда С. Коэн, Г. Бойер и их сотрудники в Стенфордском и Калифорнийском университетах в США решили использовать именно плазмиды в качестве векторов для конструирования рекомбинантных ДНК и введения их в бактериальные клетки. Решение это не с неба свалилось. Оба ученых имели опыт "классических" исследований плазмид и знали их свойства. Действительно, плазмиды - это идеальные векторные молекулы, созданные самой природой: они способны к автономной репликации, обладают генами устойчивости, позволяющими легко обнаружить плазмиды в клетке, много- либо малокопийностью, в зависимости от того, что выгоднее исследователю, способностью внедряться в хромосому, а значит, стабильно переносить в нее введенные гены и, наконец, как выяснилось позднее, многие мелкие плазмиды содержат по одному участку для нескольких рестриктаз. Это означает, что каждая такая рестриктаза не разорвет плазмиду на несколько еще более мелких кусков, а лишь разрежет кольцо плазмидной ДНК и переведет ее в линейное состояние. Вообще у плазмид есть много необходимых векторам свойств, да и сама природа часто использует их в этом качестве, когда ей, например, нужно защитить свои создания - бактерии. Неудивительно, что многие специалисты по плазмидам оказались вполне готовы включиться в генно-инженерные работы и решили испытать своих любимцев на роли векторов. Приведем слова одного из них, американского генетика батерий Стенли Фолкоу, написанные в 1977 году: "Признаться, в течение примерно 17 лет я полагал, что плазмиды (или, как мы их обычно называли, эписомы) прекрасно функционируют в качестве векторов и не нуждаются в каких-либо усовершенствованиях. Более того, мой опыт работы в клинической лаборатории свидетельствует о том, что плазмиды функционируют, пожалуй, слишком успешно!"
Фраза неплохая, однако уважаемый профессор несколько преувеличил. Плазмиды нужно и можно усовершенствовать при использовании их как векторов, и генные инженеры научились довольно хорошо это делать. Однако началось действительно с того, что Бог (а может, природа) послал, а "послал" он, надо сказать, совсем неплохую вещь - плазмиду, которую впервые обнаруживший ее ученый решил даже назвать собственным именем - pSC, то есть плазмида (от английского plasmid) Стэнли Коэна (Stanly Cohen), и дал порядковый номер 101. Так появилась эта, вскоре ставшая знаменитой плазмида pSClOl.
У плазмиды pSClOl есть несколько свойств, делающих возможным ее использование в качестве вектора. Во-первых, это - самостоятельно размножающаяся единица. Во-вторых, она несет только один участок расщепления рестриктазой EcoRI и превращается под действием этого фермента из кольцевой в линейную молекулу, концы которой могут "слипаться" между собой или с любыми фрагментами другой ДНК, полученными под действием той же рестриктазы. В-третьих, она несет ген устойчивости к антибиотику тетрациклину, а значит, легко обнаруживается в бактериях, если их растить на среде с этим антибиотиком. Все эти свойства и были использованы С. Коэном и его коллегами для создания первых рекомбинантных ДНК, да еще таких, которые были бы функционально активными, то есть могли бы стабильно существовать в клетке и наделять ее новыми признаками. Чтобы этого добиться, нужно было заставить клетку воспринять рекомбинантную ДНК.
Объектом первых опытов по генной инженерии была избрана наиболее изученная и часто используемая в лабораториях кишечная палочка (E. coli). По многим признакам хороша эта бактерия - и неприхотлива, и служит надежным хозяином для многих плазмид, и детально изучена генетически, только вот есть очень мешающий ученым недостаток: E. coli в отличие от многих других видов бактерий долгие годы не удавалось трансформировать с помощью изолированных ДНК. Следовательно, в нее нельзя было ввести и полученные "в пробирке" рекомбинантные ДНК. Чтобы преодолеть это "упрямство" E. coli, ученым пришлось разработать специальную методику. Клетки бактерий стали выдерживать на холоде в растворе кальция, а затем подвергали "тепловому шоку", переставляя пробирки с бактериями из ледяной воды в теплую. После таких "встрясок" клетка сдалась - ее мембрана стала проницаемой для поступления извне молекул ДНК. Теперь в руках ученых оказались нужные для генной инженерной работы компоненты системы - векторная молекула, фермент-рестриктаза, клетка-хозяин, в которую можно ввести гибридную ДНК. Но нужно было решить еще один вопрос: что "подшить" к вектору? Группа С. Коэна начала с самого простого. Решено было объединить плазмиду pSC101 с плазмидой E. coli, контролирующей устойчивость к антибиотику канамицину. Создание рекомбинантных ДНК осуществляли двумя путями. По одной методике смесь ДНК двух плазмид обрабатывали ферментом рестрикции, знакомой нам E. coli, и сразу использовали для переноса в бактериальные клетки. Расчет в этом случае был на то, что "липкие" концы двух линейных молекул ДНК объединятся, а замкнуть образующееся кольцо, восстановить целостность сахарофосфатных цепей ДНК сможет фермент ДНК-лигаза, находящийся в самих бактериях. Делали и по-другому: обрабатывали смесь плазмидных молекул двумя ферментами - вначале рестриктазой, затем лигазой, а после трансформировали ею E. coli. В обоих случаях отбирали клетки, устойчивые к двум антибиотикам - тетрациклину и канамицину, только при использовании второй методики такие клетки образовывались намного чаще. Теперь нужно было убедиться, что трансформаты действительно несли рекомбинантную ДНК. Для этого из них выделяли плазмидные молекулы и анализировали их, обрабатывая тем же ферментом EcoRI. Гибриды разрезались на два фрагмента, один из них по размеру точно совпадал с pSClOl, а второй - с другой, "подшитой" плазмидой. Главное, что, объединившись в одну структуру, плазмиды не потеряли своей активности: они размножались в клеточной цитоплазме независимо от хромосомы и продолжали кодировать устойчивость к антибиотикам, причем каждая к своему. Так была создана первая функционально активная рекомбинантная ДНК. Вскоре группа С. Коэна сумела получить рекомбинантную структуру, состоящую из той же плазмиды pSClOl и плазмиды устойчивости к стрептомицину, выделенной из сальмонелл - близкородственного к E. coli рода бактерий. Гибридная плазмида также контролировала устойчивость к двум антибиотикам - тетрациклину и стрептомицину. Так на заре генной инженерии ученые принципиально решили задачу конструирования in vitro функционирующих рекомбинантных ДНК на основе плазмид, выделенных из кишечной палочки и близкородственных ей бактерий. Уже в этих ранних работах оформились основные элементы техники молекулярного клонирования, то есть избирательного накопления молекул созданной рекомбинантной ДНК. Эти элементы образуют триаду: выделение гена, "сшивание" его с вектором, доставка гибридной структуры в реципиентный организм, где она сможет размножаться и наследоваться в потомстве.
Вскоре один за другим стали появляться сообщения о получении функционально активных гибридных молекул, объединяющих между собой ДНК из все более удаленных друг от друга видов организмов. Промежуточным звеном в этой цепочке исследований можно считать работы по созданию гибридных плазмид, объединяющих ДНК из различных семейств бактерий, например кишечной палочки и стафилококков, не скрещивающихся между собой в природе. И такие рекомбинантные структуры были функционально активны - фрагмент стафилококковой ДНК снабжал E. coli признаком устойчивости к пенициллину. Так, шаг за шагом решалась проблема объединения и клонирования гибридов на основе молекул ДНК из организмов, все более удаленных друг от друга на эволюционном древе. Ученые, подгоняемые азартом и любопытством, "сшили" вместе фрагменты ДНК из одного вида бактерий - они заработали, наделили клетку признаками, кодируемыми находящимися в них генами. "Сшили" ДНК из родственных бактерий - опять получилось, из более далеких - вновь удача. Нельзя ли в таком случае попробовать объединить ДНК прокариот (бактерий) и эукариот (животных, растений, человека)? Заработают ли гены высших в бактериях и наоборот? А почему бы и нет? Ведь генетический код универсален. Вспомним знаменитый закон гомологических рядов наследственной изменчивости, сформулированный Н. И. Вавиловым еще в 20-х годах: гены, кодирующие одинаковые признаки различных видов, должны быть схожи. Генная инженерия полностью доказала уже на новейшем, молекулярном уровне справедливость и всеобщность открытого Вавиловым фундаментального закона биологии - гены высших работают в бактериях, а с помощью бактериальных генов удается даже исправлять наследственные дефекты клеток у человека. На этом основана новая ветвь медицинской генетики - генотерапия.
Но все это будет немного позже, а тогда, в середине 70-х, ученые удивляли мир все более диковинными конструкциями. Создавались рекомбинантные ДНК, в которых плазмиду-вектор объединяли с ДНК из яйцеклеток лягушек, из морского ежа, из митохондрий мыши. Затем эти гибриды вводили в клетки E. coli. Конечно, бактерии, получившие такой необычный для них генетический материал, не превращались в лягушек или мышей, но главное было в другом - чужеродная ДНК размножалась в бактериях, как их собственная, и с нее списывалась РНК. Это означало, что аппарат бактериальной клетки может экспрессировать чужие гены. Правда, оказалось, что для экспрессии нужно, чтобы ген был снабжен распознаваемыми новым хозяином сигнальными элементами, но дело было сделано. Первые рекомбинантные ДНК назвали "химерами". И не зря.
Неистощимая на выдумки природа таких сочетаний генетического материала придумать не могла. Сотни миллионов лет в недрах природы сосуществуют и борются между собой два процесса - сохранение видов и их эволюция. Генетический материал вида сохраняет постоянство, но в ДНК отдельных его представителей могут произойти столь серьезные мутационные изменения, что, будучи подхвачены отбором, они способны дать начало новой ветви, новому виду. Нескрещиваемость видов - вот природный барьер для генов. Генная инженерия сломала этот барьер, создав рекомбинантные ДНК. В переносном значении слово "химера" означает "фантазия", "неосуществимая мечта". Однако химеры, созданные учеными, столь же реальны, как и скульптурные изображения мифологических чудовищ с головой и шеей льва, туловищем козы и хвостом дракона, порожденных, согласно древнегреческим мифам, Тифоном и Ехидной.
"Искусство открытия может расти вместе с открытиями", заметил Фрэнсис Бэкон. И действительно, в круг векторов стали включать новые плазмиды, имеющие ряд преимуществ по сравнению с pSClOl. Так, начали использовать плазмиду ColEl, кодирующую синтез бактерицидного вещества - колицина. В отличие от pSClOl эта плазмида очень активно размножается (копируется) в E. coli, а следовательно, способна интенсивно размножать и включенные в нее чужеродные гены. Американский ученый Д. Хелински включил в плазмиду ColEl группу генов из хромосомы E. coli, ответственных за синтез аминокислоты триптофана. Когда в клетки E. coli ввели эту гибридную ДНК, они стали вырабатывать столько ферментов, участвующих в биосинтезе этой аминокислоты, что их количество составило почти четверть всего клеточного белка. Это были первые результаты, показавшие, что с помощью генной инженерии бактерии можно сделать фабриками нужных человеку аминокислот, белков и других полезных веществ.
Создавая бактериям определенные условия, можно добиться высокой степени накопления плазмидных векторов этого типа - до нескольких тысяч копий в клетке, что помогает им потом обеспечивать размножение любого клонированного в них фрагмента ДНК. Таким способом ученые нашли возможность быстрого получения в больших количествах нужных фрагментов ДНК, а значит, и возможность массового получения определенных генов, направляющих в своих хозяевах синтез новых белков.
Плазмида ColEl стала первым вектором, использованным для генно-инженерных работ, выполненных в нашей стране под руководством академика А. А. Баева и профессора С. И. Алиханяна. Эти первые работы стали необходимой школой для осуществления в СССР многих будущих проектов генной инженерии.
Между тем продолжалось развитие ее методов, совершенствовались плазмидные векторы. Широкое распространение получила созданная Г. Бойером на основе ColEl плазмида pBR322. У нее больше участков, разрезаемых различными рестриктазами, следовательно, с ней можно "сшивать" самые разные фрагменты. Кроме того, у pBR322 не один, а два маркера для селекции: помимо тетрациклина, эта плазмида кодирует еще и устойчивость к пенициллину. Если один из этих генов разрезать определенной рестриктазой, то при "сшивании" с фрагментом чужеродной ДНК целостность гена нарушается и определяемый им признак исчезает. Это позволяет легко отбирать гибридные молекулы при трансформации E. coli. Например, если на селективной среде образуется колония потомков одной делящейся клетки, устойчивых только к пенициллину, но не к тетрациклину, то с большой долей вероятности можно надеяться, что ген, кодирующий устойчивость к тетрациклину, инактивировался встройкой в него фрагмента чужой ДНК.
Помимо плазмид, в качестве векторов стали использовать и фаги, особенно производные одного из фагов E. coli, называемого фагом лямбда. ДНК этого фага сравнительно невелика, гены его хорошо изучены, а размножаться в клетках бактерий фаг умеет очень интенсивно. Эти качества привлекли внимание генных инженеров. Рядом искусных приемов они смогли изменить фаговую ДНК так, чтобы в ней содержалось лишь 1 - 2 участка, не связанных с контролем размножения фага. Оказалось, что фаг лямбда может потерять до 25 процентов своей ДНК, не утратив при этом способности формировать зрелые фаговые частицы и разрушать бактериальные клетки. Если потеря превышает эту четверть, фаг гибнет. Но вот что интересно: фагу все равно, какой ДНК "грузиться" - своей ли, чужой, лишь бы по общей длине его ДНК соответствовала или превышала какой-то минимум, ниже которого она уже не сможет упаковаться в белковую оболочку, а без этого зрелый фаг не может существовать. Вот это-то свойство ДНК фага лямбда и используют для того, чтобы включать в нее фрагменты чужеродной ДНК. Отбор гибридных фаговых частиц ведется по жизненному признаку: зрелыми становятся лишь те частицы, в геном которых включилась добавочная ДНК. Таким способом удалось в составе фага лямбда клонировать различные фрагменты хромосомы E. coli, а вскоре и вовсе "чужую" ДНК плодовой мушки дрозофилы.
Позже были созданы космиды - особый тип векторов, сочетающих свойства плазмиды и фага лямбда. В космидах можно клонировать еще более крупные, до 40 тысяч пар нуклеотидов длиной, фрагменты ДНК. Включение таких больших кусков чужой ДНК в обычные плазмидные векторы повреждает их способность к автономному существованию.
Чем большую силу набирала генная инженерия, чем разнообразнее становился арсенал ее методов, тем чаще высказывалось учеными и общественными деятелями сомнение, не принесет ли это новое направление науки, способное столь радикально вмешиваться в наследственность любого живого организма, больше вреда человечеству, чем пользы. Мы уже упоминали, что еще автор первой генно-инженерной работы Пол Берг принял решение воздержаться от клонирования генов вируса SV40, вызывающего опухоли у обезьян, в клетках E. coli - обычных обитательниц кишечника человека и животных. С появлением первых плазмидных векторов появились опасения, что подобные плазмиды, несущие гены устойчивости к антибиотикам, слишком бесконтрольно смогут размножаться в организме человека. И, конечно, всех честных ученых волновал вопрос о том, что случится, если генная инженерия начнет служить силам зла и агрессии.
Словом, сложилась ситуация, которую еще в конце XIX века предвидел французский химик Пьер Бертло: "Значение ученого... в современном государстве непрерывно растет. Не забудем, что соответственно растут и его обязанности по отношению к другим людям". Круг "обеспокоенных ученых" все более расширялся. В феврале 1975 года в Калифорнии, в США, в Асиломарском центре по проведению конференций, собралось более ста всемирно известных молекулярных биологов. Участвовали в этой конференции и два советских ученых - академики В. А. Энгельгардт, выдающийся биохимик, создатель молекулярной биологии в нашей стране, и А. А. Баев - один из первых в мире сумевший расшифровать структуру транспортных РНК, человек, стоящий во главе всех генно-инженерных работ в СССР.
На этой конференции группа видных ученых, входящих в созданный в США Комитет по рекомбинантным молекулам ДНК, возглавляемая тем же П. Бергом, призвала ученых всего мира добровольно отложить потенциально опасные эксперименты, пока не будет всесторонне оценено, в какой мере вообще работы с рекомбинантными ДНК можно считать безопасными. В ответ на этот призыв на конференции были выработаны основные принципы обеспечения безопасности генно-инженерной деятельности, которые были положены в основу всех последующих руководств и методик. Между прочим, уже в Асиломаре задолго до того, как генно-инженерный бум охватил растения, к потенциально опасным, а значит, и нежелательным были отнесены работы по созданию рекомбинантных ДНК патогенных растений, способных увеличить степень их вредности. Ученые разных стран продемонстрировали высокую социальную ответственность перед обществом и согласились придерживаться трех наиболее принципиальных положений, определяющих политику в области генно-инженерной деятельности. Во-первых, при оценке степени риска следует исходить из наиболее точной научной информации. Во-вторых, меры против потенциальной опасности должны быть разработаны на основе совместной оценки научных данных представителями власти, науки и производства. В-третьих, широкое общественное мнение должно участвовать в принятии решений как по вопросам риска генной инженерии, так и по вопросам благ, которые она в будущем сможет принести человечеству.
Время от времени в различных странах вновь вспыхивают ожесточенные дискуссии о практическом использовании тех или иных генно-инженерных достижений. Для примера сошлемся на острые дебаты, развернувшиеся в США по поводу использования мутантных бактерий из рода псевдомонад для защиты растений от заморозков, на споры, разгоревшиеся в ФРГ, о том, можно или нельзя применять измененные в лабораториях бактерии для обогащения почвы азотом. И все же вопрос об опасности генной инженерии в настоящее время потерял свою первоначальную остроту. Стало ясно, что сами по себе рекомбинантные ДНК не представляют опасности, а лабораторные E. coli, наиболее часто использующиеся в качестве хозяев для размножения этих ДНК, практически очень быстро гибнут в организмах человека и животных, даже в условиях их искусственного скармливания в очень больших количествах. Тем не менее были разработаны специальные правила для работы с рекомбинантными ДНК, имеющие международный характер. Как справедливо отметил А. А. Баев, "...опасна не генная инженерия сама по себе, а человек, владеющий ее методами и утративший чувство ответственности перед обществом и его будущим".

Рис. 14
Покуда шли споры и вырабатывались рекомендации, на генно-инженерной "бирже" появились первые "банкиры", но в сейфах их банков лежали не деньги, а нечто более ценное - рекомбинантные ДНК - результат включения в векторы всех генов различных организмов. Чтобы заиметь собственный "банк", генный инженер должен уподобиться... охотнику, идущему на цель с дробовиком. Когда ученый не знает, в каком месте ДНК расположен интересующий его ген, он может "выпалить" по всей цели, авось куда-нибудь и попадет. Только вместо дроби в дело идет рестриктаза. Раздробив с ее помощью суммарную ДНК на фрагменты, добавляют к смеси вектор, обработанный той же рестриктазой, и всю эту "кашу" используют для трансформации бактерий. Обычно в каждую рекомбинантную клетку имеет шанс попасть одна молекула ДНК, представляющая собой гибрид вектора и какого-нибудь одного из многих фрагментов, присутствовавших в смеси. Клетка, получившая гибридную ДНК, размножившись, образует клон. Набор клонов бактерий, содержащих различные рекомбинантные молекулы, включившие все возможные фрагменты ДНК определенного организма, и составляет банк генов. Некоторые авторы предпочитают, правда, слово из другого, не финансового лексикона Они называют такие наборы клонов библиотеками генов. Банк ли, библиотека ли, важно другое - создание таких собраний генов открыло уникальные возможности для выявления, детального изучения, а если нужно, и практического использования любого гена данного организма. Техника "дробовика" позволила получить набор клонов бактерий или гибридных фагов (в последнем случае обычно используют слово шток, а не клон), различающихся по включенным фрагментам ДНК. В распоряжении ученых имеется теперь немало методов, чтобы черпать из банков нужные гены. Уже в 1974 году Д. Хогнесс с сотрудниками создали в США банк генов дрозофилы в клетках E. coli. Через два года американцы Люэс Кларк и Джон Карбон стали владельцами банка всех генов самой этой бактерии. Вслед за этим были получены банки генов и других организмов, включая человека. Надо заметить, что в отличие от взаправдашних банкиров ученые буквально сорят своими сокровищами. Они предоставляют их своим коллегам в собственных или других странах, и те, в свою очередь, получают возможность вести исследования интересующих их генов.
Подходы, о которых говорилось выше, основаны на поиске и отборе генов из природных источников. Но есть и другие возможности, например их химический синтез.
Генная инженерия открыла путь для производства различных белков путем искусственного синтеза их генов.

Рис. 15
Уже теперь химически синтезированные гены помогли создать бактериальные продуценты многих ценных лекарственных препаратов. В их числе различные гормоны - регуляторы многих жизненно важных функций организмов. Первым еще в 1977 году в лаборатории Г. Бойера, в США, был синтезирован, включен в векторную плазмиду и заработал в E. coli ген гормона млекопитающих - соматостатина. Этот крохотный пептид, состоящий из 14 аминокислот, выполняет в организме человека и животных важную функцию - регулирует уровень другого гормона, называемого гормоном роста. Приемы, использованные в этой работе, были немедленно подхвачены и применены в различных лабораториях в нашей стране и за рубежом для многих других гормонов, имеющих белковую природу. Важнейший из них - инсулин. Сейчас полученный генно-инженерными методами человеческий инсулин производится рядом крупных западных фармацевтических фирм. Он пока что не слишком дешев, но имеет несомненные преимущества перед обычными препаратами инсулина, получаемыми из поджелудочной железы свиней. Свиной инсулин хоть и близок к человеческому, а все же не свой и часто дает нежелательные побочные эффекты, аллергические реакции. Создать этот ген удалось прежде всего потому, что последовательность белка инсулина, состоящего из двух полипептидных цепочек, в одну из которых входит 21, а в другую - 30 аминокислот, была хорошо изучена. Зная аминокислотную последовательность белка и генетический код, можно определить, какая последовательность нуклеотидов будет ей соответствовать, осуществить ее синтез и встроить в плазмидный вектор. Туда же нужно включить и регуляторные участки ДНК - промоторы, без которых не может произойти образование молекул мРНК, а значит, и самого белка. Микроорганизмы, несущие такие гибридные плазмиды (теперь, помимо бактерий, в качестве "фабрик" различных нужных человеку препаратов используют дрожжи), стали продуцентами ценнейшего лекарства, без которого не могут обойтись ежедневно миллионы больных диабетом.
В практике генной инженерии часто используется и другой метод искусственного получения генов. Однако, прежде чем о нем рассказать, заметим, что и у ученых, людей, вроде бы способных к незапрограммированному, свободному мышлению, бывают догмы. Одна из них, сформулированная Ф. Криком, одним из "отцов" двойной спирали ДНК, гласит: "...генетическая информация, записанная в ДНК, переписывается на РНК, а с нее на белок". Это положение стали называть центральной догмой молекулярной биологии. Формула ДНК - РНК - белок, конечно, справедлива, но... Наверное, без таких "но" не может обойтись ни одна истина, принимаемая на веру как непреложная, неизменная при всех обстоятельствах. Прошло всего немного времени и в центральную догму пришлось внести существенную поправку: американцы Говард Те-мин и Дэвид Балтимор получили строгие доказательства того, что генетическая информация может передаваться в обратном направлении - от РНК к ДНК. Они решили выяснить одну загадку. Было известно, что существуют организмы, у которых геном состоит не из ДНК, а из РНК. Еще в 1957 году, вскоре после того как была доказана справедливость вывода Эйвери с соавторами о том, что ДНК является главным веществом наследственности, Х. Френкель-Конрат и Б. Зингер, работавшие с вирусом табачной мозаики (ВТМ), частицы которого состоят из молекулы РНК, упакованной в белковую оболочку, показали, что именно эта РНК определяет характерные признаки вирусного потомства. У многих вирусов, вызывающих опухоли у млекопитающих, включая человека, дело обстоит сложнее. Они тоже содержат РНК, но, попав в животную или человеческую клетку, присоединяются к клеточной ДНК, становясь ее частью. Замечено, что при культивировании in vitro такие инфицированные клетки ведут себя как раковые. Они начинают безудержно делиться, приобретают некоторые другие, не свойственные нормальным клеткам черты. Было непонятно, каким образом вирусная РНК может присоединиться к клеточной ДНК. Пытаясь ответить на этот вопрос, Темин предположил, что вирусная РНК превращается в ДНК и в такой форме встраивается в клеточный геном. Эта гипотеза многими учеными, убежденными сторонниками незыблемости "центральной догмы", была встречена в штыки. Однако вскоре Темин и Балтимор открыли фермент, названный обратной транскриптазой, или ревертазой, и показали, что именно он осуществляет транскрипцию РНК, синтезируя на ней, как на матрице, одноцепочечную ДНК. Затем уже клеточный фермент ДНК-полимераза, используя эту цепочку ДНК в качестве шаблона, достраивает комплементарную ей вторую цепочку. Образуется обычная двуспиральная ДНК, способная присоединиться к ДНК своей жертвы - клетки животного или человека. Открытие процесса обратной транскрипции не только внесло огромный вклад в разработку вирусной теории возникновения рака, но и дало в руки исследователей важный инструмент для искусственного синтеза генов. Ученые научились выделять в достаточных количествах мРНК отдельных генов, а затем по таким мРНК-вым копиям с помощью обратной транскриптазы синтезировать комплементарную им ДНК. Ее так и обозначают кДНК. Важно, что она соответствует только той части гена, которая кодирует его белковый продукт, а регулярные части гена в ней не представлены. Действительно, откуда им взяться в кДНК, когда их нет в мРНК? Это значит, что кДНК любого гена можно соединить с разными регуляторными элементами в зависимости от того, в каком организме - прокариотах или эукариотах (например, в растениях) должен заработать этот ген. Для того чтобы размножить кДНК, ее включают в состав вектора и вводят в клетки бактерий или дрожжей. Разработаны специальные методы, позволяющие с помощью кДНК, используемых в качестве тестеров (зондов), обнаруживать нужные гены, хранящиеся в "банковских сейфах". "Сейфами" служат индивидуальные клоны, каждый из которых несет гибридную плазмиду с включенным в нее фрагментом ДНК какого-то организма. Представим себе, что у нас уже есть банк генов какого-то растения, скажем пшеницы. Мы получили его, выделив из клетки пшеницы ДНК, расщепив ее подходящей рестриктазой на фрагменты, встроив эти фрагменты в вектор и введя полученную рекомбинантную ДНК, например, в E. coli. Но в какую из тысяч трансформированных клеток E. coli попал интересующий нас ген, как отыскать иголку в стоге сена? Вот когда пригодятся кДНК-зонды. Посмотрим, как ими пользуются.

Рис. 16
Трансформированные клетки E. coii делятся и примерно через сутки образуют на твердой питательной среде колонии. Каждая из таких колоний содержит около 100 миллионов клеток-потомков. В соседней колонии - потомки другого трансформанта и т. д. Если к поверхности плотной среды, на которой колонии растут в плоских, накрытых крышками чашках (их называют чашками Петри) приложить особую бумагу, представляющую собой фильтр из нитроцеллюлозы, каждая колония разделится - часть ее останется на чашке, а часть перейдет на фильтр. Таким способом на фильтре возникает отпечаток колоний, сформировавшихся на чашке, и положение определенных колоний тут и там полностью совпадает. Теперь нужно разрушить клетки, сидящие на фильтре, и обнажить их ДНК. Для этого используют раствор щелочи. Бактерии как бы растворяются (этот процесс называют лизисом), из них высвобождается ДНК, а ее цепи под действием щелочи расходятся. После того как фильтр прогреют при высокой температуре в вакуумной печи, цепи ДНК прочно связываются с нитроцеллюлозой. Затем на фильтр наносят кДНК интересующего гена, предварительно меченной радиоактивным фосфором. Фильтр выдерживают в условиях, при которых в случае, когда цепочка ДНК, сидящая на фильтре, имеет последовательность нуклеотидов, комплементарную кДНК, между ними может произойти сплавление. Это значит, что комплементарные основания в гене, встроенном в какую-то из рекомбинантных плазмид, и в кДНК "опознали" друг друга и объединились водородными связями. Если фильтр положить на покрытую чувствительной фотоэмульсией рентгеновскую пленку, то местоположение метки можно определить по участкам затемнения после проявления пленки. Этот метод, называемый ДНК - ДНК гибридизацией, дает возможность узнать, в какой колонии бактерий находится наш ген. Посмотрев, где отпечаталась эта колония на фильтре, легко установить, где она находится на исходной чашке. Колонию отбирают, выделяют из нее ДНК и подвергают анализу. Убедившись, что нужный ген "пойман", решают, что с ним делать дальше, как изучить его строение, функции, как заставить его работать в новых хозяевах, нельзя ли улучшить его свойства.
Мы познакомились с некоторыми общими приемами генной инженерии. Они применимы и для простейших одноклеточных, и для очень сложных многоклеточных организмов. В круг микроорганизмов, ставших "домом" для рекомбинантных ДНК и "фабрикой" для производства кодируемых этими ДНК продуктов, помимо кишечной палочки и дрожжей, включились бациллы - непатогенные почвенные бактерии, способные выделять многие белки в культуральную жидкость, псевдомонады, метилотрофные и другие бактерии. Технология рекомбинантных ДНК легла в основу создания многих полезных штаммов микроорганизмов - продуцентов аминокислот, витаминов, антибиотиков, вакцин, гормонов, антивирусных белков - интерферонов. Не остались в стороне и животноводы. Во всяком случае в нескольких лабораториях сумели ввести ген гормона роста в хромосомы яйцеклеток мышей. Родившиеся мыши росли явно быстрее контрольных, что позволило вплотную задуматься над тем, как использовать этот же подход при работе с более полезными для человека животными, скажем коровами и свиньями. Но не будем пока давать волю своему воображению и представлять коров величиной со слона, которые помогут нам решить наконец проблему снабжения населения мясом. Что-то в этом направлении делается, так что, как говорится, "поживем - увидим". Важно, во всяком случае, что в животные клетки можно вводить рекомбинантные ДНК и что чужеродные гены в них работают.
Ясно, что генно-инженерная "лихорадка" должна была распространиться и на растения. Но для этого следовало найти те "повозки", на которых гены доставлялись бы в растительную клетку. Вот с этого, пожалуй, и началась генная инженерия растений. Но только создавать поначалу ничего не пришлось. Нужно было лишь повнимательней присмотреться к природе и понять, что она задолго до рождения генной инженерии придумала способ переноса чужеродных генов в растения. Об этом замечательном даре природы мы и расскажем в следующей главе.
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'