
107. Как осуществляется биосинтез белка?
В процессе биосинтеза белка следует различать два последовательных процесса: транскрипцию и трансляцию.
При транскрипции генетическая информация, заключенная в молекуле ДНК, переписывается благодаря действию транскриптазы в информационную РНК (иРНК). В цитоплазме на рибосомах иРНК определяет порядок соединения аминокислот, осуществляя таким образом синтез специфического белка. Этот процесс называется трансляцией, в нем можно выделить несколько последовательных этапов: активацию аминокислот, образование аминоацил-тРНК и присоединение аминокислот.
Активация аминокислот и образование аминоацил-тРНК включает собственно активацию аминокислоты и перенос активированного аминоацильного остатка на молекулы тРНК с образованием аминоацил-тРНК. Обе реакции катализируются аминоацил-тРНК-синтетазой или ферментом активации, специфичным для каждой аминокислоты.
Аминокислота активируется с помощью АТФ путем ее присоединения к карбоксильной группе остатка АМФ от АТФ. Полученный аденилат аминокислоты соединяется с ферментом активации:
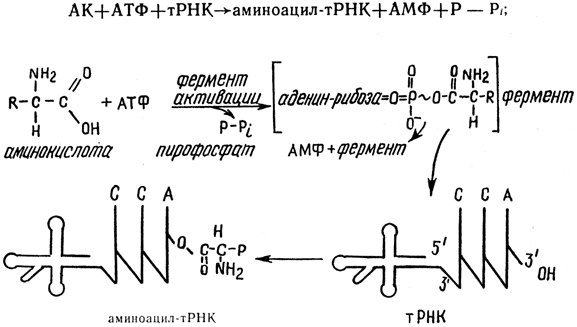
При образовании аминоацил-тРНК аденилат аминокислоты присоединяется к специфической тРНК с последующим отщеплением фермента и AMP. Полученная аминоацил-тРНК затем участвует в образовании полипептидной цепи.
Аминоацил-тРНК-синтетаза обладает двумя сайтами специфичности: один - узнающий аминокислоту, другой - узнающий определенную тРНК. От специфичности фермента зависит правильность трансляции генетической информации. Поскольку имеется множество тРНК (даже для одной и той же аминокислоты), несущих различные антикодоны, способные узнавать различные кодоны (изо-акцепторные тРНК), существует и множество аминоацил-тРНК-синтетаз, обладающих очень строгой специфичностью, так как ошибка, допущенная в период активации, уже не может быть исправлена при росте полипептидной цепи. Это может быть установлено в процессе эксперимента по трансформации цистеина в аланин и последующей вставки аланина на место цистеина в пептидной цепи (см. вопр. 62).
Эксперименты с импульсной меткой растущей цепи полипептида (гемоглобин α и β в ретикулоцитах кролика) показали, что полипептидная цепь растет в направлении от N-конца к С-концу. (В ретикулоцитах скорость роста цепи достигает 1 аминокислотного остатка в секунду; у бактерий - 20 остатков в секунду.)
Трансляция включает три этапа: инициацию, элонгацию, терминацию полипептидной цепи.
1. Инициация. У бактерий синтез полипептида начинается всегда с установки первой аминокислоты - N-формилметионина, кодируемой кодонами АУГ и ГУГ. Существует две метиониновых тРНК: тРНFмет и тРНКMмет, но только метионин, прикрепившийся к тРНКFмет, может быть формилирован, превращаясь в N-формилметионил-тРНКFмет. Формилирование Мет-тРНКFмет катализируется трансформилазой при участии N10-формилтетрагидрофолата (формил-N10-ТГФ) как донора формильной (СНО)-группы:
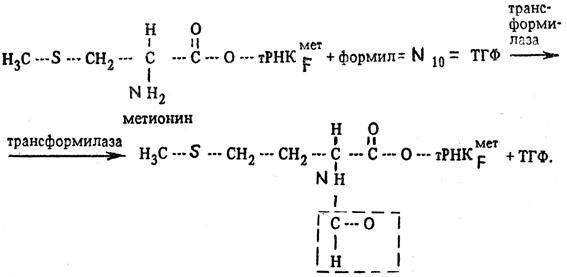
Мет-тРНКFмет включает метионин в начале цепи при наличии кодона ГУГ и АУГ, в то время как Мет-тРНКFмет содержит метионин внутри пептидной цепи при наличии кодона АУГ.
Поскольку существуют два типа метиониновых тРНК, имеется и средство распознавания инициирующего триплета единственным типом тРНК - тРНКFмет. Это средство включает наличие вблизи инициирующего кодона специфической последовательности богатой пуриновыми основаниями и комплементарной 16S РНК рибосомы 30S.
2. Образование комплекса инициации. При синтезе белка наблюдается непрерывное образование и распадение 70S рибосом (у Е. coli), поскольку тРНК и инициаторная аминоацил-тРНК не могут фиксироваться непосредственно на 70S рибосомах. А такие антибиотики, как стрептомицин и неомицин, блокирующие диссоциацию рибосом, ингибируют инициацию белкового синтеза.
В процессе инициации участвуют три фактора: IF1, IF2, IF3. Фактор инициации IF3, соединяясь с рибосомой 30S, предотвращает объединение рибосомальных субъединиц, что обеспечивает в свою очередь фиксацию иРНК на субъединице 30S. В присутствии факторов IF1, IF2 и ГТФ N-формилметионил-тРНК образует комплекс инициации. N-Формилметионил-тРНКFмет обладает структурой, позволяющей ей фиксироваться на пептидильном центре субъединицы 50S. К этому комплексу присоединяется 50S субъединица, образуя функциональную рибосому 70S. Присоединение 50S субъединицы сопровождается освобождением факторов инициации и гидролизом ГТФ на пептидильном центре субъединицы 50S (сайт Р), оставляя свободным аминоацильный центр (сайт А), к которому присоединяется аминоацил-тРНК с последующим образованием пептидной связи:
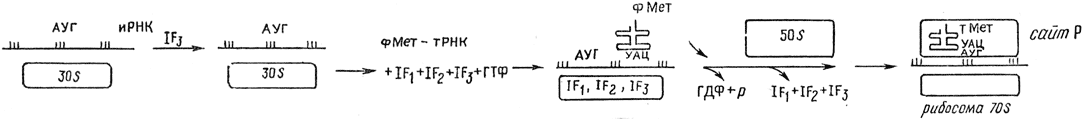
3. Элонгация включает фиксацию аминоацил-тРНК, образование пептидной связи и транслокацию.
В процессе фиксации аминоацил-тРНК, приносящая в полипептидную цепь аминокислоту № 2, прикрепляется к аминоацильному центру (А) рибосомы и встраивается на свое место благодаря антикодону и комплементарному ко-дону на тРНК. Для фиксации необходимо присутствие ГТФ и специфического белка - фактора элонгации EF - Т, который состоит из двух субъединиц, различающихся по своей термочувствительности (EF - Ts - устойчивая - stable и EF - Тu - неустойчивая - unstable). Комплекс EF - Тu - ГТФ, соединяясь с аминоацил-тРНК, позволяет ей занять аминоацильный центр.
Одновременно происходит гидролиз ГТФ, и освобождающийся ГДФ покидает рибосому в виде комплекса EF - Тu - ГДФ. Необходимо отметить, что фактор EF - Тu не способен соединяться с N-формилметионил-тРНКFмет. Следовательно, инициаторная тРНК не может присоединяться к кодону АУГ, кодирующему метионин внутри полипептидной цепи.
Между N-формилметионин-тРНКFмет и аминоацил-тРНК, находящимися в пептидильном (Р) и аминоацильном (А) центрах соответственно, образуется пептидная связь (аминогруппа аминоацил-тРНК и карбоксильная группа N-формилметионил-тРНК). Эта реакция контролируется пептидилтрансферазой - ферментом, локализованным в 50S частице. Она приводит к образованию дипептидил-тРНК. тРНК, освободившись от N-формилметионина, остается прикрепленной к пептидильному (Р) центру. Описанный процесс повторяется в каждом цикле" элонгации:
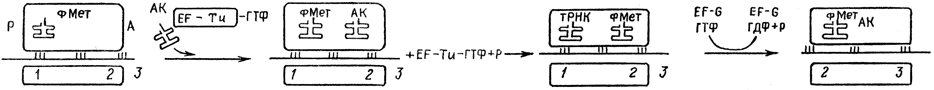
При транслокации после образования пептидной связи пептидил-тРНК фиксируется на аминоацильном центре (А). Присоединение следующей аминокислоты будет возможно только после перехода этой пептидил-тРНК в пептидильный центр (Р). Этот процесс транслокации требует присутствия фактора элонгации EF - G и ГТФ, который, гидролизуясь до ГДФ и Pi, и обеспечивает выделение энергии для передвижения рибосом вдоль иРНК. При каждом акте транслокации освобождается аминоацильный центр, что позволяет присоединить следующую аминокислоту.
Прекращение трансляции (роста полипептидной цепи) обеспечивается наличием сигналов терминации. Сигнал терминации представляет собой особый нонсенс-кодон, так как не существует ни одного антикодона, который бы к нему присоединился (УАГ, УАА, УГА). Для терминации обычно используются несколько нонсенс-кодонов, разделенных обычными кодонами. Это предотвращает действие мутаций, так как один терминирующий кодон может легко мутировать в смысловой кодон, что привело бы к синтезу двух различных соединенных пептидных цепей. В терминации участвуют факторы "освобождения" (RF от англ. releasing factors): RF1, RF2, RF3. После фиксации фактора освобождения на рибосоме полипептидил-тРНК переходит из аминоацильного центра А в пептидильный Р. Затем происходит гидролиз связи на С-конце полипептида, соединявшей его с последней тРНК. Этот гидролиз катализируется пептидилтрансферазой, чья специфичность модифицируется в присутствии фактора освобождения. Когда полипептидная цепь освобождается, тРНК покидает рибосому.
Механизм инициации потерь может начать новый цикл синтеза полипептидной цепи:
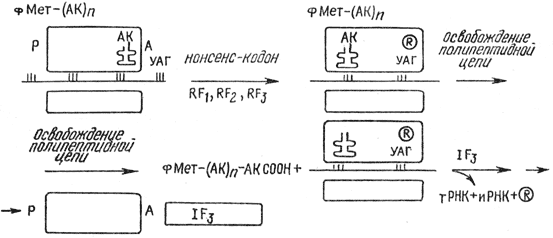
Освобожденная полипептидная цепь претерпевает определенные модификации и приобретает активную конфигурацию: 1) формильная группа на N-конце отсоединяется под действием деформилазы. Многие белки впоследствии теряют на N-конце ряд аминокислот под действием аминопептидаз; 2) между остатками цистеина образуются дисульфидные мостики; 3) некоторые аминокислоты модифицируются, например в коллагене часть остатков пролина или лизина подвергаются гидроксилированию.
Особенностью белкового синтеза эукариот является то, что у них в качестве инициаторной тРНК служит особая метионил-тРНК (Мет-тРНКF). Остаток метионила никогда не формилируется. Имеется также тРНК, включающая метионин внутри цепи (Мет-тРНКМ). На малой субъединице рибосомы первой прикрепляется инициаторная аминоацил-тРНК, а не иРНК. В момент инициации участвует метил-7-гуанозин, расположенный на 5′-конце иРНК и узнающий фактор инициации IF3. Вместо трех факторов освобождения известен только один.
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'