
4. Мутанты и метаболизм
Важная роль микроорганизмов в исследованиях, рассмотренных в предыдущих главах, обусловлена теми их свойствами, которые делают микроорганизмы особенно удобными объектами для генетических и биохимических экспериментов. С некоторыми из этих свойств мы уже познакомились в гл. 1. Однако здесь все же нам кажется целесообразным обобщить их.
1. Подавляющая часть микроорганизмов на протяжении большей части жизненного цикла гаплоидна. А из этого следует, что при работе с ними не возникает никаких осложнений, обусловленных маскированием рецессивных аллелей, благодаря чему генотип и фенотип у них эквивалентны, если только не наблюдается эпистаз или супрессия. Кроме того, в силу гаплоидности все скрещивания эквивалентны проверочному скрещиванию у дрозофилы, и их, следовательно, можно сразу интерпретировать. Правда, из-за гаплоидности возникают кое-какие проблемы в тех случаях, когда бывает необходимо исследовать взаимодействия между различными генетическими нарушениями на общем метаболическом фоне. Однако известны генетические манипуляции, которые позволяют достичь этого в большинстве систем.
2. По сравнению со многими высшими организмами, например человеком и мышью, микроорганизмы имеют короткое время генерации. Опыты по генетическому скрещиванию фага Т4 можно провести за один день и проанализировать через 24 ч. Аналогичный эксперимент на E. coli займет двое суток, на дрожжах - неделю и на нейроспоре - 10 дней. Напомним, что эксперимент по скрещиванию на дрозофиле можно провести за 10 - 7 Дней, а время генерации нематоды Caenorhabditis elegans, все более популярного организма в генетике Развития, составляет всего 3,5 дня. Так что в этом отношении преимущество микробов не так очевидно.
3. Большинство микроорганизмов, которые используются в генетических исследованиях, можно выращивать на синтетических средах, что дает возможность выявлять и изучать мутантов, у которых нарушен синтез определенных конечных продуктов метаболизма или способность использовать различные источники углерода и азота. Это свойство микроорганизмов может быть полезным только в том случае, если дефект, наблюдаемый у мутанта, можно компенсировать, изменяя состав среды. Здесь мы опять-таки считаем нужным напомнить, что дрозофилу можно выращивать на среде с известным составом и что были получены и изучены мутанты дрозофилы, у которых нарушены некоторые пути биосинтеза.
4. При выращивании микроорганизмов можно получать большие популяции, однородные в генетическом и биохимическом отношении. Они, конечно, прекрасно подходят для генетических исследований. 1 кг печени голубя содержит множество типов клеток с различными метаболическими свойствами, тогда как 1 кг дрожжей в этом отношении совершенно однороден. Такие крупные популяции облегчают выявление редких мутаций и рекомбинаций. Можно получить суспензию фага, содержащую 1011 частиц в 1 мл, а культуры E. coli и дрожжей после выращивания в течение ночи дают 108 - 109 клеток в 1 мл. Это значит, что можно обнаружить события, которые происходят с частотой 10-4 - 10-8, при условии, что имеется подходящий метод отбора. Видимо, именно в этом отношении микроорганизмы имеют большое превосходство перед дрозофилой, которая дает всего несколько сотен мух в сосуде объемом 250 мл.
Однако следует напомнить, что все-таки наиболее интенсивно исследуемый организм - человек и что информация, которую удается получить при изучении микроорганизмов, необходима в самом широком смысле лишь постольку, поскольку помогает нам познавать нас самих. Некоторыми из перечисленных выше свойств обладают клетки высших организмов, в том числе человека, при выращивании в культуре.
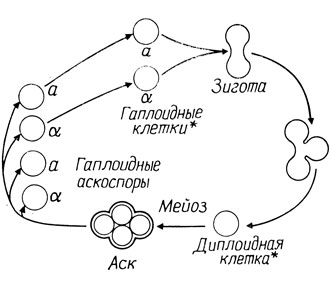
Рис. 4.1. Жизненный цикл дрожжей Saccharomyces cerevisiae. Оба типа клеток, отмеченных звездочкой (гаплоидные и диплоидные клетки), могут делиться вегетативно
Один из важнейших подходов в биохимической генетике - индукция, выделение и изучение мутантов. Дрожжи Saccharomyces cerevisiae - подходящий организм для того, чтобы описать принципы и методы изучения мутантов, так как они сочетают обычный для высших организмов жизненный цикл и рост в виде отдельных клеток, подобно бактериям. Дрожжи можно выращивать на синтетических и искусственных средах, причем последние могут содержать минеральные соли, источник азота, источник углерода (глюкозу) и витамины группы В. Дрожжи - одноклеточный неподвижный организм. Они образуют на твердой среде отдельные колонии, которые можно переносить на другую чашку и поддерживать с помощью обычного метода отпечатков. Жизненный цикл дрожжей показан на рис. 4.1. Гаплоидные клетки, относящиеся к различным типам спаривания, а и а, сливаются и образуют зиготу, от которой отпочковываются диплоидные клетки. Их можно выделить с помощью микроманипулятора или с помощью селективных сред, если спаривающиеся гаплоидные штаммы имеют комплементарные ауксотрофные потребности, затем получить из них колонии и изучать доминантность и рецессивность мутаций, которые несли исходные клетки. Мейоз диплоидных клеток индуцируется при переносе клеток на бедную среду. Это приводит к образованию четырех гаплоидных аскоспор, заключенных в общую сумку (аск). Разрушив стенки аска глюканазой, можно высвободить из аска споры, затем вырастить отдельные колонии и проследить за сегрегацией генетических маркеров.
Способ получения мутантов, неспособных расти на искусственной среде, схематически показан на рис. 4.2.
Частота появления ауксотрофных мутантов после мутагенного воздействия обычно низка: доза ультрафиолетового излучения, достаточная, чтобы убить 99% клеток в суспензии, дает примерно одного мутанта на 100 выживших клеток. При меньших дозах выживает больше клеток, но среди них оказывается меньше мутантов. Такие алкилирующие соединения, как ЭМС и НГ, дают примерно 1% мутантов при выживании ~50% клеток; во многих лабораториях их предпочитают использовать в качестве мутагенов.
Выход мутантов можно увеличить, если ввести отбор, направленный против немутировавших клеток, чаще всего прототрофов. Первым был предложен метод, основанный на применении пенициллина; он используется в настоящее время с наибольшим успехом. Пенициллин препятствует синтезу клеточной стенки у бактерий и воздействует только на активно делящиеся клетки. Если клетки, выжившие после мутагенного воздействия, инкубировать в искусственной среде, прототрофы начнут расти и делиться. При добавлении пенициллина большинство из них погибнет. Затем антибиотик удаляют путем разведения культуры или при помощи пенициллиназы, и выжившие ауксотрофы высевают на чашки с синтетической средой. Применение этого метода увеличивает долю мутантов до 10 - 20% высеянных на чашки клеток. Подобные методы существуют и для одноклеточных и нитчатых грибов.
Накопив большое число мутантов, исследователь может получить ряд мутантов, нуждающихся в одной аминокислоте, например аргинине. Посмотрим, что бы мы хотели узнать о такой группе мутантов и каким образом мы можем подойти к получению этой информации.
С точки зрения генетики следовало бы удостовериться, что все мутанты возникли в результате однократного мутационного события. Хотелось бы выяснить, сколько генов затрагивается мутацией, являются ли они доминантными или рецессивными и сцеплены ли друг с другом. Биохимик заинтересуется, почему мутанты нуждаются в аргинине и какие этапы биосинтеза аргинина нарушены, и захочет исследовать свойства измененных ферментов, синтезирующихся в мутантных клетках.
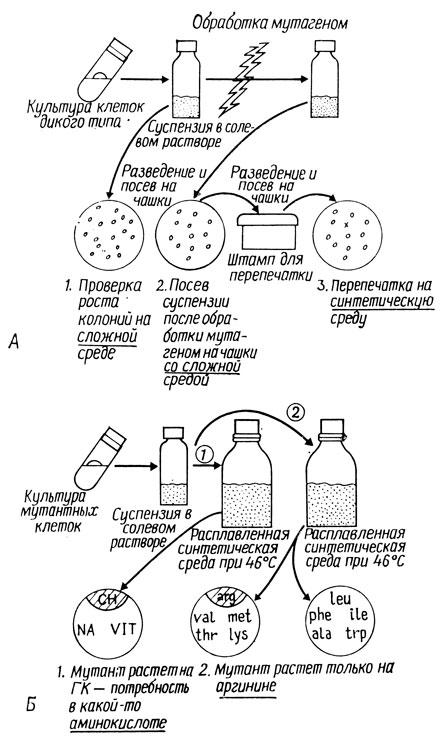
Рис. 4.2. Выделение и изучение ауксотрофных мутантов. А - индукция мутантов. 1. Подсчет колоний и вычисление количества клеток в исходной суспензии. 2. Подсчет колоний и определение доли выживших клеток после мутагенной обработки. 3. Проверка колоний и выделение ауксотрофов на чашке (отмечено крестиком). Б - изучение мутантов. ГК - гидролизат казеина, NA - гидролизат нуклеиновых кислот, VIT - смесь витаминов
Методы генетического анализа зависят, конечно, прежде всего от объекта. Однако принципы анализа и выводы, которые можно сделать из полученных результатов, носят достаточно общий характер; поэтому мы продолжим изложение на примере дрожжей, обращаясь по мере необходимости и к другим организмам.
Первое, что следует сделать, - это скрестить всех мутантов arg- со штаммом arg+, относящимся к другому типу спаривания, клонировать диплоидные клетки и проверить у них способность расти на искусственной среде. Если диплоид arg+/arg- прототрофен, можно сделать вывод, что мутация рецессивная. Именно таков будет результат опыта для большинства ауксотрофов и вообще для большинства мутантов. Затем диплоидные клетки спорулируют и у образующихся аскоспор проверяют потребность в аргинине. Если мутация затрагивает один ген, то в одном аске будут 2 споры arg+ и 2 споры arg-. После культивирования спор мы сможем отобрать мутантов, относящихся к обоим типам спаривания, а arg- и α arg-, и использовать их для выяснения вопроса о том, сколько генов затрагивают все отобранные мутации arg-.
Тест на функциональную аллельность обычно называют цис-транс-тестом. Он основан на следующих закономерностях.
1. Для отбора мутантов обычно используют отсутствие у них способности выполнять какую-либо функцию - расти на искусственной среде, регулировать синтез какого-либо метаболита, или (в случае фагов) расти на определенном штамме бактерии-хозяина. По этим признакам можно судить, что у таких мутантов утрачены какие-то специфические функции; об этом свидетельствует и тот факт, что данные мутации относятся к рецессивным (рис. 4.3, а и б).
2. Если два мутантных генома, утративших одну и ту же функцию, поместить в общую цитоплазму, то конечный фенотип культуры будет мутантным (рис. 4.3, в).
3. Если в общую цитоплазму ввести два мутантных генома, у которых нарушены разные функции, то фенотип культуры будет диким (рис. 4.3, г).
Положения 2 и 3 описывают транс-конфигурацию мутаций в цис-транс-тесте. При цис-конфигурации культура будет иметь дикий фенотип (рис. 4.3, д). На практике эту конфигурацию редко проверяют, так как для этого необходимо получить генотип двойного мутанта. Этот тест также называют тестом на комплементацию; о мутациях, которые дают положительный результат (дикий фенотип), говорят, что они комплементируют друг друга.
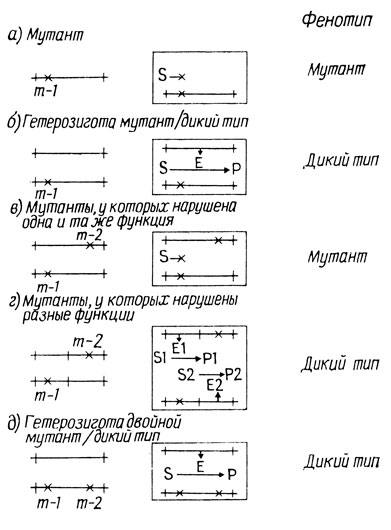
Рис. 4.3. Цис-транс-тест для выявления функциональной аллельности. S - субстрат, Р - продукт, Е - фермент
Применение цис-транс-теста позволяет определить генетическую функциональную единицу, цистрон. Этот термин был предложен Бензером в 1957 г. Бензер обнаружил, что мутации rll фага Т4, хотя они фенотипически идентичны и локализуются в очень маленькой области карты сцепления фага, можно разделить на две функциональные группы, rllA и rllB. Пары мутантов, относящихся к одной группе, rllA или rllB, не способны расти на E. coli К 12. Однако любой мутант, относящийся к rllA, в сочетании с любым мутантом rllB может расти на этом штамме и лизировать его. В потомстве после лизиса обнаруживаются только фаги, имеющие родительский генотип. Бензер сделал вывод, что у мутантов этих двух групп нарушены различные функции. Он решил, что гены rllA и rllB представляют разные функциональные единицы и предложил {называть их цистронами, так как они были выявлены с помощью цис-транс-теста.
Цис-транс-тест можно применять при изучении различных объектов, перечисленных в табл. 4.1.
Простейшая задача при работе с дрожжами и высшими организмами - получение двойной диплоидной гетерозиготы (m - 1+/+ m - 2). Смешанное заражение в системе фаг-бактерия в общем аналогично диплоидному состоянию с точки зрения выражения функции в фенотипе. При изучении нитчатых грибов и соматических клеток млекопитающих или растений, которые можно подвергнуть слиянию in vitro, используют гетерокарионы. В этом случае необходима некоторая осторожность в интерпретации результатов, так как тестируемые мутации локализуются в разных ядрах и взаимодействие между продуктами генов может быть ограничено. При работе с бактериями используют сексдукцию и абортивную трансдукцию. В первом случае один из тестируемых аллелей находится в составе фактора F1, а другой - в бактериальной хромосоме. При абортивной трансдукции фаги выращивают на одном из мутантов, и клетки второго мутанта обрабатывают суспензией фага. Если мутации не аллельны, то при трансдукции появятся нормальные прототрофные рекомбинанты, и в результате абортивной трансдукции возникнут микроколонии, в которых только одна клетка является прототрофной. Если же мутации аллельны, то рекомбинация приведет к возникновению клеток дикого типа, но не даст продуктов абортивной трансдукции. Таким образом, проявление абортивной трансдукции указывает на то, что мутации не аллельны.
Таблица 4.1
Генетические системы, применяемые в цис-транс-тесте
| Организмы | Генетическая система |
| Животные, растения и некоторые грибы, например дрожжи Neurospora, Aspergillus1 и нитчатые грибы | Диплоиды (m - 1+/+m - 2) |
| Гетерокарионы (m - l+) (+m - 2) | |
| Бактерии | Сексдукция (F'm - 1+/+m - 2) |
| Абортивная трансдукция (m - 1+2/+m - 2) | |
| Бактериофаги | Смешанная инфекция (m - 1+/+m - 2) |
1(У этих видов имеются и диплоидные формы, и гетерокарионы.)
2(Этот фрагмент ДНК не реплицируется.)
Как правило, термины "ген" и "цистрон" синонимичны, и их можно использовать как взаимозаменяемые. В некоторых случаях предпочтительно употреблять термин, который не имеет строго определенного экспериментального смысла; тогда некоторые генетики предпочитают говорить "ген". Разумеется, бывают случаи, когда более подходящим является термин "цистрон".
Применение цис-транс-теста к arg--мутациям позволяет отнести их к определенному набору генов. Следующий этап - анализ сцепления этих генов. Подробное описание анализа сцепления можно найти в любом из общих курсов генетики, перечисленных в прилагаемом списке литературы (в конце книги). Генетический анализ завершается картированием генов. Теперь можно перейти к биохимическим аспектам исследования.
В изучении биохимической природы мутаций можно выделить три уровня;
а) проверка способности мутантов использовать известные или предполагаемые промежуточные продукты метаболического пути синтеза аргинина,
б) изучение накопления или выделения промежуточных продуктов биосинтетического пути в мутантных клетках,
в) точная идентификация нарушения метаболизма путем прямого исследования ферментов биосинтеза.
Теперь рассмотрим другие организмы - arg--мутанты Neurospora. С помощью генетического анализа такого типа, который был описан выше, были идентифицированы гены от arg-1 до arg-6, arg-10 и arg-12. Мутанты по этим генам могут расти на соединениях, отличных от аргинина. Соединения, необходимые для роста мутантов, перечислены в табл. 4.2. Все обычные мутанты растут в среде, содержащей аргинин, но различаются по своей способности расти на орнитине и цитруллине. Обобщая результаты, полученные при определении потребности в различных соединениях, можно предположить наличие следующей последовательности метаболических реакций:
Орнитин → Цитруллин → Аргинин
Таблица 4.2
Соединения, необходимые для arg--мутантов Neurospora crassa
| Мутантный ген | Вещество, обеспечивающее рост |
| arg-1, arg-10 | Аргинин |
| arg-2, arg-3, arg-12 | Цитруллин, аргинин |
| arg-4. arg-5, arg-6 | Орнитин, цитруллин, аргинин |
Однако число генов, определяющих потребность в каждом из этих веществ, указывает на то, что истинная последовательность метаболических реакций гораздо сложнее.
Следующий шаг - выращивание мутантов при низкой концентрации аргинина с тем, чтобы дерепрессировать активность ферментов биосинтетического пути, и последующий анализ промежуточных продуктов, накапливающихся в бесклеточных экстрактах. Этот эксперимент показывает, что мутанты arg-1 и arg-10, которые растут только в присутствии аргинина, различаются тем, что в arg-1 накапливается цитруллин, а в arg-10 - аргининосукцинат. Активность этих двух генов должна проявляться в следующей последовательности:
Цитруллин → Аргининосукцинат → Аргинин
Наконец, последний этап биохимического анализа - определение активности отдельных ферментов биосинтетического пути. Зависимость ген- фермент на завершающих стадиях синтеза аргинина у Neurospora показана на рис. 4.4. В этих реакциях участвуют пять из восьми генов. Остальные три гена отвечают за реакции синтеза орнитина из глутаминовой кислоты.
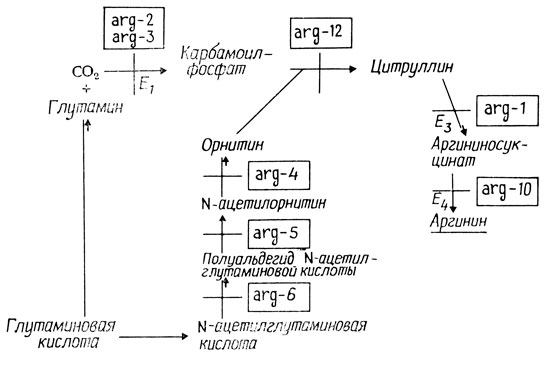
Рис. 4.4. Биохимические нарушения биосинтеза аргинина у Neurospora crassa. E1 - карбамоилфосфат-синтетаза, Е2 - орнитин-транс-карбамилаза, Е3 - аргининосукцинат-синтетаза, Е4 - аргининосукциназа
Исследование такого рода позволяет установить генетическую и биохимическую организацию того или иного метаболического пути. Анализ по такой схеме был применен на практике для расшифровки множества метаболических путей и сохраняет важное значение в настоящее время.
Имея в своем распоряжении традиционный метод анализа, мы можем теперь рассмотреть некоторые осложнения, возникающие при изучении зависимости ген - фермент. Осложнения эти бывают вызваны тем, что в ходе исследования в конце концов в каждом гене оказывается локализовано много аллельных мутаций. Прямой генетический подход сводится к тому, чтобы картировать эти аллельные мутации в пределах гена. В основе анализа тонкой структуры гена лежат скрещивания между различными мутантами с последующим определением частот рекомбинации по частотам возникновения прототрофных рекомбинантов. В некоторых системах оказалось возможным определить аминокислотные последовательности соответствующих ферментов мутантов и штаммов дикого типа. Наиболее примечательный пример такого рода - работа Яновского и его коллег по изучению триптофан-синтазы E. coli. Этот фермент состоит из неидентичных субъединиц А и В, которые кодируются прилегающими друг к другу генами. Активный фермент состоит из двух субъединиц А и двух субъединиц В и катализирует завершающую реакцию синтеза триптофана. Мутации, влияющие на активность субъединиц А, были картированы и расположены в строго определенной линейной последовательности. Эта субъединица состоит из 267 аминокислот; их последовательность была определена в белке из клеток дикого типа и ряда мутантов. Соответствие между генетической картой и положением аминокислотных замен при некоторых мутациях показано на рис. 4.5. Легко убедиться, что эти две последовательности коллинеарны. Обратите внимание, что в двух случаях мутации, затронув основания в одном и том же кодоне, привели к различным аминокислотным заменам, например мутации 23 и 46 вызвали замену аминокислоты 210 (глицин) в белке дикого типа на аргинин и глутамин соответственно.

Рис. 4.5. Коллинеарность генетической карты и аминокислотной последовательности А-субъединицы триптофан-синтазы Е. coli
Построение такой карты основано на попарном скрещивании во всевозможных сочетаниях большинства мутантов, мутации которых локализованы в данном гене. При проверке способности таких гетероаллельных комбинаций к росту на синтетической среде может оказаться, что некоторые сочетания аллельных мутаций обеспечивают рост мутантных клеток на такой среде, хотя эти клетки растут и хуже, чем клетки дикого типа. Это явление межаллельной, или внутрицистронной, комплементации открыли Финчем и Пейтман в 1957 г. Они обнаружили, что некоторые мутанты Neurospora, лишенные активности фермента NADP-зависимой глутаматдегидрогеназы, образуют гетерокарионы, которые хотя и плохо, но растут на синтетической среде. Сами мутанты были ауксотрофными. Другие мутанты по этому гену не обнаруживали такой способности ни при скрещивании друг с другом, ни в сочетании с мутантами первого типа. В то время казалось, что это обстоятельство и аналогичные данные, полученные на других системах, противоречат определению цистрона как основной функциональной единицы генома. Однако вскоре стало ясно, что логичнее объяснить это явление тем, что ферменты, которые кодируются такими генами, состоят из двух или более идентичных субъединиц. Для того чтобы произошла межаллельная комплементация, субъединицы двух мутантов с различными дефектами должны каким-то образом взаимно компенсировать эти дефекты так, чтобы мультимер, который они образуют, обладал частичной активностью фермента дикого типа. Правильность этой гипотезы была подтверждена экспериментами, доказавшими возможность межаллель- ной комплементации in vitro.
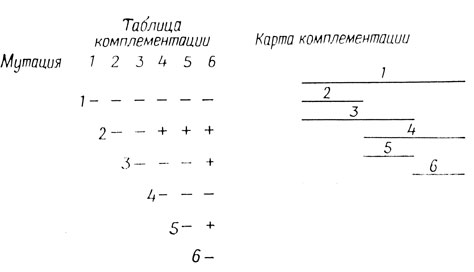
Рис. 4.6. Сводка полученных данных и карта комплементации
Если для каждого данного гена имеется большое количество мутантов, проявляющих межаллельную комплементацию, то положительные и отрицательные результаты можно свести в единую схему и с ее помощью построить карту комплементации. На таких картах мутации, неспособные к комплементации, представлены перекрывающимися отрезками, а отрезки, соответствующие комплементирующим мутациям, не перекрываются. Несложная схема такого рода и карта шести мутантов приведена на рис. 4.6. Межаллельная комплементация - явление, весьма распространенное, и, следовательно, можно думать, что мультимерные ферменты, состоящие из идентичных субъединиц, - скорее правило, чем исключение.
До сих пор мы рассматривали ауксотрофные мутанты, которые можно обнаружить по отсутствию у них способности расти на синтетической среде. У таких мутантов часто можно с легкостью определить природу метаболического нарушения и показать, что оно обусловлено утратой или изменением активности какого-либо фермента анаболизма или катаболизма. Существует, однако, множество клеточных функций, таких, как синтез ДНК, транскрипция и трансляция, при которых любая мутация, вызывающая утрату функции, оказывается летальной. Как же тогда изучать генетическую природу этих необходимых функций?
Выход состоит в использовании условных мутаций. В гл. 3 мы уже видели, как с помощью температурочувствительных (ts) мутаций было установлено, что для репликации хромосомной ДНК E. coli необходима ДНК-полимераза III. Теоретически любой продукт гена, будь то белок или нуклеиновая кислота, может быть изменен в результате мутации таким образом, что он будет выполнять свою функцию только при определенных условиях и не будет работать при других условиях. Из всех параметров окружающей среды легче всего, по-видимому, изменить температуру. Большинство исследователей так и поступают. Температурочувствительные мутанты дрожжей можно получить путем мутагенной обработки клеточной суспензии с последующим посевом на искусственную среду при 23°С. После инкубации в течение ночи колонии перепечатывают на свежие чашки с искусственной средой и инкубируют их при 36°С. Колонии, которые растут при 23°С, но не растут при 36°С предположительно являются ts-мутантами. Затем с помощью подходящих методов исследования можно определить природу нарушений у этих мутантов.
Один из самых замечательных примеров использования ts-мутантов - это исследование морфогенеза фага Т4, которое провели Эдгар и его коллеги. Они искали мутантов фага, которые могут заражать и лизировать E. coli при 25°С, но не при 42°С. Таким образом, они надеялись получить мутации большинства, а может быть и всех генов фага. Выделив около 400 ts-мутантов, они подвергли их генетическому и биохимическому анализу. Был проведен цис-транс-тест на функциональный аллелизм. Бактерии-хозяева заражали мутантными фагами попарно при 42°С. Если в результате происходил лизис клеток и образование потомства, способного к размножению при 23°С, то мутации относили к различным генам. Таким образом, было идентифицировано 60 генов, и они были картированы относительно стандартных локусов кольцевого фагового генома, таких, как ген rll.
Параллельно этим исследованиям ts-мутантов Эпстайн исследовал амбер-мутанты фага Т4 и штаммы E. coli, которые различались присутствием или отсутствием амбер-супрессора. Этим двум группам удалось идентифицировать в общей сложности около 65 генов.
Функции этих генов изучали с помощью различных подходов. Для проверки синтеза макромолекул (ДНК и белка), а также присутствия фагоспецифических компонентов клетки инфицировали фагом при рестрикти- рующей (запрещающей) температуре. Еще один способ исследования - приготовление антисывороток к таким компонентам фага, как фибриллы отростка или белки головки, и определение способности системы фаг - бактерия к синтезу молекул, осаждаемых антисывороткой. Третий подход - электронная микроскопия зараженных клеток или их лизатов для обнаружения компонентов фага. Эксперименты in vitro показали, что сборка фага идет в определенной последовательности, причем некоторые этапы сборки протекают спонтанно, а не под действием ферментов. Так, при смешивании готовых головок фага и отростков они ассоциируют с образованием инфекционного фага. Гены, определяющие синтез фаговых компонентов, участвующих в морфогенезе, расположены примерно в такой же последовательности, в какой происходит сборка. Гены, определяющие ранние функции, такие, как синтез ДНК, располагаются в одном участке карты, а те, что кодируют компоненты головки и отростка, картируются в других, вполне определенных участках. Расположение групп генов, отвечающих за различные функции, показано на рис. 4.7.
Температурочувствительные и другие условные мутации широко используются и при изучении других организмов. Они применялись при изучении генетического контроля клеточного цикла у дрожжей и оказали ценную услугу при расшифровке генетической структуры ряда вирусов животных, например вируса SV-40.
Ауксотрофные и условные мутации - лишь две из множества разновидностей мутаций, которые можно получить с помощью соответствующих методов. Устойчивость к антибиотикам и антиметаболитам представляет не только чисто научный интерес. Генетическое и биохимическое изучение устойчивых мутантов часто позволяло лучше понять механизм действия этих соединений и открывало новые перспективы в исследовании некоторых аспектов метаболизма. Например, устойчивость к аналогам аминокислот использовалась для изучения генетической регуляции поглощения аминокислот. Устойчивость к антибиотикам, нарушающим синтез макромолекул, оказалась полезной при исследовании ферментативных систем метаболизма нуклеиновых кислот. В основе анализа всех таких мутаций лежат подходы, которые мы обсуждали в настоящей главе.
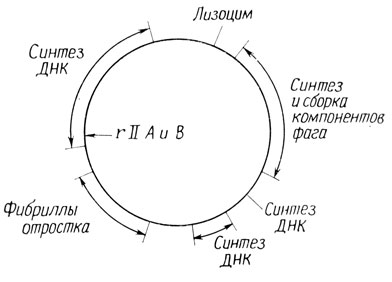
Рис. 4.7. Морфогенетическая карта бактериофага Т4
Не все метаболические процессы можно подвергнуть такому генетическому анализу, в основе которого лежат законы Менделя. Митохондрии и хлоропласты, клеточные органеллы, участвующие в дыхании и фотосинтезе соответственно, содержат ДНК, которая несет специфичную для органелл генетическую информацию. Эта ДНК реплицируется автономно, а органеллы обоих типов обычно наследуются от родителя женского пола, что усложняет генетический анализ. Работа по биогенезу митохондрий была основана, в первую очередь на том, что дрожжи являются факультативными анаэробами. Мутанты, у которых не функционируют митохондрии, можно выращивать на каком-либо расщепляемом источнике углерода, например на глюкозе. Мутантов с нарушенным дыханием называют petite (от франц. petite - маленькая), так как они образуют более мелкие колонии, чем обычные клетки. Анализ таких мутаций позволил установить автономность митохондриального генома. Дальнейшее исследование мутантов, устойчивых к антибиотикам, нарушающим синтез белка в митохондриях, показало, что митохондриальный геном кодирует, возможно, 20 видов тРНК, два вида рибосомной РНК и некоторые субъединицы АТРазы, цитохромоксидазы и комплекса цитохромов в - с1.
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'