
5. Генетическая регуляция метаболизма
Многие микроорганизмы проявляют поразительную фенотипическую пластичность. Они могут расти при различных физиологических условиях и использовать в качестве источников углерода и азота самые разнообразные соединения. Природа этой приспособляемости была предметом споров до 50-х годов, так как активность ферментов, необходимых для усвоения определенного субстрата, в большинстве случаев не обнаруживалась, если организм выращивали на другом субстрате. Например, если E. coli выращивать на лактозе в качестве единственного источника углерода, то бактерии синтезируют столько фермента β-галактозидазы, что на его долю приходится до 6% всего клеточного белка. В клетках же культуры, выращенной на глюкозе, наоборот, активность фермента обнаруживается с трудом.
Это явление синтеза фермента в ответ на присутствие в среде соответствующего субстрата было названо адаптацией. В течение многих лет считалось, что бактерии, которые проявляют, возможно, наибольшую фенотипическую пластичность из всех организмов, можно заставить расти на различных субстратах, подвергая их продолжительному воздействию этих субстратов. С развитием генетики бактерий стало ясно, что бактерии подчиняются тем же законам, что и другие организмы: генетическая вариабельность может возникнуть только в результате мутации или обмена генетической информации, как было описано в гл. 1. Концепция "воспитания" предполагала, что целая популяция организмов может приобрести новые метаболические возможности, т. е. в ней могут произойти массовые генетические изменения; это представление, конечно, несовместимо с основными законами генетики. Новые ферменты должны кодироваться новыми генами, и невозможно представить себе, что новые гены могут возникнуть просто под действием изменений в окружающей среде. И все-таки явление адаптации было экспериментальным фактом и должно было быть объяснено в рамках генетических представлений.
Синтез белка требует энергии, и производство ферментов для субстратов, которые не всегда присутствуют в среде, вызывает пустую трату энергии и важных метаболитов. Очевидно, организму невыгодно синтезировать непрерывно все свои ферменты. С телеологической точки зрения организму необходима такая система регуляции, которая позволяла бы, чтобы гены, кодирующие такие ферменты, не транскрибировались или их мРНК не транслировались бы, если в среде нет соответствующего субстрата. Таким образом, мы надеемся обнаружить два основных класса генов:
а) конститутивные гены, продукты которых синтезируются независимо от состава окружающей среды,
б) индуцибельные или репрессируемые гены, продукты которых синтезируются только при определенных условиях окружающей среды.
Далее мы займемся генами, относящимися ко второй группе.
Если мы рассмотрим какой-либо индуцибельный фермент, например β-галактозидазу, то придем к выводу, что соответствующая система регуляции должна, по всей вероятности, состоять из нескольких компонентов. Должен существовать структурный ген, кодирующий аминокислотную последовательность фермента; клетка должна обладать каким-то средством для обнаружения во внутри- или внеклеточной среде субстрата лактозы; необходим какой-то механизм для запуска транскрипции и трансляции, когда субстрат обнаружен. Исследования, в результате которых было установлено существование регуляторных механизмов, удовлетворяющих этим требованиям, были проведены Моно, Жакобом и их коллегами в Пастеровском институте в Париже.
Эти исследователи занялись ферментами E. coli, участвующими в использовании лактозы. Данный дисахарид гидролизуется β-галактозидазой с образованием глюкозы и галактозы. Фермент активен и в отношении других β-галактозидов, поэтому исследователи начали с изучения специфичности процесса адаптации под действием соединений, отличных от лактозы. Самое замечательное, что они обнаружили некоторые аналоги лактозы, которые, будучи способными индуцировать синтез фермента, не были его субстратами; в то же время были обнаружены и такие соединения, которые могли служить субстратами β-галактозидазы, не влияя при этом на ее синтез. Жакоб и Моно сделали вывод, что это явление нельзя объяснить существованием механизма адаптации: нелогично считать, что организм приспосабливается к чему-то, чего он не может использовать. Вместо этого они предложили термин индукция фермента, а соединения, которые стимулируют синтез фермента, назвали индукторами. Лактоза является одновременно и индуктором, и субстратом для ???-галактозидазы. Изопропилтиогалактозид (ИПТГ), наоборот, весьма эффективный индуктор, но не активен в качестве субстрата, тогда как о-нитрофенилгалактозид (ОНФГ) - превосходный субстрат, который не индуцирует синтеза фермента. Из этого можно сделать вывод, что β-галактозидаза не является участком узнавания для индуктора; эту функцию должны выполнять какие-то другие молекулы. Гидролиз ОНФГ приводит к образованию эквивалентного количества желтого хромофора о-нитрофенола и используется для определения активности фермента. Структурные формулы лактозы, ИПТГ и ОНФГ приведены на рис. 5.1.
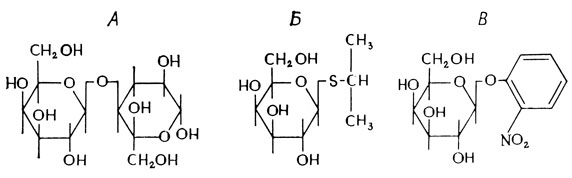
Рис. 5.1. Структурные формулы лактозы (А), ИПТГ (Б) и ОНФГ (В)
Существование таких нерасщепляемых индукторов, как ИПТГ, а также субстрата, не вызывающего индукции - ОНФГ, позволяет исследовать кинетику индукции. Клетки выращивают на неиндуцирующем субстрате, например на глицерине, затем индуцируют с помощью ИПТГ, отбирают пробы через определенные промежутки времени, лизируют клетки каплей толуола и определяют активность фермента, добавляя в пробы ОНФГ. Таким образом, можно определить кинетику синтеза фермента. В этой системе скорость роста не зависит от активности β-галактозидазы и остается постоянной. Синтез фермента начинается вскоре после добавления ИПТГ и идет с постоянной скоростью, так что активность в пересчете на единицу массы клеток не изменяется. Удаление индуктора приводит к немедленному прекращению синтеза фермента. Эти свойства системы проиллюстрированы на рис. 5.2.
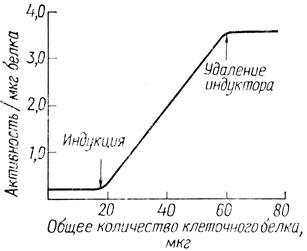
Рис. 5.2. Индукция β-галактозидазы
Сама лактоза не является ни хорошим индуктором, ни хорошим субстратом для фермента; в действительности активным индуктором in vivo служит аллолактоза, изомер лактозы. Аллолактоза образуется из лактозы под действием тех нескольких молекул β-галактозидазы, которые присутствуют в неиндуцированных клетках. ИПТГ в качестве индуктора в 6 раз активнее лактозы, а ОНФГ гидролизуется в 10 раз быстрее. Таким образом, использование этих двух аналогов максимально увеличивает реакцию системы на изменение условий.
Мутанты, у которых нарушено использование глюкозы, обнаруживают следующим образом: после мутагенной обработки культуру высевают на индикаторную среду, содержащую лактозу, а также красители эозин и метиленовый синий (ЭМС). Колонии, которые могут расщеплять лактозу, окрашиваются красителями этой среды в красновато-зеленый цвет, а мутантные клетки не окрашиваются и образуют маленькие белые колонии. Мутанты, не расщепляющие лактозу, обозначают Lac-, их можно выделить и определить в них активность β-галактозидазы. При этом оказывается, что в большинстве колоний активность фермента не обнаруживается. Соответствующие мутации можно отнести к одному гену (z) - структурному гену β-галактозидазы. Некоторые мутанты Lac обладают активностью β-галактозидазы, но тем не менее не могут использовать экзогенную лактозу. Оказалось, что в таких клетках со скрытой способностью к расщеплению лактозы нарушен транспорт ???β-галактозидов в клетку, и в них отсутствует активность β-галактозидпермеазы. Эти мутации картируются в гене у, соседнем с геном г. Третий ген, а, кодирует фермент тиогалактозид-трансацетилазу. Данный фермент, по-видимому, не обязателен для метаболизма лактозы in vivo, но его активность регулируется вместе с β-галактозидазой и пермеазой. В бактериальном геноме эти три гена располагаются друг за другом в порядке z-y-a.
Еще один класс мутантов может синтезировать все три фермента в отсутствие индуктора. Такие конститутивные мутации были картированы в четвертом гене, i, который сцеплен с тремя другими генами следующим образом:
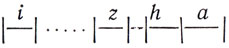
Считается, что у этих конститутивных мутантов нарушена функция гена i и соответственно их называют i--мутантами
Доминантность и рецессивность мутаций, нарушающих использование лактозы, исследовали с помощью F'-штаммов, диплоидных по лактозным генам. Активность фермента в индуцированных и неиндуцированных культурах этих частичных диплоидов и обычных мутантов приведена в табл. 5.1, а.
Таблица 5.1
Генотипы и активность ферментов лактозного оперона Escherichia coli
| Генотип | Активность β-галактозидазы1 | |
| в индуцированных клетках | В неиндуцированных клетках | |
| а) i+z+ | 100 | <0,1 |
| i+z- | 0,0 | 0,0 |
| i-z+ | 100 | 100 |
| i+z-/F'i-z+ | 240 | <1,0 |
| i-z+/F'i+z+ | 280 | <1,0 |
| б) isz+ | <1,0 | <0,1 |
| isz+/F'i+z+ | <1,0 | <0,1 |
| в) ocz+ | 95 | 25 |
| o+z+/F'ocz+ | 200 | 70 |
| o+z+/F'ocz- | 90 | 0,1 |
| iso+z+/F'i+ocz+ | 210 | 190 |
1(Приведена относительная активность β-галактозидазы, причем активность в индуцированных клетках i+z+ принята за 100. Активность фермента, превышающая 100, обусловлена тем, что в клетке присутствует более одной копии фактора F'.)
Поскольку i+-клетки активны в отношении экспрессии гена z+, если последний располагается в другой молекуле ДНК, то очевидно, что действие гена i опосредуется каким-то дитоплазматическим продуктом. Далее, этот цитоплазматический продукт, репрессор, должен каким-то образом препятствовать экспрессии стуктурных генов β-галактозидазы, пермеазы и трансацетилазы. Из этого следует, что конститутивный синтез трех ферментов в i--мутантах обусловлен отсутствием репрессора. Индукцию ферментов β-галактозидами и их аналогами можно понять, если предположить, что индукторы или эффекторы образуют комплекс с репрессором и инактивируют его. Эта модель согласуется со свойствами необычного класса мутаций, расположенных в гене i. У таких мутантов, обозначаемых is, отсутствует активность всех трех ферментов; они не индуцибельны и аллель is доминантен относительно аллеля i+ (табл. 5.1, б). Это явление можно объяснить тем, что is-мутанты образуют измененный репрессор, нечувствительный к инактивации под действием любого индуктора.
Три фермента, кодируемые генами z, у и а, совместно индуцируются β-галактозидами. Их относительные удельные активности остаются постоянными в соотношении 10:5:2 (галактозидаза : пермеаза : трансацетилаза) независимо от условий роста и эффективности индуктора. Чтобы объяснить это наблюдение, Жакоб и Моно предположили, что генетическая область z-y-a образует единицу координированной экспрессии, которую они назвали оперон. Они предположили, что экспрессия оперона регулируется специфическим операторным участком и что этот участок является одновременно местом действия репрессора и точкой, где начинается транскрипция структурных генов. Репрессор связывается с оператором, чтобы препятствовать транскрипции, а при образовании комплекса с индуктором он утрачивает сродство к оператору. Модель Жакоба и Моно, рассматривающая регуляцию использования лактозы, показана на рис. 5.3.
Построение модели позволяет сделать некоторые предсказания о механизме действия системы и взаимодействии компонентов. Так, из нее следует, что можно получить мутации операторного участка, при которых он теряет сродство к репрессору. Эти мутации должны быть конститутивными, доминантными и нечувствительными к действию измененного репрессора, который синтезируется в клетках is-мутантов. Такие мутации были получены путем отбора на конститутивность среди клеток, диплоидных по lac-области. Эти мутации, обозначенные ос, картируются в операторном участке; активность ферментов в мутантных клетках в 100 - 200 раз выше, чем в нормальных неиндуцированных клетках. Свойства конститутивных мутаций оператора приведены в табл. 5.1, в. Как предсказывает модель, они доминантны и нечувствительны к репрессору, синтезируемому в is-клетках. Однако следует отметить, что их доминантность ограничивается экспрессией генов, расположенных в той же молекуле ДНК. Аллель ос генома F' не влияет на экспрессию аллеля z+ бактериальной хромосомы. Мутации ос называются цис-доминантными.
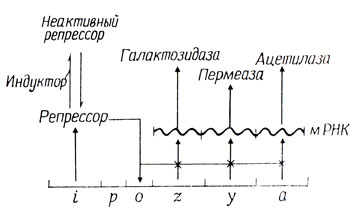
Рис. 5.3. Lac-оперон Escherichia coli
В lac-опероне имеется еще один генетический элемент. Промотор р, подобно оператору, представляет собой определенный участок ДНК, а не ген или цистрон в общепринятом смысле. Мутации промотора увеличивают или уменьшают скорость транскрипции структурных генов лактозного оперона. Оказалось, что промотор - это участок, с которым связывается РНК-полимераза, и мутации промотора картируются между геном i и оператором.
Промотор выполняет еще одну важную функцию в регуляции использования лактозы. Если культуральная среда E. coli содержит и глюкозу, и лактозу, то вначале используется глюкоза, а лактозный оперон не индуцируется до тех пор, пока не израсходуется вся глюкоза. Это явление называют катаболитной репрессией или глюкозным эффектом; оно наблюдается и в тех случаях, когда вместо лактозы используется какой-либо другой сахар. Оказалось, что глюкоза каким-то еще не вполне понятным образом регулирует концентрацию циклического AMP (сАМР) в клетках. В присутствии глюкозы концентрация сАМР низка, а в отсутствие этого сахара - высока. Поскольку глюкоза подавляет катаболизм других Сахаров, Пастан и Перлман предположили, что у мутантов, лишенных способности использовать лактозу и одновременно еще какой-либо сахар, должен быть нарушен синтез сАМР. Такие мутанты можно выделить на среде ЭМС, содержащей лактозу и еще какой-нибудь сахар, например, арабинозу, поскольку они не расщепляют субстрата. Эти мутанты распадаются на два класса: у одних нет активности фермента аденилатциклазы и они не могут превращать AMP в сАМР, а у других нет белка, который связывает с AMP и необходим для транскрипции лактозного оперона. В присутствии сАМР этот белок, активирующий катаболизм (БАК), связывается с промотором и дает РНК-полимеразе возможность также связаться с промотором и начать транскрипцию.
Теперь, когда мы уже знаем, из каких элементов состоит lac-система, мы можем рассмотреть их взаимодействия, обеспечивающие регуляцию, наблюдаемую in vitvo. Механизм регуляции гена, согласно концепции оперона, включает некоторые новые биологические понятия. Два белка, репрессор и БАК, не обладают ферментативной активностью и выполняют свою функцию, которую им отводит модель оперона, связываясь с определенными участками ДНК. Кроме того, имеются два участка ДНК, промотор и оператор, единственная функция которых состоит в том, чтобы служить участками для связывания этих белков, а также для связывания РНК-полимеразы. Можно полагать, что участок промотора-оператора располагается между терминирующим кодоном гена i и инициаторным кодоном гена z; он занимает 122 пары оснований. Функциональная организация этого участка показана на рис. 5.4. Можно видеть, что участки связывания полимеразы и репрессора почти полностью перекрываются. Таким образом, когда репрессор связан с ДНК, транскрипция не может начаться. Кроме того, следует отметить, что транскрипция начинается в пределах операторного участка, поэтому мРНК лактозного оперона имеет нетранслируемую лидерную последовательность длиной в 39 нуклеотидов, расположенную перед инициирующим кодоном гена г. В следующей главе мы рассмотрим структуры генов и их транскриптов более подробно.
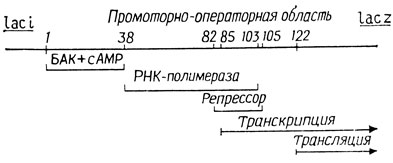
Рис. 5.4. Область промотора и оператора lac-оперона
Лактозный репрессор выделили и охарактеризовали Гилберт и Мюллер-Хилл в 1966 г. Это тетрамер с мол. массой около 150 000. Не идуцированные клетки содержат 5 - 10 молекул тетрамера, каждая из которых может связать 4 молекулы ИПТГ. Эксперименты in vitro показали, что репрессор связывается с ДНК операторного участка и что в присутствии ИПТГ репрессор теряет способность к связыванию.
Поскольку продукт гена i, репрессор, препятствует экспрессии структурных генов оперона, этот механизм регуляции называют негативным. В классической статье Жакоба и Моно дано четкое определение негативных регуляторных систем; таким образом, она определила пути дальнейшего развития работ по изучению генетической регуляции. Когда появились сообщения о системах, в которых, по-видимому, осуществляется позитивная регуляция, многие рассматривали такие системы как аномалии.
Однако мы уже видели, что для транскрипции генов лактозного оперона необходимо присутствие БАК и сАМР в области промотора. Эти соединения действуют позитивно и способствуют транскрипции. Дальше мы увидим, что позитивная регуляция свойственна последовательной стимуляции функции генов в процессе развития.
Помимо того что Жакоб и Моно заложили основу для изучения индукции ферментов, они показали, что с помощью предложенной ими схемы можно объяснить репрессию синтеза ферментов. Насколько невыгодно для организма синтезировать ферменты катаболизма в отсутствие их субстратов, настолько же невыгодно синтезировать ферменты анаболизма в присутствии конечных продуктов соответствующих метаболических путей. Существование этого явления было впервые продемонстрировано в 1953 г. Было показано, что активность триптофан-синтазы E. coli сильно снижается при добавлении в среду триптофана. Дальнейшие исследования показали, что формально эта регуляторная система подобна лактозному оперону. Гены, кодирующие ферменты пяти завершающих реакций биосинтеза триптофана, расположены друг за другом в той же последовательности, что и кодируемые ими реакции биосинтеза. Синтез этих ферментов регулируется координирование. Легче всего это прослеживается при дерепрессии, которая происходит при переносе клеток со среды, содержащей триптофан, на среду без триптофана. Экспериментально гораздо легче следить за появлением активности фермента, чем за ее исчезновением. Кривая роста активности в культуре при дерепрессии имеет примерно такой же вид, как и при индукции β-галактозидазы (рис. 5.2).
В результате отбора на устойчивость к аналогу триптофана 5-метилтриптофану были получены мутанты, которые синтезируют ферменты биосинтеза триптофана конститутивно. Некоторые из таких мутаций доминантны в частичных диплоидах и картируются рядом с геном trpE, кодирующим антранилат-синтетазу, - первый фермент биосинтетического пути. Эти мутации позволили определить, что именно на этом конце группы генов располагается операторный участок. Другая группа конститутивных мутаций, обусловливающих устойчивость к аналогу, рецессивна и картируется в гене, не сцепленном с группой генов биосинтеза. С помощью таких мутаций был обнаружен регуляторный ген trpR. В этой регуляторной системе продукт гена trpR - неактивный репрессор, который может связываться с триптофаном, выступающим в роли корепрессора, а затем - с операторным участком и подавлять транскрипцию. Таким образом, гены этого оперона не транскрибируются в присутствии экзогенного триптофана. В отсутствие корепрессора операторный участок свободен и может происходить транскрипция. Как и в лактозном опероне, промотор и оператор перекрываются, так что одновременное связывание активированного репрессора и РНК-полимеразы исключено.
Кроме того, trp-оперон подчиняется и другой системе регуляции. При дерепрессии активность ферментов в конститутивных мутантах может увеличиваться в 10 раз. Генетический анализ показал, что между оператором и геном trpE расположен еще один регуляторный участок. Основная последовательность оперона включает лидерный участок длиной в 160 пар оснований, причем часть этого участка длиной около 30 пар, непосредственно прилегающая к инициирующему кодону trpE, образует терминаторную последовательность; в этом месте РНК-полимераза стремится соскочить с ДНК. В дерепрессированных клетках транскрипция идет в полную силу. В конститутивных мутантах 9 из 10 начавшихся актов транскрипции заканчиваются в этой области аттенюатора. Следовательно, в условиях голодания по триптофану клетки должны содержать антитерминатор. По всей вероятности, его функцию выполняет не аминоацилированная тРНКTrP. Имеются достоверные данные, что и другие системы биосинтеза аминокислот регулируются при участии аттенюаторов. Общая схема регуляции триптофанового оперона показана на рис. 5.5.
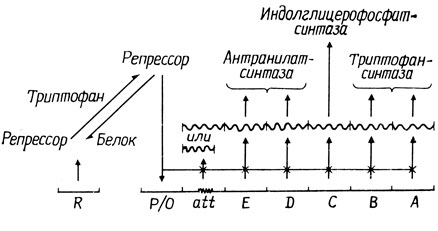
Рис. 5.5. Триптофановый оперон Escherichia coli
Исходя из этих двух примеров, мы можем сформулировать основные свойства метаболической регуляции оперонов.
1. Должен существовать кластер функционально связанных генов, имеющий на одном конце четко определенный промоторно-операторный участок.
2. Должен быть регуляторный ген, не обязательно сцепленный с опероном, кодирующий репрессор (при негативной регуляции) или активатор (при позитивной регуляции).
3. Связывание продукта регуляторного гена с промоторно-операторным участком должно усиливаться и ослабляться при образовании комплекса с низкомолекулярным метаболитом, который выступает в качестве индуктора, корепрессора или коактиватора.
4. Структурные гены оперона транскрибируются в единую полицистронную молекулу мРНК.
До сих пор мы рассматривали регуляцию простых метаболических путей. Приложимы ли основные закономерности, обнаруженные в ходе этих исследований, к более сложным ситуациям? Исследования микроорганизмов часто предпринимают с тем, чтобы, исходя из полученных результатов, сделать выводы о подобных системах у высших организмов. Этот подход особенно привлекателен для изучения процессов развития. Хотя прокариоты - простые организмы, у них все-таки наблюдаются процессы, которые можно рассматривать как модель развития.
Наиболее подробно изученная система такого рода - генетическая регуляция литического и лизогенного развития бактериофага λ. Культуры E. coli, уже несущие профаг λ, устойчивы к дальнейшему заражению этим фагом. Но если провести скрещивание Hfr-штамма, несущего профаг, с нелизогенным F--штаммом, то перенос профага при конъюгации приведет к литическому развитию фага в клетке-реципиенте. На основе этих данных было высказано предположение, что профаг λ кодирует λ-репрессор, который ингибирует репликацию дополнительных геномов фага λ и таким образом препятствует суперинфицированию фагом. При скрещивании HfrхF- перенос профага в цитоплазму F--клетки освобождает геном λ от действия собственного репрессора и приводит к литическому размножению фага. Аналогично лактозной системе репрессор должен связываться с фаговой ДНК и препятствовать транскрипции генома фага.
Модель, вытекающая из этого предположения, является упрощенной, но она объясняет наиболее важные особенности генетической регуляции развития фага λ. Схема генома фага λ, на которой отмечены основные участки транскрипции, приведена на рис. 5.6.
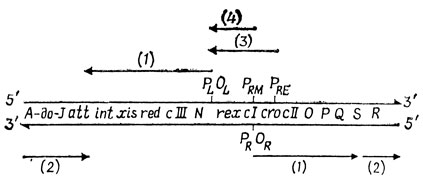
Рис. 5.6. Транскрипция генома фага лямбда. А - лактоза, Б - ИПТГ, В - ОНФГ
λ-Репрессор кодируется геном сI. Если геном фага попадает в клетку чувствительной клетки-хозяина, начинается транскрипция с двух промоторов, PL и PR, с обеих сторон от сI (рис. 5.6, 1). Транскрипция, идущая влево от промотора PL, приводит к трансляции продукта гена N; транскрипция вправо от промотора PR приводит к трансляции продукта гена cro. Геном содержит аттенюаторные последовательности между генами N и cII и между генами cro и cII. Продукт гена N действует как антитерминатор, который обеспечивает транскрипцию в левую сторону до самого гена int и в правую сторону до гена Q. Гены от N до int необходимы для лизогенизации, а гены справа от cro, кроме cII, необходимы для литического развития. В последнем случае регуляция проще, поэтому мы начнем с нее. Продукт гена cro действует как репрессор в участке ОL, в результате чего ген N и гены, необходимые для интеграции, не транскрибируются; кроме того, он подавляет транскрипцию гена cI с промотора PRM. Продукты генов О и Р необходимы для репликации ДНК фага λ, а продукт гена Q - антитерминатор, обеспечивающий транскрипцию генов от S до J (рис. 5.6, 2), кодирующих компоненты зрелого фага. Эта последовательность событий приводит впоследствии к лизису клетки.
При лизогенной инфекции продукты генов cII и cIII совместно активируют транскрипцию гена cI с промотора PRE В левую сторону; эта транскрипция идет по несмысловой цепи относительно гена cro (рис. 5.6, 3). Продукт гена cI - репрессор, который связывается с OL и OR и подавляет дальнейшую транскрипцию в левую и правую стороны. Кроме того, репрессор способствует узнаванию промотора PRM полимеразой, обеспечивая таким образом собственный синтез (рис. 5.6, 4). В результате такого хода событий ДНК фага λ, не реплицируется, а интегрируется с геномом клетки-хозяина под действием продуктов генов att, int, xis и red. Итак, выбор между лизисом и лизогенией - результат различия в скорости синтеза между двумя конкурирующими белками - продуктами генов cro и cI.
Система регуляции фага λ иллюстрирует взаимодействие позитивных и негативных систем. Кроме того, мы видели, что репрессор регулирует свой собственный синтез. Это явление называется ауторегуляцией и, видимо, встречается не так уж редко. Трудно найти такой процесс развития, в котором участвуют только негативные регуляторные системы. Позитивная активация транскрипции, очевидно, играет важную роль в этой прокариотической системе и, видимо, лежит в основе дифференцировки и развития высших организмов.
Группирование (образование кластеров) функционально родственных генов у прокариот распространено, но отнюдь не является общим правилом. Самый наглядный пример - гистидиновый оперон Salmonella typhimurium. В синтезе гистидина из АТР и фосфорибозил-1-пирофосфата участвует 10 ферментов, которые кодируются девятью генами. Эти гены расположены в хромосоме друг за другом и их экспрессия координирование регулируется гистидином. Роль регуляторной молекулы выполняет гистидил-тРНК. В не аминоацилированной форме она действует как антитерминатор на аттенюирующую последовательность, расположенную между промотором и первым структурным геном оперона. Метаболизм аргинина у E. coli представляет обратную ситуацию. Восемь генов, участвующих в его синтезе, координированно репрессируются в присутствии аргинина продуктом одного регуляторного гена argR. Однако лишь четыре гена сгруппированы вместе, тогда как остальные разбросаны по хромосоме. Очевидно, каждый операторный участок этой системы (а их должно быть шесть) обладает способностью связывать общий репрессор.
Следует напомнить, что помимо генетической регуляции, которую мы рассматривали до сих пор, ферментативная активность регулируется по механизму обратной связи, путем актизации, стабилизации, расщепления ферментов и с помощью ингибирования продуктом. Генетическая регуляция определяет количество фермента в клетке, тогда как эти дополнительные регуляторные системы обеспечивают тонкую "настройку" метаболизма.
Прежде чем очень кратко рассмотреть механизмы регуляции у высших организмов, мы должны указать на различия в процессах переноса информации между прокариотами и эукариотами. У прокариот транскрипция и трансляция происходят координироваино. Как только растущая молекула мРНК становится достаточно длинной, она может связываться с рибосомами и начинается трансляция. Если же свободный конец не защищен рибосомой, то он доступен для расщепления рибонуклеазой. Таким образом, большинство, если не все, молекулы мРНК у прокариот имеют короткое время полужизни по сравнению с продолжительностью клеточного цикла. У эукариот, наоборот, процессы транскрипции и трансляции разобщены во времени и в пространстве. Первичный транскрипт должен быть расщеплен для удаления последовательностей прерывающих ген, снова сшит, к нему должен быть присоединен poly А - "хвост" и "колпачок" (cap) прежде чем он покинет ядро для трансляции в цитоплазме. Зрелая мРНК не обязательно сразу транслируется, но может храниться в течение суток и даже недель.
Тем не менее в настоящее время можно лишь предположить, что исследователи смогут приложить концепцию оперона к регуляторным системам высших организмов. У дрожжей и Neurospora имеются несколько кластеров функционально связанных генов. Они интенсивно изучались, с тем чтобы выяснить, в какой степени они удовлетворяют модели оперона. Полученные к настоящему времени данные указывают, что все они гораздо сложнее. Например, комплекс генов his 4 у дрожжей кодирует три ферментативные активности и представляет собой одну транскрипционную единицу; имеются данные, что на одном конце этой группы генов расположен регуляторный участок. Однако комплекс his 4 представляет собой одно целое и в отношении трансляции. Один полипептид содержит все три ферментативные активности; следовательно, можно думать, что он кодируется одним геном. Имеются убедительные данные о том, что ферменты многих метаболических путей у эукариот образуют агрегаты, хотя гены, кодирующие эти ферменты, не сцеплены. Возможно, такие агрегаты увеличивают эффективность соответствующих метаболических путей, обеспечивая непосредственный переход промежуточных продуктов от фермента к ферменту в составе агрегата.
К сожалению, недостаток места не позволяет уделить должное внимание имеющимся данным о регуляции метаболизма у высших организмов. Поэтому мы отсылает читателя к книгам, перечисленным в библиографии.
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'