
3. Генетический код
Когда Бидл в 1945 г. выдвинул гипотезу один ген - один фермент, он предположил, что функция каждого гена - это определить специфичность одного фермента. Когда материал наследственности, т. е. сам ген, был идентифицирован, очередная проблема свелась к тому, чтобы изучить взаимосвязь между геном и ферментом или между ДНК и белком. Модель Уотсона и Крика рассматривала ДНК как линейную молекулу, обладающую определенной химической и структурной простотой. Белки же, наоборот, сложные соединения, как по своему строению, так и по химическим свойствам. Анализ с помощью дифракции рентгеновских лучей показал, что, хотя в основе структуры белка лежит спиральная конфигурация, из-за складывания и различных молекулярных взаимодействий возникает огромное разнообразие третичных конфигураций.
Очевидно, что если ДНК - материал наследственности, то информация, которую она содержит, должна быть переведена (транслирована) в белок; иными словами, специфичность молекул, способных принимать бесконечное число различных третичных конфигураций, определяется линейными молекулами.
Первые указания на то, каким образом может проявляться эта специфичность, были получены при изучении гемоглобина человека. В тропической Африке распространена болезнь серповидноклеточная анемия; она встречается также среди американских негров. При пониженном парциальном давлении кислорода эритроциты больных теряют округлую форму и становятся похожими по очертаниям на серп. Нил и Бит показали в 1949 г., что это состояние наследуется и что распространение болезни в пределах отдельных семей соответствует сегрегации аллелей одного гена. Эти аллели в настоящее время обозначают HbА (нормальный) и HbS (дефектный). У гомозигот HbS/HbSсерповидноклеточная анемия принимает особенно тяжелую форму, и они обычно погибают от множественного воздействия мутантного аллеля на функцию эритроцитов. У гетерозигот HbA/HbS болезнь выражена в более умеренной форме, у них менее 50% эритроцитов принимают серповидную форму в экстремальных экспериментальных условиях. Этот фенотип называют синдромом серповидноклеточности.
В том же году Полинг и его сотрудники сообщили о результатах своих исследований физико-химических свойств гемоглобина в норме и при серповидноклеточной анемии. Они полагали, что наблюдаемые изменения в морфологии эритроцитов обусловлены химическими изменениями в гемоглобине. Эти изменения могут быть связаны с изменением заряда молекулы, и тогда нормальные и мутантные молекулы можно разделить биофизическими методами. Для изучения различий в заряде молекул Полинг и его сотрудники использовали электрофорез. Они показали, что с помощью этого метода нормальный гемоглобин легко отделяется от мутантного. У больных с синдромом серповидноклеточности был обнаружен гемоглобин обоих типов (рис. 3.1).
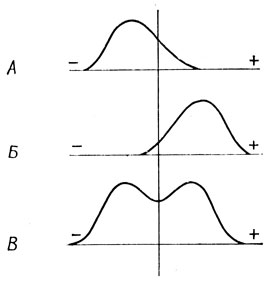
Рис. 3.1. Электрофоретическое разделение гемоглобинов HbA/HbA (A), HbS/HbS (Б) и HbA/HbS (В)
Ингрэм исследовал химические изменения, которые возникают в гемоглобине при серповидноклеточности. Он применил метод отпечатков пальцев, разработанный Сэнгером для анализа аминокислотной последовательности инсулина. Образцы гемоглобина денатурировали, нагревая их до 90°С, и гидролизовали трипсином. Полученные в результате гидролиза пептиды разделяли электрофорезом на бумаге, а затем хроматографией. Проявив хроматограммы нингидрином, обнаружили, что гидролизаты гемоглобинов HbA/HbA и HbS/HbS различались только одним пятном. Это свидетельствовало о каком-то изменении в составе одного пептида. Последующее определение аминокислотной последовательности этого пептида дало следующие результаты:
HbA/HbA: валин - гистидин - лейцин - треонин - пролин - глутаминовая кислота - глутаминовая кислота - лизин
HbS/HbS: валин - гистидин - лейцин - треонин - пролин - валин - глутаминовая кислота - лизин
Таким образом, оказалось, что различия в химических и биологических свойствах двух типов гемоглобина обусловлены заменой всего лишь одной молекулы глутаминовой кислоты на одну молекулу валина. Через несколько лет Хант и Ингрэм показали, что умеренная серповидноклеточная анемия обусловлена образованием другого измененного гемоглобина, гемоглобина С, в котором тот же остаток глутаминовой кислоты гемоглобина А замещен на лизин.
Таким образом, изменения в гене приводят к изменениям аминокислотной последовательности белков. Из этого можно заключить, что гены задают (детерминируют) аминокислотную последовательность белков и, кроме того, что именно эта последовательность в свою очередь определяет специфичность фермента. Белки содержат 20 широко распространенных аминокислот, которые перечислены в табл. 3.1. Все другие аминокислоты, встречающиеся в белках, образуются путем ферментативной модификации тех или иных из 20 основных аминокислот. ДНК - линейная молекула, в которой единственное, что может изменяться,- это последовательность пар оснований; эта линейная последовательность должна каким-то образом кодировать аминокислотную последовательность белков. Генетический код может состоять лишь из четырех элементов: аденина (А), гуанина (G), тимина (Т) и цитозина (С). Можно было допустить, что они могут считываться по одному (одно основание - одна аминокислота), по два (два основания - одна аминокислота), по три, по четыре и т. д. Число оснований, кодирующих аминокислоту, определяет функциональную ячейку кода, или кодом. В зависимости от того, сколько оснований образуют один кодон, возможно существование следующего числа кодонов.
Таблица 3.1
20 аминокислот, которые обычно встречаются в белках
| Название | Сокращенное обозначение |
| 1. Алании | Ala |
| 2. Аргинин | Arg |
| 3. Аспарагин | Asn |
| 4. Аспарагиновая кислота | Asp |
| 5. Цистеин | Cys |
| 6. Глутаминовая кислота | Glu |
| 7. Глутамин | Gin |
| 8. Глицин | Gly |
| 9. Гистидин | His |
| 10. Изолейцин | Ile |
| 11. Лейцин | Leu |
| 12. Лизин | Lys |
| 13. Метионин | Met |
| 14. Фенилаланин | Phe |
| 15. Пролин | Pro |
| 16. Серии | Ser |
| 17. Треонин | Thr |
| 18. Триптофан | Trp |
| 19. Тирозин | Tyr |
| 20. Валин | Val |
Поскольку нам надо закодировать 20 аминокислот, кодоны из 1 и 2 нуклеотидов слишком малы, 4 нуклеотида дают избыточное число кодонов, а 3 дают 64 кодона, что обеспечивает приемлемый избыток, необходимый, возможно, для обеспечения каких-то других функций кода.
| Число оснований в кодоне | Число возможных вариантов | Максимальное число кодонов |
| 1 | 41 | 4 |
| 2 | 42 | 16 |
| 3 | 43 | 64 |
| 4 | 44 | 256 |
Теоретически триплетный код может быть построен многими различными способами. Последовательность оснований может быть прочитана в виде перекрывающихся триплетов. Так, последовательность ABC ABC ABC может содержать следующие ко доны:
1. ABC 2. BCA 3. CAB 4. ABC 5. BCA 6. CAB
и т. д. При таком коде замена одного основания приведет к изменению трех аминокислот. Мы уже видели, что аллельное изменение при серповидноклеточной анемии затрагивает только одну аминокислоту. С тех пор была определена последовательность многих других вариантов гемоглобинов; и у всех них имеется замена одной - единственной аминокислоты. Кроме того, перекрывающийся код накладывал бы ограничения на аминокислотные последовательности белков, так как каждое основание при этом участвовало бы в кодировании трех аминокислот. Между тем статистический анализ известных аминокислотных последовательностей, проведенный Бреннером в 1957 г., показал, что, по всей вероятности, таких ограничений нет. Все эти данные убедительно свидетельствовали, что код не перекрывается.
Если же код состоит из неперекрывающихся триплетов и прочитывается, начиная со строго определенной точки, то изменение одного основания, наоборот, приведет к замене только одной аминокислоты, и никаких ограничений возможных аминокислотных последовательностей не будет. При таком неперекрывающемся коде без запятых последовательность
ABC ABC ABC ABC ABC
будет считываться следующим образом:
1. ABC 2. ABC 3. ABC 4. ABC 5. ABC
Замена одного основания в одном кодоне приведет к замене только одной аминокислоты:
1. ABC 2. ABC 3. ABB 4. ABC 5. ABC
Теперь мы рассмотрим, каким образом генетическая информация, закодированная в ДНК, переводится в аминокислотную последовательность белка. Мы не будем подробно останавливаться на механизме синтеза белка, так как ему посвящена другая книга настоящей серии. Вместо этого обратимся к проблеме переноса информации и посмотрим, как клетки справляются с ней.
В эукариотических клетках ДНК находится в ядре, а синтез белка происходит на рибосомах в цитоплазме. Следовательно, сама ДНК не может служить матрицей при синтезе белка; должно существовать какое-то промежуточное звено, которое и переносит генетическую информацию из ядра в цитоплазму:
ДНК → ? → Белок
Такое промежуточное звено - информационную РНК (матричную РНК, мРНК) - впервые обнаружили в клетках E. coli, зараженных фагом Т2, Волкин и Астрахан в 1957 г. Эта РНК была лабильной, ее последовательность оснований была комплементарна фаговой ДНК. На долю этой РНК приходилось лишь 2% РНК зараженных клеток. Таким образом, информация переносится в следующей последовательности:
ДНК → РНК → Белок
Этап ДНК → мРНК называется транскрипцией, этап мРНК ДНК → белок - трансляцией. Общее положение, что информация переносится от ДНК к РНК, а от РНК к белку, обычно называют "центральной догмой молекулярной биологии". В действительности перенос информации между этими тремя типами макромолекул происходит не только в одном направлении. Точнее представить их в виде следующей схемы:
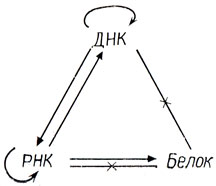
Здесь стрелки обозначают возможные пути переноса информации, а крестики - запрещенные пути. Обратите внимание, что информация, закодированная в ДНК, может воспроизводиться с помощью ДНК-полимеразы, равно как и информация, содержащаяся в РНК, когда она служит генетическим материалом (у РНК-содержащих вирусов), может воспроизводиться под действием РНК-полимеразы1. Кроме того, фермент РНК-зависимая ДНК-полимер аза может копировать геном некоторых РНК-содержащих вирусов, синтезируя при этом ДНК. Эта ДНК-копия может затем "лизогенизировать" зараженную клетку (внедряться в ее собственные хромосомы).
1(РНК-полимеразой называют ДНК-зависимую РНК-полимеразу - необходимый компонент каждой живой клетки; РНК-зависимую РНК-полимеразу, которую имеет в виду автор, обычно называют РНК-репликазой. - Прим. перев.)
Транскрипция осуществляется ДНК-зависимой РНК- полимеразой. Этот фермент копирует одну из цепей двойной спирали, образуя при этом комплементарную нить мРНК. Считываемая цепь ДНК, которая содержит истинный код для того или иного белка, называется смысловой (кодирующей) цепью.
У фага SP8, инфицирующего Bacillus subtilis, две цепи ДНК сильно различаются по нуклеотидному составу, так что их можно разделить центрифугированием в градиенте плотности после диссоциации нативной двухцепочечной ДНК с помощью соответствующей обработки. Определение способности разделенных цепей ДНК к образованию (путем связывания комплементарных оснований) гибридных молекул с мРНК, полученной из зараженных клеток, показало, что в гибридизацию вступает только тяжелая цепь, более богатая пурином. Эта цепь является смысловой для всех генов фага. У большинства вирусов и у всех прокариот и эукариот обе цепи содержат смысловые участки, но для каждого данного гена смысловой является только одна из двух цепей.
Рассмотрим теперь трансляцию мРНК, ведущую к образованию белка. Трудно представить себе, каким образом основания мРНК могли бы взаимодействовать с аминокислотами и выстраивать их в определенном порядке при синтезе белка; очевидно, для этого необходимы какие-то адапторные молекулы-посредники. Такими адапторами служат транспортные РНК (тРНК). Молекулы тРНК содержат 70 - 80 нуклеотидов, причем некоторые участки молекулы связываются между собой водородными связями и образуют общую для всех молекул тРНК структуру, напоминающую клеверный лист (рис. 3.2). Антикодон - участок тРНК, - узнающий соответствующий кодон в мРНК, располагается в неспаренной части молекулы тРНК. На 3'-конце молекулы тРНК находится неспаренная последовательность - ССА, которая добавляется под действием особого фермента после того, как основная последовательность уже протранскрибирована. Это - место присоединения аминоациладенилата, который образуется в результате реакции между аминокислотой и АТР, катализируемой аминоацил-тРНК - синтетазой. Аминоацил-синтетазы и тРНК специфичны в отношении аминокислот. Когда к - ССА-концу тРНК присоединена соответствующая аминокислота, говорят, что данная тРНК нагружена.
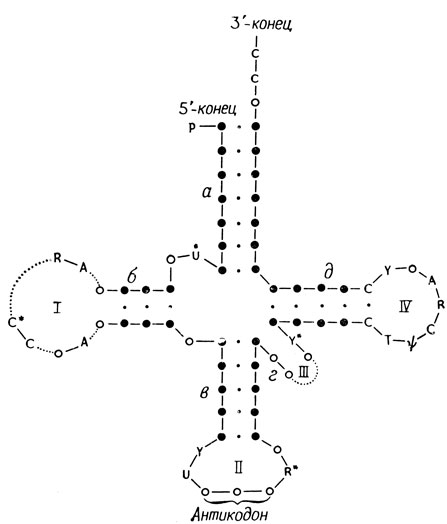
Рис. 3.2. Обобщенная структура молекулы тРНК в виде клеверного листа. (Е. Smith. Protein Biosynthesis, рис. 2.29, стр. 33.)
Рибосомы ориентируют аминоацил-тРНК относительно мРНК и располагают их в правильном порядке для синтеза белка. Рибосомы состоят из РНК и белка. У рибосом прокариот коэффициент седиментации при ультрацентрифугировании составляет 70S. Они легко диссоциируют на две субчастицы - 30S и 50S. Легкая субъединица содержит участок связывания мРНК, а тяжелая - два участка связывания нагруженных тРНК. Вначале нагруженная тРНК связывается с рибосомой в аминоацильном участке. Затем остаток аминокислоты с помощью пептидной связи присоединяется к остатку, связанному с той тРНК, которая уже занимает пептидильный участок. Последняя тРНК покидает рибосому, а тРНК, которая была в аминоацильном участке, перемещается в пептидильный участок. Таким образом, полипептидная цепь удлиняется на один аминокислотный остаток. Эта последовательность событий в крайне упрощенном виде показана на рис. 3.3.
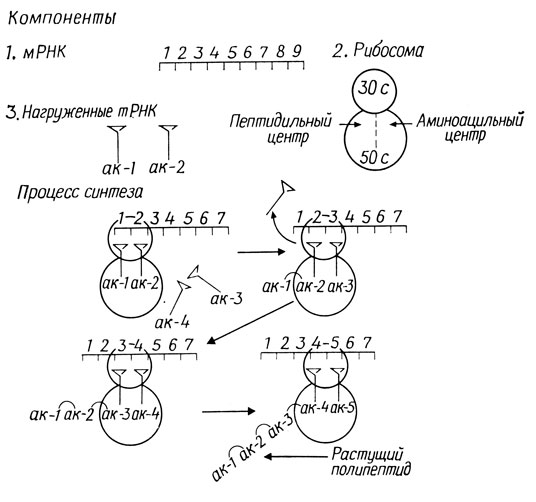
Рис. 3.3. Общая схема синтеза белка
Точная природа генетического кода была установлена с помощью изящных экспериментов Крика, Барнета, Бреннера и Уотс-Тобина в 1961 г. Они использовали в качестве объекта фаг Т4, который заражает и лизирует E. coli. В частности, они использовали мутантов по гену rll, образующих при заражении E. coli В характерные стерильные пятна. Фаги дикого типа (r+) образуют маленькие мутные пятна, а rll-мутанты - большие и прозрачные. Кроме того, rll-мутанты не растут на E. coli К12.
Таким образом, фаги дикого типа и rll-мутанты различаются по следующим свойствам.
| Генотип | Морфология стерильных пятен | |
| E. coli В | E. coli К12 | |
| r+ | Маленькие мутные | Маленькие мутные |
| rll | Большие прозрачные | Не растут |
Совместное заражение E. coli d различными мутантами по гену rll приводит к образованию r+-рекомбинантов. Таких рекомбинантов можно выявить, проверяя лизат на способность образовывать стерильные пятна на чашках, засеянных E. coli К12.
Крик и др. начали работать с rll-мутантом, индуцированным акридиновым красителем профлавином. Мутагенез под действием акридинов приводит к вставке или потере одиночных пар оснований при репликации ДНК. При изучении мутанта был выделен ряд ревертантов к дикому типу rll→r+. Эти ревертанты были выявлены по их способности расти на E. coli К12. Генетический анализ показал, что некоторые из этих ревертантов возникли в результате второй мутации в гене rll: таким образом, сочетание двух мутаций приводило к возникновению фенотипа, сходного с диким типом (псевдодикий тип). Эти вторичные мутации сами по себе обусловливали типичный фенотип rll-мутантов. Авторам удалось выделить ряд ревертантов из нескольких подобных вторичных мутантов. Появление этих ревертантов также было обусловлено мутациями в гене rll. Из этих третичных мутантов были получены новые ревертанты и т. д.
Все мутации, выделенные таким образом, были картированы; они локализуются в ограниченной области гена rll. Все они обусловливали характерный фенотип rll. Таким образом, в распоряжении исследователей имелась следующая коллекция мутантов: .
| 1-я серия | мутант 1 | |||
| 2-я серия | мутант 1 | + мутант 2 | ||
| 3-я серия | мутант 2 | + мутант 3 | ||
| 4-я серия | мутант 3 | + мутант 4 |
Дальнейшие эксперименты показали, что почти все двойные мутанты, полученные в результате рекомбинации между мутантами 1 и мутантами 4, имели псевдодикий фенотип. Все комбинации мутантов 3 с мутантами 1, наоборот, имели фенотип rll. В общем все двойные мутанты, полученные путем рекомбинации между мутантами нечетной и четной серии, имели псевдодикий фенотип, в то время как рекомбинанты двух мутантов четной или двух мутантов нечетной серии давали фенотип rll.
Для объяснения этих результатов была предложена поразительная по простоте гипотеза. Крик и его коллеги начали с предположения, что генетическая информация, соответствующая гену rll, и, следовательно, вообще весь генетический код, считывается триплетами, начиная с определенной точки, как показано ниже (1). Если так, то добавление или делеция одного основания, которые, как считалось, происходят при мутагенезе под действием акридинов, сдвинет код, начиная с точки, в которой произошла мутация. Так, делеция С в четвертом триплете приведет к мутантной последовательности 2.
| 1 | ABC | ABC | ABC | ABC | ABC | ABC | ABC | ABC | ABC | ABC |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |
| 2 | ABC | ABC | ABC | ABC | BCA | BCA | BCA | BCA | BCA | BCA |
| 1 | 2 | 3 | 4' | 5' | 6" | 7 | 8 | 9 | 10 |
Эта мутация может ревертировать, если код частично восстанавливается под действием второй мутации в триплете 6.
| 3 | ABC | ABC | ABC | ABA | BCA | BCC | ABC | ABC | ABC | ABC |
| 1 | 2 | 3 | 4' | 5' | 6" | 7 | 8 | 9 | 10 |
Обратите внимание, что произошло лишь частичное восстановление, так как некоторые кодоны остались измененными; этим объясняется псевдодикий фенотип, который проявляется у таких мутантов. Возможен и другой путь реверсии, если дополнительное основание будет вставлено перед тем триплетом, в котором произошла первоначальная мутация, скажем во 2-м триплете
| 4 | ABC | ABA | CAB | CAB | ABC | ABC | ABC | ABC | ABC | ABC |
| 1 | 2' | 3' | 4" | 5 | 6 | 7 | 8 | 9 | 10 |
Если теперь выделить эти вторичные мутации, сами по себе они. конечно, запутают всю информацию, заложенную в гене. Например, вставка во 2-й триплет, приведенная в примере 4, даст такую последовательность:
| 4 | ABC | ABA | CAB | CAB | CAB | CAB | CAB | CAB | CAB | CAB |
| 1 | 2' | 3' | 4' | 5' | 6' | 7' | 8' | 9' | 10' |
Далее авторы рассуждали так. Если эта гипотеза справедлива, то фаг, полученный путем рекомбинации и несущий столько вставок или делеций, сколько оснований содержится в одном кодоне, будет иметь псевдодикий фенотип. Авторы решили назвать исходную мутацию (серии 1) делецией. Им удалось показать, что сочетание трех вставок (серии 2 или 4) или трех делеций (серии 1 или 3) действительно дает псевдодикий фенотип. Отсюда они заключили, что генетическая информация, как и предполагалось, считывается кодонами по три основания. Можно было также сделать вывод, что код вырожден, т. е. что каждая аминокислота кодируется более чем одним триплетом, так как почти все комбинации вставки и делеции давали псевдодикий фенотип. Очевидно, этого не наблюдалось бы, если бы большинство из 64 кодонов были бессмысленными и не кодировали бы никаких аминокислот. Однако подробный анализ расположения вставок, способных приводить к реверсии определенной делеции, и наоборот, показал, что существуют определенные ограничения в локализации мутации. Из этого следовало, что существуют, очевидно, участки, мутации в которых не могут быть исправлены сколько-нибудь приемлемым образом. Крик и его сотрудники предположили, что эти ограничения обусловлены образованием триплетов, вызывающих преждевременную терминацию белка, кодируемого геном rll.
Мутации типа вставок и делеций действуют путем изменения границ кодонов; они называются мутациями со сдвигом рамки считывания. Иногда их еще называют просто мутациями со сдвигом рамки.
Расшифровка кода, т. е. выяснение соответствия между триплетами и определенными аминокислотами, была начата Ниренбергом и Маттеи в 1961 г. Перед этим было показано, что бесклеточная система, содержащая рибосомы, тРНК, аминоацил-тРНК - синтетазы, аминокислоты и другие необходимые компоненты, может синтезировать белок, используя в качестве матрицы эндогенную мРНК. Ниренберг и Маттеи сделали принципиально важный шаг в изучении кода: они ввели в эту систему синтетическую матрицу и посмотрели, какой белок при этом синтезируется. Они поставили следующий опыт: ряд пробирок содержал необходимые компоненты бесклеточной системы и все 20 аминокислот. Какая-то одна из аминокислот в каждой пробирке была помечена 14С, причем во всех пробирках были помечены разные аминокислоты. Затем в пробирки внесли синтетическую матрицу - полинуклеотид, содержащий только одно основание. Такие полинуклеотиды были синтезированы с помощью фермента полинуклеотидфосфорилазы. Пробирки некоторое время инкубировали, а затем осадили все новосинтезированные белки трихлоруксусной кислотой (ТХУ). Для того чтобы выяснить, какая аминокислота включилась в белок, определяли радиоактивность осадков. Авторы обнаружили, что полиуридиловая кислота (polyU) вызывала включение 4!С-фенилаланина в ТХУ-нерастворимый материал. Отсюда Ниренберг и Маттеи сделали вывод, что кодон для фенилаланина в мРНК - UUU; в смысловой цепи ДНК ему должен соответствовать триплет AAA. Далее они показали, что polyA вызывает включение лизина, a polyC - пролина и, следовательно, в мРНК эти аминокислоты кодируются кодонами AAA и ССС.
Остальные кодоны аминокислот были идентифицированы с помощью различных методов. Вначале лаборатория Ниренберга занималась бесклеточными системами, синтез белка в которых стимулировали полинуклеотидами, содержащими 2 или 3 основания в случайной последовательности. Например, polyUC стимулировал включение серина, пролина и лейцина. Зная соотношение оснований в составе полинуклеотида, Ниренберг и его сотрудники вычислили ожидаемые частоты встречаемости различных триплетов и сравнили их с наблюдаемым включением аминокислот. Отсюда можно было сделать вывод о составе кодонов, но не об их последовательности, например:
3U - фенилаланин; 2U : 1С - лейцин и серин; 1U : 2C - пролин
Для того чтобы установить последовательность нуклеотидов в кодонах, Корана и его коллеги синтезировали полинуклеотиды, в которых основания чередовались в определенном порядке, например UCUCUCUC.... Такая синтетическая матрица вызывала синтез полипептида серин-лейцин-серин-лейцин...; следовательно, этим аминокислотам соответствовали кодоны UCU и CUC.
Затем Ниренберг и Ледер обнаружили, что добавление тринуклеотидов к стандартной смеси, содержащей рибосомы и другие компоненты бесклеточной системы, вызывает связывание аминоацилированных тРНК с рибосомами. Если в систему вносили тринуклеотид UUU, то с рибосомами связывалась фенилаланил-тРНКPhe. Тринуклеотиды с известной последовательностью было сравнительно легко синтезировать и очистить, так что вскоре расшифровка остальных кодонов была завершена.
Путем сочетания этих подходов удалось найти соответствие определенным аминокислотам для 61 из 64 возможных триплетных кодонов. Значения кодонов для различных триплетов, встречающихся в мРНК, приведены в табл. 3.2. В скобках указаны соответствующие основания в смысловой цепи ДНК.
Таблица 3.2
Генетический код
(Терм. 1, 2 и 3 - терминирующие кодоны.)
| Первое основание | Второе основание | Третье основание | |||
| U(A) | C(G) | A(T) | G(C) | ||
| U(A) | 1 Phe | 17 Ser | 33 Tyr | 49 Cys | U(A) |
| 2 Phe | 18 Ser | 34 Tyr | 50 Cys | C(G) | |
| 3 Phe | 19 Ser | 35 Терм. 2 | 51 Терм.3 | A(T) | |
| 4 Phe | 20 Ser | 36 Терм. 1 | 52 Trp | G(C) | |
| C(G) | 5 Leu | 21 Pro | 37 His | 53 Arg | U(A) |
| 6 Leu | 22 Pro | 38 His | 54 Arg | (G)C | |
| 7 Leu | 23 Pro | 39 Gin | 55 Arg | A(T) | |
| 8 Leu | 24 Pro | 40 Gin | 56 Arg | G(C) | |
| A(T) | 9 Iie | 25 Thr | 41 Asn | 57 Ser | U(A) |
| 10 Iie | 26 Thr | 42 Asn | 58 Ser | C(G) | |
| 11 Ile | 27 Thr | 43 Lys | 59 Arg | A(T) | |
| 12 Met | 28 Thr | 44 Lys | 60 Arg | G(C) | |
| G(C) | 13 Val | 29 Ala | 45 Asp | 61 Gly | U(A) |
| 14 Val | 30 Ala | 46 Asp | 62 Gly | C(G) | |
| 15 Val | 31 Ala | 47 Glu | 63 Gly | A(T) | |
| 16 Val | 32 Ala | 48 Glu | 64 Gly | G(C) | |
Можно видеть, что код действительно вырожден, как и предсказывали Крик и его коллеги. Серину и аргинину соответствует по шесть кодонов, а всем остальным аминокислотам, кроме триптофана и метионина, по меньшей мере по два. Три кодона не соответствуют никаким аминокислотам; они кодируют терминацию полипептидной цепи. Вырожденность кода не случайна. Для большинства аминокислот, детерминируемых несколькими кодонами, первые два основания в различных кодонах одинаковы, а третье основание варьирует. Это означает, что даже при больших различиях в нуклеотидном составе ДНК организмы могут иметь одинаковый общий аминокислотный состав и метаболические возможности. Например, соотношение A + T/G + C у человека, мыши, лягушки и Е. coli равно 1,52, 1,27, 1,75 и 1,00 соответственно1.
1(Преимущественное использование тех или иных кодонов при кодировании белков у человека, мыши и лягушки не имеет отношения к общему нуклеотидному составу ДНК, так как последовательности ДНК, кодирующие аминокислотные последовательности у высших организмов, составляют весьма незначительную часть всей ДНК. - Прим. перев.)
Исходя из данных о соответствии кодонов и аминокислот, можно предсказать, что число различных тРНК в данной клетке должно составлять 61. На самом деле клетка E. coli содержит около 50 тРНК. Некоторые из этих тРНК имеют разные последовательности, но узнают один и тот же кодон, тогда как другие тРНК имеют разные последовательности и узнают различные кодоны для определенной аминокислоты. Если для данной аминокислоты имеется более одной тРНК, то все они аминоацилируются под действием одной аминоацил-тРНК - синтетазы.
Исходя из данных о существовании различных типов тРНК в клетке и о наличии необычных оснований в определенных участках молекулы тРНК, в том числе в антикодоне, Крик выдвинул "гипотезу качаний" (гипотезу неоднозначного соответствия, wobble-гипотезу). Рассмотрим ее на следующем примере. Инозин часто обнаруживается на 5'-конце антикодона, что соответствует третьему основанию кодона в мРНК. Структура инозина позволяет ему образовывать приемлемые с точки зрения структуры двойной спирали пары с аденином, цитозином и урацилом. Крик предположил, что эти вариации спаривания возможны при взаимодействии мРНК с тРНК и что возможны и другие приемлемые пары оснований. Такое неканоническое (неоднозначное) спаривание позволяет одной тРНК узнавать несколько различных кодонов для данной аминокислоты. Согласно гипотезе неоднозначного соответствия, возможно образование следующих пар оснований.
| Третье основание кодона | Соответствующее основание в антикодоне |
| A, G | U |
| G | C |
| U | A |
| C, U | G |
| A, C, U | I |
Такое спаривание объясняет в большинстве случаез вырожденность кодонов по третьему положению (см. табл. 3.2).
Генетические эксперименты Крика и его сотрудников позволили твердо установить, что код считывается триплетами с определенной начальной точки. Из этого можно сделать вывод, что должны существовать специальные сигналы, по-видимому, какие-то кодоны, отмечающие инициацию и терминацию транскрипции1. Оказалось, что у E. coli синтез белков начинается с кодона AUG, единственного кодона метионина. Эксперименты по синтезу белка in vitro показали, что первая аминокислота в белках - N-формилметионин. Эта аминокислота связывается с особой тРНК, тРНКFМеt, которая узнает кодон AUG в мРНК, связанной с 30S-субчастицей рибосомы, до того как происходит сборка рибосомы из двух субчастиц. Имеются надежные данные, свидетельствующие о том, что TPHKFMet может связываться также с GUG, CUG и, возможно, с UUG, когда эти триплеты расположены таким же образом относительно 30S-cyбчастицы, как AUG. "Нормальная" метиониновая тРНК, TPHKMet, наоборот, связывается только с кодоном AUG и только тогда, когда он занимает аминоацильный участок рибосомы. Таким образом, с N-формилметионина может только начинаться синтез белка, а метионин может быть только внутренней аминокислотой в пептидной цепи2.
1(По всей вероятности, в данном случае автор имеет в виду трансляцию. - Прим. перев.)
2(Следует отметить, что формильная группа N-формилметионина блокирует атом азота и не позволяет этой аминокислоте включаться в полипептидную цепь, кроме как в N-концевое положение. - Прим. перев.)
Хотя процессы инициации у прокариот и эукариот протекают одинаково, в белках эукариот N-формилметионин никогда не обнаруживается в качестве N-конце- вой аминокислоты. Формильная группа in vivo удаляется под действием особого фермента; кроме того, во многих белках отщепляется и метионин. Определение нуклеотидных последовательностей ДНК, соответствующих N-концевым участкам нескольких белков, показало, что в качестве инициаторного кодона чаще всего используется AUG.
Перейдем теперь к тому, как были расшифрованы кодоны терминации полипептидной цепи, или нонсенс (бессмысленные) - кодоны. Но сначала рассмотрим некоторые предполагаемые свойства мутаций, приводящих к возникновению нонсенс-кодонов или супрессирующих (подавляющих) их эффект. Во-первых, если в результате мутации кодон какой-либо аминокислоты превратится в нонсенс-кодон, то в этом месте образование полипептидной цепи будет преждевременно заканчиваться. Во-вторых, эффект мутации, вызвавшей образование нонсенс-кодона, может быть подавлен в результате другой мутации, которая так изменит последовательность оснований какой-либо тРНК, что мутантный антикодон сможет связываться с нонсенс-триплетом и вставлять в пептидную цепь приемлемую аминокислоту. Можно предполагать, что такая нонсенс-супрессорная мутация будет обладать аллельной специфичностью и плейотропным действием. Таким образом, мутации, которые проявляются в фенотипе на одном генетическом фоне и не проявляются на другом, с наибольшей вероятностью можно считать нонсенс-мутациями.
Идентификация триплетов UAA, UAG и UGA в качестве нонсенс-кодонов была начата в работах Брейнера. Он использовал в качестве объекта определенный класс условных мутантов фага Т4, у которых было нарушено образование белка головки. Эти мутанты, которым было дано общее название амбер, были способны расти на некоторых штаммах E.coli, но не росли на других штаммах. Штаммы-хозяева, на которых росли фаги, назвали пермиссивными, а те, на которых они не росли - непермиссивными. Ряд данных, полученных различными исследователями, указывал, что у амбер-мутантов происходит преждевременная терминация цепи. Можно было сделать вывод, что пермиссивные штаммы клеток-хозяев содержали нонсенс-супрессоры, обеспечивающие синтез нормального или приемлемого для развития фага продукта гена.
Заражение непермиссивного хозяина амбер-мутантом по гену белка головки оказывается не полностью непродуктивным, так как последовательность оснований, предшествующая нонсенс-кодону, все-таки транслируется. Группа Бреннера сравнила генетическую карту ряда таких мутантов с пептидами белка головки, который образуется при заражении непермиссивных хозяев. В белке фага дикого типа было обнаружено восемь пептидов, тогда как во всех мутантных белках число пептидов было меньше. На рис. 3.4 приведено сравнение генетической карты с числом пептидов, которое дают соответствующие мутанты. Белки синтезируются, начиная с N-конца, что соответствует левому краю генетической карты. Можно видеть, что в случае амбер-мутаций, локализованных в левой части генетической карты, образуется меньше пептидов и положение мутации на карте во всех случаях коррелирует с числом пептидов. Этот эксперимент доказал, что шибер-мутации в самом деле вызывают преждевременную терминацию цепи и что ген и его белковый продукт коллинеарны.
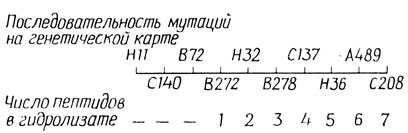
Рис. 3.4. Преждевременная терминация синтеза полипептидов у амбер-мутанта фага Т4 по гену белка головки
Ряд данных указывал на существование более одного типа нонсенс-мутаций. Например, некоторые условные мутации не подавлялись в присутствии одних амбер-супрессоров, но подавлялись в присутствии других. Этот второй тип мутаций получил название охра-мутаций. Между амбер-и охра-кодонами, по-видимому, существовала какая-то связь, так как охра-супрессоры подавляли амбер-мутации, но не наоборот. Последовательность оснований двух соответствующих кодонов была расшифрована с помощью изящного сочетания генетических и биохимических методов. Для этого Бреннер и его коллеги изучили индукцию и реверсию мутаций у фага Т4, вызывающих быстрый лизис клеток (г), под действием химических мутагенов (гидроксиламина и 2-аминопурина). Эти два соединения действуют па ДНК строго специфично: гидроксиламин вызывает замену пары оснований G : С→А.: Т, а 2-аминопурин может превращать G : C→А : Т и обратно. Охра- и амбер-мутанты реагировали на обработку этими мутагенами следующим образом.
| Гидроксиламин | 2-аминопурин | |
| Индукция | Амбер, охра | Амбер, охра |
| Реверсия | Не происходит | Амбер, охра |
| Взаимопревращения | Не наблюдалось | Охра переходит в амбер |
Поскольку гидроксиламин индуцирует возникновение и амбер-, и охра- r-мутантов, можно заключить, что оба мутантных гена содержат хотя бы одну А: Т-пару. Невозможность реверсии амбер- и охра-мутаций под действием этого мутагена показывает, что они не содержат G : С-пар или что превращение G : С→А : Т просто переводит один бессмысленный кодон в другой без изменения фенотипа. Превращение охра в амбер под действием 2-аминопурина должно идти путем замены А : Т→G : C. Следовательно, амбер-кодон ДНК должен содержать А : Т- и G : С-пары, а охра-кодон должен содержать А : Т-пару, соответствующую G : С-паре в амбер-мутанте. Затем исследователи провели эксперимент, который позволил дифференцировать мутации в смысловой и комплементарной ей цепи ДНК. Это дало им возможность сделать вывод, что амбер-кодон в ДНК должен содержать две А: Т-пары в противоположной ориентации и что третьей парой в этом кодоне должна быть пара G : С. Поскольку охра-кодон отличается от амбер-кодона только тем, что содержит А: Т-пару вместо G : С, он должен содержать три А : Т-пары.
Группа Бреннера проанализировала аминокислотный состав пептидов, которые накапливаются при заражении бактериальной клетки амбер-мутантами фага Т4 по гену белка головки, упоминавшимися выше. Они обнаружили, что терминация цепи происходит в тех местах, где в белке дикого типа расположены остатки триптофана и глутамина. У ревертантов амбер-мутантов, как оказалось, на месте обрыва цепи снова появляется одна из этих двух аминокислот. Таким образом, кодоны триптофана, глутамина и амбер-кодон должны различаться заменой одной пары оснований. Триптофан кодируется только одним кодоном, АСС, а глутамин - двумя, СТТ и СТС. Ранее Бреннер показал, что амбер-кодон содержит А, Т и G или С. Триптофановый кодон должен превращаться в амбер-кодон и обратно в результате одной замены пары оснований; поэтому амбер-кодон в ДНК должен быть АТС или ACT. Однако только АТС может превращаться в один из глутаминовых кодонов, CTC, в результате одной замены. Итак, амбер-кодон в ДНК имеет последовательность АТС и в мРНК - UAG. Это значит, что охра-кодон в мРНК должен быть UAA, так как UAU уже был идентифицирован как кодон тирозина.
Третий нонсенс-кодон, UGA, называют опал. Все три кодона были обнаружены в последовательностях ДНК и мРНК. Мы уже говорили о том, что нонсенс- мутации будут супрессироваться под действием тРНК с измененными антикодонами. Поскольку пермиссивные и непермиссивные штаммы клеток-хозяев были обнаружены случайно, можно предположить, что супрессоры нонсенс-мутаций не очень редки. По всей вероятности, штаммы, содержащие такие супрессоры, будут расти хуже, гак как эти клетки неспособны осуществлять правильную терминацию какой-то части белковых цепей. Это предположение в общем, видимо, верно, хотя эффективность супрессии в опытах Бреннера колебалась в пределах 5 - 55%. Оказывается, амбер- и опал-кодоны, которые супрессируются чаще всего, нередко обнаруживаются вместе, следующими друг за другом, что препятствует действию супрессии. Охра-кодон чаще встречается один, поэтому штаммы, несущие охра-супрессоры, растут плохо.
Идентификация кодонов, результаты которой показаны в табл. 3.2, была проведена только в экспериментах на прокариотах или на отдельных ферментах и органеллах эукариот. Поэтому уместно задать вопрос: универсален ли код? Данные, полученные к настоящему времени, свидетельствуют, что это действительно так. Все аминокислотные последовательности и соответствующие нуклеотидные последовательности прокариот и эукариот согласуются с принятыми значениями кодонов; с ними согласуются и все известные замещения аминокислот в гемоглобине человека. Трансляционный аппарат бактерий способен считывать мРНК высших организмов, и наоборот1. Мы уже отмечали, что нуклеотидный состав ДНК различных организмов различается; можно ожидать, что это будет отражаться в использовании синонимичных кодонов. В табл. 3.3 приведены частоты использования 6 кодонов серина у трех фагов, содержащих одноцепочечную ДНК (у фагов G4, ∅'Х174 и MS2), в гене lacl E.coli и в ДНК вируса млекопитающих SV-40. Очевидно, что в этих пяти системах кодоны используются с различной частотой.
1(В последнее время было показано, что генетический код? который используется в митохондриях, несколько отличается от того кода, который до сих пор считался универсальным. - Прим. перев.)
Таблица 3.3
Частота использования сериновых кодонов
| Объект | Общее содержание остатков серина | Частота использования кодонов, % | |||||
| UCU | UCC | UCA | UGG | AGA | AGC | ||
| Фаг ∅X174 | 158 | 41 | 12 | 15 | 16 | 10 | 6 |
| Фаг G4 | 192 | 45 | 14 | 21 | 11 | 6 | 3 |
| Фаг MS2 | 97 | 15 | 21 | 17 | 23 | 8 | 16 |
| Ген lacI | 32 | 22 | 19 | 9 | 15,5 | 15,5 | 19 |
| Вирус SV-40 | 48 | 33 | 8 | 13 | 0 | 33 | 13 |
Итак, мы установили, что генетическим материалом является ДНК (или РНК у некоторых вирусов) и что генетическая информация кодируется в виде линейной последовательности оснований ДНК. Теперь рассмотрим подробнее молекулярные основы мутаций. Мутацию можно определить как любое изменение генетического материала; таким образом, к мутациям относятся химические и физические изменения от замены одной пары оснований до значительных изменений структуры хромосомы. Мы остановимся на так называемых точковых мутациях, которые изменяют одну или несколько пар оснований.
Уотсон и Крик постулировали, что пуриновые и пиримидиновые основания могут существовать в альтернативных таутомерных формах, которые могут образовывать аномальные пары оснований. Альтернативная таутомерная форма аденина может спариваться с цитозином; образующаяся в результате АС-пара при следующем цикле репликации даст нормальную А : Т-пару и мутантную G : С-пару. Это изменение можно отнести к спонтанным мутациям.
Рентгеновские лучи и другие формы ионизирующей радиации вызывают сильное повреждение хромосом. Считается, что их действие обусловлено главным образом вторичными последствиями прохождения заряженных частиц через клетку, так как при этом, возможно, образуются свободные радикалы. Ультрафиолетовый свет (УФ) не вызывает ионизации, но обладает сильным мутагенным действием. Его первичное действие состоит в том, что он вызывает димеризацию соседних пиримидинов. Такие пиримидиновые димеры, среди которых чаще всего встречаются димеры тимин - тимин (рис. 3.5), образуются путем поперечной сшивки двух остатков, расположенных рядом в одной цепи ДНК. Наличие таких димеров нарушает репликацию и транскрипцию и приводит к гибели клетки, если они не подвергаются репарации.
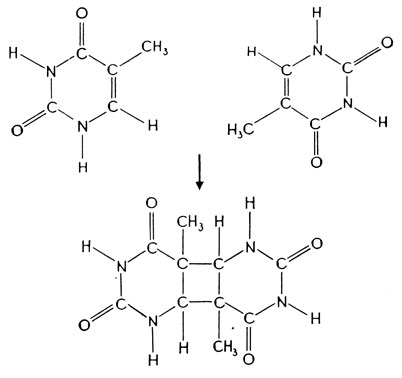
Рис. 3.5. Образование тиминового димера
Клетки обладают несколькими системами для удаления тиминовых димеров. Наиболее эффективная из них - фотореактивация. Этот процесс осуществляется ферментативной системой, которая индуцируется видимым светом. Фермент расщепляет димер на два мономера. Фотореактивация обнаруживается у всех организмов, которые подвергаются действию солнечного света. У облигатного внутреннего паразита Haemophilus influenzae этой системы нет. У людей, больных пигментной ксеродермой, активность фермента фотореактивации сильно понижена; при этой болезни характерна высокая частота возникновения рака кожи. Другие системы репарации активны в темноте. Одна из них, репарация путем "иссечения" (вырезания), весьма эффективна. Образовавшийся димер и участок поврежденной цепи ДНК вырезаются под действием экзонуклеазной активности, а недостающие основания замещаются под действием полимеразы. Если димер не репарирован, аппарат репликации проскакивает его и пропускает, видимо, 1000 нуклеотидов. Эти пропущенные основания, по всей вероятности, замещаются при участии ферментативной системы, которая не обеспечивает строгого спаривания оснований, что приводит к возникновению мутаций.
Многие химические вещества являются мутагенами, и молекулярные механизмы их мутагенного действия в некоторых случаях известны. Наиболее детально изученные соединения можно отнести к следующим группам: а) соединения, воздействующие на нереплицирующуюся ДНК, и б) соединения, действующие на реплицирующуюся ДНК. Кроме того, действие химических мутагенов классифицируют в зависимости от того, какие замены пар оснований они вызывают. Замещения одного пурина или пиримидина другим, A G или С
G или С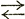 Т, называют транзициями, замены пурина пиримидином, и наоборот, А или G
Т, называют транзициями, замены пурина пиримидином, и наоборот, А или G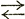 T или С, называют трансверсиями.
T или С, называют трансверсиями.
Рассмотрим вначале соединения, которые действуют на нереплицирующуюся ДНК. Азотистая кислота дезаминирует аденин с образованием гипоксантина (Н), который может спариваться с цитозином, а цитозин под действием азотистой кислоты дезаминируется с образованием урацила, который может спариваться с аденином. Таким образом, азотистая кислота может вызывать следующие изменения:
A : T → H : T → H : C → G : C
и
C : G → U : G → U : A → T : A
Как уже говорилось в настоящей главе, гидроксиламин вызывает замещение G : С → А : Т. Это происходит в результате реакции с аминогруппой при С-4 цитозина. Образующийся гидроксицитозин может спариваться с аденином, что приводит к появлению А: Т-пары.
Видимо, самые распространенные соединения, относящиеся к этой группе, - алкилирующие агенты этилметансульфонат (ЭМС) и N-метил-N'-нитро-N-нитрозогуанидин (НГ). Эти агенты присоединяют к основаниям алкильную группу. В результате модифицированное основание может отщепиться от ДНК, что приводит к ошибке при пострепликациониой репарации или к неправильному спариванию. Алкилированию подвергаются главным образом гуанин и тимин; оно вызывает замещения G : С → А: Т и Т : А → С: G соответственно1.
1(Алкилированию подвергаются преимущественно гуанин и аденин; механизм мутагенного действия не позволяет сделать определенных выводов о возникающих замещениях. - Прим. перев.)
Аналоги нормальных оснований включаются в ДНК во время репликации. Два из них, 5-бромурацил (5BU) и 2-аминопурин (2АР), широко используются в качестве мутагенов при исследовании бактерий. Они действуют, замещая обычные основания в ДНК и переходя затем в альтернативную таутомерную форму, которая отличается своей способностью к спариванию от обычного основания. 5BU - аналог тимина и спаривается с аденином; его альтернативная таутомерная форма может спариваться с гуанином. Таким образом, 5BU может вызывать следующие замены:
A : T → А : 5BU → G : 5BU → G : C
и
G : C → G : 5BU → A : 5BU → A : T
2АР - аналог аденина, который может также спариваться, как гуанин. Поэтому он вызывает замещения
T : A → C : G и С : G → T : A
Структура этих двух аналогов оснований показана на рис. 3.6.
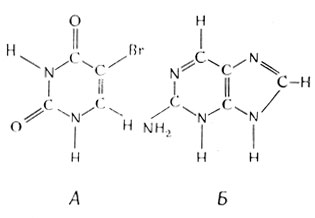
Рис. 3.6. Мутагенные аналоги оснований. А - 5-бромурацил, Б - 2-аминопурин
Мутагенное действие акридинов обусловлено их интеркалированием между соседними основаниями в ДНК. Это приводит к локальному искажению структуры двойной спирали, и в результате при репликации или репарации происходит утрата или добавление одного основания. Поэтому, как мы уже видели в случае профлавина, акридины вызывают мутации со сдвигом рамки. Акридины обладают особенно сильным мутагенным действием в отношении бактериофагов, но они влияют также на репликацию внехромосомной ДНК, например фактора F бактерий и митохондриальной ДНК эукариот. Мутации со сдвигом рамки можно индуцировать у бактерий и высших организмов с помощью акридинипритов, таких, как ICR-170, молекулы которых содержат одновременно акридиновый остаток и алкилирующую группу.
О специфичности мутагенов часто можно судить, исходя из результатов, полученных в опытах по обращению мутаций. Например, можно взять ряд мутантов, индуцированных азотистой кислотой, и проверить их реверсию под действием гидроксиламина и аналогов оснований. Мы уже видели, как такая информация была использована для расшифровки амбер- и охра-кодонов.
Если мы рассмотрим последствия мутации на уровне продукта гена, то увидим, что, за исключением мутаций, вызываемых акридинами, чаще всего изменение кодона приводит к замещению одной аминокислоты другой. Следует отметить, что мутантный фенотип возникает только в том случае, если новая аминокислота частично нарушает или полностью подавляет функцию образующегося белка. Такую мутацию называют миссенс-мутацией (мутацией с изменением смысла). Выше мы уже рассматривали нонсенс-мутации, которые приводят к появлению кодона, терминирующего синтез полипептидной цепи. Эти два типа мутаций, а также мутации со сдвигом рамки обычно можно дифференцировать, исследуя фенотип мутантов, реверсию мутаций и их реакцию на супрессоры. Мутации со сдвигом рамки полностью подавляют синтез продукта гена, их эффект не подавляется нонсенс-супрессорами, и они обращаются только под действием акридинов. Известны также мисенс-супрессоры, но они встречаются крайне редко и обладают высокой специфичностью. Легче всего идентифицировать нонсенс-мутащт, так как их действие подавляется нонсенс-супрессорами.
Эймс и его коллеги использовали эти и другие свойства процесса мутирования для разработки весьма эффективного способа определения мутагенности неизвестных соединений. Ауксотрофные штаммы Salmonella typhimurium с известными генетическими нарушениями наносят в виде газонов на поверхность чашек Петой с синтетической средой, на которой они не растут. Тестируемые соединения помещают в середину чашки. В результате мутагенеза происходит индукция прототрофных ревертантов. Поскольку некоторые соединения становятся мутагенами или канцерогенами только в организме млекопитающих в результате каких-то метаболических превращений, в тест-систему вносят микросомную фракцию клеток печени крысы. Полученные к настоящему времени результаты показывают, что между положительным результатом в тесте Эймса и данными последующего исследования на целых животных или культуре клеток наблюдается совпадение в 95% случаев.
В 1962 г. Чеймп и Бензер обнаружили, что некоторые rll-мутанты фага Т4 обладают способностью расти в клетках E. coli К12 в присутствии 5-фторурацила (5FU), аналога урацила. Поскольку действие 5FU снимается в присутствии урацила, но не тимидина, а потомство фага, образующееся при заражении, сохраняет генотип rll, авторы заключили, что функциональная репарация повреждения, вызванного rll-мутацией, происходит на уровне фенотипа и что аналог действует на мРНК, а не на ДНК. Действительно, структура этого аналога (рис. 3.6) позволяет ему спариваться и с аденином, и с гуанином. Он не включается в ДНК, и восстановление фенотипа происходит в результате изменения взаимодействия кодона мРНК с антикодоном тРНК.
В то время было неизвестно, происходит ли при синтезе мРНК считывание одной или обеих цепей ДНК. Чеймп и Бензер решили, что они могут ответить на этот вопрос, изучая генотипическую и фенотипическую реверсию rll-мутантов. Мутант, ревертирующий под действием 5FU к дикому фенотипу, должен содержать А: Т-пару, которой в гене дикого типа соответствует G : С-пара, как показано ниже:
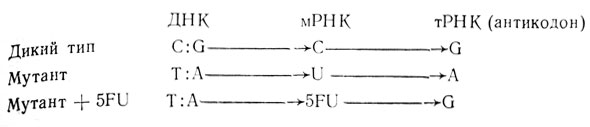
Если обе цепи ДНК транскрибируются, то все мутации, относящиеся к транзициям G : С → А : Т, должны подвергаться фенотипической реверсии в присутствии 5FU. Если же транскрибируется только одна цепь, то ревертировать в присутствии 5FU будут только те транзиции, при которых А окажется в смысловой цепи. Авторы проанализировали 109 rll-мутантов на способность к реверсии под действием 2АР, гидроксиламина, 5BU и 5FU. Этот подход позволил им разделить всех мутантов на четыре группы и определить, какое основание содержится в смысловой цепи мутантов. Результаты этих экспериментов суммированы в табл. 3.4.
Таблица 3.4
Реверсия генотипа и фенотипа rll-мутантов [Данные из статьи Champe S. P., Benzer S. (1962), Proc. Nat. Acad. Sci. USA, 48, 532.]
| Класс мутантов | Число мутантов | Индукция реверсии под действием | Пара оснований | Смысловая цепь | |||
| 2АП | 5BU | NH2OH | 5FU | ||||
| 1 | 17 | + | - | - | + | А : Т | A |
| 2 | 31 | + | - | - | - | А : Т | Т |
| 3 | 21 | + | + | + | - | G : C | G или C |
| 4 | 40 | - | - | - | - | ? | ? |
Известно, что гидроксиламин вызывает только транзиции G : С → А : Т, поэтому мутанты 3-го класса должны содержать G : С-пару. Это значит, что мутанты 1-го и 2-го классов, которые ревертируют только в присутствии 2АР, содержат А : Т-пару, которая ревертирует в G : С-пару. Однако фенотипическая реверсия под действием 5FU наблюдается только у мутантов 1-го класса. Мутанты этого класса содержат в смысловой цепи А, который спаривается с 5FU в мРНК.
Теперь мы можем подытожить изложенное. Мы определили ген как функциональную единицу, определяющую синтез одного первичного продукта, который может быть полипептидом или молекулой РНК, транспортной или рибосомной. Данные, приведенные в настоящей главе, позволяют рассматривать ген как последовательность пар оснований, соответствующая мРНК которой начинается с инициирующего кодона, считывается триплетами и кончается терминирующим кодоном. Как мы увидим в гл. 5 и 6, это - упрощенное представление. Некоторые последовательности оснований выполняют регуляторную функцию и не транскрибируются, тогда как другие транскрибируются, но не транслируются.
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'