
2. Нуклеиновые кислоты как генетический материал
Роль хромосом в наследственности была признана примерно в то же время, когда Гаррод высказал предположение, что нехватки ферментов наследуются. К этому времени детали мейоза и митоза были в общем хорошо известны, и было ясно, что поведение хромосом в мейозе соответствует расхождению аллельных пар. Независимое расхождение признаков в двухфакторных скрещиваниях можно было объяснить тем, что соответствующие аллельные пары расположены в различных хромосомах и что различные пары хромосом сегрегируют независимо друг от друга.
Как и в биохимической генетике, один из пионеров цитологии Э. Вильсон в 1900 г. выдвинул поразительно точное предположение, согласно которому периодические изменения способности хроматина к окрашиванию на протяжении клеточного цикла обусловлены тем, что важнейшими компонентами хромосом являются нуклеиновые кислоты. В то время было известно, что хромосомы состоят в основном из нуклеиновых кислот и гистоновых белков. С помощью доступных тогда методов окрашивания было показано, что во время деления клетки большая часть белков отделяется от хромосом, тогда как нуклеиновые кислоты сохраняются. Предположением Вильсона, как и гипотезой Гаррода, большинство исследователей пренебрегло. Цитологи не сомневались, что хромосомы - носители наследственности; но ведь они содержат нуклеиновые кислоты и белки. Химический анализ показал, что белки построены весьма сложно, что существует множество аминокислот и, следовательно, число возможных структурных комбинаций достигает астрономических величин. По сравнению с белками нуклеиновые кислоты химически просты - сахар, фосфат, пуриновые основания (аденин и гуанин) и пиримидиновые основания (тимин и цитозин). Было очевидно, что это слишком простые соединения, чтобы нести всю ту генетическую информацию, которая необходима для развития сложного живого организма.
События, позволившие установить, что ДНК является генетическим материалом, лежали в стороне от главного русла генетических исследований. В качестве экспериментальных организмов в них использовали различные штаммы патогенных бактерий, и экспериментаторы должны были публиковать свои данные преимущественно в медицинских журналах; вследствие этого большинство генетиков не знало об этих работах.
В 1928 г. Ф. Гриффит изучал вирулентные и авирулентные штаммы бактерии Diplococcus pneumoniae. Штаммы, которые он использовал, различались по нескольким признакам: вирулентные штаммы имеют полисахаридную капсулу и образуют на агаре гладкие колонии, тогда как авирулентные штаммы утратили способность к образованию капсулы и образуют шероховатые колонии. Кроме того, у Гриффита было два штамма Diplococcus, различающихся по своим антигенным свойствам или по серотипу. Штаммы, использованные им в решающих экспериментах, имеют следующие свойства.
| Вирулентность | Морфология колоний | Серотип | Обозначение |
| Вирулентный | Гладкие | III | IIIS |
| Авирулентный | Шероховатые | II | IIR |
Гриффит установил, что при введении бактерий IIR, а также убитых нагреванием бактерий IIIS мыши выживают. При введении живых клеток IIIS мыши, конечно, гибнут. Когда же он ввел одновременно два безвредных по отдельности препарата, клетки IIR и убитые нагреванием клетки IIIS, то с удивлением обнаружил, что мыши гибнут. Из этих погибших мышей Гриффиту удалось выделить вирулентные бактерии с серотипом III (IIIS). Контрольные эксперименты показали, что этот результат был обусловлен не какой-то методической ошибкой, а теми взаимодействиями, которые происходят между введенными бактериальными клетками в организме мыши. Гриффит предположил, что убитые нагреванием бактерии IIIS каким-то образом превращают живые клетки IIR в вирулентные клетки IIIS. Он назвал это явление трансформацией и предположил, что трансформирующим началом служит полисахаридная оболочка вирулентных клеток или какие-то клеточные компоненты, необходимые для синтеза оболочки. По-видимому, он недооценил тот факт, что трансформация вызывала наследуемые изменения бактерий.
В течение нескольких последующих лет было вначале показано, что для получения данного эффекта не обязательно вводить бактерии мышам: трансформация бактерий IIR в бактерии IIIS происходит просто при выращивании живых клеток IIR в присутствии убитых нагреванием клеток IIIS. Затем оказалось, что достаточно проинкубировать живые клетки IIR в присутствии бесклеточного экстракта IIIS. Таким образом, трансформация стала явлением, легко воспроизводимым в лабораторных условиях in vitro.
Эти достижения позволили Эвери, Мак-Леоду и Мак- Карти осуществить в 1944 г. химическую идентификацию трансформирующего начала. Они экстрагировали и очистили трансформирующее начало из большого количества культур IIIS Diplococcus (теперь переименованных в Pneumococcus). Клетки убивали нагреванием, экстрагировали с помощью лизиса в присутствии детергента и после осаждения абсолютным этанолом и депротеинизации хлороформом получали трансформирующее начало в высокоактивной форме. Конечный продукт давал отрицательные реакции на белок и РНК и резко положительную реакцию на ДНК. Трансформирующая активность препарата была устойчива к протеолитическим ферментам и рибонуклеазе, но разрушалась под действием ферментов, расщепляющих ДНК.
С помощью этих экспериментов было твердо установлено, что ДНК способна переносить генетическую информацию от одной бактерии к другой. Уже не за горами было и признание роли ДНК в генетике высших организмов. В 1924 г. Фёльген показал, что основной фуксин специфически окрашивает гидролизованную ДНК, после чего этот краситель стал широко использоваться цитологами для окрашивания хромосом.
В 1950 г. Свифт применил метод фотометрии для определения количества красителя и, следовательно, ДНК в клетках на различных стадиях митоза и мейоза. Результаты, которые он получил, работая с клетками Tradescantia и Zea mays, приведены в табл. 2.1.
Таблица 2.1
Относительное содержание ДНК на протяжении клеточного цикла Tradescantia paludosa и Zea mays (из статьи Swift Н. S., Proc. Nat. Acad. Sci. USA, 11, 643 - 654, 1950)
| Фаза клеточного цикла | Содержание ДНК1 | |
| Tradescantia | Zea mays | |
| Митоз | ||
| Интерфаза | 2,0 | 2,0 |
| Профаза | 4,0 | 4,0 |
| Телофаза | 2,0 | 2,0 |
| Мейоз I | ||
| Лептотена | 3,0 | |
| Зиготена | 3,0 | |
| Пахитена | 4,0 | |
| Диплотена | 4,0 | |
| Мейоз II | ||
| Телофаза | 1,0 | |
1(За единицу принято наименьшее из полученных значений.)
Относительное содержание ДНК в ядрах обоих организмов четко коррелирует со стадиями клеточного деления; изменение количества ДНК соответствует поведению хромосом.
В то время компоненты ДНК были хорошо известны: сахар дезоксирибоза, фосфат, аденин, гуанин, тимин и цитозин. Было известно, что элементарная единица ДНК содержит пуриновое или пиримидиновое соединение, сахарный остаток и фосфат и представляет собой нуклеотид. Строение пуриновых и пиримидиновых оснований и соответствующих нуклеотидов приведено на рис. 2.1. Однако относительное содержание каждого из четырех нуклеотидов не было исследовано, и обычно считалось, что ДНК состоит из повторяющихся структурных единиц, содержащих по четыре нуклеотида.
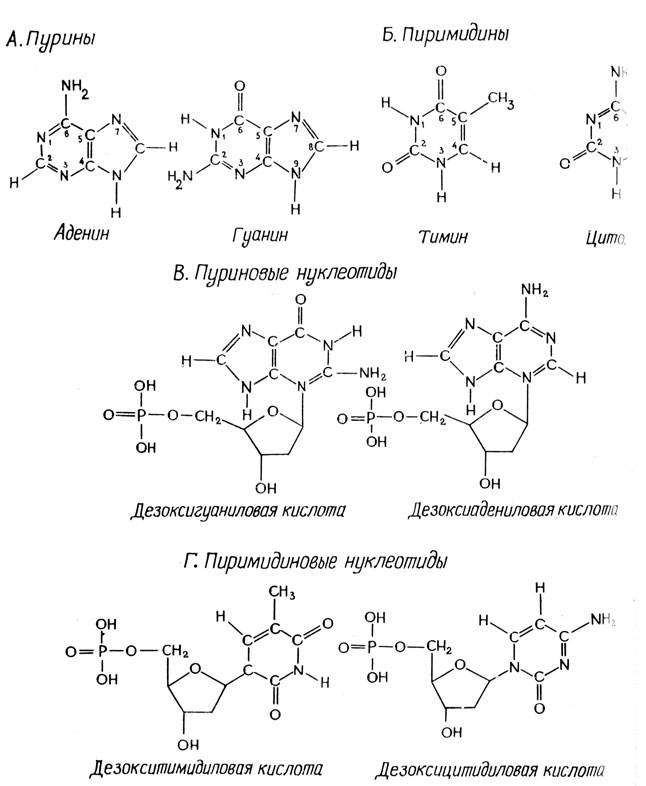
Рис. 2.1. Структурные формулы пуриновых и пиримидиновых оснований и соответствующих нуклеотидов
Важнейший шаг в изучении соотношения различных нуклеотидов в ДНК был сделан Чаргаффом в 1950 г. Он выделил высокоочищенную ДНК из разных тканей и различных организмов. Эти образцы гидролизовали кислотой для отщепления пуриновых и пиримидиновых оснований, которые затем разделяли с помощью хроматографии на бумаге. Пятна, соответствующие различным основаниям, идентифицировали и определяли количество оснований методом ультрафиолетовой спектрофотометрии. Чаргафф обнаружил, что относительное содержание пуринов и пиримидинов было видоспецифично, но не тканеспецифично (табл. 2.2). Главное его открытие состояло в том, что молярное соотношение общего количества пуринов и пиримидинов равно примерно единице; кроме того, он показал, что молярное содержание аденина было примерно равно содержанию тимина, а гуанина - цитозину. Таким образом, на каждый остаток аденина в ДНК приходится один остаток тимина, и на каждый остаток гуанина - один цитозин. Это явление равного молярного содержания оснований часто называют "правилом Чаргаффа". Оно сыграло ключевую роль в установлении структуры ДНК.
Таблица 2.2
Содержание пуринов и пиримидинов в ДНК
(Рассчитано относительно содержания аденина по данным Чаргаффа (Chargaff Е. 1950, Experientia, 6, 201 - 209).)
| Организм | Ткань | Аденин | Тимин | Гуанин | Цитозин |
| Человек | Сперма | 1,00 | 1,07 | 0,62 | 0,62 |
| Тимус | 1,00 | 1,00 | 0,68 | 0,57 | |
| Бык | Тимус | 1,00 | 0,83 | 0,72 | 0,61 |
| Селезенка | 1,00 | 0,92 | 0,81 | 0,65 | |
| Дрожжи | 1,00 | 0,97 | 0,60 | 0,50 | |
| Туберкулезная палочка птичьего типа | 1,00 | 0,92 | 2,32 | 2,16 |
К тому времени ДНК привлекала внимание биологов, биохимиков и биофизиков. Эксперименты Херши и Чейза, проведенные в 1952 г., показали, что ДНК является генетическмериалом фага Т2; это было еще одним доводом в пользу важного биологического значения молекулы ДНК. Основные компоненты фага - ДНК и белок. Их можно пометить по отдельности, используя 32Р, который включается только в ДНК, и 35S, включающейся лишь в белок. Фаги метили путем инфицирования и последующего лизиса бактерий, которые были выращены в среде, содержащей 32Р-ортофосфат и 35S-сульфат магния. Получив в результате меченые фаги, их использовали для заражения и лизиса немеченых бактерий. Вначале авторы показали, что фаговая ДНК вводится в бактерию, причем 45% 32Р обнаруживается в фаговом потомстве, а 87% 35S связано с бактериальным дебрисом, образующимся в результате лизиса. Современные электронные микрофотографии показывают, что фаг Т2 прикрепляется к бактерии-хозяину с помощью отростка. Херши и Чейз решили, что если культуру таких бактерий с прикрепленным фагом Т2 перемешивать в гомогенизаторе Уоринга, то головки фагов отделятся от бактерий и, следовательно, проникнувшую в клетки ДНК можно будет отделить от остальной части фаговой частицы. Поставив такой опыт, они обнаружили, что при такой обработке терялось 86% 35S-метки из препарата зараженных бактерий, хотя способность давать нормальный выход фагового потомства при этом не изменялась.
Структуру ДНК установили Уотсон и Крик в 1953 г. Книга Уотсона "Двойная спираль" - подробное изложение событий, которые привели к одному из самых значительных открытий в истории науки. Ни Уотсон, ни Крик не занимались в то время ДНК, но оба понимали, что расшифровка ее структуры позволит решить одну из основных загадок жизни и почти наверняка принесет им Нобелевскую премию.
Любая модель ДНК должна учитывать биологические свойства, которыми должно обладать вещество наследственности: точное удвоение, способность хранить генетическую информацию и потенциальную способность к мутациям. Кроме того, она должна удовлетворять правилу Чаргаффа. Химические данные определенно указывали на то, что молекула ДНК обладает какой-то комплементарностью; по всей вероятности, эта комплементарность имела существенное биологическое значение.
В это время Розалинд Франклин и Уилкинс в Лондоне исследовали структуру ДНК с помощью дифракции рентгеновских лучей. Незадолго до этого Полинг использовал тот же метод для доказательства α-спиральной структуры белков. Суть его состоит в следующем. Через кристалл исследуемого вещества пропускают тонкий пучок рентгеновских лучей и регистрируют дифракционную картину на фотопластинке. Если сравнить картины, полученные при различных положениях кристалла относительно пучка, можно выяснить расположение элементарных структурных единиц, составляющих этот кристалл. Анализ дифракционных картин, проведенный Франклин, показал, что структура представляет собой спираль с повторяющимися через каждые 3,4 и 0,34 нм элементами. Следовательно, спираль состоит из пуриновых и пи- римидиновых оснований, расположенных на расстоянии 0,34 нм, причем на один поворот спирали приходится 10 оснований. Теперь были известны биологические, химические и физические требования, которым должна удовлетворять модель.
Уотсон решил, что самый плодотворный подход - тщательно строить молекулярные модели, пока не будет найдена модель, удовлетворяющая соответствующим физическим и химическим требованиям. Наиболее разумная модель представляла собой двойную спираль, в которой два сахарофосфатных остова удерживались водородными связями соединенных попарно оснований. Из правила Чаргаффа и физических параметров молекулы вытекало, что каждая пара оснований должна состоять из одного пурина и одного пиримидина, а из молекулярной совместимости (способности образовывать нужные водородные связи) - что такими парами должны быть аденин: тимин и гуанин: цитозин. Структуры этих пар оснований приведены на рис. 2.2.
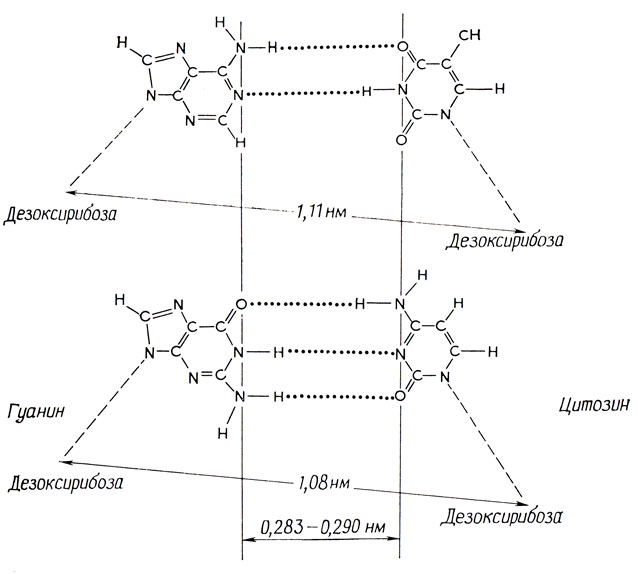
Рис. 2.2. Возможные пары оснований в ДНК
Если к тому же принять во внимание структуру нуклеотидов, то легко представить, что двойная спираль ДНК должна состоять из антипараллельных полуспиралей: в одной из них остатки сахара соединяются фосфатными группами в направлении 3'→5', тогда как в другой - в направлении 5'→3'. Эти полуспирали часто называют "Уотсон" и "Крик", не уточняя, какое из этих имен соответствует направлению 3'→5', а какое - направлению 5'→3'. Строение двойной спирали ДНК схематически показано на рис. 2.3, А. Уотсон и Крик считали, что предложенная ими структура обладает способностью к точному удвоению. Поскольку полуспирали комплементарны, они могут служить матрицами для синтеза точно таких же полуспиралей. Это свойство модели иллюстрируется на рис. 2.3, Б. Уотсон и Крик предложили также возможный механизм мутаций: таутомерный сдвиг атомов водорода аденина позволяет ему спариться с цитозином. Если это случится во время репликации, произойдет замена исходной пары оснований аденин: тимин парой гуанин: цитозин. В то время когда была предложена модель, авторы не могли представить, каким образом структура ДНК позволяет ей так специфически влиять на клетку; но они указали, что эта специфичность, возможно, обусловлена последовательностью пар оснований в молекуле.
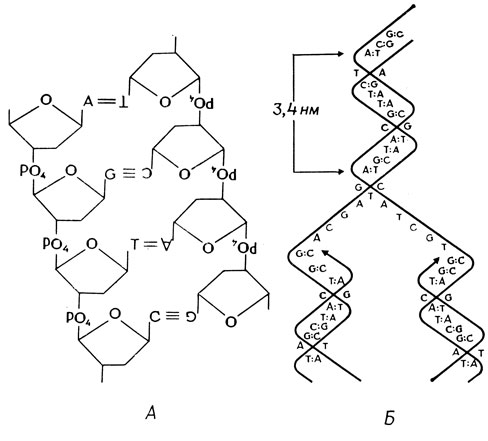
Рис. 2.3. Двойная спираль ДНК. А - строение, Б - репликация
Одно из предсказаний модели Уотсон а и Крика - это способ репликации с образованием двух идентичных дочерних молекул: каждая из них должна состоять из одной старой и одной новой полуспирали. Данные, подтверждающие правильность этого предсказания, получили Меселсон и Сталь в 1958 г. Они исходили из того, что, если получить ДНК, в которую вместо обычного легкого изотопа 14N будет входить тяжелый изотоп азота 15N, плотность молекул ДНК изменится и их можно будет отделить от легких молекул центрифугированием в градиенте плотности. При использовании этого метода препарат ДНК наслаивают на концентрированный раствор хлористого цезия и подвергают высокоскоростному ультрацентрифугированию. В центробежном поле образуется градиент концентрации соли, и молекулы ДНК седиментируют до тех пор, пока их плавучая плотность не уравновесится с плотностью раствора соли. Меселсон и Сталь показали, что препараты ДНК, содержащие 15N и 14N, можно полностью разделить с помощью этого метода (рис. 2.4). Затем они выращивали E. coli в среде, содержащей 15NH4Cl в качестве единственного источника азота, пока вся ДНК не была равномерно помечена. После этого был добавлен избыток l4NH4Cl и бактерии продолжали выращивать на протяжении четырех поколений. Через определенные промежутки времени отбирали образцы культуры, и ДНК анализировали с помощью ультрафиолетовой спектрофотометрии и микроденситометрии после равновесного центрифугирования. Результаты этого эксперимента схематически показаны на рис. 2.4. Можно видеть, что после одного деления в среде, содержащей 14N, молекулы обладают промежуточной плотностью; этот факт можно объяснить образованием гибрида, в котором одна старая полуспираль, содержащая 15N, соединена с новой14N-полуспиралыо - в точном соответствии с предсказанием Уотсона и Крика. В следующем поколении появляются молекулы с плотностью, соответствующей 14N-ДНК, что указывает на репликацию гибридных спиралей 15N : 14N с образованием чистой 14N : 14N-спирали и гибрида 15N : 14N. Молекулы с плотностью, соответствующей гибридам, обнаруживаются еще через четыре поколения после пересева на среду с 14N. Это указывает, что в процессе репликации линейная целостность полуспиралей сохраняется. Такой способ репликации называется полуконсервативным. Модель консервативной репликации, при которой исходная двойная спираль служит матрицей для синтеза новой двойной спирали, была убедительно опровергнута этим экспериментом.
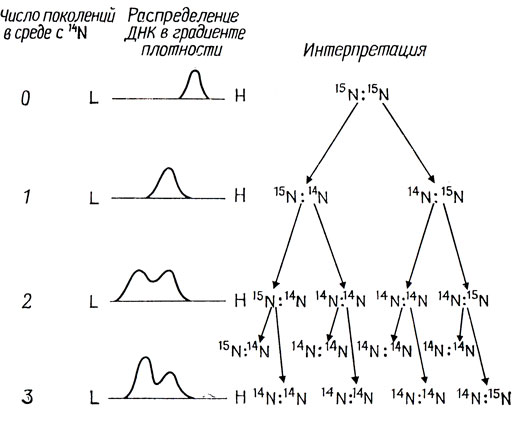
Рис. 2.4. Эксперимент Меселсона и Сталя
Спустя год, в 1959 г., Тэйлор, Вудс и Хьюз показали, что хромосомы высших организмов также реплицируются полуконсервативно. ДНК можно специфически пометить, включив в нее меченный тритием тимидин (3Н - TdR) - предшественник тимина, входящего в состав ДНК. Если покрыть меченые препараты слоем фотографической эмульсии, можно увидеть распределение включившейся метки. Положение зерен серебра, наблюдаемое после проявления эмульсии, соответствует молекулам ДНК, включившим радиоактивную метку. В качестве объекта исследования Тэйлор и его коллеги использовали бобы, Vicia faba, которые имеют характерные крупные хромосомы. Проросшие горошины инкубировали в солевой среде, содержащей 3Н-тимидин, чтобы хромосомы равномерно пометались, а затем переносили в нерадиоактивную среду и инкубировали в ней в течение 34 ч; этого достаточно, чтобы закончился митотический цикл, который длится 24 ч. При этом раствор содержал колхицин - вещество, ингибирующее образование митотического веретена. Благодаря этому легче рассмотреть отдельные хромосомы; кроме того, колхицин вызывает полиплоидизацию.
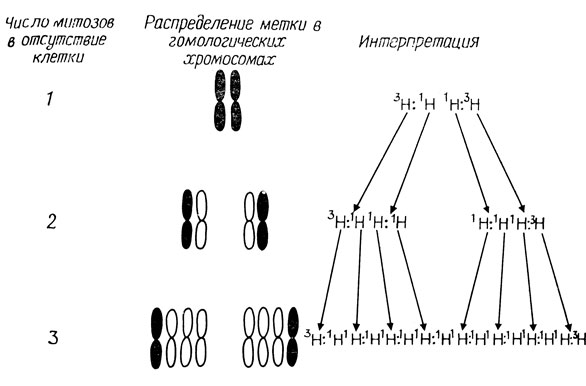
Рис. 2.5. Судьба меченой ДНК при последовательных удвоениях хромосом Vicia faba
При радиоавтографии хромосом в метафазе митоза клеток, которые росли в присутствии колхицина в течение 10 ч, оказалось, что плотность гранул серебра в спаренных хроматидах одинакова, а следовательно, одинаково и включение 3Н-тимидина. Через 34 ч роста в присутствии колхицина многие клетки прошли полный митотический цикл и стали тетраплоидными. В метафазных пластинках этих клеток метка обнаруживалась только в одной хроматиде каждой хромосомы (рис. 2.5). Некоторые клетки были октаплоидными; в таких клетках у половины хромосом одна хроматида была помечена, а остальные хромосомы не содержали метки. Этот эксперимент четко продемонстрировал, что репликация ДНК в эукариотической клетке происходит в соответствии с моделью Уотсона и Крика. Кроме того, он указывал, что при репликации хромосомы ДНК хроматиды ведет себя как одиночная линейная структура.
Радиоавтографические исследования Кэрнса, выполненные в 1963 г., позволили установить, что хромосома E. coli реплицируется как одно целое, т. е. представляет собой единый репликон. Казалось маловероятным, что обычная эукариотическая хромосома также представляет собой один репликон, так как в этом случае репликация всей ДНК хромосомы заняла бы слишком много времени. В 1968 г. Хьюберман и Риггс установили, что хромосомы млекопитающих состоят из множества последовательно расположенных репликонов и что репликация этих репликонов идет в двух направлениях. Они вводили в культуру клеток 3Н-тимидин в течение непродолжительного промежутка времени, а затем после такой "горячей импульсной метки" добавляли избыток немеченого тимидина (вытеснение метки). При исследовании включения метки методом радиоавтографии было обнаружено, что вдоль одной хромосомы имеется много мест одновременного синтеза ДНК. Кроме того, можно видеть, что на обоих концах каждого меченого участка плотность зерен серебра уменьшается; по всей вероятности, это происходит в результате разведения метки избытком "холодного" (немеченого) тимидина на обоих концах репликонов. Следовательно, синтез ДНК одного репликона начинается в определенной точке и затем идет в обоих направлениях, пока не достигнет определенного сайта, получившего название точки терминации. Репликоны любой данной хромосомы не синхронизированы. На рис. 2.6 показана схема репликации эукариотической хромосомы, основанная на этих данных.
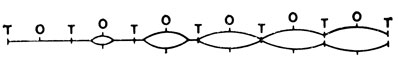
Рис. 2.6. Репликация эукариотической хромосомы. Обратите внимание на то, что in vivo репликоны реплицируются асинхронно
Три года спустя, в 1971 г., Мастерс и Брода доказали двунаправленную репликацию хромосомы E. coli. На кольцевой карте сцепления хромосомы E. coli начало и конец репликации расположены в строго определенных точках.
Схема репликации, предложенная Уотсоном и Криком, предполагала, что новые одноцепочечные спирали синтезируются одновременно, как показано на рис. 2.3, Б. Однако все известные ферменты, которые катализируют синтез ДНК in vitro, работают только в направлении 5'→3'. Таким образом, одна цепь должна синтезироваться в направлении репликационной вилки, а другая - от нее, как показано на рис. 2.7. Эта модель прерывистого синтеза ДНК была предложена на основании экспериментов Оказаки, проведенных в 1968 г. Он обнаружил, что при культивировании E. coli в условиях, при которых время одной генерации очень велико (около 3 ч), кратковременная (импульсная) инкубация в присутствии Н-тимидина приводит к включению метки в полинуклеотидные цепи длиной около 1000 пар оснований. При более длительной импульсной метке получаются более длинные меченые куски; следовательно, короткие фрагменты соединялись между собой и образовывали более длинные. В настоящее время имеются убедительные данные о том, что и у прокариот и у эукариот синтез в направлении от репликационной вилки идет путем образования коротких фрагментов Оказаки, которые соединяются под действием ДНК-лигазы. Синтез ДНК в направлении репликационной вилки идет, по-видимому, непрерывно.
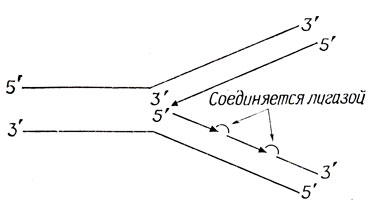
Рис. 2.7. Прерывистый синтез ДНК
Рассмотрим теперь энзимологию синтеза ДНК. У E. coli были обнаружены три ДНК-полимеразы; все они могут считывать одноцепочечную матрицу в подходящей солевой среде в присутствии четырех дезоксирибонуклеотидов. Однако все они нуждаются в затравке - короткой последовательности оснований, связанных с матрицей водородными связями и имеющих свободную 3'-концевую гидроксильную группу, на которой может начаться синтез. В 1963 г. Де Лючия и Кэрнс подвергли клетки E. coli мутагенному воздействию и проверили выжившие клетки на присутствие активности ДНК-полимеразы I. Этот фермент был изучен Корнбергом, установившем, что он способен правильно синтезировать ДНК in vitro. Однако он обладал способностью расщеплять ДНК как в направлении 5'→3', так и в направлении 3'→5'. Поэтому можно было предположить, что он проявляет свою активность в основном при репарации поврежденной ДНК, а не при репликации. Проверив несколько тысяч культур, Де Лючия и Кэрнс нашли один мутант, у которого осталось менее 1% активности ДНК-полимеразы I по сравнению с родительским штаммом. Этот мутант, не обладающий ДНК-полимеразой I, хорошо рос, но проявлял повышенную чувствительность к ультрафиолетовому свету. Существование такого мутанта делало весьма маловероятным, что именно ДНК-полимераза I является тем ферментом, который отвечает за синтез ДНК при репликации.
Оставались полимеразы II и III. Для того чтобы выяснить, какой из этих ферментов отвечает за синтез ДНК in vivo, Гефтер и его сотрудники проверили активность этих двух ферментов у ряда мутантов, у которых ДНК могла реплицироваться при 30°С, но не при 42°С. Мутации в этих клетках затрагивали 7 генов, от dna А до dna G. Культуры мутантов выращивали при 25°С; затем из бесклеточного экстракта выделяли полимеразы и определяли их активность при 30 и 45°С. Результат этого эксперимента, был однозначен: полимераза II мутантов по всем семи генам была активна при обеих температурах, тогда как активность полимеразы III у мутантов по гену dnaE при 45°С была понижена до минимального уровня и оставалась на нормальном уровне у мутантов по остальным шести генам. Отсюда авторы сделали вывод, что ген dnaE кодирует ДНК-полимеразу III и что именно этот фермент отвечает за репликацию ДНК в клетках E. coli in vivo.
В событиях, связанных c репликацией ДНК, участвуют и другие белки помимо ДНК-полимеразы. ДНК-гираза действует впереди репликационной вилки; она вызывает образование в молекуле ДНК супервитков отрицательного знака1; расплетающий фермент разделяет цепи ДНК в области репликационной вилки, а белок, дестабилизирующий двойную спираль, удерживает их в расплетенном состоянии, что необходимо для самого процесса репликации. Репликация начинается с образования РНК-затравки длиной примерно в 100 нуклеотидов. Эта затравка комплементарна матричной цепи ДНК. Затем полимераза III присоединяет нуклеотиды к 3'-ОН-группе затравки до тех пор, пока не достигает предыдущей РНК-затравки. Затравки удаляются под действием 5'→3'-экзонуклеазной активности ДНК-полимеразы I и замещаются дезоксирибонуклеотидами под действием того же фермента. Теперь ДНК-лигаза соединяет образовавшиеся фрагменты Оказаки.
1(По всей вероятности, автор имеет в виду другой фермент, ДНК-топоизомеразу, который действует как шарнир, снимающий напряжение в молекуле ДНК, и не расходует при этом АТР; ДНК-гидраза, наоборот, закручивает ДНК, используя энергию АТР, и не имеет прямого отношения к процессу репликации. - Прим. перев.)
До сих пор мы рассматривали только ДНК. Обратимся теперь к другой нуклеиновой кислоте, очень сходной с ДНК, - к РНК. В отличие от ДНК она содержит сахар рибозу вместо дезоксирибозы и урацил вместо тимина. РНК чаще всего находится в виде одноцепочечных, а не двухцепочечных молекул. На рис. 2.8 приведены структурные формулы урацила, рибозы и уридиловой кислоты. РНК играет очень важную роль в метаболизме; информационная РНК (матричная РНК, мРНК) транскрибируется с ДНК и транслируется с образованием белка; транспортная РНК (тРНК) - адапторная молекула, которая обеспечивает связь между аминокислотами и мРНК при трансляции генетической информации, и наконец, рибосомная РНК (рРНК) - структурный компонент рибосом. Хотя РНК представляет собой в основном одноцепочечные молекулы, входящие в нее пуриновые и пиримидиновые основания способны спариваться, как и в ДНК, причем аденин спаривается с урацилом, а гуанин - с цитозином. Такие спаренные участки позволяют молекулам принимать определенную вторичную и третичную конфигурацию; они имеют важное значение для специфического функционирования различных РНК.
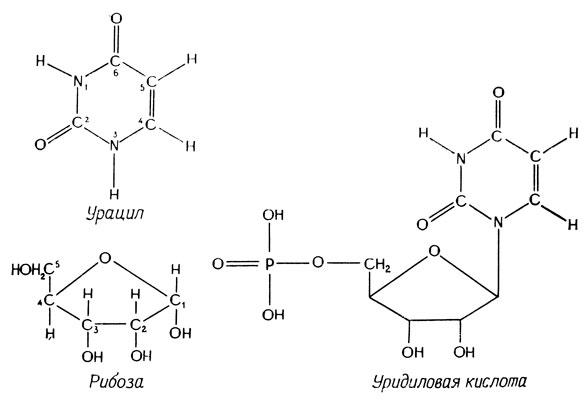
Рис. 2.8. Урацил и уридиловая кислота
РНК - генетический материал у ряда вирусов, поражающих самые различные организмы - от E. coli до человека. Одним из первых генетически исследованных вирусов был вирус табачной мозаики (ВТМ), который при введении в листья табака вызывает некротические поражения. Этот вирус состоит из большого числа идентичных белковых субъединиц, уложенных в палочковидную структуру, через которую проходит одноцепочечная нить РНК (рис. 2.9).
В 1956 г. Гирер и Шрамм показали, что генетическим материалом ВТМ является именно эта РНК. Они удаляли белковую оболочку с помощью фенола и получали препарат чистой РНК. Если эту РНК наносили на листья табака, она вызывала характерные некротические поражения; эффективность заражения составляла 2% от эффективности нативного вируса. Дальнейшее развитие этой работы, по-видимому, одно из самых изящных и убедительных доказательств генетической роли нуклеиновых кислот.
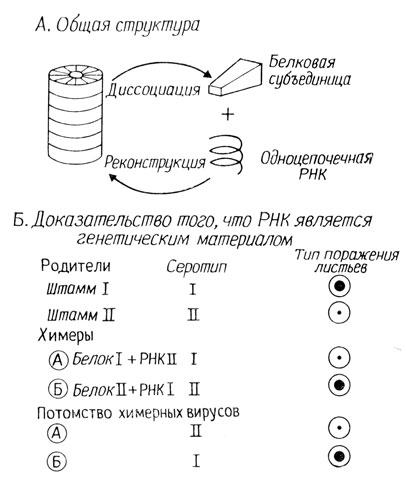
Рис. 2.9. Вирус табачной мозаики (ВТМ)
В 1955 г. Френкель-Конрат показал, что белковый и нуклеиновый компоненты ВТМ можно диссоциировать и затем реассоциировать; правда, инфекционность при этом падает на 97%. Затем он показал, что путем реассоциации РНК и белка двух различных штаммов вируса можно получить "химеры". Эти два штамма различались серотипом и характером некротических поражений, которые они вызывали. Реконструированные "химеры" вируса обладали серотипом того родительского штамма, от которого был взят белок, но вызывали поражения, характерные для родительского штамма - донора РНК. Эта ситуация проиллюстрирована на рис. 2.9. Эксперимент Френкель-Конрата отчетливо показал, что именно РНК определяет взаимодействие вируса и клетки-хозяина, а также генотип и фенотип вирусного потомства.
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'