
1. Организмы, гены и ферменты
Считается, что гибриды между родственными организмами часто оказываются более сильными и плодовитыми, чем их родители. То же самое можно сказать и о науке, возникшей в результате слияния двух других наук, как это произошло, в частности, с генетикой и биохимией. Гибрид, получивший название биохимической, или молекулярной, генетики, оказался необычайно продуктивным и дал больше информации, чем ее можно было получить из генетики и биохимии по отдельности. Настоящая книга - попытка описать в общих чертах, как возник этот гибрид и к чему привело его развитие.
Хотя при экспериментальных исследованиях в области молекулярной генетики используется множество самых разнообразных организмов, основные результаты были получены при исследовании человека и микроорганизмов. Важнейшие из них - бактерия Escherichia coli и ее фаги λ, (лямбда), Т4, а также два гриба, Neurospora crassa и Saccharomyces cerevisiae (дрожжи). Поэтому, для того чтобы познакомиться с экспериментальными основами биохимической генетики, необходимо описать генетические системы этих организмов.
Оба гриба принято относить кэукариотам; они различаются тем, что Neurospora образует гифы, а дрожжи - одноклеточные, одноядерные организмы. Жизненный цикл Neurospora показан на рис. 1.1, а жизненный цикл дрожжей рассматривается в гл. 4. Neurospora растет на поверхности твердой питательной среды, содержащей агар, в виде сплетения гиф, мицелия.
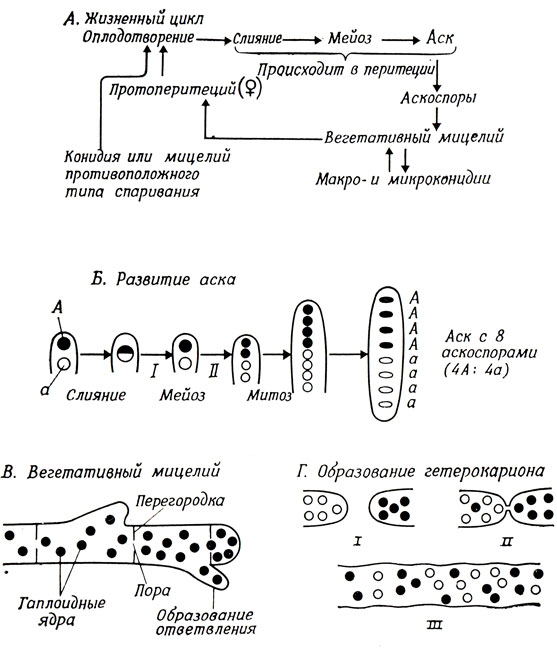
Рис. 1.1. Neurospora crassa
Гифы - многоядерные образования; в них на определенных расстояниях расположены перегородки, но они имеют поры, через которые могут проходить ядра. Мицелий образует конидиеносцы, на которых образуются многоядерные конидии. Половой цикл контролируется двумя аллелями, А и а, локализованными в локусе, детерминирующем тип спаривания. Культуры обоих типов спаривания могут образовывать женские органы размножения, которые называются протоперитециями; они могут быть оплодотворены при любом контакте с "клеткой" противоположного типа спаривания. Пара ядер, принадлежащих к различным типам спаривания, претерпевает сложную последовательность делений и слияний и образует много одинаковых диплоидных ядер внутри общего перитеция. Эти диплоидные ядра немедленно вступают в мейотическое деление и образуют отдельные аски. Гаплоидные продукты мейоза делятся митотически и образуют четыре пары гаплоидных аскоспор. Аскоспоры можно выделить в большом количестве как случайный набор продуктов мейоза, или из одного аска, и проанализировать сегрегацию генетических маркеров.
В обычных условиях все ядра в одной колонии имеют один и тот же генотип: в то же время гифы с ядрами различных генотипов могут сливаться и образовывать гетерокарион. Эту систему можно использовать для изучения взаимодействия различных генотипов в общей цитоплазме.
С точки зрения генетика, особенно удобны следующие особенности Neurospora: а) гаплоидность, так как мутации сразу же экспрессируются; б) существование гетерокарионов, так как оно позволяет исследовать взаимодействие изучаемых генов в общей цитоплазме; в) легкое выделение и анализ продуктов мейоза; г) быстрый рост и цикл воспроизводства, который длится 14 дней; д) способность расти на искусственных средах. При дальнейшем изложении будет ясно, какие преимущества дает каждая из этих особенностей Neurospora.
Escherichia coli также обладает некоторыми из этих свойств: это гаплоидный, быстрорастущий организм, который можно культивировать на синтетической среде, т. е. на среде определенного химического состава. В бактериях происходит обмен генетической информацией, который приводит к возникновению новых рекомбинантных генотипов; однако процессы, которые приводят к такому обмену, существенно отличаются от оплодотворения и мейоза, характерных для высших организмов.
Штаммы E. coli различаются в половом отношении наличием фактора плодовитости (фертильности), который обозначается буквой F. Штаммы, содержащие фактор F (штаммы F+), могут переносить его в штаммы, не несущие фактора F (штаммы F-); таким образом, штаммы F+ выступают в качестве доноров, а штаммы F- в качестве реципиентов. Фактор F - автономная кольцевая молекула ДНК, реплицирующая независимо от бактериальной хромосомы. Когда клетки F+ и F- смешивают друг с другом, они соединяются с помощью полового пиля, образование которого детерминируется фактором F, и фактор F переносится из F+-клеток в F--клетки. Бактериальная хромосома, для которой также характерна кольцевая форма, имеет свою собственную систему репликации. В бактериальной ДНК и в ДНК фактора F имеется область гомологии, что позволяет им спариваться, в результате чего фактор F может интегрироваться с бактериальной хромосомой. Когда клетки, в которых это произошло, конъюгируют с F--клетками, механизм переноса интегрированного фактора F активируется, кольцевая хромосома разрывается в сайте интеграции и фактор F осуществляет ориентированный перенос бактериальной хромосомы от донора к реципиенту. Эти события проиллюстрированы на рис. 1.2. Мостик между конъюгирующими клетками хрупок, и перенос всей хромосомы донора, который при 37°С занимает 90 мин, редко доходит до конца. Та часть хромосомы донора, которая проникает в F--клетку, может спариваться с гомологичным участком хромосомы реципиента и обмениваться с ним в результате рекомбинации. Донорные штаммы с интегрированным фактором F обозначают Hfr (от англ. high frequency of recombination - высокая частота рекомбинации), а процесс переноса генов называют конъюгацией. Штаммы Hfr различаются ориентацией фактора F в бактериальной хромосоме и, следовательно, последовательностью переноса генов донора. Поскольку при данной температуре перенос происходит с постоянной скоростью, относительное расположение определенных генов донора можно определить, отбирая из смеси клеток F+ и F- пробы и сильно встряхивая их, с тем чтобы разрушить конъюгационные мостики. Затем пробы высевают на селективную среду и анализируют реципиентные клетки на присутствие соответствующих генов донора.
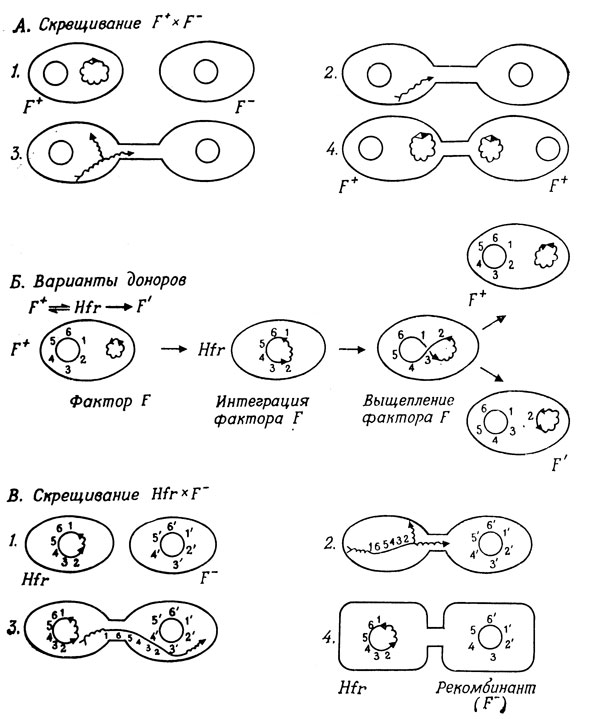
Рис. 1.2. Конъюгация у E. coli
Состояние Hfr нестабильно, и фактор F может отделиться от хромосомы в результате процесса, обратного интеграции. Иногда такое исключение фактора F из хромосомы происходит неправильно, и некоторые бактериальные гены включаются в состав фактора F. Такие мутантные факторы F обозначают F'; они сохраняют способность переноситься в клетки F-, которые становятся в результате гетерозиготными по этим бактериальным генам. Это явление, получившее название сексдукции, было с успехом использовано при изучении регуляторных систем.
У бактерий встречается еще два способа переноса генов. Один из них - трансформация - осуществляется чистой ДНК (гл. 2). Второй - трансдукция; она происходит при участии определенных бактериофагов, поэтому мы сначала рассмотрим эти "организмы".
Бактериофаги - простейшие организмы, которые используются в генетических исследованиях. На рис. 1.3 показана морфология типичного бактериофага Т2. Генетический материал, ДНК, заключен в головке фага. Т2 - вирулентный фаг; инфицирование этим фагом чувствительной клетки-хозяина приводит к ее лизису и высвобождению фагов-потомков. Фаговые частицы прикрепляются к специфическим участкам бактериальной клеточной стенки с помощью фибрилл отростка. Чехол отростка сокращается, и содержимое головки проникает внутрь бактерии, как бы впрыснутое шприцем. Фаговая ДНК проходит через отросток в бактериальную клетку, подавляет белок-синтезирующие механизмы клетки-хозяина и заставляет их синтезировать компоненты фага, используя в качестве матрицы фагоспецифические мРНК. В цитоплазме бактерии происходит сборка полных фаговых частиц, которые затем выходят из клетки в результате лизиса клеточной оболочки.
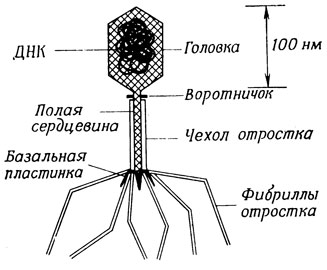
Рис. 1.3. Бактериофаг Т2
Есть и такие фаги, которые, инфицируя клетку, не обязательно вызывают ее лизис; вместо этого фаговый геном может включиться в бактериальную хромосому. Пример такого умеренного или лизогенизирующего фага - фаг лямбда. Интегрированный фаговый геном называют профагом. В случае фага лямбда профаг бывает локализован в специфическом сайте хромосомы E. coli рядом с группой генов, отвечающих за катаболизм галактозы. Интеграция этого профага метастабильна: высвобождение фагового генома может произойти спонтанно с частотой примерно 10-31 или оно может быть индуцировано ультрафиолетовым облучением.
1(Имеется в виду вероятность события за время между двумя последовательными делениями клетки. - Прим. перев.)
Некоторые из фагов-потомков, высвобождающихся в результате спонтанного или индуцированного лизиса, содержат фрагменты бактериальной хромосомы; эти фрагменты могут быть перенесены в другие штаммы путем заражения и последующей лизогенизации. В ходе этого процесса, который называется трансдукцией, переносится не более 1% донорного генома. Подобно конъюгации, трансдукция - однонаправленный перенос. Трансдуцированные гены донора включаются в тот участок бактериальной хромосомы, в котором расположены гомологичные гены реципиента. Иногда трансдуцированный фрагмент ДНК не интегрируется, а остается в цитоплазме бактерии; в этом случае он не может делиться, но способен транскрибироваться и транслироваться. Это - абортивная трансдукция; она обусловливает гетерозиготность по генам, содержащимся в перенесенном фрагменте, и позволяет исследовать функцию генов и их взаимодействие. Описанные варианты процесса трансдукции проиллюстрированы на рис. 1.4.
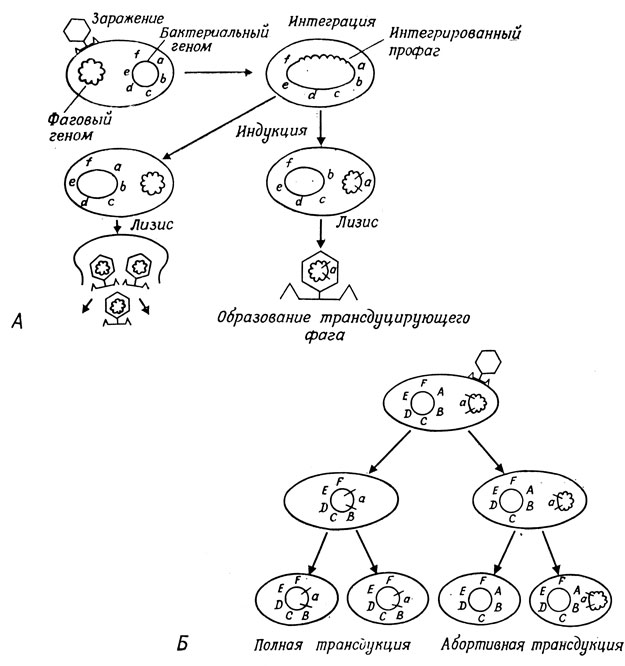
Рис. 1.4. Лизогения и трансдукция. А - лизогенизация и индукция; Б - полная и абортивная трансдукция
Для генетического анализа любого организма необходимо иметь устойчивые наследуемые различия. У бактерий и грибов в качестве таких признаков обычно используют способность синтезировать или использовать небольшие молекулы, например сахара и аминокислоты. Поскольку фаги - паразитические организмы, они лишены таких свойств; поэтому приходится использовать такие мутанты фагов, у которых нарушены различные процессы взаимодействия с клеткой-хозяином.
Если несколько капель бактериальной культуры смешать в агаре при 46°С с суспензией фага, содержащей, например, 50 инфекционных частиц, и затем вылить на поверхность питательной среды с агаром в чашке Петри, то после инкубации в течение ночи на чашке появится сплошной газон бактерий со стерильными пятнами в тех местах, где фаговые частицы, заразив одну-единственную бактерию, вызвали образование расширяющихся участков лизиса. Для каждой данной системы фаг - хозяин размер и морфология стерильных пятен стабильны в ряду поколений и наследуются; можно выделить и проанализировать мутантов с измененными стерильными пятнами. Видимо, самые удобные мутации фагов те, выражение которых зависит от условий окружающей среды. Например, можно получить мутантов, которые лизируют определенные клетки-хозяева при 25°С, но не при 37°С. Затем можно применить различные методы, скажем биохимический анализ или электронную микроскопию для выявления нарушенного процесса, который не позволяет фагу нормально расти при 37°С.
Генетический анализ можно проводить, заражая бактерию одновременно различными мутантами фага. Оба мутантных генома будут реплицироваться; при этом между ними будут образовываться участки синапсиса, и они будут рекомбинировать. Затем, исследовав продукты лизиса этой гетерозиготной системы, можно определить количество фагов в пробе, обладающих соответствующим фенотипом, и вычислить частоты рекомбинации.
Теперь вернемся к истории развития биохимической генетики. Первое указание на потенциальные возможности этой гибридной дисциплины было получено в 1909 г., когда Гаррод показал, что болезнь алкаптонурия обусловлена нарушением метаболизма ароматических аминокислот фенилаланина и тирозина. Больные алкаптонурией выделяют с мочой гомогентизиновую кислоту, которая обусловливает почернение мочи под действием воздуха. Гаррод доказал, что при повышении содержания фенилаланина и тирозина в пище количество гомогентизиновой кислоты в моче увеличивается. Он предположил, что у больных алкаптонурией отсутствует фермент, необходимый для метаболизма гомогентизиновой кислоты. Его данные по распространению болезни у членов одной семьи проанализировали два генетика, Бэйтсон и Прюнет. Они показали, что оно может быть объяснено наследованием двух аллелей одного гена. Так, больные были гомозиготными по рецессивному аллелю (а/а), тогда как у гетерозигот (А/а) и у индивидуумов, гомозиготных по доминантному аллелю (А/А), признаков заболевания не наблюдалось.
В 1914 г. было показано, что у больных алкаптонурией отсутствует активность фермента - оксидазы гомогентизиновой кислоты, - который превращает гомогентизиновую кислоту в малеилацетоуксусную кислоту. Таким образом, было доказано, что рецессивная форма гена каким-то образом связана с определенным дефектом фермента. Гаррод назвал такие болезни "врожденными ошибками метаболизма".
Нарушения метаболизма ароматических аминокислот вызывают также и другие болезни: фенилкетонурию, тирозиноз, кретинизм (при эндемическом зобе) и альбинизм. Биохимические нарушения, которые вызывают эти болезни, показаны на рис. 1.5.
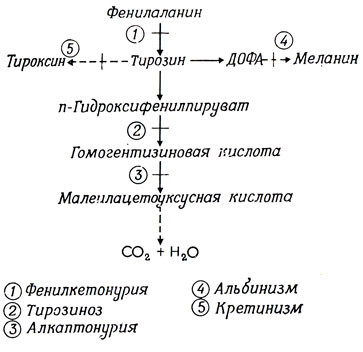
Рис. 1.5. Наследственное нарушение метаболизма фенилаланина и тирозина
Фенилкетонурию и тирозиноз можно "вылечить" с помощью диеты, содержащей минимальное количество фенилаланина и тирозина. Возможность излечения биохимических нарушений путем введения в пищу или, наоборот, исключения определенных питательных веществ является, как мы увидим далее, важным инструментом исследования в биохимической генетике.
Работа Гаррода, указавшая на многообещающую связь между биохимией и генетикой, была забыта большинством исследователей. Позднее, в 1936 г. Бидл и Эфрусси исследовали физиологию наследования окраски глаз у Drosophila. Они показали, что соответствующие гены можно расположить в определенной функциональной последовательности. Глаза дрозофилы содержат смесь розовых птеридинов и коричневых оммохромов. Нарушения синтеза птеридинов приводят к коричневым глазам (brown, bw); у мух с мутациями vermilion (v), cinnabar (cn) scarlet (si) нарушен синтез оммохрома.
Участки ткани личинки, которые впоследствии разовьются в определенные органы взрослого животного, называются имагинальными дисками. Их можно пересадить из одной личинки в другую, и они будут нормально развиваться. Фенотип пересаженного глаза - результат взаимодействия между генотипом самого трансплантата и тем метаболическим окружением, которое обеспечивается тканями хозяина. Трансплантаты глазных дисков из мутантов vermilion и cinnabar в личинки дикого типа превращаются в глаза с нормальной пигментацией дикого типа. Это означает, что ткани личинок дикого типа каким-то образом компенсируют метаболическое нарушение обеих мутаций, vermilion и cinnabar.
Разумеется, в следующем эксперименте был проведен обмен трансплантатами между двумя мутантами. Оказалось, что в трансплантатах vermilion, пересаженных в хозяина cinnabar, образуются нормальные пигменты - такие, как в глазах дикого типа. В тех же случаях, когда cinnabar-трансплантат пересаживали в хозяина с мутацией vermilion, эффект мутации не подавлялся. Бидл и Эфрусси предположили, что у этих мутантов нарушены две последовательные реакции, и в результате в глазах накапливаются различные промежуточные продукты синтеза оммохрома. Поскольку мутанты vermilion могут метаболизировать вещество, которое накапливается у мутантов cinnabar, и образовывать оммохром, а мутанты cinnabar не могут метаболизировать продукт, накапливающийся у мутантов vermilion, они сделали заключение, что последовательность реакций должна быть следующей:
Предшественник → Вещество v+ → Вещество cn+
К настоящему времени промежуточные продукты этого метаболического пути идентифицированы, и известны соответствующие биохимические нарушения:
Триптофан → N-формилкинуренин → Кинуренин → 3-гидроксикннуренин → Феноксиазинон → Ксантомматин
В то время, примерно в 1938 г., многие исследователи хорошо понимали, что гены участвуют в регуляции определенных реакций либо непосредственно, либо детерминируя специфичность соответствующих ферментов. Однако Drosophila была не очень удобным объектом для подобных экспериментов. В большинстве случаев влияние известных мутаций на фенотип было сложным, и казалось маловероятным, что первичное метаболическое нарушение, которое они вызывают, можно будет легко обнаружить.
Для дальнейшего развития в этой области исследования необходимо было найти другой подход: исследовать влияние генов на совершенно определенные биохимические реакции. Для этого Бидл и Татум избрали Neurospora, которая, как тогда уже было известно, вполне подходила для генетических исследований. Как и многие микроорганизмы, Neurospora может расти на очень простой среде. Достаточно всего лишь источника углерода, обычно сахарозы, неорганических солей, источника азота и витамина биотина, чтобы споры гриба проросли и образовали колонии. На этой среде грибам приходится синтезировать все обычные клеточные компоненты. Бидл и Татум предположили, что обработка рентгеновскими лучами вызовет мутации в генах, отвечающих за определенные реакции. Если в результате такой мутации гриб потеряет способность синтезировать какую-либо аминокислоту, то он не сможет больше расти на синтетической среде, если в нее не будет добавлена соответствующая аминокислота. Бидл и Татум считали, что этот общий принцип может быть использован для изучения самых различных метаболических процессов, но лишь в тех случаях, когда конечный продукт соответствующей последовательности реакции при добавлении в среду может использоваться грибом.
В соответствии с этими рассуждениями Бидл и Татум облучили споры и дали им прорасти на сложной среде, содержащей солодовый экстракт, неорганические соли и сахарозу. Клетки, выдержавшие облучение, образовали колонии, которые были пересеяны на синтетическую среду. Из 2 ООО проверенных колоний три не смогли расти на синтетической среде. В каждом из трех мутантов был нарушен синтез одного из витаминов: один нуждался в пиридоксине, второй - в пантотенате и третий - в n-аминобензойной кислоте. Генетическую природу мутации, вызвавшей потребность в пиридоксине (pdx-), исследовали, скрещивая мутант с грибом дикого типа и анализируя продукты мейоза. Сегрегация признака потребности в пиридоксине среди аскоспор в соотношении 14 pdx+: 15 pdx- соответствовала сегрегации двух аллелей одного гена.
Бидл и Татум оказались правы в своих рассуждениях. Они смогли получать мутантов по одному гену, у которых были нарушены специфические этапы биосинтетического пути. Успехи, которых достигли Бидл и Татум, благодаря использованному ими подходу, были удивительны. К 1946 г. Бидл и его сотрудники установили шесть групп сцепления у Neurospora и охарактеризовали мутантов, нуждающихся в аминокислотах, витаминах, пуринах, пиримидинах и холине. Генетический дефект индивидуальных мутантов во всех случаях соответствовал мутации в одном гене.
Несомненно, самый важный вывод из работы с Neurospora - это наличие соответствия между генами и биохимическими процессами. Поскольку большинство мутантов были чувствительны к отсутствию только какого-то одного соединения, проще всего было предположить, что один ген определяет специфичность одного фермента. Эту гипотезу "один ген - один фермент" впервые со всей определенностью сформулировал Бидл в 1945 г.
Как можно было предвидеть, вскоре были обнаружены исключения из этого правила. Например, один мутант Neurospora проявлял потребность одновременно и в метионине и в треонине. Сегрегация этой двойной потребности происходила таким образом, как если бы она была обусловлена мутацией в одном гене. Объяснить это можно было тем, что мутировавший ген кодировал два фермента, один из которых был необходим для синтеза метионина, а другой - треонина. Однако оказалось, что первичное метаболическое нарушение, которое вызывает эта мутация, - отсутствие способности синтезировать гомосерин (предшественник обеих аминокислот). Еще одна кажущаяся аномалия - двойная потребность в изолейцине и валине - тоже объяснилась довольно просто. Пять последних этапов синтеза этих аминокислот представляют собой одинаковые химические реакции, которые катализируются одними и теми же ферментами. Поэтому мутация, инактивирующая один из этих ферментов, блокирует синтез обеих аминокислот.
Около 1950 г. было показано, что биохимические нарушения у нескольких мутантов Neurospora, нуждающихся в тех или иных питательных веществах, обусловлены потерей активности соответствующих ферментов. Митчелл и Лейн показали, что у мутанта, нуждающегося в триптофане, отсутствует активность триптофансинтазы, а Финчем продемонстрировал, что у мутанта, у которого нарушена реакция аминирования, нет глутамат-дегидрогеназы.
В настоящее время мы знаем, что теория один ген - один фермент была упрощением: не все гены кодируют ферменты, а некоторые ферменты представляют собой продукты более чем одного гена. Точнее было бы сказать, что один ген определяет синтез одного первичного продукта. Тем не менее к началу 50-х годов стало ясно, что гены кодируют ферменты; самой неотложной задачей поэтому стало изучение природы гена и идентификация генетического материала.
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'