
IX.3. Изучение структуры генов у высших эукариот на примере гена (rosy у Drosophlla melanogaster)
Традиционный метод картирования гена по частоте рекомбинаций у высший эукариот чрезвычайно трудоемок и длителен, так как частоты кроссинговера у них намного ниже, чем у прокариот и низших эукариот. Если сопоставить длину всех групп сцепления в геноме, выраженную в процентах, с содержанием ДНК, и в качестве относительной величины для сравнения взять 50% рекомбинации, то среднее расстояние между независимо рекомбинирующими единицами, выраженное в парах оснований ДНК, у бактериофага Т4 составил 1*104, у Е. colt 1,2*105, дрожжей 2,5*105, у дрозофилы 2,5*107, у мыши 9*107 п. о. (Льюин, 1987).
Если предположить, что в гене дрозофилы в среднем 5000 пар оснований и 2,5*107 п. о. соответствует 50% рекомбинаций, можно рассчитать, что частота рекомбинаций между мутациями на концах гена будет соответствовать примерно 0,01% кроссинговера. Другими словами, для обнаружения рекомбинации между мутациями, локализованными на концах гена, нужно проанализировать не менее 10 тыс. потомков, т. е. поставить сотни скрещиваний. Кроме того, жизненный цикл у высших эукариот достаточно продолжителен, а потенциал размножения у многих недостаточно велик. Поэтому внутригенное картирование на основе определения частоты кроссинговера удалось провести лишь на дрозофиле после того, как были разработаны селективные методы выделения редких рекомбинантов.
Первым геном у дрозофилы, структуру которого удалось определить, был ген rosy (ry), локализованный в правом плече хромосомы 3 и фланкированный рецессивными леталями. Для картирования гена сначала получили в нем большое количество мутаций путем обработки мух Х-лучами и этилметансульфонатом (ЭМС). Было установлено, что мутации в гене гу приводят к потере (или снижению) активности фермента ксантидегидрогеназы (КДГ) и уменьшению содержания красного пигмента - дрозо-птерина: окраска глаз у большинства этих мутантов коричневая. Мутанты, полученные в лаборатории Човника (1977), были разделены на три группы.
- Изоаллели дикого типа с красными глазами, различающиеся по электрофоретической подвижности КДГ, среди них - один с высокой и один с низкой подвижностью фермента.
- Коричневоглазые мутанты с нулевой активностью КДГ. Было установлено, что КДГ состоит из двух идентичных субъединиц. Проверка на аллелизм 68 мутантов этого типа позволила разделить данную группу на две подгруппы. 11 мутантов обнаружили межаллельную комплементацию, что проявлялось в появлении красной окраски глаз и частичном восстановлении активности КДГ (до 1 - 16% от нормы) у компаундов по этим мутациям. Остальные 57 мутаций не проявили межаллельной комплиментации. Гомозиготные по аллелям ry мухи из этой группы накапливают субстрат КДГ, который легко определяется хроматографически в гомогенате из голов и брюшек мух.
- Мутанты, чувствительные к пуринам, с низким уровнем активности КДГ (от 1 до 24% от нормы) - "lеаку"-мутанты.
Были обнаружены фланговые летали (11, 12, 13, 14), что позволило применить систему отбора рекомбинантов, возникающих в результате кроссинговера на участке гена rosy. Все это - жизнеспособность мутантов, возможность изучения гена на уровне контролируемого им фермента и наличие фланговых маркеров - послужило предпосылкой для изучения структуры гена rosy.
Для внутреннего картирования скрещивали самок-компаундов по двум мутациям, например, rex и ryy с гомозиготными по rosy самцами (например, ry2/ry2), имевшими инверсию в области 11-14. При этом одна из картируемых мутаций, например, гух, была локализована в одной хромосоме либо с леталями 11 и 12 (серия А), либо с леталями 13 и 14 (серия В). Результаты скрещиваний представлены на рис. IX.4. Очевидно, что в обеих сериях опытов некроссоверные особи должны погибать из-за выхода в гомозиготу одной из леталей. Выживать может только 1/4 рекомбинантов, возникающих на участке 11-12, и 1/4 - на участке 13-14, и 1/2 в гене rosy.
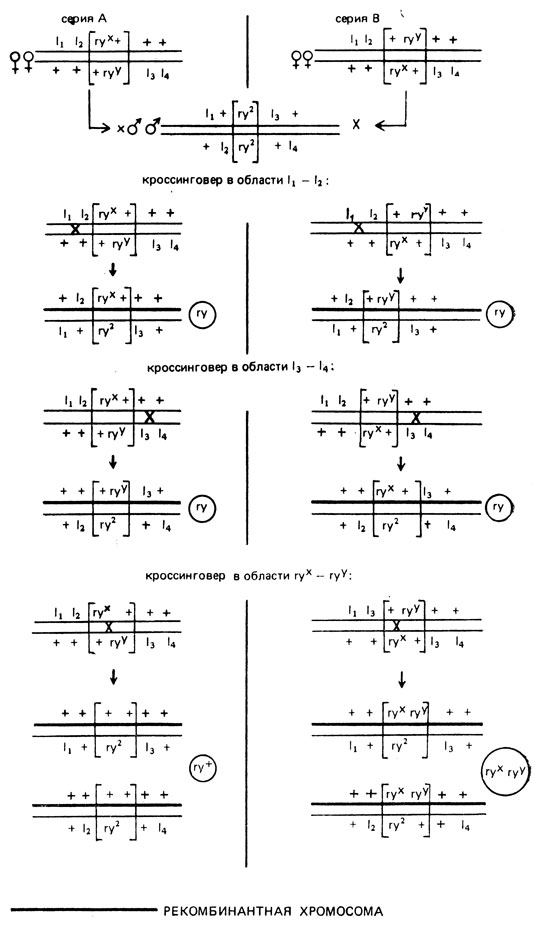
Рис. IX.4. Локализация мутации ryx относительно мутации ryy. Схема опытов
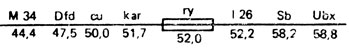
Локализуемая мутация, например ryx, может находиться справа или слева от другой мутации - ryy. Как видно из рис. IX.4, рекомбинанты ry+ могут появляться в серии А, если мутация ryx локализована левее ryy. В этом случае в серии В рекомбинанты ry+ погибают, но возникают двойные мутанты - ryxryy, неотличимые от одиночных. Если мутация ryx лежит правее ryy, то ожидается обратный результат: в серии В появляются рекомбинанты дикого типа, а в серии А только мухи с фенотипом ry - одиночные и двойные мутанты. В дальнейшем система скрещиваний была усовершенствована введением неселективных маркеров, что позволяло судить о расположении мутаций ry1 и ry26 без данных реципрокных скрещиваний. В качестве неселективных маркеров служили следующие мутации: cu (curved) - крылья загнутые кверху, тело темное, kar (karmoisin) - ярко-красные глаза; рецессивные летали М(3)34 (Minute 34) и 1(3)26(lethal 26); доминантные видимые мутации с рецессивным летальным действием Dfd (Deformed) - глаза маленькие или сморщенные, Sb (Stubble) - щетинки короткие толстые, Ubx (Ultrabithorax) - жужжальца расширенные, расположенные на генетической карте в следующем порядке:
Схемы скрещиваний этих опытов представлены на рис. IX.5. Среди выживших потомков (51410) появилась лишь одна муха с фенотипом ry+в серии В. Следовательно, мутация ry1 локализована правее ry26. Хромосома этой мухи несла неселективный маркер 1(3)26. Для увеличения элиминации нерекомбинантных потомков можно культивировать мух при повышенной температуре (29° С) или на средах, обогащенных пурином, который добавляют в пробирки с кормом после удаления родителей. В этом случае погибают не только нерекомбинантные мухи, но и рекомбинанты типа ry.
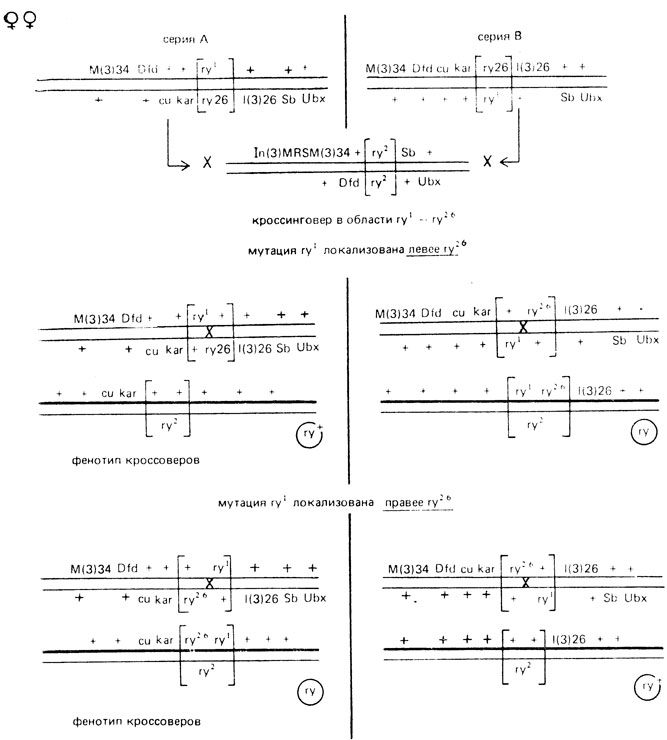
Рис. IX.5. Локализация мутаций ry1 и ry26 в гене rosy с использованием неселективных маркеров, cu, kar, 1(3)26 - неселективные маркеры, In(3) MRS - инверсия, запирающая кроссинговер в 3-ей хромосоме
С помощью этих методов было картировано 32 мутации в гене rosy, различающиеся по электрофоретической подвижности КДГ, по чувствительности к пуринам и способности к межаллельной комплементации; была составлена карта этого гена (рис. IX.6).
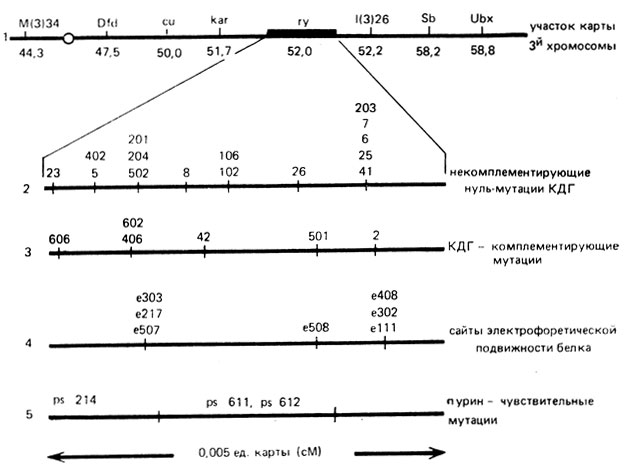
Рис. IX.6. Карта тонкой структуры гена rosy у дрозофилы (по Chovnic, 1977)
Тот же принцип был использован при картировании и других генов дрозофилы. Так, для выявления внутригенных рекомбинаций по гену r (rudimentary), локализованному в 1-й хромосоме, контролирующему ферменты, действующие на разных этапах биосинтеза пиримидинов и вызывающего развитие рудиментарных крыльев и снижение плодовитости самок, применяется селективная среда без пиримидинов, на которой выживают только рекомбинантные самки дикого типа. Для изучения структуры гена, контролирующего алкогольдегидрогеназу (АДГ), локализованного во 2-й хромосоме, селективной является среда с этанолом, на которой также выживают только рекомбинанты дикого типа.
Рекомбинационный анализ, проведенный по фенотипу на миллионах мух, позволил построить генетическую карту гена white, вызывающего белую окраску глаз дрозофилы. Установлено, что все аллели этого гена, кроме двух (wBwx и wDzL),- рецессивные и локализованы в 8 сайтах. Рестрикционный анализ (см. С. 233) многих мутантов этого гена позволил определить, что часть мутаций представляет собой делеции размером 50-100 п. н. Восемь из 14 исследованных спонтанно возникших независимых мутантов содержали вставки больших размеров, они связаны с присутствием подвижных генетических элементов в нормальном гене w+.
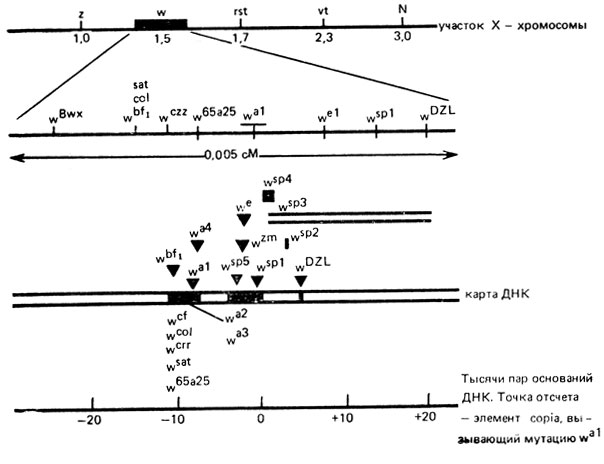
Рис IX.7. Карта тонкой структуры гена white у дрозофилы. Карта ДНК (по Айала, 1987)
Карта гена white состоит из двух функциональных областей, одна из которых (левая), включая аллель wa1, содержит мутации, контролирующие пигментацию глаз (не менее 7000 п. н.); другая правая) связана с мутациями, влияющими на проявление мутаций левой части гена. Она содержит примерно 14 000 п. н. (рис.
Очевидно, что методы изучения структуры генов у эукариот, основанные на учете внутригенных рекомбинаций, недостаточно эффективны и сложны из-за трудоемкости и громоздкости экспериментов. Применение селективных методов для отбора рекомбинатов хотя и облегчает эту работу, но не снимает главного ограничивающего фактора - необходимости получения громадных
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'