
Глава I. Генетика бактерий (Д. М. Гольдфарб)
1. Введение
За последние 15-20 лет стало очевидным, что бактерии и фаги - прекрасные объекты для изучения фундаментальных проблем генетики. Вместе с тем в течение долгого периода времени эти организмы не привлекали к себе достаточного внимания генетиков. Ошибочно считалось, что бактерии лишены дифференцированных структур, определяющих их наследственные признаки. Отсюда возникло неверное представление об обособленности бактерий и вирусов от других классов живых существ и о невозможности их использования для изучения генетических проблем. Такое негативное отношение к бактериям и вирусам подкреплялось тем, что они из-за малых размеров, лабильности признаков ограничивали возможности генетического анализа. Наконец, незнание механизмов генетического обмена у бактерий и, тем более, у вирусов не позволяло изучить организацию и структуру их наследственного аппарата.
Быстрый прогресс генетики микробов, который мы отмечаем за последнее время, обусловлен многими причинами, и в первую очередь открытием у бактерий и фагов механизмов генетического обмена.
У высших организмов обмен наследственной информации обеспечивается в процессе мейоза. У бактерий и вирусов существуют другие механизмы, а именно: трансформация, трансдукция и конъюгация. Генетический обмен у фагов осуществляется в процессе их репродукции внутри клетки. Открытие этих механизмов переноса наследственного материала в сочетании с развитием методов биохимической генетики привело к расшифровке генетической организации бактерий и вирусов.
Итоги исследований показали, что бактерии и вирусы, так же как и все организмы, обладают специализированными структурами, несущими наследственную информацию. Именно на бактериях была впервые установлена химическая природа наследственного материала, и этим самым был заложен фундамент молекулярной генетики. Как известно, последующее развитие этой новой отрасли генетики завершилось решением проблемы генетического кода. Широкое использование бактерий и фагов в генетике обогатило нас сведениями об организации наследственного материала, начиная от целого генома и кончая элементарными его единицами.
Поскольку основой всех этих и ряда других достижений было познание механизмов генетического обмена у бактерий и фагов, то мы сочли целесообразным уделить здесь наибольшее внимание вопросам, касающимся способов переноса наследственного материала у бактерий.
2. Ядерные структуры бактерий
Эквивалентом ядра клеток высших организмов у бактерий являются хроматиновые образования, описанные под различными наименованиями: "хроматиновые тельца", "бактериальное ядро", "нуклеоид", "ядерный эквивалент", или "ядерная вакуоль". Такое разнообразие обозначений возникло вследствие того, что организации генетических структур у бактерий и клеток высших организмов отличаются друг от друга.
В отличие от ядер растений и животных, бактериальный нуклеоид не ограничен дифференцированной мембраной и весьма вариабилен по форме (рис. 1). Полиморфизм нуклеоида зависит от среды, в которой находится бактерия.
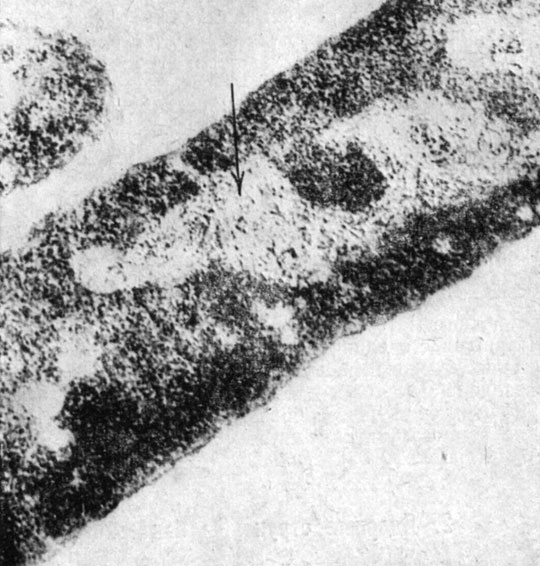
Рис. 1. Электронная микроскопия нуклеоида (отмечен стрелкой)
Цитологические наблюдения указывают, что нуклеоиды делятся в период роста бактериальной клетки. Как правило, деление нуклеоидов предшествует делению бактерии. Деление нуклеоида осуществляется путем продольного расщепления на два новых нуклеоида [1-3].
Бактериальные нуклеоиды, подобно хромосомам клеток растений и животных, содержат ДНК, которая выявляется, положительной реакцией Фельгена и специфической флюоресценцией при окраске акридином - оранжевым. Специфичность наблюдаемых цитохимических реакций подтверждается тем, что они исчезают после обработки бактерии ДНК-азой. Вероятно, вся ДНК бактериальной клетки содержится в нуклеоидах.
Для ответа на вопрос, является ли нуклеоид бактерий аналогом ядра клеток высших организмов, необходимо было доказать, что именно эти структуры хранят в себе наследственную информацию бактериальной клетки. Известно, что количество нуклеоидов в клетках Escherichia coli изменяется в зависимости от фазы роста культуры. В покоящихся бактериальных культурах каждая клетка обычно содержит один нуклеоид. Установлено, что при делении нуклеоида, ДНК которого мечена радиоактивным изотопом, половина метки оказывается в новом нуклеоиде. Следовательно, репликация ДНК в нуклеоиде происходит полуконсервативным путем и отделившийся нуклеоид содержит ту же генетическую информацию, которая была в исходном. В лаг-фазе каждая бактерия имеет два нуклеоида, а в логарифмической фазе - четыре. Отсюда следует, что мутации, индуцированные в культурах на различных этапах культивирования, будут давать в потомстве либо чистые клоны, либо смешанные; причем отношение мутантных клонов к диким зависит от количества нуклеоидов в мутировавшей клетке, что показано Виткиным [4] на примере индукции ультрафиолетом lас--мутантов (неспособность ферментировать лактозу) кишечной oпалочки, находящейся в различных фазах роста (рис. 2).
![Рис. 2. Схема опыта Виткина. Индукция lac--мутаций у Е. coli: а - покоящаяся культура, клетки содержат один нуклеоид; б - культура в lag-фазе, клетки содержат два нуклеоида; в - культура в логарифмической фазе, клетки содержат четыре нуклеоида. Светлые кружки - нуклеоиды, в которых произошла мутация lac-; темные кружки - нуклеоиды дикого типа lас+ [8]](pic/000001.jpg)
Рис. 2. Схема опыта Виткина. Индукция lac--мутаций у Е. coli: а - покоящаяся культура, клетки содержат один нуклеоид; б - культура в lag-фазе, клетки содержат два нуклеоида; в - культура в логарифмической фазе, клетки содержат четыре нуклеоида. Светлые кружки - нуклеоиды, в которых произошла мутация lac-; темные кружки - нуклеоиды дикого типа lас+ [8]
Таким образом, было подтверждено, что нуклеоид является структурой, хранящей наследственную информацию бактерии, и что каждая бактерия является гаплоидом.
3. Генетический обмен у бактерий
Генетическая организация бактериальной хромосомы была установлена в результате изучения механизмов генетического обмена между двумя бактериальными клетками. При таком генетическом обмене происходит перераспределение генетического материала между родительскими клетками, и возникающее потомство характеризуется новой комбинацией наследственных признаков. Все известные феномены обмена наследственными детерминантами у бактерий завершаются генетической рекомбинацией, а полученные в результате этого особи с новой комбинацией генов называют рекомбинантами. Описано три основных механизма обмена генетическим материалом у бактерий: трансформация, трансдукция и конъюгация.
Следует отметить, что успехи в познании генетической организации бактериальной клетки стали возможны после значительного прогресса в изучении изменчивости бактерий, разработки методов селекции бактерий и развития исследований в области бактериального мутагенеза. Поэтому, прежде чем рассмотреть указанные три феномена генетического обмена у бактерий и результаты изучения генетической организации бактериальной хромосомы, целесообразно привести некоторые данные об изменчивости бактерий и дать ряд определений, необходимых для дальнейшего изложения.
1) Генотип и фенотип бактерий
Генотипом бактерий, как и генотипом любого другого организма, обозначают совокупность генов, т. е. их генетический потенциал.
Фенотип характеризует комплекс признаков, наблюдаемых у бактерии в конкретных условиях ее существования. Таким образом, фенотип бактерии представляет собой результат взаимодействия ее генотипа и среды. Иными словами, данная генетическая детерминанта бактерии проявляется фенотипически лишь в определенных условиях внешней среды.
Например, ряд бактерий способен синтезировать ферменты, обеспечивающие ферментирование лактозы. Установлено, что этот признак обусловлен специальными генами бактериальной хромосомы. Наследственное изменение этого свойства возникает вследствие мутации хотя бы одного из генов, контролирующих этот признак. Такая бактерия не синтезирует соответствующие ферменты, независимо от присутствия углевода в среде (табл. 1).

Таблица 1. Взаимоотношение между генотипами и соответствующими фенотипами
Из табл. 1 следует, что изменение способности бактерий ферментировать лактозу может быть результатом либо изменений в генетическом аппарате, либо изменений среды, в которой находится бактерия (стрелка 2). В первом случае мы говорим о генотипической изменчивости, во втором - о фенотипической, не наследуемой, изменчивости. Эта таблица иллюстрирует одно из фундаментальных положений генетики: взаимоотношение между генотипом и фенотипом зависит от условий окружающей среды.
2) Бактериальные мутации
Мутацией называют изменение генотипа, не связанное с рекомбинационным механизмом. Данное определение включает мутации, возникающие в результате внутригенных изменений, вследствие утрат генетических детерминант (делеция) или их перераспределения в хромосоме (инверсия и транслокация).
Бактериальные мутации обнаруживают по появлению наследственных (генотипических) изменений, которые могут относиться к любому из известных признаков микроорганизма. По мере расширения наших знаний, касающихся структуры, физиологии и биохимии бактерий, увеличиваются возможности обнаружения разных типов мутантов. К таким важнейшим признакам относятся:
1. Ауксотрофность к аминокислотам, т. е. неспособность бактерии синтезировать соответствующую аминокислоту. Ауксотроф растет на питательной среде в присутствии готовой аминокислоты. Микроорганизм, способный синтезировать соответствующие аминокислоты и другие необходимые для жизни соединения, называется прототрофом.
2. Ауксотрофность по пуринам.
3. Ауксотрофность по пиримидинам.
4. Ауксотрофность по витаминам.
5. Способность или неспособность бактерии утилизировать различные источники энергии.
6. Чувствительность или резистентность к различным антибактериальным веществам или зависимость от них.
7. Чувствительность или резистентность к бактериофагу.
8. Лизогенность и др.
Для обозначения мутантов предложена следующая система символов: ауксотрофность и прототрофность обозначают начальными буквами английского названия метаболита, например, потребность в гистидине - "his" или "his-", в триптофане - "try" или "try-", в аргинине - "arg" или "arg-" и т. д., прототрофность по аргинину - "arg+".
Если на генетической карте известно положение мутировавшего локуса (см. "Организация генетического аппарата у бактерий"), то к наименованию метаболита добавляют большую латинскую букву, обозначающую локус. Обозначение "his B" характеризует гистидиновый ауксотроф, мутация которого локализована в локусе В, a "his E" - ауксотроф, у которого мутация произошла в другом локусе - Е. Для дифференцирования двух мутантов в одном и том же локусе к обозначению добавляют арабскую цифру, например try D-10, try D-55, что означает 10 и 55 триптофановые ауксотрофы в локусе D.
Соответственно двойные и тройные ауксотрофы обозначают следующим образом: arg- cys- или arg cys, т. е. ауксотроф, зависимый и от аргинина, и от цистина.
Если двойной ауксотроф получен в результате двух последовательных независимых мутационных актов, то каждую мутацию обозначают тремя начальными буквами названия маркера, например, arg cys; если же он получен в результате одного мутационного события, т. е. в бактерии одновременно возникли две мутации, то такой ауксотроф обозначается двухбуквенным символом, например ph ty, т. е. бактерия, зависимая от фенилаланина и тирозина.
Способность ферментировать углеводы, например лактозу и арабинозу, обозначают lас+ и аrа+, а мутации, приводящие к неспособности ферментировать эти углеводы, - lас-, аrа-.
Чувствительность к стрептомицину описывают символом Sm-s, резистентность - Sm-r, а зависимость - Sm-d, резистентность к пенициллину - Реn-r,
Лизогенность бактерии помечают наименованием умеренного фага в скобках после названия штамма бактерии, например E. coli K12 (λ), чувствительность и резистентность к фагам - T1,5-s и Т1,5-r.
Мутирование по перечисленным признакам дает возможность, как уже указывалось, осуществить эффективную селекцию мутантов и их количественный учет.
Обычно бактериальные мутанты делят на две категории: 1) спонтанные, т. е. возникающие под влиянием факторов внешней среды, но без вмешательства экспериментатора, и 2) индуцированные, т. е. возникающие в результате обработки бактериальной популяции так называемыми мутагенными агентами, к числу которых относятся различные виды радиации, температура, фаги, антибиотики и химические соединения. Разработка методов индукции и отбора бактериальных мутантов явилась важнейшей предпосылкой для расшифровки механизмов генетического обмена у микробов. Это позволило преодолеть основное препятствие, лимитирующее развитие генетики микробов, т. е. низкую частоту (порядка 10-5-10-8) получения рекомбинантных типов - особей, возникших в результате генетического обмена между двумя клетками, отличающимися друг от друга по своим генотипам. Иными словами, современная генетика микробов располагает методами генетического анализа с высокой разрешающей способностью. Это дало возможность открыть новые механизмы и закономерности процесса генетических рекомбинаций, изучение которых было малодоступно у организмов, размножающихся половым путем и обладающих сложноорганизованным ядром.
3) Трансформация
Процессы генетической рекомбинации у бактерий, как и у других организмов, предусматривают существование механизмов переноса генетического материала из одних клеток в другие, отличающиеся своим генотипом. Одним из таких механизмов является трансформация наследственных признаков у бактерий, обусловленная введением в клетку чужеродной ДНК. В трансформации участвуют бактерия-донор, являющаяся источником ДНК, и бактерия-реципиент, воспринимающая ДНК донора.
Феномен трансформации бактерий был описан еще в 1928 г. Гриффитсом [5] при изучении природы вирулентности пневмококка.
Гриффите превратил бескапсульный авирулентный вариант одного типа пневмококка (R-форма) в другой, вирулентный тип, обладающий капсулой (S-форма). Такую наследственно фиксированную трансформацию пневмококков Гриффите наблюдал в опытах in vivo. Мышам подкожно вводилось небольшое количество жизнедеятельных клеток R-пневмококка и большое количество 5-пневмококков, убитых нагреванием.
Постмортально от этих мышей выделяли капсульный вирулентный пневмококк S-типа.
Наблюдения Гриффитса были подтверждены другими исследователями, и очень скоро было показано, что трансформацию можно индуцировать in vitro.
Весьма важным было наблюдение Сиа и Даусона [6], которые установили, что очищенный пневмококковый полисахарид, входящий в капсулу, не индуцирует превращение R-типа в S.
Далее Алловей [7] показал, что превращение R-пневмококков в S происходит in vitro в присутствии бесклеточных экстрактов S-типа. Таким образом, в результате этих работ, выполненных до классического исследования Эвери с сотр. [8], стала очевидной возможность изменения наследственных признаков микроба как in vivo, так и in vitro в присутствии бактерии-донора или продуктов ее разрушения. Однако природа факторов, индуцирующих трансформацию бактерий, оставалась неизвестной.
1944 год - год публикации исследования Эвери с сотр. [8] - явился переломным этапом в современной генетике и молекулярной биологии. Этим авторам удалось установить химическую природу трансформирующего фактора (ТФ) пневмококков и показать что им является дезоксирибонуклеиновая кислота. Огромное значение этого открытия и то влияние, которое оно оказало и оказывает до сих пор на развитие генетики и молекулярной биологии, заключается в том, что понятия "генетическая детерминанта", "фактор наследственности", "ген" приобрели конкретное химическое содержание, а это, в свою очередь, послужило основой для развития новых идей молекулярной и биохимической генетики. Основной вывод Эвери и его сотрудников о том, что ТФ идентичен ДНК, основан на следующих фактах.
Конечный продукт, обладавший трансформирующей активностью, выделенный из экстрактов пневмококков, давал положительную реакцию с дифениламином и отрицательные реакции на белок и РНК. Серологические тесты подтвердили чистоту полученных препаратов, так как они не давали преципитации с сывороткой против пневмококка-донора. Инактивация ТФ после обработки ДНК-азой окончательно подтвердила, что его генетическая активность обусловлена ДНК. Для инактивации ТФ требовалось ничтожное количество фермента: 0,005 γ/мл полностью инактивировало препарат, а 0,001 γ/мл вызывало частичную, но явную потерю активности. Однако вывод Эвери и его сотрудников об идентичности ТФ и ДНК был подвергнут сомнению в связи с невозможностью выявления белка в трансформирующих препаратах химическими и иммунологическими методами, недостаточно чувствительными для обнаружения незначительных примесей. Чувствительность ТФ к ДНК-азе объяснялась тем, что он представляет собой нуклеопротеид, инактивация которого ферментом связана с разрушением комплекса. Для окончательного выяснения истинной природы ТФ, начиная с 1944 г., было проведено большое число исследований, результаты которых сводятся к следующему:
1. Очистка ТФ от примесей белка, РНК и полисахаридов не сопровождается снижением биологической активности. Хочкис показал, что количество белка в трансформирующем факторе пневмококка составляет всего 0,02% (см. Заменгофф [9]).
Заменгофф [9] приводит расчет, согласно которому количество примесей белка в ДНК, выделенной из Hemophilus influenzae и необходимой для трансформации одной клетки, приблизительно равно 6 молекулам с весом 105 и одной - с весом 106. Если такой белок является действующим веществом ТФ, то приходится признать за ним невероятно высокую активность.
Однако вопрос о наличии белковых примесей в ТФ до сих пор нельзя считать окончательно решенным, так как в приведенных выше расчетах предполагалось наличие в ТФ белков с относительно высоким молекулярным весом.
Эфрусси-Тейлор [10] указывает, что если каждая молекула ДНКТФ пневмококка соединена с одной молекулой белка, равной молекуле рибонуклеазы, то отношение белка к ДНК равно
| 14⋅103 | , | |
| 7⋅106 |
или 0 2%, т. е. в десять раз превышает количество, указанное Хочкисом, которое теоретически может присутствовать в ДНК и не обнаруживаться доступными методами. При этом допускается, что каждая молекула трансформирующего фактора находится в комплексе с молекулой белка. Необходимо подчеркнуть следующее: присутствие в ТФ следов белка ни в какой мере не подвергает сомнению, что его генетическая активность обусловлена ДНК. Значение этой гипотетической белковой части может выражаться либо в стабилизации молекул ДНК, либо в том, что белок, возможно, выполняет роль пускового фактора в гетерокаталитической активности или репликации ДНК.
2. Агенты, реагирующие с ДНК, инактивируют ТФ. Выше уже указывалось на специфическую инактивацию ТФ дезоксирибонуклеазой. Трансформирующая активность ТФ снимается также при действии ультрафиолетовых [УФ] и рентгеновых лучей, азотистой кислоты, формальдегида, аналогов иприта и др. Перечисленные агенты, как известно, характеризуются высокой мутагенной активностью. Эти результаты доказывают, что носителем генетической активности ТФ является ДНК. Наоборот, воздействия, приводящие к денатурации белков, не инактивируют трансформирующую активность. Последняя сохраняется при обработке 4M. мочевиной [10] и при действии температуры в диапазоне, вызывающем денатурацию белка. Инактивация очищенного ТФ H. influenzae начинается лишь после часовой обработки при температурах выше 81° [11] и быстро нарастает в диапазоне от 85 до 95°.
Анализ результатов этих опытов указывает на существование разных механизмов инактивации трансформирующей ДНК.
Первый вопрос, подлежавший разрешению, заключался в выяснении корреляции между трансформирующей активностью и степенью физической деградации молекулы ДНК. Молекулярный вес ТФ, определяемый по константе седиментации, вязкости растворов и другими способами, равен около 5⋅106. Близкие значения молекулярного веса были получены в опытах Флюка с сотр. [12] при бомбардировке ТФ пневмококков электронами и дейтронами. Есть основания полагать, что трансформирующая активность сохраняется при распаде молекулы ДНК на фрагменты с молекулярным весом порядка 3-5⋅105, т. е. при разделении исходной молекулы на 20 частей с разрывом приблизительно в 0,1% всех межнуклеотидных связей [13].
Литман [14] установила, что минимальный размер ДНК ТФ, при котором компетентная клетка способна его утилизировать, равен 4⋅105.
Дальнейшая деградация ДНК сопровождается потерей трансформирующей активности. Наблюдаемая при этом инактивация может быть связана либо с потерей способности трансформирующей ДНК проникать в клетку, либо же с повреждением ее генетической активности как таковой. Установлено, что энзиматически деградированная ДНК с трудом проникает в трансформабильные клетки [15]. Однако из этого нельзя было сделать заключение о протяженности участка молекулы ДНК, проникающего в клетку, который несет генетическую детерминанту и включается в процесс рекомбинации. Генетические данные указывают, что отдельный ген занимает только часть молекулы трансформирующей ДНК, т. е. в рекомбинацию включается не вся молекула.
Литман попыталась установить истинные размеры той части молекулы ДНК ТФ, которая ответственна за ее генетическую активность. Для этих целей она сопоставила химические и генетические изменения, наблюдавшиеся в ТФ пневмококка при обработке УФ и азотистой кислотой [14]. При дозах HNO2, вызывающих 99,9% инактивации активности пневмококкового ТФ, дезаминировалось от 10 до 15% гуанина и 1-2% аденина. Дезаминирование цитозина в условиях этих опытов не было выявлено. Исходя из предположения о том, что каждое дезаминирование любого из этих двух оснований обусловливает наблюдавшийся биологический эффект, Литман определяет размер инактивированного участка в 150-200 пар оснований.
Остается неясным, за какой этап трансформации ответственна эта чувствительная область ДНК пневмококкового ТФ. Необходима ли она для эффективного спаривания, т. е. для объединения ДНК реципиента с фрагментом ДНК донора, для рекомбинации или же для осуществления других фаз реакции трансформации. Во всяком случае, очевидно, что в зависимости от степени деградации трансформирующего фактора могут быть нарушены по крайней мере два механизма: первичный этап трансформации, т. е. проникновение ДНК в клетку, и последующие фазы реакции, развертывающиеся внутри клетки.
3. Индукция мутаций в результате обработки ТФ химическими мутагенами. Известно, что азотистая кислота является мутагеном, действие которого обусловлено дезаминированием азотистых оснований ДНК. Действие HNO2 на ТФ пневмококка также сопровождается индукцией мутаций. В этих опытах в качестве донора использовался штамм пневмококка, резистентный к стрептомицину, но чувствительный к оптохину и аминоптерину. ДНК донора обрабатывалась in vitro HNO2, а потом инкубировалась с клетками реципиента, которые затем высевались на селективные среды. Количество трансформантов по признаку Sm-r уменьшалось по мере удлинения времени обработки ДНК, а количество трансформантов по признакам Аm-r и 0-r увеличивалось, достигая максимума при относительно низком уровне инактивации признака стрептомицинорезистентности. Иными словами, HNO2 индуцировала мутации в изолированной ДНК донора, которые затем фиксировались в геноме реципиента.
Наследственный характер изменений генетических свойств ДНК донора подтверждался тем, что ДНК, выделенная из трансформированных клеток, была способна трансформировать по этим признакам свежий штамм реципиента.
4. Активность денатурированной и ренатурированной ДНК трансформирующего фактора. Одним из важнейших доказательств природы ТФ являются результаты опытов с денатурированной и ренатурированной ДНК. Напомним, что денатурация заключается в разделении двунитчатой молекулы ДНК на отдельные полинуклеотидные нити. Такое разделение происходит вследствие разрыва водородных связей, объединяющих две полинуклеотидные цепочки. Денатурация может быть вызвана температурой в диапазоне 85-100°, снижением рН до 2,5, или повышением его до 12,0, действием 8 М мочевины или 95%-ным формальдегидом.
Две изолированные полинуклеотидные нити, полученные при тепловой денатурации, можно объединить в двунитчатую структуру при медленном охлаждении раствора [16, 17].
Важно подчеркнуть, что денатурация и ренатурация - процессы, специфические для двунитчатой ДНК. Это придает особое значение результатам опытов, в которых было показано, что денатурация сопровождается инактивацией трансформирующего фактора, а ренатурация - ее восстановлением [18, 19]. Объяснение низкой трансформирующей активности денатурированной ДНК мы находим в работах Роджер и Хочкиса, Лермана и Тольмаха [20, 21], из которых следует, что денатурированная теплом ДНК с трудом проникает в трансформабильную клетку.
Таким образом, на основании всей совокупности фактов, установленных при изучении процессов инактивации изолированного ТФ, приходится признать, что носителем его генетических свойств является ДНК, независимо от возможного присутствия в нем небольших количеств белка.
Некоторые факторы, определяющие эффективность трансформации
Феномен трансформации, открытый, как указывалось, у пневмококков на примере капсулообразования, вскоре был обнаружен и у других микроорганизмов в отношении различных признаков. Трансформация резистентности пневмококков к пенициллину и стрептомицину была описана Хочкисом в 1951 г. [22]; у пневмококков же была осуществлена трансформация типоспецифического М-протеина [23]. Кроме пневмококков экспериментальным объектом, широко применяемым для изучения трансформации, являются бактерии рода Hemophilus. Александер и его сотрудники трансформировали штаммы R-типа. в S-тип, а затем показали возможность индукции у этих бактерий стрептомицинорезистентности. Этими же исследователями была осуществлена трансформация у менингококков [24-26]. Перечень бактериальных видов, у которых оказалось возможным воспроизвести феномен трансформации, был дополнен В. subtilis и стрептококками [27-30].
Обычно частота трансформации различных признаков оказывается величиной порядка 1⋅10-3. Что касается данные Буавена о возможности трансформации бактерий кишечной группы, то они пока не были достоверно подтверждены. Таким образом, несмотря на то, что с момента открытия феномена трансформации у пневмококков прошло около 20 лет, количество бактериальных видов, у которых удалось воспроизвести это явление, остается довольно ограниченным. Вместе с тем нельзя не отметить, что перечень трансформабильных бактерий медленно, но безусловно расширяется. Тот факт, что трансформация обнаружена у бактерий, относящихся к различным семействам и родам, свидетельствует о распространенности среди бактерий этого феномена как механизма передачи генетической информации.
Чем же объяснить тот факт, что до настоящего времени мы располагаем относительно небольшим числом трансформабильных систем? По мере накопления наблюдений о кинетике трансформации стало очевидным, что даже различные штаммы одного и того же вида резко отличаются по своей трансформабильности. Вскоре было показано, что на эффективность трансформации влияют свойства среды, в которой осуществляется реакция. Так, трансформация пневмококков зависела от качества настоя мяса. Химическими факторами, стимулирующими трансформацию пневмококков, оказались пирофосфат [7] и сывороточный альбумин [31]. Факторы, усиливающие трансформацию, неодинаковы для различных систем. Например, трансформация Hemophilus, в отличие от пневмококка, осуществляется в сложной среде, но без добавления альбумина [32].
Ряд наблюдений привели к заключению о том, что способность клеток подвергаться трансформации определяется как свойствами среды, так и физиологическим состоянием самой бактерии. Бактерии в оптимальном для трансформации физиологическом состоянии называют "компетентными". Состояние компетентности наблюдается лишь в определенной фазе развития бактерий [33]. Это состояние можно зафиксировать, если культуру подвергнуть глубокому замораживанию [34, 35]. Иными словами, возможность генетического обмена путем трансформации регулируется самой бактерией и осуществляется лишь при ее определенном физиологическом состоянии. Факторы внешней среды могут влиять как на первичные этапы процесса трансформации (вероятность контакта молекул ДНК с клеткой и фиксация их на поверхности клетки), так и на ее внутриклеточные этапы. Существование продуктов метаболизма бактерии, ответственных за компетентность реципиентных клеток, было установлено в культурах Н. influenzae. Компетентные культуры этого микроба, дважды отмытые солевым раствором от среды, в которой они выращивались, теряли на 97% способность трансформироваться. Способность таких клеток подвергаться трансформации частично восстанавливалась после их ресуспендирования в бульоне Левинталя, содержащем 3⋅10-3 М спермина и от 3 до 6% надосадочной жидкости, полученной после центрифугирования компетентной культуры. Вопрос о природе компетентности получил развитие в исследовании Пакула с сотр. [35]. Эти авторы выделили из компетентных культур стрептококка внеклеточный фактор, стимулирующий трансформацию стрептомицинарезистентности стрептококков. Стимуляция выражалась в сокращении отрезка времени, необходимого для развития состояния компетентности и в резком увеличении числа трансформированных клеток, достигавших у некоторых штаммов 30-40% от общего количества клеток (Пакула, неопубликованные данные 1963 г.). Фактор, открытый Пакула с сотрудниками, способен индуцировать компетентность в 2-3-часовых культурах стрептококка, когда бактерии обычно не могут трансформироваться; процент превращения некомпетентных бактерий в компетентные зависит от температуры и достигает максимума при 37°.
Весьма важным свойством стимулятора трансформабильности оказалась его специфичность: фактор, выделенный из компетентной культуры Streptococcus sanguis, стимулировал способность к трансформации у гомологичных некомпетентных клеток и не активировал штамм challis, и наоборот. Не исключено, что интенсивность синтеза этих веществ и их свойства (устойчивость или чувствительность к факторам среды) определяет различную частоту трансформации, наблюдаемую у разных бактерий.
Относительно недавно [36] был открыт генетический фактор, влияющий на эффективность трансформации. Основной опыт (рис. 3), доказывающий существование в ДНК донора фактора, способного угнетать трансформацию, заключался в следующем: было взято два штамма пневмококка (Rx и Rz), чувствительных к стрептомицину и эритромицину. При трансформации штамма Rx препаратами дезоксирибонуклеиновой кислоты, полученной от стрептомицино- и эритромицинорезистентного донора, трансформанты по обоим признакам возникали с одинаковой частотой. Если же в качестве реципиента использовался второй штамм (Rz) и та же самая ДНК, то количество трансформаций по признаку стрептомицинорезистентности резка снижалось. Грин, описавший это явление, высказал гипотезу о том, что специфическое угнетение трансформации по одному из двух признаков и только в отношении одного штамма обусловлено генетическим фактором (депрессор или "dep"), который сцеплен в хромосоме донора с детерминантой, определяющей стрептомицинорезистентность. По данным Грина, эффект угнетения обусловлен тем, что участок трансформирующей ДНК донора не является гомологичным ДНК штамма Rz, но гомологичен ДНК штамма Rx. В отличие от других факторов, определяющих частоту трансформации (физиологические, физические), депрессор действует только в момент объединения генома донора и реципиента. Естественно возник вопрос, существует ли. этот фактор в клетке до приобретения ею свойства резистентности к стрептомицину, влияет ли он на уровень резистентности или же препятствует взаимодействию фрагмента ДНК донора с ДНК реципиента. Последующее изучение этого вопроса показало [37], что сам по себе депрессор, как и предполагал Грин, не влияет на уровень резистентности к антибиотику, но снижает вероятность объединения двух геномов.
![Рис. 3. Схема опыта Грина [47] (объяснение см. в тексте)](pic/000003.jpg)
Рис. 3. Схема опыта Грина [47] (объяснение см. в тексте)
Природа и генетический механизм действия депрессора объясняются следующим образом: информация, закодированная в участке хромосомы, контролирующем чувствительность к антибиотику, изменяется в результате мутации, которая может сопровождаться одновременным перераспределением генетического материала, т. е. инверсией.
Наличие в трансформирующей ДНК инвертированной области затрудняет объединение геномов донора йодного из реципиентов и снижает трансформацию стрептомицинорезистентности.
Межвидовая трансформация
В предыдущем разделе было указано, что неодинаковая трансформирующая активность ДНК, наблюдаемая в различные периоды роста одного и того же штамма реципиентных бактерий или же у разных штаммов в один и тот же период их развития, зависит от физиологического состояния микроба, называемого компетентностью. Наряду с этим известно и другое обстоятельство, лимитирующее эффективность трансформации, а именно отсутствие структурной гомологии между ДНК донора и ДНК реципиента. С одним из таких случаев мы познакомились при описании механизма действия депрессора. Рассмотрим межвидовую трансформацию. Если мы трансформируем один и тот же штамм, находящийся в одинаковом физиологическом состоянии, с помощью ДНК, характеризующейся одинаковыми физико-химическими свойствами, но выделенной из различных микробных видов, и наблюдаем при этом различную частоту трансформации, то это можно объяснить либо генетической гетерологичностью между ДНК донора и наследственным аппаратом реципиента или же особенностями адсорбции и проникновения ДНК различных видов бактерий в клетку реципиента. Сказанное имеет прямое отношение к межвидовой трансформации, открытой у представителей рода Hemophilus [38, 39].
Особенностью межвидовой трансформации, отличающей ее от внутривидовой, является относительно низкая частота выхода трансформантов. По данным Шеффера [40], гомоспецифическая трансформация штамма Rd дезоксирибонуклеиновой кислотой из стрептомицинорезистентного мутанта этого же штамма завершалась выходом трансформантов с частотой около 1×10-3. При гетероспецифических трансформациях она была значительно ниже*.
* (Обозначения: Rd - штамм H. influenzae; Fid - штамм Н. parainfluenzae; А61 - штамм Н. suis.)
1) Rd × ДНК - Fid Sm-r - частота трансформации 3 × 10-6; 2) Rd × ДНК - А61 Sm-r - частота трансформации 1 × 10-7
Низкая частота межвидовой трансформации не связана с компетентностью клеток, а зависит от особенностей трансформирующей ДНК. Изменение компетентности одинаково отражается на гетероспецифической и гомоспецифической трансформациях. Отношение частот выхода трансформированных клеток при обоих типах реакции остается постоянным в культуре данного вида, находящейся в разных физиологических состояниях. Стабильность этого соотношения наблюдают и при изменении концентрации ДНК, а также при различной продолжительности контакта ДНК донора с клеткой реципиента [41].
Наконец было показано, что различие в частотах меж- и внутривидовой трансформации не может быть объяснено неодинаковой способностью ДНК доноров фиксироваться на реципиенте и проникать внутрь него [40]. Все это приводит к выводу о том, что эффективность трансформации наряду со свойствами реципиента (компетентность), определяется особенностями ДНК донора и, вероятнее всего, степенью ее генетического подобия с ДНК реципиента.
Механизм трансформации
Конечным результатом трансформации является, как указывалось, изменение генотипа реципиента. Этому предшествует ряд событий, началом которых является контакт трансформирующей ДНК с поверхностью трансформируемой бактерии. Общая схема трансформации и последовательность отдельных ее этапов состоит [40] из следующих процессов: 1) адсорбции молекулы трансформирующей ДНК на поверхности бактерии; 2) проникновения молекулы ДНК внутрь клетки; 3) специфического спаривания внедрившейся молекулы с хромосомными структурами реципиента; 4) включения генетической детерминанты и хромосомную структуру реципиента; 5) сегрегирования трансформированного нуклеоида бактерии в ходе одного или двух делений.
В опытах с ДНК H. influenzae, меченной Р32, было показано, что компетентная клетка поглощает радиоактивность и сохраняет ее после отмывания и обработки реципиента ДНК-азой. Число полученных трансформантов пропорционально количеству поглощенной ДНК [40, 42]. Результаты опытов с изотопами хорошо согласуются с данными, полученными после обработки ДНК-азой комплекса ДНК + клетка-реципиент. Было установлено, что первая фаза трансформации обратима, так как в это время комплекстрансформируемая клетка + ДНК не устойчив к ДНК-азе, вторая - необратимая - устойчива к обработке ферментом. ДНК донора, проникшую в клетку реципиента, можно обнаружить путем разрушения обработанных клеток лизоцимом. В полученных лизатах выявляется ТФ, чувствительный к ДНК-азе. Активность ТФ, освобожденного из клеток на первых: этапах трансформации, соответствует количеству ДНК, поглощенному клетками. Отличительной особенностью первого и второго этапа (адсорбция, проникновение) трансформации является: отсутствие специфичности, т. е. реципиент в одинаковой степени поглощает трансформирующий фактор и нетрансформирующую ДНК, а также гомо- и гетероспецифичные ДНК при внутри- и межвидовой трансформации. Вместе с тем известно, что нетрансформирующая ДНК, добавленная к смеси ТФ + клетка, угнетает реакцию трансформации. Хочкис исследовал зависимость выхода трансформантов от концентрации трансформирующей ДНК в присутствии нетрансформирующей. На приведенном рисунке (рис. 4) изображена активность пневмококковой ДНК, несущей признак стрептомицинорезистентности. Мы видим, что количество трансформированных бактерий пропорционально концентрации ДНК. Такая зависимость сохраняется до тех пор, пока концентрация активной ДНК не достигнет уровня, равного 0,1 γ/мл. После этого способность клеток реагировать с ДНК "насыщается" и на кривой появляется плато (кривая 1). Линейная зависимость сохраняется и в тех случаях, когда ДНК пневмококка, обладавшего стрептомицинорезистентностью, разбавлялась в 2 и 5 раз препаратом пневмококковой ДНК, не обладавшей признаком Sm-r. Однако появление плато в этих случаях снижалось, т. е. "насыщение" компетентных клеток происходило при более низких концентрациях трансформирующей ДНК, что свидетельствует о наличии конкуренции между генетически активными и неактивными молекулами ДНК. Такую конкуренцию описывают как феномен угнетения трансформации.
![Рис. 4. Зависимость Sm-r-трансформирующей активности от концентрации ДНК, несущей фактор Sm-r: I - 100% ДНК-Sm-r; II - 49% ДНК-Sm-r; 51% ДНК-F; III - 20% ДНК-Sm-r; 80% ДНК-F; IV - зависимость выхода трансформантов от общей концентрации ДНК. Указанные смеси с 'посторонней' ДНК (также извлеченной из пневмококков, но несущей вместо фактора Sm-r фактор F) добавляли в возрастающих количествах к образцам той же культуры. Продолжительность инкубации - 5 мин., t 37° [58]](pic/000004.jpg)
Рис. 4. Зависимость Sm-r-трансформирующей активности от концентрации ДНК, несущей фактор Sm-r: I - 100% ДНК-Sm-r; II - 49% ДНК-Sm-r; 51% ДНК-F; III - 20% ДНК-Sm-r; 80% ДНК-F; IV - зависимость выхода трансформантов от общей концентрации ДНК. Указанные смеси с 'посторонней' ДНК (также извлеченной из пневмококков, но несущей вместо фактора Sm-r фактор F) добавляли в возрастающих количествах к образцам той же культуры. Продолжительность инкубации - 5 мин., t 37° [58]
Изучение угнетения трансформации Н. influenzae нетрансформирующей ДНК показало, что эффект угнетения зависит от степени насыщения клетки молекулами обоих типов ДНК. Если компетентная клетка реципиента насыщена молекулами ТФ (множественность 10), то относительно небольшой избыток сопутствующей ДНК угнетает выход трансформантов. В отсутствие насыщения бактерий трансформирующей ДНК угнетение выхода трансформантов наблюдается лишь при значительном избытке конкурентной ДНК. При этом в обоих случаях наименьшие концентрации сопутствующей ДНК, обеспечивающие угнетение трансформантов, оказались константными и равными 0,1 γ/мл, т. е. множественности 10. Указанные взаимоотношения иллюстрируются табл. 2 [40].
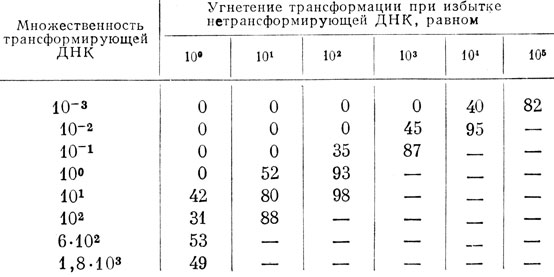
Таблица 2. Угнетение трансформации нетрансформирующей ДНК как функция концентрации ТФ (в %)
Таким образом, угнетение трансформации возникает в результате конкуренции между генетически активными и инертными молекулами ДНК.
Изложенное выше объяснение основано на предположении об однородности бактериальной популяции по своей компетентности, что само по себе требует экспериментальных доказательств. Однако очевидно, что описываемое угнетение трансформации связано с внутриклеточными стадиями реакции. Что же происходит с молекулой трансформирующей ДНК после проникновения ее в клетку реципиента? Прежде всего необходимо было выяснить, как быстро реципиент приобретает наследственный признак донора после поглощения ТФ.
В опытах с хлорамфениколом (специфический ингибитор синтеза белков), добавленным к клеткам пневмококка, находившимся в течение 3 мин. в контакте с трансформирующей ДНК, было установлено, что нарастающее нарушение клеточного метаболизма, вызванное антибиотиком, сопровождается "излечением" бактерий от внедренной ДНК. Эфруеси-Тейлор [15] приходит к выводу, что трансформирующее действие может быть заблокировано хлорамфениколом непосредственно после поглощения ДНК клеткой. Иными словами, в этот период еще нельзя говорить о трансформации. Клетки с поглощенной ДНК правильнее называть потенциальными трансформантами. Устойчивое состояние трансформации развивается в бактериях значительно позже, после поглощения ДНК [15].
На графике рис. 5 видно, что обратимость трансформации сохраняется в клетке по крайней мере в течение 10 мин., затем число необратимых трансформантов резко возрастает и достигает максимума к 22-й мин., после чего популяция стабилизируется. Вторая волна стабилизации наступает от 40-й до 60-й мин. Таким образом, состояние устойчивой трансформации в культуре развивается ступенчато. Сопоставление динамики формирования стабильных трансформантов с процессом деления бактерий приводит к следующему заключению: после адсорбции трансформирующей ДНК в бактериальной популяции присутствуют лишь потенциально-обратимые трансформанты. Необратимость возникает в клетках лишь при определенном физиологическом состоянии, когда с момента поглощения клеткой ДНК прошло 2/3 периода генерации. Количество стабильных трансформантов в данный отрезок времени для определенной культуры и конкретного гена - величина постоянная.
![Рис. 5. Формирование трансформантов в клетках, обработанных хлорамфениколом. Цифрами на кривых показано время начала действия антибиотика после контакта реципиента с ДНК донора [23]](pic/000006.jpg)
Рис. 5. Формирование трансформантов в клетках, обработанных хлорамфениколом. Цифрами на кривых показано время начала действия антибиотика после контакта реципиента с ДНК донора [23]
Ступенчатость формирования необратимых трансформантов зависит также от циклов размножения клеток. Количество необратимых трансформантов, возникших до первого деления клеток, постоянно до определенного момента, предшествующего второму делению, когда новая часть нестабильных трансформантов превращается в стабильные. Конечный уровень превращения потенциальных трансформантов в стабильные определяется биологическими особенностями изучаемой культуры.
Характерная особенность трансформации заключается в том, что внесенная в бактерию генетическая детерминанта не реплицируется синхронно с делением клетки, поскольку относительное количество трансформантов, обнаруживаемых после первого деления, равно количеству, выявляемому до деления. Таким образом, состояние стабильности трансформанта характеризует собой процесс интеграции трансформирующей ДНК с хромосомным аппаратом бактерии. Эта интеграция наступает в определенной фазе цикла деления и не осуществляется сразу при одном и том же делении во всех клетках, поглотивших молекулу трансформирующей ДНК.
Интеграция двух генетических начал в клетке реципиента представляет собой важнейший заключительный этап трансформации, выражающийся в переходе от состояния нестабильности (потенциальные трансформанты) к стабильности (приведенные выше опыты Эфрусси-Тейлор с влиянием хлорамфеникола). Роль интеграции геномов в формировании стабильных трансформантов доказывается тем, что ДНК донора, внедрившаяся в клетку реципиента, не способна индуцировать синтез ферментов до тех пор, пока она не объединится с хромосомой бактерии [43]. И, наконец, тот факт, что невозможно обнаружить трансформирующую ДНК в реципиентных клетках через некоторое время после поглощения ими ДНК донора [44], указывает на объединение внедрившейся ДНК с бактериальной хромосомой.
Каковы же механизмы, обеспечивающие интеграцию двух генетических начал в ходе трансформаций?
Некоторые сведения о молекулярном механизме интеграции ДНК донора и генома реципиента были получены в опытах с изотопами [45]. В них было показано, что сразу после внедрения около половины ДНК находится в клетке в виде одной нити, вторая половина разрушается до диализабильных олигонуклеотидов и неорганического фосфата. По мере инкубации клеток с трансформирующей ДНК радиоактивность нативной фракции бактериальной ДНК реципиента возрастала. Источником этой радиоактивности являются фрагменты разрушенной нити ДНК донора, использованные в ходе обычного синтеза, и однонитчатая ДНК, часть которой целиком включается в ДНК реципиента. Увеличение радиоактивности нативной ДНК реципиента и исчезновение однонитчатой ДНК донора соответствует моменту появления трансформантов. Таким образом, однонитчатая ДНК донора, с трудом проникающая в клетку, находясь внутри нее, является тем субстратом, который объединяется с ДНК бактерии. Если же искусственно обеспечить проникновение в бактерию однонитчатой ДНК, то клетка трансформируется [18-20]. Однако, как указывалось выше, не вся проникшая молекула ДНК включается в геном бактерии. Отсюда следует, что количество генетических детерминант, локализованных в одной молекуле ДНК, способных включиться в геном реципиента, лимитировано, т. е. ограничено узкой областью. Вопрос о том, каков диапазон трансформации, или какое количество генов можно передать бактерии, решается в опытах со сцепленной и несцепленной трансформацией.
Сцепленная и несцепленная трансформация
На первых этапах изучения трансформация описывалась как передача генетических факторов, независимых один от другого. Одиночный генетический локус, локализованный в ДНК донора, формирует трансформант с одним измененным признаком. Линейная зависимость между количеством трансформантов и концентрацией ДНК [46-48] указывает, что образование трансформанта есть результат взаимодействия одной бактерии с единицей трансформирующей активности. Однако в последующем были описаны трансформации по двум признакам: трансформация антигенов у Н. influenzae [49] признаков ферментирования манита и стрептомицинорезистентности у пневмококка [50], резистентности к катомицину и стрептомицину у бактерий рода Hemophilus [51]. Двойные трансформации могут быть вызваны смесью молекул ДНК, выделенных из разных штаммов, каждый из которых несет отдельную генетическую метку, или одной ДНК, выделенной из клетки, меченной двумя или более мутантными генами.
В первом случае частота двойных трансформаций описывается как функция частот отдельных трансформаций. Во втором случае наблюдают два результата: когда количество двойных трансформантов равно числу трансформантов, обнаруживаемому при одновременной передаче двух независимых признаков; когда количество двойных трансформантов больше количества, ожидаемого при трансформации отдельными признаками (табл. 3). Первый тип трансформантов возникает за счет трансформации, индуцированной двумя молекулами ДНК, а трансформанты второго типа за счет одной молекулы, несущей оба гена.
![Таблица 3. Трансформация Н. influenzae сцепленными и несцепленными генами [48]](pic/000007.jpg)
Таблица 3. Трансформация Н. influenzae сцепленными и несцепленными генами [48]
Примечание. С - резистентность к стрептомицину; К - резистентность к катамицину; С + К - смесь ДНК, выделенных из отдельных резистентных штаммов; СК - ДНК, выделенная из штамма, резистентного к обоим антибиотикам.
И в первом, и во втором случае трансформация обусловлена взаимодействием отдельной молекулы ДНК с компетентной клеткой. Двойные трансформанты, возникающие при контакте компетентных бактерий с ДНК, меченной двумя сцепленными генами, формируются в результате одноступенчатого акта. Двойные трансформанты, получаемые при воздействии препаратов ДНК, содержащих смесь молекул, несущих различные гены, формируются в результате двойного акта взаимодействия клетки с двумя генетически различно меченными ДНК. Это хорошо доказывается опытами со ступенчатой индукцией различных уровней резистентности к антибиотикам [52]. У трех мутантов Н. influenzae уровень резистентности к стрептомицину был 10, 100 и 700 γ/мл. Оказалось, что это связано с существованием в хромосоме бактерий двух генетических участков, мутация одного из которых приводит к формированию устойчивости против 10 γ, а второго - против 100 γ. Соответственно вариант, обладавший высшей резистентностью (700 γ/мл), являлся мутантом по двум независимым локусам. Три типа ДНК были выделены из перечисленных мутантов и использованы в опытах трансформации.
ДНК из штамма Sm10 и Sm100 не индуцировали трансформантов с устойчивостью против 700 у/мл. Полученные трансформанты обладали уровнем резистентности, соответствующим штамму, из которого они были получены.
При перекрестной трансформации штамм Sm10 × ДНК Sm100 и штамм Sm10 × ДНК Sm100 трансформанты обладали высшим уровнем резистентности, т. е. каждая из указанных ДНК дополняла генотип реципиента, включаясь в хромосому как независимая единица, в результате чего формировался фенотип, характерный для двойного мутанта.
ДНК, выделенная из штамма с резистентностью к 700 γ/мл стрептомицина, индуцировала трансформанты трех типов: 1) с уровнем резистентности, равным 10 γ/мл; 2) с уровнем 100 γ/мл и 3) с резистентностью против 700 γ/мл. Количество трансформантов третьего типа соответствовало частоте трансформации по двум независимым генетическим локусам, находящимся в различных молекулах ДНК.
При трансформации бактерии ДНК, несущей сцепленные гены, частота появления двойных трансформантов колеблется, так как и в этом случае трансформация является функцией количества компетентных клеток и количества молекул, которые с ними реагируют. Поэтому более точно считать, что показателем сцепленной трансформации будет не только большое количество полученных двойных трансформантов, но и постоянство отношения частоты появления двойных трансформантов к одиночным при различных концентрациях компетентных клеток и ДНК. Отмечено также, что выход трансформантов будет различен при различных сцепленных признаках. Например, число трансформантов по признакам А и В может быть большим, чем по признакам А и С. Это определяется расстоянием между генами по длине хромосомы. ДНК, выделенная из двойного трансформанта, аналогично исходной ДНК донора, трансформирует клетки трех типов. Например, в приведенном выше случае трансформанты будут характеризоваться следующими признаками: стрептомицинорезистентностью, катамицинорезистентностью, двойной резистентностью (С и К).
Каково происхождение одиночных трансформантов при трансформации ДНК, несущей два сцепленных мутантных гена? Хочкис и Мармур [50], изучавшие трансформацию пневмококков двумя сцепленными признаками (ферментирование маннита и резистентность к стрептомицину), полагают, что трансформанты, несущие только один из признаков донора, возникают в результате рекомбинации между фрагментом внесенной ДНК и ДНК реципиента. Гудгэл, изучавший этот же вопрос на Н. influenzae [48], также указывает, что одной из причин появления одиночных трансформантов при работе со сцепленными признаками является рекомбинация между участками ДНК бактерии-реципиента и трансформирующей ДНК донора.
Как же осуществляется последний этап трансформации - собственно генетический обмен, завершающийся передачей реципиенту гена донора? Важное значение для понимания механизма внутриклеточных этапов трансформации имеют опыты, в которых с помощью генетических методов определялся размер трансформирующих единиц. Хочкис и Эванс [53] получили сульфамиднорезистентные мутанты пневмококка, которые при делении сохраняли уровень резистентности исходных клеток. Однако ДНК, выделенная из таких культур, трансформировала большинство реципиентных клеток в резистентные, но с различным уровнем устойчивости к сульфамиду. Только у небольшого числа трансформантов уровень резистентности был равен таковому у исходной культуры. Генетический анализ исходной культуры показал, что в ее генотипе имеются три детерминанты (а, б, в), каждая из которых контролирует соответствующий уровень резистентности к сульфамиду.
Из трансформантов, индуцированных ДНК штамма с максимальной чувствительностью, были выделены варианты, характеризующиеся следующими генотипами: а, б, в, аб, бв и абв. Каждый из этих штаммов характеризовался специфичным для него Уровнем резистентности. ДНК, выделенная из этих трансформантов, индуцировала в новых реципиентах лишь определенный Уровень резистентности, соответствующий данному генотипу. Количественное распределение отдельных типов трансформантов было следующее: 0,4% - типа абв, 20% - типов аб и бв, 79,6% - типов а, в, б. Таким образом, в этой системе мы имеем дело с простейшими генетическими детерминантами, которые более часто внедрялись в геном реципиента, чем комплекс в целом.
Иными словами, чем больше генетическая область, тем меньше шансов на то, что все локализованные в ней детерминанты окажутся переданными в хромосому компетентной клетки.
В настоящее время, кроме приведенных выше данных [45], нет прямых экспериментальных доказательств для окончательного решения вопроса о точном механизме генетической рекомбинации, происходящей при трансформации.
Однако на основании косвенных показателей более приемлемым является представление о том, что рекомбинация в клетке реципиента осуществляется за счет разрыва и воссоединения взаимодействующих молекул ДНК, а не за счет избирательного кодирования. Это подкрепляется следующими положениями:
1. Внедрившаяся ДНК донора не реплицируется в клетке реципиента в период ее первого деления, хотя в это время и формируется часть необратимых трансформантов.
2. Количество клеток, содержащих трансформирующую ДНК, после первого деления такое же, как и до первого деления.
3. Зависимость между протяженностью генетических детерминант и частотой выявления трансформантов свидетельствует о том, что генетическая интеграция, происходящая при трансформации, осуществляется в ограниченном участке молекулы ДНК. Следовательно, рекомбинация является следствием дезорганизации ДНК донора, внедрившейся в клетку реципиента.
4) Трансдукция
Трансдукция - феномен переноса генетического материала из одних бактерий в другие, осуществляемый умеренными бактериальными вирусами (фагами). Умеренные фаги способны извлечь из бактерии-донора некоторую часть ее генетического материала и перенести его в клетку реципиента. Таким образом, трансдукцию можно определить как изменение с помощью фага наследственных свойств бактерии-реципиента в направлении наследственных признаков бактерии-донора (рис. 6).
![Рис. 6. Схема трансдукции [65]](pic/000008.jpg)
Рис. 6. Схема трансдукции [65]
Два типа трансдукции (неспецифическая и специфическая). Феномен трансдукции был описан Циндером и Ледербергом с фагом Р22 [54]. В этих опытах было показано, что обработка культур, не ферментирующих арабинозу или рамнозу, фильтратами фаголизатов клеток, обладавших этими свойствами, приводит к появлению бактерий, расщепляющих эти углеводы. Способность ферментировать арабинозу и рамнозу у таких бактерий наследственно закреплена. Таким образом, в феномене трансдукции принимают участие три компонента: бактерия-донор, трансдуцирующий фаг и бактерия-реципиент.
Результаты опытов Циндера и Ледерберга были подтверждены на различных фагах, бактериях и в отношении разных признаков. Было показано, что некоторые фаги способны передать неподвижным штаммам салмонелл гены, контролирующие образование жгутиков или жгутикового антигена [55, 56].
Трансдукция жгутиков у салмонелл подробно изучена Винклером [57], который выделил 14 фагов из 14 лизогенных штаммов S. typhimurium. Все фаги были способны индуцировать образование жгутиков или жгутиковых антигенов. Трансдуцируемыми оказались гены, определяющие способность ферментировать различные углеводы [54, 58], резистентность к антибиотикам [59, 60], пенициллиназную активность[61], спорообразование [62]. Наконец, сама лизогенность является признаком, который может быть передан от донора реципиенту [63]. Большое значение имеют исследования по трансдукции вирулентности. Возможность превращения авирулентного штамма в вирулентный в результате трансдукции была показана Фарнес и Роулей на двух штаммах [64]. Оба штамма оказались ауксотрофами по аденину, а в результате трансдукции они превратились в прототрофы, т. е. стали независимыми от этого азотистого основания. По-видимому, в данном случае авирулентность штамма была связана с потребностью в этом веществе, а микроб не мог получить его из тканей организма.
Переход упомянутых штаммов в вирулентную форму не сопровождается лизогенизацией и этим отличается от описанного Громэном превращения С. diphtheriae в токсигенную форму. Трансдукцию можно вызвать фагом, потерявшим инфекционность после облучения ультрафиолетом, а также у иммунных бактерий, когда фаг адсорбируется и инъецирует в бактерию ДНК, но активная инфекция при этом не возникает. Следовательно, для осуществления трансдукции необходимы закрепление частицы фага на бактерии-реципиенте и инъекция в нее содержимого головки фага.
Трансдукция осуществляется только определенными типами умеренных фагов. Так, из 23 испытанных умеренных фагов лишь один обладал трансдуцирующей активностью. Как правило, специфичность трансдуцируемого признака определяется бактерией-донором, а не фагом. Один и тот же фаг может трансдуцировать различные признаки от доноров к бактериям-реципиентам (неспецифическая трансдукция). Например, фаг Р22 в опытах Циндера и Ледерберга был использован для трансдукции признака расщепления углеводов [54]; он же оказался переносчиком и других признаков, в частности устойчивости к стрептомицину и прототрофности в отношении аденина, а также генов S. typhimurium, контролирующих синтез триптофана, пролина, аргинина, аденина, цистеина и цистина [65]. Частота трансдукции, или отношение числа трансдуцированных клеток к количеству бактерий, адсорбировавших фаг, одинакова для разнообразных признаков и выражается показателями порядка 10-5-10-7, Таким образом, в большинстве случаев трансдукция неспецифична в отношении признака, переносимого от бактерии-донора к бактерии-реципиенту. Наряду с этим результат трансдукции, т. е. изменение генотипа реципиента, зависит и от бактерии-реципиента. Это означает, что один и тот же фаг, размножившись на доноре, характеризующемся тем или иным наследуемым признаком, не в состоянии передать его всем штаммам-реципиентам. По данным Винклера [57], из девяти безжгутиковых штаммов салмонелл, использованных в качестве реципиента, у двух не удалось вызвать трансдукцию гена образования жгутиков. Отмечено также, что бактерия-реципиент, инертная к восприятию одного гена, переносимого данным фагом, трансдуцируется этим же фагом по другому гену. Фаг Р22 является эффективным переносчиком фактора прототрофности в отношении аденина на штаммах S. typhimurium D2 и D10, но не передает это свойство другому штамму, хотя трансдуцирует его в резистентный к стрептомицину [64].
Систематическое изучение компетентности реципиентов, т. е. способности различных штаммов бактерий воспринимать в ходе трансдукции те или иные гены, было проведено на золотистом стафилококке [60].
В качестве донора была использована культура, вырабатывающая пенициллиназу и резистентная к хлортетрациклину. Из 47 штаммов-реципиентов 25 оказались компетентными к гену Pase (резистентность к пенициллину). Из этих 25 штаммов 14 были изучены как реципиенты генов, контролирующих резистентность к хлортетрациклину (Tet) и новобиохину (Nov). Трансдукция осуществлялась тем же фагом, что и в первом случае.
Оказалось, что ген резистентности к хлортетрациклину Tet передавался со значительно большей частотой, чем ген Pase, а ген Nov, хотя и передавался каждому из 14 штаммов, но частота его трансдуктантов сильно варьировала. Природа различной компетентности клеток при трансдукции разных признаков не выяснена.
Поскольку в этих опытах разная частота выхода трансдуктантов наблюдалась при применении одного и того же фага и одних и тех же культур, то предположение о различной степени проникновения разных генетических детерминант в реципиент маловероятно. Скорее всего, различия в компетенции определяются механизмами внутриклеточной фазы трансдукции, т. е. степенью совместимости между фрагментом хромосомы донора и хромосомой реципиента.
Альтернативное объяснение заключается в предположении, что ассоциация "хромосомы" фага-переносчика с различными генетическими детерминантами донора осуществляется по-разному. Это предположение основано на наблюдении, что отношение частоты трансдукции генов Pase и Tet у S. aureus, равное 1:10, изменялось при применении других фагов, за счет уменьшения выхода трансдуктантов только по признаку Pase, а по признаку Tet оно оставалось таким же.
Наряду с описанным выше неспецифическим типом трансдукции известен и другой, который характеризуется высокой специфичностью - способностью фага переносить от донора только определенные гены. Морзе, Ледерберг Е. и Ледерберг Д. [66] обнаружили, что фаг λ, полученный в результате индукции лизогенных бактерий, ферментирующих галактозу, трансдуцирует исключительно этот ген. Недавно была открыта специфическая трансдукция гена синтеза триптофана умеренным фагом Ф80, который локализуется в хромосоме Е. coli K12 близко от триптофанового маркера [67]. Попытки трансдуцировать этим фагом какие-либо другие гены кроме триптофанового оказались неудачными [68]. Если принять во внимание, что указанные профаги локализуются на хромосоме бактерий рядом с участком, контролирующим расщепление галактозы или синтез триптофана, то очевидно, что в описываемом варианте трансдукции генетический материал фага-переносчика и трансдуцируемый фактор тесно связаны, т. е. взаимоотношения между профагом и хромосомой бактерии сохраняются в вегетативном и зрелом фаге, используемом для трансдукции. Способность к трансдукции зависит от способа получения λ и Ф80. Если они получаются в результате индукции лизогенных бактерий, то они трансдуцируют соответствующие признаки. Если же они получены в результате литического цикла в чувствительной Е. coli К12, то они не трансдуцируют бактерию-реципиент. Это существенно отличает данный тип трансдукции от неспецифической, например трансдукции фагами S. typhimurium P1, P1 dl, трансдуцирующая активность которых не зависит от их существования в клетке донора в фазе профага [69].
Причиной этих различий являются неодинаковые механизмы формирования трансдуцирующих частиц фага при обоих типах трансдукции.
Механизм трансдукции
Механизм первых этапов трансдукции заключается в том, что при инфекции умеренным фагом бактерии-донора генетические структуры последней расщепляются на фрагменты и включаются в геном трансдуцирующего фага.
Для понимания трансдукции как механизма передачи наследственных признаков у микробов необходимо ответить на два важных вопроса:
1. В каком состоянии находится генетический фрагмент бактерии-донора в частице трансдуцирующего фата? Иными словами, включается ли генетический материал бактерии в "хромосому" бактериофага или же они находятся в белковой оболочке фага независимо друг от друга.
2. Как осуществляется интеграция между генетическим аппаратом бактерии реципиента и фрагментом хромосомы донора?
Известно, что трансдукция осуществляется без лизогенизации, т. е. умеренный фаг передает реципиенту генетический материал донора, не лизогенизируя клетку; показателем этого является неспособность трансдуцированной бактерии спонтанно или индуцированно формировать зрелые частицы фага.
Адамс и Луриа [70] показали, что если фагом Р1 заразить бактерию-реципиент, так чтобы на клетку приходилась одна частица фага, то большинство транедуцированных клонов будет не лизогенно. Такой же результат был получен Арбером с сотр. [71] и Кэмпбелом [72] при трансдукции признака ферментации галактозы с помощью фага λ. Лизатами клеток Е. coli K12 gal+ обрабатывались реципиенты gal- таким образом, чтобы на каждую клетку приходилось менее одной часгицы фага. Селекционированные бактерии gal+ ни спонтанно, ни после индукции не формировали частиц фага.
Такой же результат был получен при трансдукции гена, контролирующего синтез метионина, штамму 23-М Bacillus subtilis фагом S1 [73]. В дополнение к этим данным следует упомянуть опыты Циндера и Ледерберга [54] с вирулентными мутантами фага Р22, который осуществлял транедукцию при суперинфекции клеток, лизогенизированных фагом Р22.
Эти результаты, как и упомянутые выше данные о транедуцирующей активности умеренных фагов, инактивированных УФ, рассматривали как свидетельство раздельного существования в частице трансдуцирующего фага наследственных детерминант бактерии-донора и самого фага. Такое предположение основывалось на мысли, что транедуцирующий элемент функционирует независимо, при кажущемся исключении функциональной активности генетического аппарата фага. Однако это предположение изменилось в связи с открытием факта, что транедуктанты, полученные под влиянием фага λ, представляют собой дефективно-лизогенные штаммы [71, 74-75].
В результате трансдукции они приобретают иммунитет к фагу λ. Следовательно, трансдукция осуществляется неполноценными частицами умеренного фага, дефективность которых выражается в потере одной или ряда детерминант, контролирующих вегетативный цикл развития фага. Эти дефективные частицы формируются в клетке донора в процессе развития фага и обозначаются символом λdg (дефективный фаг λ, транедуцирующий признак gal+).
Каков механизм их образования?
Экспериментальные данные указывают, что дефективность трансдуцирующего фага обусловлена заменой сегмента его генома сегментом бактериального генома; это выражается в изменении как физических, так и генетических свойств фага.
Степень генетического обмена между бактерией-донором и транедуцирующим фагом варьирует в разных системах. В трансдуцирующих дефективных частицах фага λ (λdg) от 1/4 до 1/3 генома замещено соответствующим фрагментом генома бактерии.
Но даже в одном и том же транедуцирующем фаге степень замещения генома фага геномом бактерии неодинакова. Кэмпбелл показал, что различные образцы фага λdg, трансдуцирующего признак gal+, отличаются друг от друга по наличию остаточных генетических признаков, характерных для исходного фага.
Все эти наблюдения хорошо согласуются с результатами исследования трансдуцирующих фагов λ в градиенте плотности, в котором было установлено, что различные образцы таких фагов либо легче, либо тяжелее нормальных, т. е. содержат иное количество ДНК; это связано с замещением участка ДНК фага фрагментом ДНК бактерии-донора. Различная плотность λdg и исходных фагов указывает на то, что генетический сегмент бактерии, включающейся в фаг, неодинаков по молекулярному весу с замещенным сегментом фага.
Все приведенные данные были получены при изучении фагов λdg. Исследование других трансдуцирующих фагов установило существенные отличия от описанной системы. Так, например, трансдуцирующие варианты кишечных фагов Р1 и Р22 и стафилококкового фага, по данным седиментационного анализа, существенно не отличаются от инфекционного фага, что свидетельствует о наличии в них близких количеств генетического материала [65, 69].
Второе важное отличие этих фагов от λdg заключается в том, что их трансдуцирующая активность не связана с предварительным существованием внутри донора в фазе профага. В отличие от фага λdg в фаге P1 dl (вариант фага Р1, трансдуцирующий ген ферментирования лактозы) не установлено потери какой-либо генетической детерминанты исходного фага.
Предполагается, что в геноме фага Р1 имеются участки, способные к обмену с фрагментом бактериальной хромосомы. Обмениваемые участки хромосомы фага содержат мало генетических детерминант или не имеют их, поэтому трансдуцирующие варианты фага Р1 с трудом дифференцируются как дефективные [76].
Следовательно, степень и характер дефективности сформировавшегося трансдуцирующего фага обусловлены свойствами той части генома фага, которая замещается в нем на бактериальный. Физическая дифференциация различных λdg-фагов согласуется с данными тонкого генетического анализа, свидетельствующими о том, что эти фаги теряют различные участки нормального генома. Общим признаком для всех λdg-фагов является то, что в пределах утраченного участка генома всегда находится детерминанта, контролирующая диапазон действия фага, так называемый h-признак [77]. Важная особенность заключается в том, что степень замещения участка генома фага сегментом бактериальной хромосомы у разных линий λdg-фагов не изменяется в процессе роста бактерии или фага.
Следующим доказательством интеграции в трансдуцирующей частице генетических элементов бактерии-донора и фага-переносчика является получение Hft лизатов фага λ, способных с большой частотой переносить признак gal+ в gal- бактерии.
Выше упоминалось, что частота трансдукции невелика и колеблется от 10-7 до 10-5. Такие показатели частоты получены при трансдукции gal+-признака к Е. coli К12 gal- с помощью фага, индуцированного в лизогенной культуре К12 gal+ (λ). Фаголизаты, дающие низкую частоту трансдукции, обозначают индексом Lft (от англ. Low frequency of transduction).
Если генетический материал фаговой частицы, обладающей трансдуцирующей активностью, объединен с генетическим фрагментом бактерии, то, попав в клетку реципиента, он должен сохраниться в ней в объединенном состоянии и в случае репродукции воспроизводиться совместно. Если же сегменты хромосомы донора и частицы фага существуют раздельно, то при воспроизведении дефективных частиц фага они не будут объединены в потомстве. Иначе говоря, потомство дефективных частиц фага, полученное из трансдуцированных клеток, не должно обладать трансдуцирующей активностью.
Поскольку у дефективных фагов отсутствуют некоторые гены, образование оформленных частиц такого фага обычно невозможно. Но в том случае, когда в клетке, несущей дефективный профаг, размножается нормальный фаг λ, образуется также много дефективных частиц, способных трансдуцировать признак gal+ [75]. Лизаты, содержащие большое число трансдуцирующих частиц фага, обозначают индексом Hft (от англ. High frequency of transduction). Получить их можно путем индукции УФ трансдуктантов из лизогенных культур, обработанных фагом λdg [66]. Таким образом, в данном случае комплекс - генетический фрагмент фага + генетический фрагмент бактерии, - находящийся в исходной трансдуцирующей частице, сохраняется и в потомстве, что могло быть лишь при их совместной репродукции.
Следовательно, трансдуцирующий фактор появляется в результате генетической рекомбинации между наследственными структурами умеренного фага и бактерии донора, в которой он размножается. В данном случае возникает ситуация, при которой "генетическая детерминанта бактерии ведет себя как часть генома фага" [74].
Жакоб и Вольман предполагают, что рекомбинация между генетическими структурами бактерии и профага, заканчивающаяся образованием дефективного фага, обусловлена ошибкой копирования во время репликации фага в лизогенной бактерии [74]. Вейгль с сотр. [78] предполагает, что формирование λdg-фага. происходит в процессе, аналогичном двойному кроссинговеру.
Кэмпбелл [77] считает, что профаг, объединенный с хромосомой Е. coli K12, обычно при индукции отрывается в участках, где произошло объединение двух геномов; в результате этого восстанавливается нормальный геном фага λ. В тех случаях, когда расчленение двух геномов произошло в других точках, возникают варианты λdg, несущие участок хромосомы бактерии.
Таким образом, не исключено, что генетический фрагмент бактерии попадает в трансдуцирующую частицу фага двумя способами: 1) при индукции лизогенной бактерии, когда отделяющийся геном фага увлекает часть бактериального генома взамен части своего собственного (фаг λdg); 2) в результате обмена фрагментами в ходе вегетативного цикла развития умеренного фага.
Чем же объяснить, что в одних случаях такая рекомбинация осуществляется специфично, т. е. в геном фага включаются определенные детерминанты бактерии (специфическая трансдукция), а в других - неспецифично, когда трансдуцирующий фаг может передавать различные признаки. Вероятно, это зависит от локализации данного профага на хромосоме бактерии. Если умеренный фаг, например λ, всегда прикрепляется к сегменту хромосомы бактерии в том участке, который контролирует ферментацию галактозы, то трансдуцирующий вариант этого фага (λdg) будет переносить этот признак в бактерию-реципиент.
Противоположным примером является фаг 363, для которого не установлена избирательная хромосомная локализация. Жакоб и Вольман [74] предполагают, что фаг 363 не занимает постоянного участка на хромосоме Е. coli K12, а может фиксироваться на различных ее сегментах. Такой фаг, в отличие от фага λ, способен осуществлять неспецифическую трансдукцию.
Следовательно, специфичность или неспецифичность трансдукции является отражением характера связи между хромосомой бактерии и геномом умеренного фага.
Что же происходит в клетке реципиента, в которую внедрилась ДНК трансдуцирующего фага?
На примере трансдукции "признака gal+ фагом λdg показано, что реципиент gal- приобретает признак gal+, но полученные трансдуктанты не являются истинными рекомбинантами: они отщепляют галактозоотрицательные нелизогенные клоны, т. е. являются гетерогенотами. Данным термином обозначают мерозиготы - неполные диплоиды, в которых присутствуют не все аллели бактерии-донора и реципиента (они диплоидны только в отношении перенесенных генов). Это отличает их от полных зигот (голозигот) высших форм, которые содержат геномы мужской и женской клетки. В отличие от гетерогенот, мерозиготы,. содержащие идентичные аллели, называют гомогенотами.
В приведенном примере аллель gal- является частью хромосомы реципиента и называется эндогенотой, а аллель gal+ представляет собой часть генома бактерии-донора, она соответственно называется экзогенотой. Таким образом, генетическую структуру описываемого трансдуктанта можно изобразить в виде формулы gal-/ex. gal+.
Между бактериальной хромосомой реципиента и внесенной в клетку "хромосомой" фага иногда возможны рекомбинации, в результате чего возникают нелизогенные, галактозоположительные гаплоидные или диплоидные сегреганты. Механизм такой рекомбинации сводится к внедрению в бактериальную хромосому реципиента сегмента профага λdg.
Судьба генетического фрагмента, внесенного в клетку реципиента, может быть различной. Иногда по невыясненным причинам (при последующем делении клетки реципиента) теряется λdg-профаг вместе с фрагментом хромосомы донора и потомство реципиента остается неизменным, т. е. происходит отщепление gal-гаплоида. Потеря λdg-профага указывает, что он не является частью хромосомы реципиента, хотя и связан с ней. В некоторых случаях фрагмент хромосомы донора реплицируется в бактерии синхронно с хромосомой реципиента и передается всем дочерним клеткам. Полученные гетерогеноты являются gal-/ex. gal+. Они не устойчивы, среди них могут произойти рекомбинации, в результате которых окажутся следующие типы рекомбинантов: gal+/ex. gal-; gal+/ex. gal+; gal-/ex. gal-.
В соответствии с приведенной выше терминологией рекомбинанты первого типа являются гетерогенотами, а второго и третьего - гомогенотами. Наконец, возможно формирование устойчивых рекомбинантных гаплоидных клонов, т. е. таких линий клеток, которые являются gal+ и не отщепляют gal--вариант. Механизм формирования всех типов рекомбинантов иллюстрируется схемой, представленной на рис. 7. Формирование стабильных gal+-гаплоидов указывает на прямое внедрение генетического материала донора, доставленного фагом в хромосому реципиента. Необходимо отметить, что gal+-гаплоиды не обладают иммунитетом к фагу λ, в то время как указанные в схеме гетерогеноты и гомогеноты дефективно лизогенны.
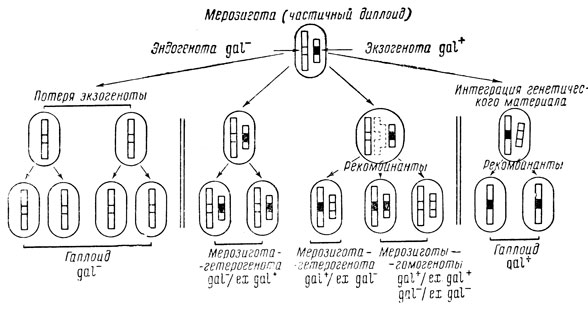
Рис. 7. Схема, изображающая 'судьбу' генетического фрагмента бактерии-донора в клетках реципиента при трансдукции
Для объяснения этого необходимо напомнить, что иммунитет лизогенных бактерий к повторному заражению гомологичным фагом определяется тем, что в геноме умеренного фага имеется специализированная область (С), контролирующая выработку репрессора, который блокирует структурные гены, ответственные за синтез в зараженной клетке биохимических предшественников фага (белки хвоста и головки фага, фаговый лизоцим). Если таким фагом заразить бактерию, то внутри клетки будет вырабатываться репрессор, который и заблокирует синтез белков, необходимых для размножения фага. В этом случае ДНК умеренного фага объединится с хромосомой бактерии и последняя станет лизогенной. Умеренный фаг, фиксированный на хромосоме бактерии, сохраняет способность контролировать синтез репрессора. Если лизогенную клетку повторно заразить гомологичным фагом, то репрессор, синтезированный под контролем профага, блокирует функцию ДНК суперинфицирующего фага.
Трансдуцирующие фаги сохраняют эту часть генома (С-область), но в них отсутствуют другие участки, а именно структурные гены, обеспечивающие синтез различных компонентов частицы фага. Такие дефективные фаги, проникнув в реципиент, придают ему состояние иммунитета, а сами клетки становятся дефективно лизогенными.
На основании этого понятно, что иммунитет гомо- и гетерогенот, возникших в результате трансдукции фагом λdg, обусловлен присутствием в бактерии С-области генома фага λ. Нелизогенность и отсутствие иммунитета у устойчивых гаплоидов gal+ зависят от того, что при взаимодействии хромосомы реципиента с трансдуцирующим фагом в геном реципиента инкорпорируется лишь фрагмент бактериальной хромосомы, фаговая же часть генома элиминируется. Иными словами, в клетке донора в геном фага включается gal-область хромосомы бактерии, но хромосома реципиента не включает в себя С-область фага. Эта избирательность включения указывает на отсутствие гомологии между остаточной частью генома фага в трансдуцирующей частице и бактериальной хромосомой.
Итак, мы видим, что генетический фрагмент донора, внесенный дефективным умеренным фагом в клетку реципиента, может быть удален из клетки, реплицироваться совместно с хромосомой реципиента или же внедриться в нее.
Возможен еще четвертый случай в судьбе фрагмента донора, я именно автономное существование его и передача по одной линии дочерних клеток. Это означает, что хромосома реципиента реплицируется, а фрагмент донора остается неизменным и при делении попадает только в одну из дочерних клеток. Данное явление называют абортивной трансдукцией. Абортивная трансдукция описана при передаче генов S. typhimurium, контролирующих подвижность бактерии [56], генов, детерминирующих синтез пуринов [79], и синтез β-d-галактозидазы [80].
Таким образом, трансдукция слагается из следующих этапов: 1) расщепления бактериальной хромосомы в результате репродукции в зараженной или лизогенной бактерии вегетативного умеренного фага; 2) внедрения соответствующего фрагмента хромосомы донора в геном фага; 3) передачи генетического материала бактерии-донора бактерии-реципиенту; 4) формирования мерозигот и последующей рекомбинации между фрагментом хромосомы донора и хромосомой реципиента.
5) Конъюгация
Конъюгация - способ переноса генетического материала от одной бактериальной клетки к другой. Этот феномен был открыт в результате изучения генетических рекомбинаций у бактерий, впервые описанных в 1946 г. в классическом исследовании Ледерберга и Тэтума [81]. В своих опытах они использовали культуру Е. coli K12, обладающую способностью расти на синтетической среде без добавления к ней факторов роста. Из этой культуры можно легко получить ауксотрофные мутанты, зависимые по аминокислотам, азотистым основаниям или витаминам. Система, использованная Ледербергом и Тэтумом, состояла из следующих двух штаммов Е. coli K12: штамма, зависимого по биотина (biot), фенилаланина (phe) и цистина (cys); штамма, зависимого от треонина (thr), лейцина (leu) и витамина В1 (В1).
При смешанном посеве этих штаммов на минимальную среду обнаруживаются колонии бактерий, независимых от указанных факторов. Эти колонии возникают в результате генетической рекомбинации между родительскими штаммами. Частота возникновения таких прототрофных рекомбинантов была низкой и равнялась 10-6. Схема описанного опыта изображена на рис. 8.
![Рис. 8. Схема опыта Ледерберга и Тэтума [82]](pic/000010.jpg)
Рис. 8. Схема опыта Ледерберга и Тэтума [82]
Уже на первых этапах изучения феномена Ледерберга и Тэтума было установлено следующее.
1. Генетический обмен осуществляется только при контакте между рекомбинирующими штаммами.
2. Для осуществления рекомбинации необходимо присутствие неповрежденных и жизнедеятельных бактерий обоих штаммов [82].
3. Признаки, по которым не производилась селекция, сегрегируют среди рекомбинантов в соответствии с линейным расположением генов в одной группе сцепления [83].
Морфологическое выражение процесса конъюгации
При конъюгации двух клеток между ними формируется цитоплазматический мостик, через который генетический материал одной особи переходит в другую. Объединение клеток при конъюгации можно обнаружить в фазово-контрастном микроскопе и при обычной микроскопии на окрашенных препаратах [84, 85]. Электронноскопическое изучение конъюгации выявило следующие морфологические особенности, характерные для этого процесса [86]: а) контакт конъюгирующих клеток осуществляется на ограниченном участке; б) спаривание клеток может произойти по концам, по боковым поверхностям и между концом и боковой поверхностью клетки; в) цитоллазматический мостик региден и достигает толщины до 300 ммк.
Половая дифференциация конъюгирующих клеток
Первым указанием на физиологическую дифференциацию между двумя родительскими штаммами, участвующими в скрещивании, является открытие Хейса, сделанное при скрещивании двух генетически отличающихся штаммов, один из которых был резистентен к стрептомицину, а другой чувствителен [87]. Хейс показал, что количество рекомбинантов, обнаруживаемых на селективной среде, зависит от выживаемости на ней лишь одного из родительских штаммов. Так, количество рекомбинантов в скрещивании штамма А, чувствительного к стрептомицину, с антибиотикорезистентным штаммом Б будет одинаковым при высеве на среду с антибиотиком и без него. При обратной комбинации, т. е. при резистентном штамме А и чувствительном штамме Б, рекомбинанты будут обнаружены лишь на среде без стрептомицина. Следовательно, роль штамма А сводится к передаче штамму В генетического материала, после чего его присутствие необязательно, так как рекомбинанты возникают в штамме Б. Иными словами, было показано, что при скрещивании двух бактерий одна является донором, а другая - реципиентом. Исходя из этих данных, Хейс сформулировал концепцию об одностороннем переносе генетического материала при скрещивании бактерий (рис. 9).
Рис. 9. Схема опыта Хейса (объяснение см. в тексте)
Гипотеза Хейса была подтверждена различными методами, в частности было показано, что клетка донора, изолированная после конъюгации, никогда не является рекомбинантом [88]. Следовательно, донор оплодотворяет клетку реципиента и только внутри последней происходит перераспределение между генетическим материалом родителей. Исходя из этого, клетки донора именуют мужскими клетками, обладающими фактором плодовитости (F+), а клетки реципиента - женскими, не обладающими этим фактором (F-). Действительно, скрещивание штаммов F-×F- всегда стерильно, при скрещивании штаммов F+×F+ обнаруживается некоторое количество рекомбинантов, что связано с присутствием в F+-штаммах небольшой части клеток, ведущих себя, как женские гаметы - F- [89]. Лишь при скрещивании штаммов F+×F- регулярно образуются рекомбинанты с частотой около 10-6. Существование фактора F, контролирующего способность бактерии функционировать в качестве донора, доказывается возможностью передачи этого фактора от F+ к F--клеткам, в результате чего последние превращаются в F+-вариант. Передача F-фактора при скрещивании F+×F--штаммов осуществляется с очень большой частотой, которая в 1000 раз превышает частоту получения рекомбинантов в этих же скрещиваниях. Это указывает на автономность F-фактора в клетке от прочих генетических детерминант [90-92]. Упомянутая высокая частота переноса F-фактора в реципиентные клетки послужила основанием уподобить этот процесс инфекции чувствительных бактерий фагом и считать F-фактор инфекционным агентом.
Было установлено, что на эффективность переноса F-фактора реципиенту влияет штамм, в котором находится данный F-фактор. Следовательно, один и тот же F-фактор, находящийся в различных культурах, реплицируется в них с различной частотой, либо передается с разной степенью эффективности. Спонтанное превращение F+-клеток в F- происходит крайне редко и связано с потерей или инактивацией F-фактора. Однако при Помощи акридиновых красителей, солей кобальта и никеля почти все клетки F+-популяции могут быть превращены в F- [93-95]. Высокая стерилизующая активность акридина косвенно указывает на то, что активным началом F-фактора является ДНК.
Высокая частота передачи самого F-фактора свидетельствует о том, что низкая частота рекомбинантов, наблюдаемая при скрещивании F+×F-, не связана с малым количеством межклеточных контактов, а зависит от других причин. Выяснение их стало возможным после открытия у бактерий двух типов доноров. Первый из них - уже описанный F+ - при смешивании с F--клетками обусловливал появление рекомбинантов с низкой частотой. Второй тип донора в скрещивании с этими же F--клетками индуцировал появление рекомбинантов с очень высокой частотой, порядка 10-1 - 10-3.
Донорские F+-штаммы, обеспечивающие высокую частоту рекомбинантов, обозначают символом Hfr (High frequency of recombination). Первый такой штамм был открыт в 1950 г. Ковалли [по 96] среди мутантов Е. coli К12 (штамм 58-161). В отличие от исходного F+-штамма, Hfr вариант не переносил F-фактора в клетку реципиента. При скрещивании Hfr×F- потомство состояло из клеток Hfr и F-.
Значительный вклад в расшифровку природы Hfr-штаммов был сделан Хейсом [91], показавшим, что Hfr-штаммы являются "мутантами" F+-бактерий. Хейс установил, что превращение F+-штамма в Hfr не связано с потерей F-фактора. Ему удалось получить обратные "мутанты", т. е. превратить Hfr-штамм в исходный F+. Такой обратный "мутант", аналогично исходному F+-штамму, был способен переносить F-фактор в бактерию-реципиент, но не давал при скрещивании большого количества рекомбинантов.
Таким образом, взаимоотношение между F+, F- и Hfr-клетками можно изобразить следующей схемой [89]:
F+ →← Hfr ↓ F-
Механизм переноса хромосомного материала в процессе конъюгации
Большое значение в понимании механизма генетических рекомбинаций у бактерий имел вывод Хейса об одностороннем переносе генетического материала от мужской клетки к женской, что следовало уже из опытов скрещивания F+×F- и особенно ясным стало после открытия Hfr-штаммов. Следующим этапом в развитии представлений о механизме обмена генетическим материалом при конъюгации бактерий является концепция о частичном переносе хромосомы донора. Это явление выражается в том, что при конъюгации некоторые гены передаются клетками с большей частотой, чем другие. Рассмотрим случай скрещивания двух следующих штаммов: Hfr thr+leu+ В1+ Az-s T1-s lac+gal+mal+xyl+man+Sm-s×F-thr-leu-B1-Az-r T1-r lac-gal-mal-xyl-man-Sm-r.
После часового контакта указанных культур произведем высев на синтетическую среду, к которой добавлены глюкоза, витамин B1 и стрептомицин. На такой среде появятся колонии рекомбинантов, резистентных к стрептомицину и способных синтезировать треонин и лейцин. Следовательно, мы селекционировали клетки с генотипом thr+leu+Sm-r. Последующий анализ отобранных культур показал, что в генотипе полученных рекомбинантов присутствуют мутантные гены mal-xyl-man- и отсутствуют гены донора mal+xyl+mаn+. Остальные гены, по которым не проводилась селекция, распределились среди рекомбинантов thr+leu+Sm-r следующим образом: тон чувствительности к азасерину (Az-s) обнаруживался у 90% рекомбинантов, T1-s (чувствительность к фагу Т1) в 70%, lас+ в 45% и gal+ в 25%. Различная вероятность передачи генов, по которым не проводилась селекция, от Hfr донора к F--реципиенту характеризует локализацию этих детерминант в хромосоме донора относительно генов, контролирующих синтез треонина и лейцина. В данном случае наиболее удаленными от генов thr+ leu+ оказался ген gal+. Следовательно, чем дальше в хромосоме донора расположен данный ген от других, передающихся при конъюгации с большой частотой, тем менее вероятен его перенос в клетку реципиента.
Гипотеза о частичном переносе хромосомы была подтверждена и развита в блестящих работах Вольмана и Жакоба [74, 97, 98].
Сущность их исследований сводилась к выявлению рекомбинантов после механического разрушения комплекса конъюгировавших клеток в различные отрезки времени от начала скрещивания (рис. 10). Конъюгированные клетки разделялись встряхиванием в смесителе Уоринга. В этих опытах было установлено, что перенос генетического материала от донора к реципиенту осуществляется в строгой последовательности, т. е. ориентированно. Последовательность переноса отдельных генетических меток (маркеров) в реципиентную бактерию точно соответствует последовательности их расположения в хромосоме донора. Количество перенесенных генов от донора к реципиенту зависит от времени их контакта, но редко бывает полным.
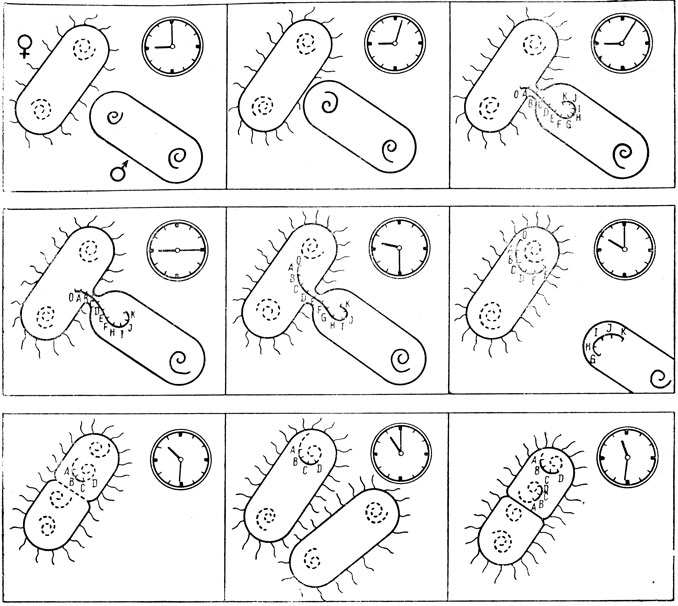
Рис. 10. Схема конъюгации Hfr-бактерий (с жгутиками) с F--бактериями (без жгутиков). Часы показывают время от начала приготовления смеси культур. Буквами обозначена последовательность расположения отдельных генетических детерминант вдоль хромосомы донора (по Жакобу и Вольману)
Если смесь бактерий штаммов Hfr×F- подвергнуть встряхиванию не более чем через 8 мин. после начала контакта, то рекомбинанты в потомстве вообще не обнаруживаются. Через 30 мин. после начала скрещивания почти все признаки, выявляемые среди рекомбинантов с высокой частотой, оказываются перенесенными. Гены, локализованные в хромосоме донора близко друг к другу, переносятся в резистентную клетку примерно через одинаковые интервалы времени. Так, например, известно, что детерминанта признака ферментирования галактозы (gal+) находится в хромосоме лизогенной Е. coli К12 очень близко от профага λ. Методами классического скрещивания показано, что в TL-gal-сегменте хромосомы Е. coli К12 генетические участки, контролирующие отдельные признаки, располагаются в определенном порядке (рис. 11). Этому, соответствует последовательность и скорость переноса указанных генов в клетку реципиента. Перенос всегда начинается с участка хромосомы TL и заканчивается профагом λ. Время переноса указанных генов от штамма донора Hfr в клетку F- соответственно равняется 9, 24 и 26 мин. Величина этого сегмента равна 1/4-1/5 длины хромосомы бактерии.
![Рис. 11. Схема организации хромосомы Е. coli, штамм Hfr: а - латинскими буквами показана последовательность передачи отдельных маркеров при конъюгации различных штаммов, б - схематическое изображение хромосом различных штаммов. В скобках указаны генетические маркеры. Обозначения маркеров: TL - синтез треонина и лейцина; М - метионина; B1 - тиамина; Lac - ферментирование лактозы; Gal - галактозы; Mal - мальтозы; Xyl - ксилозы; Mtl - маннитола; Az - чувствительность или резистентность к азиду натрия; S - к стрептомицину; T1 - к фагу Тl (по Хейсу, с изменениями) [113]](pic/000013.jpg)
Рис. 11. Схема организации хромосомы Е. coli, штамм Hfr: а - латинскими буквами показана последовательность передачи отдельных маркеров при конъюгации различных штаммов, б - схематическое изображение хромосом различных штаммов. В скобках указаны генетические маркеры. Обозначения маркеров: TL - синтез треонина и лейцина; М - метионина; B1 - тиамина; Lac - ферментирование лактозы; Gal - галактозы; Mal - мальтозы; Xyl - ксилозы; Mtl - маннитола; Az - чувствительность или резистентность к азиду натрия; S - к стрептомицину; T1 - к фагу Тl (по Хейсу, с изменениями) [113]
Вскоре, однако, было найдено, что различные Hfr штаммы Е. coli K12 переносят реципиенту генетические детерминанты донора с разной последовательностью. Для всех штаммов было установлено, что перенос ориентирован, т. е. начинается с определенной детерминанты, но признаки, обнаруживаемые среди рекомбинантов с высокой частотой, для каждого штамма были различны. Важно то, что признаки, оказавшиеся сцепленными при скрещивании данного Hfr-штамма с F--культурой, сохраняли сцепленность при применении другого Hfr-донора.
При использовании всех Hfr-штаммов, как и штамма Хейса, наблюдался частичный перенос генетического материала от донора реципиенту.
Таким образом, из этих данных следует, что при конъюгации Hfr-штаммов с F--культур а ми происходит ориентированный, односторонний, частичный перенос генетического материала донора в клетку реципиента. Участок хромосомы бактерии, внедряющейся первым в клетку реципиента, обозначают буквой О (Origine).
Частичный перенос объясняется тем, что во время перехода хромосомы донора через цитоплазматический мостик в клетку реципиента могут произойти спонтанные разрывы хромосомы, в результате чего не все гены окажутся перенесенными. Чем дальше от участка "О" находится ген, тем менее вероятно его попадание в бактерию-реципиент.
Скорость переноса за 1 мин. соответствует примерно 20 единицам рекомбинации (см. "Организация генетического аппарата бактерий"), т. е. около 105 парам нуклеотидов, что хорошо согласуется с количеством ДНК в ядре Е. coli, равном 107 парам нуклеотидов, и временем переноса всей хромосомы, равным примерно 100 мин. [96]. Значение разрывов хромосомы как фактора, обусловливающего частичный перенос, наглядно показано в опытах с распадом Р32 [99].
Штамм Hfr, меченный Р32, хранился в жидком азоте. В разные промежутки времени брали пробы, которые оттаивались и скрещивались с немеченным F--штаммом. Количество рекомбинантов экспоненциально уменьшалось как функция времени хранения. Если разрыв происходил между признаками, находящимися ближе к проксимальному концу, условно обозначаемыми Е и F, то участок хромосомы ABCDE переносился, а участок FGHIKL и т. д. не переносился. Чем больше атомов фосфора находится между начальными участками хромосомы ("О") и данным геном, тем более вероятно, что произойдет разрыв и дистальный участок окажется не перенесенным в женскую клетку.
Открытие разных Hfr-штаммов, обладавших специфичностью переноса отдельных наборов генов в бактерию-реципиент и отличающихся друг от друга последовательностью переноса генов, наиболее удачно объясняется предположением, что хромосома Е. coli K12 существует в клетке в виде замкнутой циркулярной структуры (рис. 11), которая может рваться в различных участках.
В зависимости от локализации точки разрыва в циркулярной хромосоме донора при последующей конъюгации, генетические детерминанты донора будут переноситься в клетку реципиента с разной последовательностью. Необходимо было выяснить, какой механизм обеспечивает разрыв хромосомы донора, что обусловливает специфичность этого явления, т. е. место разрыва и, следовательно, ориентированный перенос разорванной циркулярной хромосомы.
Ответы на эти вопросы мы находим главным образом в исследованиях Хейса, Вольмана и Жакоба, результаты которых позволили создать стройную теорию о природе Hfr-штаммов и механизме переноса генетического материала при конъюгации.
Из этих работ можно сделать следующие основные выводы:
1. Мужские половые клетки являются носителями фактора фертильности (F+), который находится в них в автономном от ядра состоянии. Этот вывод доказывается независимостью передачи фактора от хромосомных детерминант и возможностью его элиминирования с помощью акридина без повреждения ядерных структур бактерии.
2. Бактерия может содержать несколько копий F-фактора, который размножается в клетках быстрее, чем ядерные структуры. Есть основания полагать, что F-фактор фиксирован на клеточной стенке бактерии. В популяции F+-штаммов возникает небольшая часть Hfr-мутантов, которые и ответственны за появления рекомбинантов при скрещивании F+×F- [100]. Hfr-мутанты, присутствующие в популяциях разных F+-штаммов, принадлежат к различным типам и находятся в них в разных количествах.
Таким образом, гипотеза Вольмана и Жакоба предусматривает существование в F+-штаммах автономного F-фактора, который с определенной частотой прикрепляется к циркулярной хромосоме донора. При конъюгации последняя разрывается в точке прикрепления F-фактора и становится линейной. Линейность является необходимым условием для эффективного ориентированного переноса генетического материала от донора к реципиенту. Свободный проксимальный конец хромосомы ("О") первым начинает внедряться в женскую клетку, а сам F-фактор находится на противоположном конце и поэтому практически редко попадает в реципиентную бактерию (рис. 12).
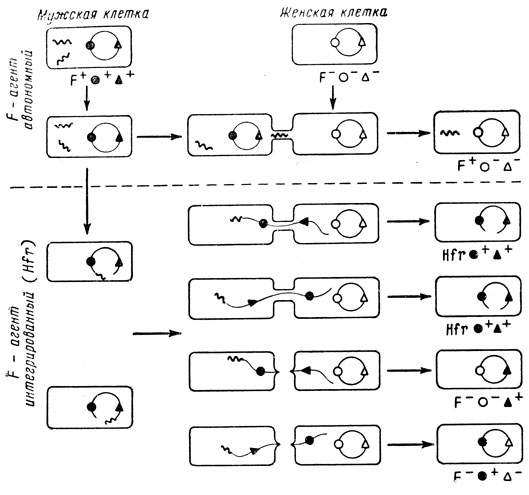
Рис. 12. Схема конъюгации бактерий (зигзагообразной линией показан F-фактор)
Установлено, что различные F-факторы, обнаруженные в различных Hfr-штаммах Е. coli K12, избирательно прикрепляются к отдельным участкам хромосомы. Вследствие этого разрыв хромосомы у различных Hfr-штаммов происходит в разных местах, что и обусловливает неодинаковую последовательность переноса отдельных маркеров от разных Hfr-доноров. Те признаки, которые локализованы на проксимальном конце разорванной хромосомы данного Hfr-штамма, будут обнаруживаться среди рекомбинантов с высокой частотой, а локализованные в дистальном отрезке, в том числе и сам F-фактор, - с низкой.
Обратный процесс, т. е. превращение Hfr-штаммов в F+, вероятнее всего, связан с отрывом F-фактора от хромосомы и переходом его в F+-состояние [102].
После того как F-фактор интегрирует с хромосомой, клетка оказывается неспособной хранить его в автономном состоянии. Она становится "иммунной" к внехромосомному фактору плодовитости. Эта ситуация близка к состоянию иммунитета лизогенных бактерий, невосприимчивых к суперинфекции гомологичным фагом [102].
Природа генетического материала, переносимого при конъюгации
Ряд экспериментальных фактов доказывает, что в ходе конъюгации ДНК переходит от донора к реципиенту. Это было установлено измерением переноса Р32 от донора к реципиенту [103], а также путем определения внедрения Р32 в фаг Т2 после заражения им фагочувствительных F--клеток, скрещенных с меченым фагорезистентным Hfr-донором [104]. В этих опытах было показано, что радиоактивный фосфор переносится лишь от Hfr-клеток к F--бактериям. Расчеты подтверждают, что перенос ДНК, меченной Р32, от Hfr- к F--клеткам неполный и составляет от 1/10 до 1/5 части ДНК, входящей в хромосому донора [74]. Этот результат согласуется с данными генетических исследований и подтверждает одно из важнейших положений гипотезы Хейса о частичном переносе генетического материала при конъюгации. Прямое доказательство наличия непосредственного перехода ДНК от донора к реципиенту было представлено Вольманом и Стентом (см. Жакоб, Вольман [74]), проследившими переход радиоактивности от донора к реципиенту при скрещивании штамма Hfr, меченного Н3-тимидином, с немечеными F--клетками. Известно, что тимидин включается только в ДНК, поэтому перенос метки в клетку реципиента отражает переход самой ДНК донора. Через два часа после скрещивания в реципиенте обнаруживалось 7-12% меченого тимидина, что соответствовало переносу от 1/5 до 1/3 хромосомы. Выводы о переносе ДНК от Hfr-донора в F--реципиент были подтверждены недавно Сильвером [105]. В опытах Сильвера донором был штамм Е. coli К10, резистентный к фагу Т6. Этот штамм способен в течение 10 мин. передать F--реципиенту гены, контролирующие ферментирование лактозы.
Клетки донора метили 14С-тимидином, а также 14С-урацилом, 14С-пролином, 14С-лизином, 14С-лейцином и 14С-аргинином. Использование меченого урацила и аминокислот давало возможность установить, происходит ли во время скрещивания перенос РНК и белков. После скрещивания фагочувствительные клетки реципиента лизировались, и в фильтрованных фаголизатах определялась радиоактивность.
Результаты этих опытов сводятся к следующему: 1) количество ДНК, переносимой от Hfr-донора реципиенту в течение 90 мин., равнялось 9%; 2) не было обнаружено переноса ни РНК, ни белка; 3) перенос ДНК не осуществлялся от F+ к F+ или от F- к F-.
Следовательно, можно считать доказанным, что при конъюгации от донора к реципиенту переносится ДНК, количество [которой обычно соответствует 1/3-1/10 части хромосомы.
Меромиксис и формирование рекомбинантов в клетках реципиента
При конъюгации, как при трансформации и трансдукции, в реципиентную клетку переносится лишь часть хромосомы донора. В отличие от первых двух феноменов генетического обмена, в ходе конъюгации Hfr-штаммов с F--клетками в реципиентную клетку попадает значительно больший участок хромосомы. Тем не менее, как правило, и в этом случае мы можем говорить лишь о частичном переносе хромосомы донора реципиенту. Это и является главным отличием конъюгации бактерий от полового процесса у высших форм, у которых при слиянии половых клеток образуется полная зигота. Следовательно, при конъюгации в большинстве скрещиваемых пар бактерий формируются частичные зиготы - мерозиготы. Меродиплоидность - состояние временное, в дальнейшем из мерозиготы возникает гаплоидное потомство.
После конъюгации в мерозиготе формируется рекомбинантная хромосома, в которой большинство детерминант происходит от реципиента, а часть - от донора. Поскольку в реципиентной бактерии может быть несколько нуклеотидов, то рекомбинанты выявляются через несколько генераций, в течение которых происходит сегрегация рекомбинантной хромосомы от хромосом реципиента.
Сам механизм формирования рекомбинанггов еще недостаточно изучен. При конъюгации, также как и при трансформации и трансдукции, в реципиентной клетке целая хромосома взаимодействует с фрагментом хромосомы донора. Это обстоятельство исключает возможность получения реципрокных рекомбинантов, и мы не можем, следовательно, проследить за переходом генетического материала реципиента в геном донора. Существуют две точки зрения на механизм генетического обмена между фрагментом донора и целой хромосомой реципиента. Возможно, что рекомбинант образуется в результате разрыва хромосомы реципиента и воссоединения с фрагментом донора. Второй предполагаемый механизм заключается в том, что рекомбинация у бактерий при конъюгации и трансдукции, а также у фагов осуществляется в результате так называемого избирательного копирования. При этом в ходе реплицирования родительских хромосомных нитей копирование начинается на одной из них, а затем может переключиться на другую. Вновь возникающая структура частично копирует одну нить и частично другую. Следовательно, она несет генетическую информацию обоих родителей, т. е. является рекомбинантной.
4. Организация генетического аппарата бактерий
Как указывалось ранее, бактерия является гаплоидом. Наши знания относительно генетической организации бактериальной хромосомы основаны главным образом на результатах, полученных при изучении описанных выше механизмов генетического обмена: трансформации, трансдукции и конъюгации. Каждый из феноменов может быть использован для изучения следующих вопросов: в какой последовательности располагаются в хромосоме отдельные генетические детерминанты, контролирующие те или иные признаки, какова протяженность отдельных детерминант, каково расстояние между ними и какова структура самих генетических детерминант, контролирующих отдельный признак (состоят ли они из субъединиц и что является в хромосоме бактерии единицей функции, мутации и рекомбинации)? Ответы на эти вопросы дает генетический анализ, в основе которого лежит количественный учет рекомбинантов, возникших в результате генетического обмена, геном которых содержит большую часть хромосомы реципиента и часть генома донора. В результате изучения процесса рекомбинации были созданы генетические карты ряда бактерий, представляющие собой условную схему хромосомы, на которых показаны отдельные участки, детерминирующие различные признаки. Генетическая карта предусматривает последовательность расположения отдельных генетических детерминант, относительную протяженность расстояния между ними, выраженную в условных единицах, и протяженность самих детерминант, выраженную в этих же единицах.
Таким образом, для построения генетических карт необходимо: 1) иметь бактериальные культуры, отличающиеся друг от друга по генетическим признакам, 2) осуществить между ними генетический обмен и 3) обладать способами отбора рекомбинантов. Полнота генетической карты, ее детализация в значительной степени зависят от эффективности самого механизма генетического обмена, т. е. от частоты появления рекомбинантов, а также и от разрешающей способности метода селекции - от возможности отбора рекомбинантов среди огромного количества особей, участвовавших в скрещивании. Развитие экспериментальной генетики в значительной мере определялось усовершенствованием приемов анализа, отвечающих указанным требованиям.
Использование бактерий в качестве объекта экспериментальной генетики намного расширило возможности самого генетического анализа. Гаплоидность бактерий, или присутствие в них наследственной информации в одном наборе, исключает маскирование генетических детерминант из-за явления доминантности. Огромное количество особей в бактериальных культурах позволяет наблюдать результаты генетического обмена, даже если таковой осуществляется с весьма низкой частотой (порядка 10-7). Точные методы селекции делают возможным количественный анализ процесса. И наконец, описанные ранее различные способы генетического обмена, которые отличаются друг от друга не только по механизму, но и по величине фрагмента "хромосомы", передаваемого от донора реципиенту, дают информацию об ее организации в целом и о структуре отдельных ее участков.
Рассмотрим простейшие случаи построения генетической карты бактерии. Предположим, мы имеем два штамма бактерий, характеризующихся шестью генетическими признаками, условно обозначенными A, B, C, D, E, F (дикий тип). Нас интересует, как расположены в хромосоме бактерии детерминанты, контролирующие эти признаки. Прежде всего из исходной культуры получают два варианта, отличающиеся друг от друга мутациями отдельных генов. Обозначим генотип указанных мутантных штаммов следующим образом: 1) А, В, С, d, e, f и 2) а, b, с, D, Е, F, где большими буквами помечены неизмененные гены, а малыми - мутировавшие гены.
При скрещивании произойдет рекомбинация и возникнут потомки, в хромосоме которых будут объединены гены обоих родителей. Если мы используем методы селекции, допускающие отбор особей по отдельным признакам, то окажется, что количество рекомбинантов, обладающих генами AF и аf, будет максимальным, а генами Ав и аВ минимальными. Промежуточное положение между этими рекомбинантами займут рекомбинанты типа Ас и аС, AD и ad, AE и ае.
Взаимоотношение между числом указанных типов рекомбинантов окажется следующим: AF > AE > AD > Ac > Ab.
Перераспределение генетического материала между бактерией-донором и реципиентом легко объясняется на основе классического кроссинговера, т. е. перекреста хромосом в гомологичных участках. Так же как и у высших организмов, частота рекомбинаций (степень вероятности обмена двух участков хромосомы) пропорциональна расстоянию между ними. Очевидно, что рекомбинанты типов AF и af возникают при перекресте в любом из участков указанного отрезка бактериальной хромосомы, а рекомбинанты Аb и аВ лишь в том случае, если перекрест происходит только в начальном участке. Это дает возможность построить генетическую карту бактерии в виде линии, на которой точками отмечено положение отдельных генов, а расстояние между ними пропорционально частоте рекомбинаций. За единицу длины на генетической карте условно принята частота рекомбинации, равная 1%.
Первая генетическая карта бактерий была создана Ледербергом для штамма кишечной палочки К12 [83]. В качестве генетической метки (маркера) использовалась ауксотрофность. Один из родительских штаммов был двойным ауксотрофом по биотину и метионину bio-met-, а другой - тройным, неспособным синтезировать треонин (thr-), лейцин (leu-) и витамин В1 (В1-). В дальнейшем Ледерберг увеличил количество маркеров, добавив, в частности, способность ферментировать лактозу (1ас+) и нечувствительность к бактериофагу Т6 (Т6-r). Пары скрещиваемых штаммов отличались также друг от друга чувствительностью к фагу Т1 (маркеры T1-s и Т1-r).
Генетическая карта E. coli К12, построенная Ледербергом на основании относительной частоты появления рекомбинаций между указанными генетическими признаками, представлена на рис. 13.
Рис. 13. Первая генетическая карта Е. coli К12
При рассмотрении этой карты становится очевидным, что в хромосоме бактерии отдельные генетические детерминанты располагаются близко друг от друга (сцепленные гены), вследствие чего рекомбинация между ними - относительно редкое событие. Расстояние между другими детерминантами относительно велико (несцепленные гены), поэтому вероятность рекомбинации между ними увеличивается.
Из этой же карты следует весьма важный вывод о том, что ее полнота зависит от возможности проведения скрещиваний среди пар штаммов, отличающихся друг от друга характером мутаций. Если мы располагаем большим числом штаммов, у которых удалось вызвать и регистрировать самые разнообразные мутации, то этим создаются предпосылки для заполнения "белых" пятен на генетической карте данного микроба. Следовательно, с увеличением возможностей наблюдения за мутациями отдельных генетических детерминант и разработки эффективных способов селекции из популяции особей - носителей этих мутаций - будут расширяться и уточняться наши знания о генетической структуре хромосомы бактерий. Если же мутация соответствующего гена приводит к таким изменениям фенотипа, которые не регистрируются доступными методами, то участок карты, где этот ген локализован, останется незаполненным, так как генетическая карта бактерии строится, по существу, путем определения локализации мутации одного гена по отношению к мутации другого.
Поскольку частота рекомбинантов является важнейшим критерием, пользуясь которым, локализуют данный ген по отношению к другому в хромосоме бактерий, то естественно, что точность генетического анализа будет более высокой при скрещиваниях бактерий, у которых частота появления рекомбинантов достаточно велика. Первые же опыты генетической рекомбинации проводились Ледербергом на штаммах E. coli К12, характеризовавшихся низкой частотой рекомбинации.
По мере расширения изучаемых генетических признаков и способов селекции рекомбинантов становилось очевидным, что генетический анализ, проводимый в системах с низкой частотой рекомбинации, сопряжен с трудностями, а результаты, получаемые разными авторами, оказываются иногда противоречивыми. Напомним (см. "Конъюгация бактерий"), что этими штаммами были F+ и F- и, хотя последовательность генов в отдельных группах сцепления устанавливалась достаточно точно, попытки расположить эти группы на генетической карте давали порой разноречивые результаты [74]. Обнаружение Hfr-штаммов разъяснило причины этих противоречий и обеспечило дальнейший прогресс генетического анализа у бактерий.
Изучение отдельных Hfr-штаммов привело к выводу, что обычно хромосома Е. coli K12 циркулярна и разрывается в том участке, где на ней фиксируется А-фактор.
Применение метода разрыва конъюгировавших клеток и изучение влияния распада Р32 на перенос отдельных генов от донора реципиенту позволило создать подробную генетическую карту хромосомы кишечной палочки.
Бактериальная хромосома представляет собой замкнутую структуру, состоящую из дискретных генетических детерминант-генов. Здесь уместно рассмотреть эволюцию самого понятия "ген".
На заре развития генетики ген рассматривался как единица функции, рекомбинации и мутации - как предел функциональной делимости хромосомы.
По мере развития генетики накапливались данные, указывающие на сложную организацию гена. Ген начали рассматривать как комплексную систему. Это стало очевидным после открытия у дрозофилы множественного аллелизма, когда установили, что аллели одного гена отличаются друг от друга. Идея о сложном строении гена, сформулированная на основе генетического изучения дрозофилы, получила дальнейшее развитие в микробной генетике.
Данные, полученные при изучении бактерий, отличающихся друг от друга по внешним признакам, обогатили нас сведениями о природе и организации хромосомы как целого и позволили локализовать в ней участки, детерминирующие отдельные признаки.
Однако они не всегда давали возможность ответить на вопрос, представляет ли собой фрагмент хромосомы, контролирующий, например, синтез аминокислоты или определяющий уровень резистентности к антибиотику, функциональную единицу или же он состоит из ряда субъединиц, функционирующих независимо. Хотя мутация в любом участке этого фрагмента и завершается одинаковым физиологическим эффектом, однако это не исключает сложность строения фрагмента и существования в нем отдельных единиц, функционирующих независимо друг от друга и обеспечивающих отдельные этапы в цепи сложной биологической реакции.
Строение генетических детерминант бактерий было детализировано в результате изучения рекомбинаций между мутантами с однозначным изменением фенотипа. Это осуществлялось путем скрещивания независимых мутантов, принадлежащих к одной фенотипической группе, или же путем осуществления между ними трансдукции либо трансформации. Оказалось, что два мутанта, неспособные синтезировать один и тот же фермент или аминокислоту, давали прототрофный рекомбинант. Частота рекомбинаций в скрещивании таких пар мутантов была низкой, что свидетельствовало о сцеплении участков, изменение которых приводило к одной и той же ауксотрофности. Все независимые ауксотрофные мутанты, нуждающиеся для роста в наличии того или иного фактора, оказалось возможным разделить на группы, соответствующие отдельным этапам его синтеза. Так, например, 77 мутантов S. typhimurium, неспособных синтезировать триптофан (try-мутанты), распределялись по следующим группам, соответственно схеме биосинтеза триптофана: try А-13, try В-40, try С-6 и try D-18 [106].
В опытах трансдукции установлено, что рекомбинация среди мутантов в каждой группе - событие редкое, а между мутантами других групп происходит чаще. Эти четыре группы мутантов возникли в четырех отдельных участках "хромосомы", каждый из которых контролирует отдельный этап синтеза аминокислоты. Следовательно, каждый из этих участков ответствен за индивидуальную функцию бактериального генома. Согласно терминологии Демереца, такой участок характеризуется как генетический локус, а по аналогии с функциональной единицей генома фага, идентифицированной Бензером, его можно назвать цистроном.
Дальнейший анализ структуры генетической области хромосомы S. typhimurium, контролирующей синтез триптофана, показал, что порядок расположения генетических локусов, или цистронов, определяющих разные этапы реакции, соответствует последовательности отдельных реакций синтеза [107].
Изучение структуры гистидиновой области хромосомы S. typhimurium также было осуществлено с помощью трансдукции [108] (рис. 14). Установлено, что эта область, включающая 1,3⋅104 пар нуклеотидов [109], состоит из 9 генетических локусов. Изучение функции этих локусов в гистидиновом участке "хромосомы" S. typhimurium показало, что некоторые из них контролируют синтез индивидуальных ферментов (F-, А-, Н- и С-участок схемы), состоящих только из одной полипептидной цепочки (мономеры). Другие локусы (Е и В) контролируют синтез полимерных ферментов, состоящих из субъединиц, представляющих собой отдельные полипептидные цепочки, синтез каждой из них контролируется одним и тем же геном.
![Рис. 14. Хромосома S. typhimurium [123]](pic/000016.jpg)
Рис. 14. Хромосома S. typhimurium [123]
В настоящее время известно также, что некоторые ферменты включают две разные полипептидные цепочки, специфичность которых контролируется отдельными генетическими локусами (участки схемы Da и Db). Такие два локуса могут быть сцепленными, как это показано на схеме (рис. 14), или несцепленными.
И, наконец, имеются ферменты, контролирующие более чем одну специфическую реакцию (бифункциональные ферменты - на схеме В и D). Таким образом, мы видим, что область хромосомы S. typhimurium, ответственная за способность микроба синтезировать гистидин, представляет собой весьма сложную структуру, где отдельные участки контролируют самостоятельные специфические функции.
Сложная организация генетических детерминант, установленная в опытах по трансдукции на примере триптофановой и гистидиновой областей хромосомы S. typhimurium, в принципе однозначна для иных генетических детерминант этого же микроба и других видов бактерий.
С помощью трансдукционного анализа было показано сложное строение участка хромосомы, детерминирующего у салмонеллы синтез треонина (четыре локуса); наличие пяти генетических локусов для изолейцина и изолейцин-валина [110]; генетически дифференцированные участки были выявлены в пределах областей генома, детерминирующих синтез аденина [111] и цистеина [112, 113].
При трансдукции Е. coli фагом Р1 было установлено существование четырех генетических локусов, контролирующих отдельные этапы биосинтеза триптофана [114, 115], и трех локусов, контролирующих ферментирование арабинозы [116].
У стафилококков было показано существование двух сцепленных локусов, контролирующих синтез триптофана [117].
Вывод о существовании отдельных генетических локусов или цистронов в пределах определенной области хромосомы, контролирующей данный признак, сделанный на основе трансдукционного анализа, согласуется с результатами, полученными при конъюгации и трансформации мутантов, относящихся к одной фенотипической группе.
Упомянутые выше данные опытов Хочкиса и Эванса [53] также свидетельствуют о наличии у пневмококков локусов, контролирующих разный уровень резистентности к сульфамиду.
Замечательным оказалось то, что в ряде упомянутых случаев функционально связанные генетические локусы чаще всего расположены в хромосоме бактерий близко друг к другу, а последовательность их на карте соответствует последовательности биохимических реакций, контролируемых ими [118].
Таким образом, данные биохимической генетики микробов, полученные впервые на Neurospora, а затем и на бактериях, позволили уточнить понятие ген и определить его как участок хромосомы, контролирующей синтез отдельного пептида. Иными словами, постулат "один ген - один фермент" остается справедливым лишь для детерминирования мономерных ферментов. В более общем виде этот постулат формулируется следующим образом: "один ген - один пептид".
Исходя из этого определения термины: ген, генетический локус и цистрон являются синонимами. Однако в некоторых случаях невозможно определить существование генетического локуса на основании сопоставления данных рекомбинации с биохимическими экспериментами. В этих случаях можно прибегнуть к функциональному тесту, позволяющему разделить сложную генетическую область на независимые функциональные единицы - на локусы, или цистроны.
Сущность этого теста сводится к выяснению взаимоотношений между положением мутаций в хромосоме и функцией. Функциональный тест, устанавливающий наличие отдельных специфических локусов, выявляет, имеют ли два мутанта, относящихся к одной фенотипической группе, изменения в одном и том же или в разных участках хромосомы. Если гетерозигота а/б имеет фенотип, подобный гомозиготам а/а или б/б, то тогда а и б рассматриваются как мутанты, возникшие в одной детерминанте, контролирующей одну специфическую функцию. Если же такая гетерозигота характеризуется диким фенотипом, то а и б рассматриваются как мутанты, возникшие в результате изменений в различных генах (генетических локусах или цистронах), контролирующих отдельные функции. В первом случае мы говорим, что мутации а и б не комплементарны, а во втором - комплементарны. Дикий фенотип гетерозиготы будет в том случае, если две рецессивные мутации локализованы в одной хромосоме (цис-конфигурация). Вторая хромосома, несущая два немутантных гена, обеспечит контроль синтеза необходимых метаболитов. Такой же результат мы наблюдаем в транс-конфигурации только тогда, когда обе мутации, относящиеся к двум различным генетическим локусам, локализованы в разных хромосомах. В этом случае хромосома I, дефектная по первому локусу, осуществит полноценный контроль синтеза фермента Б, а хромосома II, дефектная по второму локусу, - синтез фермента А. В результате в клетке окажется весь комплекс ферментов, необходимый для осуществления реакции А → В.
Если же обе мутации расположены в разных хромосомах (транс-конфигурация); но в одном локусе, то такая клетка будет иметь мутантный фенотип; в этом случае полноценный генетический контроль осуществится лишь в отношении одного фермента, а второй окажется дефектным.
Таким образом, для определения в хромосоме ряда локусов, контролирующих отдельные функции, необходимо иметь набор независимых мутантов, характеризующихся одинаковым фенотипом, и установить комплементарность этих мутаций. Следует подчеркнуть, что описанный тест комплементарности, или, как его называют, цис-транс-тест, независим от теста рекомбинации и легко осуществим в отношении диплоидных организмов, в которых парные хромосомы гетерозигот могут быть носителями рецессивных мутаций. Применительно к бактериям такой функциональный тест (цис-транс-тест) также осуществим с помощью абортивной трансдукции, при которой диплоид содержит полную хромосому реципиента и фрагмент хромосомы донора. Напомним, что при абортивной трансдукции фрагмент хромосомы донора не реплицируется и не рекомбинирует с хромосомой реципиента. Абортивная трансдукция как метод выявления генетических локусов была использована Озеки у салмонелл [79].
Допустим, что реципиентом является ауксотрофный мутант, требующий для своего роста наличия в минимальной среде аминокислоты, витамина или азотистого основания. В качестве донора используем прототроф. После проведения трансдукции и высева трансдуцировавных клеток на минимальную среду на ней будут обнаружены колонии нормального типа (транс-дуктанты-прототрофы) и микроколонии. Микроколонии формируются за счет клеток реципиента, в которых произошла абортивная трансдукция. В них фрагмент донора при каждом делении передается только одной клетке, остальные клетки не имеют этого фрагмента и, следовательно, лишены генетических детерминант, обеспечивающих контроль синтеза соответствующего фактора. Эти клетки не размножаются. Если донором вместо дикого типа взять мутант, характеризующийся такой же ауксотрофностью, как и реципиент, то микроколонии возникнут, если мутация донора произошла в одном гене, а мутация реципиента в другом. Иными словами, прототрофность в абортивнотрансдуцированной клетке реципиента возникает лишь в случае комплементарности мутаций. Фрагмент бактерии-донора, инкорпорированный в реципиентную клетку, восполнит в ней генетический дефект, вызванный мутацией в ее хромосоме. Если же у мутанта-донора и у мутанта-реципиента изменения произошли в одном локусе, то прототрофность не возникает, и микроколонии на чашках не будут обнаружены.
Таким образом, абортивная трансдукция между фенотипически подобными мутантами дает возможность установить без биохимических тестов различие или общность генетических локусов, мутирование в которых приводит к однозначным внешним дефектам.
В общем результаты, полученные с помощью абортивной трансдукции, хорошо согласуются с данными рекомбинационного анализа и биохимическими тестами [118, 119]. В последнее время накапливаются данные, указывающие, что комплементарность возможна не только при мутациях, локализованных в разных генетических локусах или цистронах, но и в пределах одного генетического локуса. Эти данные, полученные Гартманом и его сотрудниками, касаются локуса his В (рис. 14) у S. typhimurium. Указанный локус контролирует активность дегидразы, которая превращает имидазолглицерол-фосфорный эфир в имидазолацетол-фосфорный эфир. Среди 34 аллельных мутантов локуса his В 18 удалось разделить на четыре группы по их комплементарной способности в отношении друг к другу.
Мутанты каждой группы были некомплементарными друг к другу, но дополняли любой мутант остальных трех групп. Другие десять аллельных мутантов были комплементарными в отношении одной или двух групп, но не дополняли остальные две. И, наконец, остальные шесть мутантов были полностью некомплементарны. Рекомбинационный анализ установил локализацию всех четырех групп в пределах генетического локуса his В. Таким образом, оказалось, что и в пределах отдельного гена находятся субъединицы, выявляемые тестом комплементарности. Демерец и Гартман назвали их комплементарными единицами. В связи с этим они считают, что цистрон (как указывалось, термин, близкий по смыслу термину "генетический локус") не всегда можно характеризовать как участок карты, где локализованы некомплементарные мутации. Вероятно, в некоторых случаях гены (генетический локус или цистрон) включают в себя дифференцируемые участки, т. е. упоминавшиеся выше комплементарные единицы. Механизм внутригенной или внутрилокусной комплементарности Гартман и сотр. [109] объясняют следующим образом. Некоторые генетические локусы, в частности his В, контролируют синтез полимерного фермента, состоящего из идентичных полипептидных цепочек (рис. 14). Допустим, что в клетке реципиента произошла мутация, вызвавшая дефект в полипептидной цепочке, а в клетках донора в пределах этого же гена - мутация в другом участке, вызвавшая другой дефект в полипептиде. В абортивно трансдуцированной клетке будут синтезироваться оба по-разному дефектных полипептида, но в результате объединения их образуется полимер, обладающий ферментативной активностью. Очевидно, что у двух мутантов в зависимости от места мутации и, следовательно, характера дефектов, возникающих в полипептиде, такая комплементарность может оказаться невозможной либо в силу значительной денатурации пептида, либо при потере у него способности объединения с другой дефектной цепочкой.
Естественно возникает вопрос: из каких элементов построен сам ген? В настоящее время можно утверждать, что ген, контролирующий синтез специфического пептида, состоит из мельчайших элементов (англ. "sites") - участков, которые можно отделить друг от друга с помощью теста рекомбинации. Эти участки называют реконами. Здесь необходимо напомнить (см. выше), что частота рекомбинаций в этом случае будет очень низкой, поскольку рекомбинируемые участки находятся в хромосоме очень близко друг от друга. Следовательно, тесты рекомбинационного анализа в пределах одного гена должны обладать очень высокой разрешающей способностью, так как необходимо осуществить отбор весьма редко возникающих рекомбинантов из большого количества клеток родительских типов. Рассмотрим более подробно принципы генетического анализа отдельного локуса. Если мы знаем, что локус А детерминирует синтез фермента ФА, то мы можем отобрать ряд независимо возникших мутантов, дефектность которых определяется неспособностью синтезировать именно этот фермент. Проведем рекомбинацию между этими мутантами, применив для этого трансдукцию. Мы увидим, что все мутанты по способности давать рекомбинацию разделятся на три группы.
1. Мутанты, рекомбинирующие друг с другом и дающие в результате дикий фенотип.
Эти точечные мутанты произошли в результате изменения различных участков в пределах данного генетического локуса. Такие мутанты можно назвать псевдоаллелями. Демерец [120] называет их неидентичными аллелями, а Ромен [121] - гетероаллелями.
2. Мутанты, которые рекомбинируют только с некоторыми мутантами типа 1.
Предполагается, что они произошли в результате изменения двух или более соседних участков в пределах данного гена. Следовательно, в отличие от точечных мутаций их можно назвать протяженными мутациями или многоточечными. Характерными особенностями данного типа мутаций является то, что они обнаруживаются значительно реже, чем точечные, не рекомбинируют с тесно сцепленными маркерами и не обладают способностью давать обратные мутации. Все это свидетельствует о том, что многоточечные мутации являются результатом сложных изменений в геноме бактерий, таких, как выпадение участка хромосомы (делеция) или перестройка ее (инверсия, транслокация).
3. Мутанты, которые не рекомбинируют друг с другом, но рекомбинируют с мутантами типа а. Эти точечные мутанты произошли в результате одинаковых повреждений в одном и том же участке генетического локуса. Их можно назвать истинными аллелями, идентичными аллелями (Демерец) или гомоаллелями (Ромен).
Экспериментальные данные, полученные в опытах по трансдукции, доказывают, что различные генетические локусы бактериальной хромосомы содержат большое количество единиц рекомбинации. При этом отдельные гены отличаются друг от друга количеством выявляемых в них реконов (табл. 4).
![Таблица 4. Организация некоторых генетических локусов в хромосоме S. typhimurium [118]](pic/000017.jpg)
Таблица 4. Организация некоторых генетических локусов в хромосоме S. typhimurium [118]
Примечание. Данные не приведены - ×.
Делимость генетического локуса на составляющие его реконы является общим правилом. Мы обнаруживаем реконы у различных видов бактерий и фагов не только с помощью трансдукционного анализа, но и в опытах по трансформации, а также при конъюгации бактерий, мутации у которых локализованы в одном гене.
Если исходить из того, что хромосома S. typhimurium представляет собой молекулу ДНК, имеющую около 2⋅107 пар нуклеотидов, а гистидиновая область, состоящая минимум из 10 генов, включает в себя 1,3⋅104 пар нуклеотидов, то отдельный рекон может состоять из нескольких пар нуклеотидов. Основное свойство рекона выражается в его способности рекомбинировать, или вступать в генетический обмен. Возникает вопрос, играют ли эти субъединицы в пределах гена одинаковую роль? Ответ на него можно получить, изучив свойства ряда независимых бактериальных мутантов, мутации у которых находятся либо в разных реконах одного гена, либо в одном и том же реконе.
Напомним, что отдельный ген или генетический локус контролирует индивидуальную функцию клетки, выражающуюся в синтезе полипептидной цепочки. Мутации, возникающие в любом из участков этого локуса, окажут влияние на весь локус в целом в том смысле, что будет нарушена его функция и искажена структура соответствующего пептида. Однако можно предположить, что в зависимости от места изменения локуса, т. е. от характера искажения информации, закодированной в нем, различные мутации в пределах одного локуса вызовут неодинаковые изменения функции - неравнозначные нарушения в свойствах синтезируемого полипептида. Это можно проследить, изучив свойства мутантов, возникших в результате изменения отдельных участков локуса. Действительно, Гартману [108] удалось показать, что ауксотрофные мутанты S. typhimurium, не синтезирующие гистидин за счет мутации в локусе his А, отличаются друг от друга. Например, одни из них росли на среде при добавлении одного из пуринов, а другие - только в присутствии гистидина. Эти наблюдения были подтверждены и в отношении пурино-зависимых мутантов этого же микроба, для одних из которых необходим был тиамин, а для других - пантотенат [111]; наконец, цистеиновые ауксотрофы, мутировавшие в локус cys В, дифференцировались на две группы, для роста одной из них необходим был сульфит, а для другой гипосульфит [112].
Как правило, различные ауксотрофные мутанты, возникшие в результате изменения генетической информации в одном и том же гене, отличаются друг от друга по частоте обратных мутаций, возникших спонтанно или индуцированных химическими мутагенами. Это хорошо иллюстрируется схемой одного из опытов, проведенных Демерецом с сотрудниками: в опыт были взяты четыре независимых try D мутанта S. typhimurium, соответственно обозначенные try D-1, D-42, D-10 и D-55 (рис. 15).
Рис. 15. Индукция обратных мутаций аукеотрофа, мутировавшего в триптофановом локусе D (объяснение в тексте): а - контроль; б - диэтилсульфат; в - β-пропиолактон; г - 2-аминопурин
Все четыре мутации произошли, следовательно, в D-локу-се - области, контролирующей синтез триптофана. Согласно приведенной выше классификации Демереца, они относятся к неидентичным аллелям. Последовательность расположения упомянутых мутаций в D-локусе, установленная в опыте по трансдукции, представлена верхней частью схемы, под которой изображены 16 чашек с минимальной средой, дефицитной по триптофану. Каждый вертикальный ряд чашек показывает результат высева данного мутанта на эту среду: на первой чашке - необработанный мутант, на трех последующих высев этого же штамма после обработки тремя указанными химическими мутагенами. Горизонтальный ряд дает возможность сравнить поведение всех четырех мутантов как без обработки (контроль), так и после действия указанными мутагенами.
Колонии в контрольных чашках возникали из тех бактерий, у которых произошла спонтанная обратная мутация в try D-локусе. Избыток колоний прототрофа, выявленный на чашках с мутагенами, сравнительно с контрольными характеризует уровень индукции обратных мутаций использованными мутагенами. Было выяснено, что частота обратных спонтанных мутаций у четырех указанных аллелей относительно невелика, поэтому не всегда на чашке можно обнаружить прототрофную колонию. Так, для мутантов try D-1 она равнялась 6⋅10-10, для try D-42 - 1,5⋅10-10, для try D-10 - 3⋅10-10 и, наконец, для try D-55 - 17⋅10-10.
Приведенная схема хорошо иллюстрирует различия в свойствах мутантов, которые локализованы, как указывалось, в одном локусе или цистроне. Так, у мутанта try D-1 реверсия к прототрофности наблюдается под влиянием всех трех мутагенов, мутант try D-42 ревертирует лишь под влиянием диэтилсульфата и β-пропиолактона, 2-аминопурин вызывает обратные мутации лишь у мутанта try D-10, и ни один из трех мутагенов не индуцирует обратные мутации у штамма try D-55. Итак, мы приходим к заключению, что мутации, возникающие в разных участках одного и того же гена, контролирующего синтез одного пептида (фермента), отличаются друг от друга не только локализацией, но и характером изменения информации, закодированной в нем. Это означает, что искажение информации, определяющей синтез данного полипептида, в зависимости от локализации мутационного изменения в пределах локуса, может выразиться либо в полном отсутствии активного пептида, либо в его изменении. Измененная полипептидная цепочка может оказаться либо совершенно неспособной осуществлять свою каталитическую функцию, либо эта функция может быть искаженной или сниженной. Нарушения свойств полипептида, возникшие в результате мутаций в разных участках одного и того же гена, могут выражаться в изменении электрофоретической подвижности пептида, его сродства к субстрату, к специфическому ингибитору, чувствительности к температуре, ионам металла и т. д.
Подводя итог, можно заключить, что изменения в разных рекомбинируемых участках одного гена, в разных реконах, приводят к различным изменениям в пептидах. Поскольку сам по себе рекой может объединить несколько нуклеотидов, то естественно предположить, что и он не является элементарной единицей гена. Можно привести ряд фактов, указывающих, что в пределах рекона - в участке хромосомы, объединяющем несколько десятков нуклеотидов, локализован ряд мутаций. Следовательно, если рассматривать рекон как некий уровень делимости хромосомы, то мы имеем основание считать, что в его пределах заключены элементарные единицы мутации, называемые мутонами. Действительно, в опытах с S. typhimurium было показано, что мутации, возникающие в результате изменений в одном рекомбинирующем участке, т. е. недифференцируемые с помощью чувствительного теста трансдукции, могут характеризоваться различным фенотипом.
Этот факт в дальнейшем был подтвержден при изучении тонкой структуры генетических детерминант пневмококка, контролирующих резистентность к стрептомицину.
Из всего изложенного следует, что хромосома бактерии, представляющая собой замкнутую молекулу ДНК, состоит из крупных участков, контролирующих сложные реакции синтеза какого-либо продукта - аминокислоты, витамина, фермента, азотистого основания и т. д. Такой участок относительно большой протяженности называют генетической областью. Генетическая область состоит из субъединиц, или отдельных генов, контролирующих биосинтез промежуточных продуктов, необходимых для осуществления конечной реакции - синтеза данного соединения. Эти субъединицы называют также генетическими локусами, просто локусами или цистронами. Гены являются функциональными единицами хромосомы в том смысле, что они контролируют синтез отдельного пептида. Последовательность генов в хромосоме бактерии, как правило, соответствует последовательности этапов биохимической реакции, которая ими контролируется. Следовательно, между соседними генами в хромосоме существуют тесные взаимоотношения. Гены, в свою очередь, состоят из мельчайших элементов, способных вступить в генетический обмен, т. е. из реконов, а последние включают в себя наименьшие по величине участки, изменение которых приводит к мутациям, - мутоны. Протяженность реконов выражается несколькими парами нуклеотидов, а мутона - одной парой.
Литература

|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'