
Глава II. Тонкая структура гена (А. А. Прозоров)
1. Развитие понятия "ген" в генетике многоклеточных организмов
Термин "ген" существует более 50 лет. Эквивалентный термин "фактор" был введен Г. Менделем в начале 60-х годов прошлого века. За столетнюю историю содержание термина несколько раз менялось; изменения были связаны с введением новых моделей, методик, развитием генетики и смежных областей биологии. Небезынтересно проследить общую тенденцию этих изменений.
Мендель, как известно, ставил опыты на горохе, изучая поведение при скрещивании таких морфологических признаков, как форма и окраска семян и цветков. На основании полученных количественных закономерностей был сделан вывод о том, что изученные признаки определяются какими-то задатками, находящимися в половых клетках. Эти задатки он назвал факторами. По мнению Менделя, в гибридном организме отцовский и материнский факторы, влияющие на один тот же признак, взаимодействуют таким образом, что один из них является преобладающим, доминирующим и совершенно затемняет влияние второго. Например, растение, полученное от скрещивания особей с желтыми и зелеными семенами, имеет желтые семена без всяких промежуточных оттенков к зеленому. Однако в потомстве гибрида вновь возникают особи, обладающие подавленным, рецессивным признаком. Таким образом, фактор данного признака отнюдь не уничтожается, а сохраняется и может выявиться вновь.
Мендель не имел никаких сведений о местонахождении факторов в клетке, их химической природе, механизме влияния на признак и т. д. Однако менделевское учение о факторах как единицах наследственности легло в основу теории гена.
В самом конце XIX и начале XX века, независимо от работ Менделя, некоторыми исследователями-цитологами было высказано предположение о ядерной хромосомной локализации факторов наследственности. Это предположение основывалось главным образом на несомненной индивидуальности отдельных хромосом и большой точности их распределения при делении клетки.
В 1907 г. Иогансен ввел термин "ген", заменивший синоним "фактор". Дальнейшая конкретизация понятия "ген" тесно связана с выдающимися работами школы Моргана. Морган имел дело с чрезвычайно удобным объектом - плодовой мушкой Drosophila melanogaster, размножавшейся гораздо быстрее растительных объектов, использовавшихся в работах предшествовавшего периода. Кроме того, дрозофила имела лишь четыре пары хромосом, легко различавшихся по форме и величине.
Вначале Морган [1] изучал закономерности появления у потомства одной из мутаций, затрагивающей окраску глаз, т. е. наследственных изменений признака "белые глаза" вместо нормальных "красных глаз". Оказалось, что при скрещивании нормальных и мутировавших мух этот ген всегда проявлялся у потомков-самцов, но не у самок.
К тому времени уже было известно о существовании так называемых половых хромосом; в диплоидных клетках самок находятся две одинаковые хромосомы XX, у самцов - одна X-хромосома и одна Y-хромосома.
Было сделано предположение, что фактор окраски глаз у дрозофилы находится именно в Х-хромосомах. Тогда у самцов дрозофилы, имеющих лишь одну такую хромосому, гены, находящиеся в ней, будут свободно проявляться, не взаимодействуя со своими аллелями.
Открытие факторов, наследующихся сцепленно с полом, было первым доказательством хромосомной локализации генов.
В дальнейшем было показано, что в потомстве особей, различающихся по множеству признаков, эти признаки распределяются не беспорядочно, а группами. Между этими "группами сцепления" (как их стали называть) возможно свободное комбинирование. У дрозофилы были обнаружены четыре группы сцепления. Это соответствовало числу пар хромосом и свидетельствовало о том, что гены расположены во всех хромосомах, а не только в половых. Каждая группа сцепления была равнозначна одной хромосоме; собственно, гены потому и наследовались одной группой, что располагались на одной непрерывной материальной структуре.
Соответствие между числом групп сцепления и числом пар хромосом было найдено, кроме дрозофилы, и у других животных и растений.
На основании только что приведенных данных (и многих других, менее прямых доказательств), можно было заключить о хромосомной локализации генов; оставалось неизвестным, в каком порядке они располагаются в хромосомах. Этот вопрос был детально изучен в лаборатории Моргана; в основу легли следующие наблюдения.
Изучалось потомство, полученное от скрещивания родителей, различавшихся по признакам одной группы сцепления (например, черных мух с зачаточными крыльями и нормальных мух). У большей части потомства (83%) мутировавшие гены находились в одной группе сцепления, не комбинируясь с дикими. Однако в 8,5% случаев ген зачаточных крыльев был объединен в одной группе сцепления с геном серой окраски тела; ген черной окраски тела в 8,5% случаев также оказывался сцепленным с геном нормальных крыльев. Таким образом, наблюдалось перекомбинирование не только между группами сцепления, но и внутри этих групп.
Для объяснения полученных результатов было выдвинуто предположение о том, что обмен генами - лишь следствие обмена участками гомологичных хромосом, несущих эти гены (подобные процессы, напоминающие обмен хромосомного материала, уже наблюдались цитологами). Это явление получило название кроссинговера (перекреста).
Величина кроссинговера между любыми двумя генами одной группы сцепления была специфической для каждой пары. Очевидно, это отражало какое-то отношение между генами. Наиболее простым оказалось предположение, что это число отражает расстояние между генами.
В самом деле, если допустить, что кроссинговер происходит с приблизительно одинаковой частотой по всей длине хромосомы (так как определяется, в общем, случайными обстоятельствами), то чем дальше расположены гены, тем больше шансов, что они будут разделены кроссинговером; и наоборот, чем ближе гены, тем более вероятно, что кроссинговер между ними не произойдет.
Таким образом, открылась возможность построить план взаимного расположения в хромосоме известных генов (хромосомную карту) и вычислить приблизительное расстояние между ними (в процентах числа кроссинговерных потомков-рекомбинантов от общего числа скрещиваний). Кроме того, можно было нанести на такую карту каждый вновь выделенный ген, определив частоту его перекреста с уже известными генами.
Впрочем, уже сам Морган считал, что расстояния на картах в процентах кроссинговера не всегда могут совпадать с реальными расстояниями на хромосомах в линейных мерах длины. В 1922 г. он писал: "...Длина отрезка хромосомы, соответствующая единице расстояния (1%), может быть различной в разных районах хромосомы. Параллелью к картам может служить железнодорожное расписание поездов, в котором дано число минут между станциями. По такому расписанию можно точно судить о последовательности станций и лишь грубо - о фактическом количестве миль между ними" [2].
В 20-годах не обнаружили кроссинговер между аллельными генами. Поэтому аллельной парой стали считать два гена, расположенных на гомологичных хромосомах в строго идентичных участках (на схемах - друг против друга) и влияющих на развитие одного и того же признака.
Ген теперь представлялся как обособленный участок хромосомы, контролирующий один определенный признак, изменяющийся (мутирующий) как единое целое и неделимый при кроссинговере. Такое представление подчеркивало и преувеличивало дискретность гена. На хромосомных картах ген соответствовал геометрической точке, не имеющей измерений.
Взглядов на ген как на единицу функции, мутации и рекомбинации придерживались очень долго, хотя, как будет показано ниже, вскоре были получены факты, противоречащие этим представлениям.
Большое значение для исследований внутренней структуры гена имели работы, проделанные школой А. С. Серебровского [3]. В этих работах изучались мутации гена scute-achaete, приводящие к редукции щетинок на теле дрозофилы. Незадолго перед этим установили, что рентгеновы лучи обладают сильным мутагенным действием; благодаря этому стало возможным быстро получать большое количество самых разнообразных мутаций.
При исследовании нескольких мутаций гена scute-achaete, полученных таким путем, оказалось, что мутации, локализованные в одном и том же участке хромосомы, имеют не вполне одинаковое фенотипическое выражение (например, в одном случае сокращалось число щетинок на брюшке и на голове, в другом - лишь на брюшке, и т. д.). Это можно было принять за явление множественного аллеломорфизма; однако принципиально новой особенностью серии обнаруженных аллелей были необычные отношения между этими аллелями в гетерозиготе.
При скрещивании мутантов отношения доминантности-рецессивности проявлялись здесь не полностью; у потомства изменения были выражены лишь в тех участках тела, которые были изменены у обоих родителей (в приведенном выше примере - лишь на брюшке). Те участки, которые изменились лишь у одного из родителей, у потомства развивались нормально. Наследование происходило так, как если бы потомство было гомозиготно по признаку "щетинки на брюшке" и гетерозиготно по признаку "щетинки на голове". Однако речь шла об одном и том же гене, об одном и том же участке хромосомы; оставалось допустить, что этот ген состоит из участков со сходной функцией, каждый из которых контролирует развитие признака на определенной части тела дрозофилы и может самостоятельно мутировать. Явление получило название ступенчатого аллеломорфизма.
На основании этих данных А. С. Серебровским была создана так называемая центровая теория гена. Согласно этой теории весь ген (или базиген) может состоять из отдельных участков - центров, трансгенов, каждый из которых несет сходную функцию. Аллельные отношения внутри базигена между трансгенами такие же, как между отдельными функционально различными генами; мутация может нарушать деятельность одного из трансгенов, не затрагивая других.
Таким образом, эти работы поставили под сомнение два важных положения Моргана о природе гена: представление о гене как о единице, целиком изменяющейся при мутации, и представление о гене как о неделимой функциональной единице. Через несколько лет ревизии было подвергнуто и положение о гене как о единице кроссинговера. К этому привело изучение явлений псевдоаллелизма.
Псевдоаллелизм был вначале обнаружен у дрозофилы. При скрещивании мух с мутацией lozenge, локализованной в определенной области хромосомы и имеющей у всех мутантов одинаковое фенотипическое выражение (изменение строения глазных фасеток), среди очень большого числа потомков было получено, наряду с мутантными особями, некоторое количество дрозофил с диким генотипом [4]. Этот факт мог быть объяснен лишь тем, что мутационные изменения затронули два, хотя и расположенных рядом, но различных участка одного и того же гена; кроссинговер же прошел между ними, и в результате рекомбинации воссоздалась хромосома дикого типа. Таким образом, могли существовать мутации с одним фенотипическим проявлением, но разделимые кроссинговером (т. е. лежащие в различных, хотя и близко расположенных, точках гена). Поскольку считалось, что аллели занимают строго идентичные участки, мутанты с одним и тем же фенотипом, но рекомбинирующиеся при кроссинговере, стали называть псевдоаллельными.
Отношения в гетерозиготе между участками гена, расположенными на очень близких расстояниях, оказались непохожими на отношения между отдельными генами. До открытия явления псевдоаллелизма неизменно оказывалось, что гетерозигота, несущая в гомологичных хромосомах две пары аллельных генов (один из членов каждой пары был неизмененным, другой - мутировавшим), всегда обладает диким фенотипом. Это происходило и в том случае, когда неизмененные гены находились в одной гомологичной хромосоме, а их мутировавшие аллели - в другой (так называемое цис-положение), и тогда, когда аллельные пары располагались "крест-накрест", т. е. на каждой гомологичной хромосоме было по мутировавшему и неповрежденному гену - так называемое транс-положение (рис. 1). В транс-положении, следовательно, каждая хромосома имела по мутировавшему участку; однако в гетерозиготе неповрежденный участок гомологичной хромосомы "работал за двоих", и хромосомы функционально дополняли друг друга.
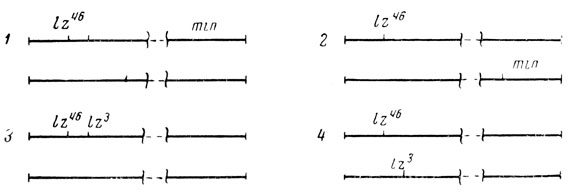
Рис. 1. Цис-транс-тест. Схематически изображены два гена, находящиеся в хромосоме I дрозофилы: ген lozenge (контролирующий развитие глаз) - слева, и ген miniature (контролирующий развитие крыльев) - справа. Расстояние между генами условное. На схемах 1 и 2 гетерозиготы, несущие мутации обоих этих генов, функционируют по дикому типу, независимо от того, находятся ли эти мутации в одной хромосоме (цис-положение, схема 1) или на разных (транс-положение, схема 2). На схемах 3 и 4 показаны две мутации (46 и 3 - порядковые номера мутаций) одного и того же гена lozenge. В данном случае, при локализации мутаций внутри одного гена, гетерозигота функционирует по дикому типу лишь тогда, когда мутации находятся в цис-положении (схема 3). В транс-положении (схема 4) она дает мутантный фенотип
Отношения взаимодополняемости, или комплементарности, между двумя парами генов наблюдались при любых расстояниях между этими парами, даже между соседними генами. Тем самым разделяемость кроссинговером и комплементарность для относительно крупных участков хромосом совпадали.
Казалось бы, что гетерозигота с двумя псевдоаллелями, находящимися в гомологичных хромосомах (т. е. в транс-положении), также должна обладать диким фенотипом, поскольку псевдоаллели разделимы кроссинговером. Однако фенотип такой гетерозиготы обычно был измененным. Следовательно, внутригенные отношения отличались от межгенных отсутствием комплементарности.
На основании этих закономерностей Льюис [51 предложил так называемый цис-транс-тест, позволивший решить, находятся ли два мутационных изменения в одном гене, точнее, в пределах одной функциональной единицы, или принадлежат разным генам. Если в гетерозиготе две мутации, находящиеся в цис- или транс-положении, допускают развитие дикого фенотипа, то эти мутации повреждают разные гены. Если же две мутации, находящиеся в цис-положении, допускают развитие дикого фенотипа, а в транс-положении приводят к развитию измененного фенотипа, то они занимают два участка одной функциональной единицы, хотя эти участки и могут быть разделимы кроссинговером (рис. 1).
Наиболее интересной особенностью, выявляющейся посредством цис-транс-теста, было своеобразное отношение между участками одной функциональной единицы. Льюис, а также К. Офферман [6] объясняли эти отношения следующим образом. Если предположить, что конечный продукт, вырабатываемый геном, возникает в результате ряда последовательных реакций, то для начала последующей реакции нужен продукт предыдущей. Такая цепь реакций происходит лишь на поверхности хромосомы: промежуточные продукты либо не могут диффундировать в цитоплазму, либо для реакции требуется непосредственный контакт реагентов на поверхности хромосомы. Поэтому для деятельности функциональной единицы нужна непрерывность соответствующего участка хромосомы, и в пределах функциональной единицы нет отношений комплементарности. Эти отношения возникают лишь между функциональными единицами, каждая из которых вырабатывает полноценный, поступающий в цитоплазму продукт.
Многолетние исследования структуры и функции гена, проведенные на высших организмах, дали к началу 50-х годов XX века результаты, которые можно резюмировать следующим образом:
Ген - это участок хромосомы, контролирующий развитие определенного признака. Ген обладает известной протяженностью и может быть поврежден в нескольких точках, что доказывается существованием мутаций, разделимых при кроссинговере. Ген комплексен, так как его отдельные участки могут несколько различаться по функции и в их совместной деятельности существует определенная субординация.
2. Некоторые особенности генетики микроорганизмов
Дальнейшему изучению тонкого строения генетического материала во многом содействовало введение нового объекта исследований - микроорганизмов. Своеобразная биология микроорганизмов и приемы работы с ними требуют некоторого пояснения.
Микроорганизмы стали применяться в качестве модели для генетических исследований с начала 40-х годов. До этого времени считалось, что по особенностям наследственного аппарата они сильно отличаются от высших организмов и закономерности генетики многоклеточных для них неприемлемы. Однако за последние 15-20 лет положение изменилось. Сперва было показано, что понятия генетики высших организмов применимы и к низшим; затем большинство исследований по биохимической генетике стали проводить лишь на грибах и бактериях; в настоящее время многие закономерности, установленные в опытах на микроорганизмах, ждут своего подтверждения и на многоклеточных.
Микроорганизмы, с которыми работали и работают генетики, очень разнообразны - иногда их сближают лишь микроскопические размеры и скорость размножения. К микроорганизмам обычно относятся и аспергиллы (многоклеточные организмы), дрожжи, различные бактерии кишечной группы, пневмококки, гемофильные бактерии, сенная палочка и, наконец, фаги преимущественно кишечной группы бактерий. Особняком стоят вирусы растений; наиболее часто как модель употребляется вирус табачной мозаики.
Работа с микроорганизмами имела ряд важных преимуществ. В большей части своего жизненного цикла микроорганизмы гаплоидны; гаплоидность при наличии и диплоидных форм давала дополнительные возможности изучения функционирования гена.
У микроорганизмов в гораздо большей степени, чем на прежних моделях, в понятие "признак" было вложено биохимическое содержание. Сначала на нейроспоре, а затем "на бактериях" удалось разработать способы получения и изучения биохимических мутаций. Было выделено множество мутантов, которые не росли без добавления в среду определенного вещества; при исследовании этих мутантов оказывалось, что у них нарушена та или иная ферментативная реакция. Обычно одной мутации какого-либо гена соответствовало выпадение функции одного определенного фермента; на основании этих данных Бидл сформулировал известный принцип - "один ген - один фермент". Этот принцип сохраняет свое значение и по настоящее время.
Микроорганизмы размножаются несравненно быстрее всех прочих "лабораторных животных" и дают огромное "количество поколений за короткие промежутки времени. Применяя селективную методику, из многих миллионов размножившихся особей можно было выделить несколько индивидуумов, обладающих свойствами, измененными в ожидаемом направлении. Поскольку разрешающая способность генетического анализа определяется числом произведенных скрещиваний, то даже для картирования хромосом (хорошо изученного на дрозофиле и других высших животных)*, микроорганизмы оказались очень полезным объектом. На них можно было легко изучить тесно соприкасающиеся генетические области, рекомбинации между которыми происходят настолько редко, что особи, несущие рекомбинированные участки хромосом, могут из-за своей малочисленности не встретиться в изучаемой популяции дрозофил.
* (Поскольку у микроорганизмов до сих пор не обнаружено морфологических образований, похожих на хромосомы многоклеточных, то правильнее было бы говорить о группах сцепления генов. Однако мы сочли возможным употребить этот термин из-за полной функциональной аналогии между группами сцепления у микроорганизмов и хромосомами.)
Получение гетерозиготы для проверки аллелизма и построения хромосомных карт достигается разными способами. Скрещиваются далеко не все микроорганизмы; из перечисленных выше истинный половой процесс наблюдается у нейроспоры, аспергиллов и дрожжей. Приходилось различными путями получать диплоидную клетку, в которой взаимодействовали аллельные гены, независимо от того, представлен ли второй партнер целым геном или только группой генов, среди которых есть и исследуемый (в последнем случае гетерозиготу иногда называют мерозиготой). Такое положение могло быть достигнуто разными путями. Вкратце остановимся на каждом из них, чтобы избежать пояснения в последующем тексте (см. также главу "Генетика бактерий").
Гетерокариоз. В этом случае в одной и той же клетке присутствуют два разных ядра, которые не сливаются, взаимодействуя лишь "на расстоянии" и конкурируя за управление тем или иным звеном в метаболизме клетки. Этот процесс обычно наблюдается у грибов. С помощью гетерокариоза могут быть проверены аллельные отношения между локусами [7].
Смешанная фаговая инфекция. Здесь взаимодействуют геномы фагов при смешанной инфекции бактериальной клетки. Взаимодействие может быть двух типов - "на расстоянии", как при гетерокариозе, и непосредственное с помощью кроссинговера, или по крайней мере с результатами, которые могут быть описаны в терминах кроссинговера. Роль гетерозиготы, доступной для наблюдения исследователя, выполняет клетка-хозяин - бактериальная клетка, лизис которой произойдет в зависимости от того, будут ли дополнять друг друга геномы проникших в клетку фагов-мутантов (каждый из которых по отдельности утратил лизирующую способность) [8]. О способах составления хромосомных карт фагов сказано ниже.
Завершенная трансдукция. При завершенной трансдукции партнерами являются целый геном одной бактерии и очень небольшой участок генома другой бактерии. Участок постороннего генома вносится в клетку фагом. Клетка проходит стадию мерозиготы, но не задерживается на ней, так как очень скоро происходит включение внесенного участка в хромосому бактерии-реципиента. О механизме включения можно лишь строить догадки; результаты включения могут быть описаны в терминах кроссинговера. При завершенной трансдукции можно построить карты взаимодействующих участков хромосом [9, 10].
Абортивная трансдукция. В случае абортивной трансдукции включения участка генома бактерии-донора в хромосому реципиента не происходит; этот участок, однако, присутствует на протяжении ряда поколений в бактериальной клетке, не удваиваясь при ее делении, но передаваясь одной из разделившихся клеток и взаимодействуя с соответствующим участком хромосомы реципиента по типу гетерокариоза. Кроссинговера здесь не происходит, но легко проверяются аллельные отношения [9, 10].
И завершенная, и абортивная трансдукции изучались преимущественно на таких бактериях, как салмонеллы и кишечная палочка.
Конъюгация. Это явление внешне напоминает половой процесс. Одна из бактериальных клеток слипается с другой; клеточные стенки в месте соприкосновения прорываются, и довольно значительный участок генома клетки-донора переходит в клетку-реципиент. Стадия мерозиготы после завершения конъюгации длится меньше, чем при абортивной трансдукции; через одно-два поколения происходит рекомбинация между внесенным генетическим материалом и хромосомой клетки-реципиента, и клетка вновь становится гаплоидной. Однако у некоторых штаммов этого не наблюдается и мерозигота существует много поколений [11].
Способность к переносу участка хромосомы связана с наличием в клетке-донора "полового фактора" - автономной частицы неизвестной природы, относимой к так называемым эписомам и по некоторым признакам напоминающей фага; это сближает конъюгацию с трансдукцией (см. главу "Генетика бактерий").
Конъюгация изучалась главным образом на бактериях кишечной группы; она также имеется и у некоторых других бактерий. С помощью конъюгации можно картировать относительно большие участки хрюмосом, а также проверять аллельные отношения.
Трансформация. При трансформации происходит, видимо, тот же процесс, что и при завершенной трансдукции; основная разница в том, что в данном случае участок генома (часть молекулы ДНК) донора поглощается клеткой реципиента без участия фага. Здесь также можно предположить очень кратковременное существование мерозиготы, а затем - включение внесенного участка генома в хромосому реципиента. Таким образом, в этом случае возможно построение карты очень небольшого участка хромосомы [12].
Трансформация применялась для исследования тонкого строения наследственных структур преимущественно у пневмококков и сенной палочки.
Таким образом, у микроорганизмов возможны (при изучении мерозигот и гетерокарионтов) как анализ аллельных отношений, так и построение хромосомных карт. Это и было использовано при изучении у данных объектов тонкой структуры гена.
Наибольшее влияние на современные представления о строении генетического материала оказали работы Бензера и других на бактериофагах [13-17]. Терминология, которая все чаще употребляется для обозначения субъединиц гена, была предложена именно в этих работах. Поэтому целесообразно рассматривать результаты, полученные на фагах, а затем сравнивать их с данными, известными из работ с другими микроорганизмами.
Следует коротко остановиться на объектах опытов Бензера и на некоторых особенностях этих опытов. У фагов кишечной палочки существует обширная группа мутантов r, образующих более крупные стерильные пятна на чашках с определенными штаммами бактерий, чем фаги дикого типа. Это связано с ускоренным лизисом клеток, откуда и происходит название мутантов r - rapid lysis). При росте на других бактериальных штаммах мутанты дают пятна той же величины, что и фаги дикого типа; на некоторых же штаммах эти мутанты вообще не могут расти.
Существует несколько групп мутантов r. Каждая из этих групп отличается от другой поведением при заражении какого-либо штамма кишечной палочки. Например, группа r II фага Т4 дает крупные пятна при заражении штамма В и вообще не дает пятен на штамме К; группа r III дает крупные пятна на штамме В, а также пятна нормальной величины - на штамме К. При картировании мутантов r обнаружилось, что таким различиям между группами этих мутантов соответствует их неодинаковое расположение на хромосоме фага.
Таким образом, мутации r - сборная группа сходных морфологических мутаций; биохимический механизм изменений фенотипа, наступающих при этом, пока что неизвестен.
В опытах Бензера исследовалось большое количество мутантов фага Т4 группы r II. Хромосомная область r II, в которой локализовались мутации этой группы, была приравнена к гену. В большинстве случаев у мутантов различного происхождения были повреждены неодинаковые участки этой области хромосомы; это доказывалось возможностью рекомбинации между такими мутантами. Рекомбинанты дикого типа возникали после одновременного заражения двумя мутантами бактерии В. Рекомбинанты можно было затем обнаружить, высевая размножившиеся фаги на штамм К (фаговые частицы дикого типа давали здесь пятна, в отличие от основной массы фагов-мутантов; поэтому даже очень редкие рекомбинации, порядка 10-6, удавалось легко выявить). На основании частоты появления рекомбинантов можно было (точно так же, как и у дрозофилы) определить взаимное расположение мутантов и относительное расстояние между ними, т. е. построить карту области r II (рис. 2). Картирование облегчалось тем, что среди точечных мутаций были и мутации, вызванные выпадением целых участков генетического материала - делеции. Такие мутации не давали рекомбинантов дикого типа при скрещивании с партнером, у которого мутация находилась в пределах, затронутых у первого фага делецией. Поэтому, подобрав мутанты с делециями, в сумме захватывающими весь ген r II, можно было сперва скрещивать с этими немногочисленными мутантами каждый новый мутант с неизвестной локализацией повреждения (а не подряд со всеми известными точечными мутантами). Затем, установив положение мутации в определенном участке гена r II, можно уточнить ее локализацию, производя скрещивание с мутантами, имеющими точечные мутации заведомо в данном участке. Считалось, что если между двумя точечными мутациями не происходит рекомбинации, то они занимают на хромосоме фагов идентичные участки.
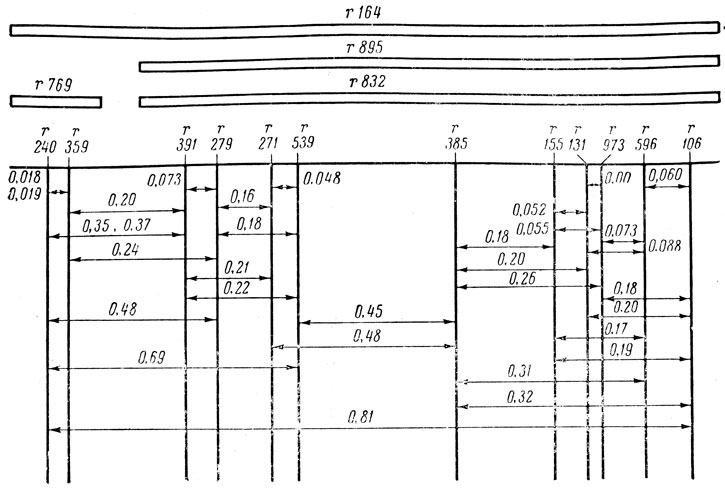
Рис. 2. Карта расположения мутаций в участке r 164 области r II фага Т4. Участок r 164 - небольшая часть всей области r II; наверху указаны номера мутаций (например, r 385; r 131). Числа над стрелками обозначают процент рекомбинаций между мутациями. Прямоугольниками над картой обозначены мутации, имеющие значительную протяженность - делеции
Неспособность мутантов r II развиваться в клетках штамма К удалось оценивать не только качественно, но и количественно. Оказалось, что у определенной части таких мутантов все же происходит нормальное созревание и выход из клетки небольшой части фаговых корпускул (их можно потом сосчитать, высевая на штамм В). Такие мутанты были названы leaky - "растекающимися". Степень "растекаемости" была постоянной величиной для каждого отдельного мутанта и характеризовала фенотипическое проявление мутации.
Если бактерия штамма К одновременно с мутантами заражалась и фагом дикого типа, то дозревание мутантов заканчивалось; они вместе с частицами дикого типа и рекомбинантами выходили из разрушенной клетки. Такое поведение мутантов r II принято объяснять следующим образом. У них нарушен синтез какого-то нужного для развития вещества; у "нерастекающихся" это вещество полностью неактивно, у "растекающихся" оно сохраняет часть активности. Фаг дикого типа с избытком продуцирует это вещество. При совместном заражении его хватает и на то, чтобы обеспечить развитие мутантов. Предполагается, что нарушен синтез какого-то белка, хотя этот белок еще не выделен.
3. Тонкая структура гена у микроорганизмов
1) Единица рекомбинации
Длина генетических карт измеряется, как известно, в условных единицах - процентах кроссинговера. Поэтому, рассматривая все классы генетических субъединиц, выделенных после изучения области r II фага Т4, уместно начать с единицы рекомбинации - рекона. Реконами можно назвать наименьшие рекомбинирующиеся участки генетического материала (т. е. участки, между которыми еще возможен кроссинговер).
При скрещивании мутантов r II разного происхождения, как говорилось выше, возникают рекомбинанты дикого типа. Это доказывает, что через ген фага Т4, как и у дрозофилы, может проходить кроссинговер. Частота появления рекомбинантов характерна для каждой пары мутантов; на основании этих данных были построены подробные внутригенные карты области r II. Благодаря большой разрешающей способности генетического анализа у фагов удалось показать, что делимость внутригенного материала была очень высока; можно разделить точки, лежащие, видимо, чрезвычайно близко (наименьшая частота рекомбинаций равнялась 0,02%). Делимость таких точек выявляется лишь при большом числе скрещиваний. Значило ли это, что с увеличением числа скрещиваний разрешающая способность генетического анализа будет непрерывно повышаться? Существует ли предельное расстояние между двумя точками хромосомы, которое можно принять за абсолютно неделимый участок? Бензер в своих экспериментах с фагом Т4 решил признать минимальную достигнутую им частоту рекомбинаций (0,02%) за характеристику длины минимального участка хромосомы, способного делиться кроссинговером. Следовательно, участок меньшего размера, уже неделимый, мог считаться реконом. Для доказательства того, что число 0,02% действительно является характеристикой наименьшего делимого участка, Бензер сопоставил результаты генетического анализа с предполагаемым строением молекулы ДНК. Считается, что у фага Т4 "генетическую функцию" несет около 40% ДНК, или 1,6⋅105 нуклеотидов. Если принять, что схема Уотсона-Крика в основном соответствует строению ДНК фага, это даст 8⋅104 пар нуклеотидов. Экспериментально найдено, что общая длина генетической карты фага равна 800% рекомбинаций. Можно предположить, что для всех участков хромосомы фага вероятность возникновения кроссинговера в общем одинакова. В таком случае вероятность рекомбинации для одной нуклеотидной пары в любом участке группы сцепления составит 800:80000, т. е. 0,01% (число, очень близкое эмпирически найденному при рекомбинации внутри гена r II). Если этот расчет справедлив, то для фага Т4 величина рекона - одна пара нуклеотидов.
Получить какие-либо данные о единице рекомбинации на бактериях и других микроорганизмах и выразить длину этой единицы в нуклеотидах было несравненно труднее, чем на фагах. Во-первых, на фагах было легче добиться рекордного числа скрещиваний; во-вторых, было совершенно очевидно, что ДНК прочих микроорганизмов функционально более гетерогенна, чем у фагов. Поэтому сопоставление общего числа рекомбинаций с общим числом нуклеотидных пар (вроде того, которое проделал Бензер) здесь не столь убедительно. Однако Понтекорво и Ропер [18], пользуясь подобными расчетами, определили единицу рекомбинации для аспергиллов в 8 пар нуклеотидов. Это число не так сильно отличается от размера рекона для фага Т4.
Данные о расстоянии между рекомбинирующимися единицами содержатся в работе Хенинга и Яновского [19]. Изучался аминокислотный состав триптофансинтетазы кишечной палочки у одного из мутантов с измененной активностью этого фермента. Отличие строения фермента мутанта от фермента бактерии дикого типа сводилось к тому, что у мутанта в определенном участке полипептидной цепи глицин был заменен одной из двух аминокислот - глутаминовой кислотой или аргинином. При рекомбинации аргининового и глутаминового мутантов возникали, и клетки с нормальным фенотипом, т. е. с наличием глицина. Поскольку эти аминокислоты, замещая друг друга, занимали одно и то же, строго определенное место в полипептиде, можно думать, что и мутации, и рекомбинации шли в пределах единицы нуклеотидного кода, определяющей специфичность одной . аминокислоты. Крик назвал такую единицу к о до ном. Принимая, что кодон является триплетом азотистых оснований, можно предполагать, что рекон в данном случае равен одному нуклеотиду; возможно, что кроссинговер вообще может происходить между любыми соседними нуклеотидами, без каких-бы то ни было ограничений.
2) Единица мутации
Другой генетической единицей, выделенной Бензером у фага Т4, была единица мутации, или мутон - наименьший участок генетического материала, изменение которого еще приводит к генетическим изменениям.
Многочисленные спонтанные мутанты гена r II фага Т4 отличались друг от друга по способности к реверсии. Одни из них никогда не давали возврата к дикому типу. При картировании таких мутантов обнаруживалось, что поврежденная часть хромосомы занимает здесь обширный участок и соответствует делециям у высших организмов. Естественно, такие участки хромосомы не подпадали под определение мутона.
Мутации другой группы были похожи на точечные мутации дрозофилы. Среди них относительно часто наблюдались спонтанные реверсии. Было важно определить, как относятся между собой участок, затронутый такой мутацией, и рекон, а также может ли мутон делиться при кроссинговере.
Для этого Бензер исследовал участки с тремя близко расположенными мутациями. Сравнивалась частота рекомбинаций между двумя крайними мутациями и сумма частот рекомбинаций между первой - второй и второй - третьей мутациями. Если центральное повреждение имело какую-то протяженность и через поврежденный участок мог проходить кроссинговер, то сумма частот рекомбинаций между центральной мутацией и двумя другими должна быть меньше, чем частота рекомбинаций между крайними мутациями. Разность соответствует величине участка, затронутого центральной мутацией (рис. 3). Для нескольких, расположенных рядом групп из трех точечных мутации величина средней мутации, вычисленной таким путем, была несколько больше рекона; она соответствовала 0 05% рекомбинаций.
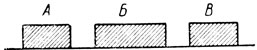
Рис. 3. Определение длины мутона. Если мутационные изменения А, Б и В расположены рядом и мутация Б разделима кроссинговером, то число рекомбинаций между мутациями А и В должно превышать сумму рекомбинаций между А и Б и между Б и В (так как на участке АВ поместится больше кроссинговеров, чем на сумме участков АБ и БВ). Превышение должно соответствовать длине участка Б в единицах рекомбинации
Бензер сопоставил также число мутаций в небольших "насыщенных" повреждениями участках области r II с длиной этих участков (в процентах общего числа кроссинговеров). Оказалось, что иногда на участок, содержащий девять разделимых мутаций, падало до 0,8% всех рекомбинаций; таким образом на каждую мутацию приходилось не более 0,09% всех рекомбинаций.
На основании этих данных можно было заключить, что мутон - очень небольшой и относительно несложный участок ДНК, хотя и больший, чем рекон. Бензер в работах 1955-1959 гг. был склонен считать мутоном группу из пяти нуклеотидов [13, 16, 17].
Однако после работ Фриза [20, 21], в которых исследовалось мутагенное действие аналогов пуриновых и пиримидиновых оснований для области r II, стало казаться более вероятным, что мутоном является один нуклеотид; на это указывал предполагаемый механизм действия использованных мутагенов (замена нормального основания на аналог). Далее, мутации обычно были обратимыми (обратимых изменений следовало ждать скорее от повреждения одного нуклеотида, чем от группы нуклеотидов); и, наконец, кривая реверсии мутантов носила одноударный характер.
Данные ранних опытов Бензера о том, что точечные мутации занимают на генетической карте у фага Т4 участок определенной длины, не могли исключить предположения о соответствии мутона одному нуклеотиду. При тех способах, которые применял для определения длины мутона Бензер, могла быть найдена лишь наибольшая длина участков, пораженных мутацией, и то весьма приблизительно.
В исследованиях генетического кода области r II нашла подтверждение точка зрения на нуклеотид как на единицу мутации. В известной работе Крика и др. [22] было показано, что специфичность каждой аминокислоты определяется, вероятно, группой из трех лежащих рядом основании, выпадение, вставка или изменение хотя бы одного члена триплета ведет к нарушению белкового синтеза, т. е. к мутации.
Изучение точечных мутаций одного и того же гена проводилось, кроме фага, и на других микроорганизмах. Генетические карты в этом случае были не столь подробны; поэтому измерением мутона в рекомбинационных единицах с последующим перерасчетом на нуклеотиды здесь не занимались.
У салмонелл единицы, в какой-то мере похожие на мутон, в работах школы Демереца носят название "site" [23]. Число таких рекомбинирующихся между собой участков в гене было невелико (около десяти). Не совсем понятно, чем можно объяснить столь малое количество; может быть, это следствие сравнительно малого числа мутантов каждого гена, исследованного у салмонелл. Мутации, затрагивающие один такой участок, были обратимы. Поражение разных участков в одном гене у салмонелл давало фенотипически одинаковую реакцию - "прекращение синтеза определенного фермента.
У нейроспоры анализ расположения точечных мутаций внутри функциональных субъединиц гена был проведен Чайзом и Джилсом [24] на одном из генов, контролирующих синтез пантотеновой кислоты. Значительное расстояние между этими мутациями (судя по низкой частоте рекомбинаций) подчеркивало сходство с мутоном фага. Относительно обратимости этих мутаций сведений не было.
Таким образом, при картировании точечных мутаций у бактерий и грибов было выяснено, что некоторые из этих мутаций лежат очень близко друг к другу. Участок, в котором происходила точечная мутация, напоминал мутон фага Т4. Можно было допустить, что этот участок соответствовал нуклеотиду. Данные, полученные в опытах на микроорганизмах в работах по изучению мутаций, вызванных аналогами оснований и азотистой кислотой, подтвердили это.
Многочисленные исследования с аналогами оснований проводились преимущественно на салмонеллах [25-28]. У бактерий, как и у фагов, мутации возникали, очевидно, в результате замены нормального основания на аналог. И механизм действия этих мутагенов, и обратимость мутаций позволили думать, что для мутации достаточно изменения одного нуклеотида.
С этой группой работ можно сопоставить опыты с применением 5-фторурацила (5-ФУ) и 8-азагуанина, которые проводились за последнее время на фагах и на нейроспоре [29, 30]. При добавлении 5-ФУ (аналога урацила, входящего в состав измененной м-РНК мутантов) развитие мутантов происходило по дикому типу. Эффект был фенотипическим и исчезал при удалении 5-ФУ. Результаты истолковывались как следствие замены в молекуле м-РНК урацила на 5-ФУ ("работающего" как цитозин - нормальный компонент м-РНК). Поскольку последовательность оснований в м-РНК соответствует их последовательности в ДНК, действие 5-ФУ может быть приравнено к замене одного нуклеотида в ДНК.
Наиболее четким доказательством того, что изменение лишь одного нуклеотида меняет генотип, следует считать результаты опытов по мутагенезу у вируса табачной мозаики (ВТМ) [31-34]. Несколько раньше было показано, что РНК ряда растительных и животных вирусов, искусственно отделенная от белка, все же способна заражать хозяина. В опытах Гирера и Мандри [31, 32] очищенная РНК ВТМ обрабатывалась раствором азотистой кислоты. Затем такой РНК заражалось растение. После инкубационного периода на листьях появлялись пятна - колонии вируса; среди них были и мутантные, отличавшиеся по величине и форме. Судя по количественным отношениям между азотистой кислотой и РНК, для каждой мутации было достаточно изменения лишь одного нуклеотида. Вероятно, вследствие дезаминирования аденин превращался в гипоксантан, гуанин - в ксантин и цитозин - в урацил.
Сходные результаты были получены Каудевицем [35] при испытании действия азотистой кислоты на бактерии. Одноударность кинетики мутагенеза указывала на то, что для мутации достаточно одной реакции на клетку, скорее всего - дезаминирования одного азотистого основания.
3) Единица функции
Третьей генетической единицей, которую выделил Бензер, была единица функции - цистрон. Дать полное определение этому термину трудно, так как во многих отношениях это синоним гена. Цистроном можно назвать наименьший участок хромосомы, целиком отвечающий за развитие определенного признака, т. е. функционально единый. Поэтому цистрон часто называют единицей функции. Если же исходить из поведения цистрона в цис-транс-тесте, то можно сказать, что это участок хромосомы, еще проявляющий в гетерозиготе свойство комплементарности по отношению к другим таким же участкам. Может быть, правильнее было бы придерживаться старой номенклатуры Серебровского, называя цистрон трансгеном (это подчеркивает его подчиненное положение по отношению к собственно гену - базигену). Однако термин Бензера уже получил широкое распространение.
Основанием для выделения такой категории единиц, как цистрон, послужили следующие опыты [13, 16]. Если штамм К кишечной палочки заражался двумя мутантами r II с поражением в разных участках хромосомы (что было заранее известно Б результате картирования этих мутантов), то при совместной инфекции, как и при заражении одним из этих мутантов, развитие фагов в бактерии не проходило до конца и лизиса не наступало. Однако при некоторых комбинациях мутантов лизис все же происходил. Вся обширная группа мутантов r II делилась по результатам смешанной инфекции на две подгруппы. Любая пара мутантов из одной и той же подгруппы при одновременном заражении бактерии не лизировала ее; напротив, при заражении мутантами из разных подгрупп, происходил лизис. На хромосомных картах было видно, что обе подгруппы мутантов делят между собой область r II на два не заходящих друг за друга участка (рис. 4).
Рис. 4. Комплементарные единицы области r II. На схеме I цифрами обозначены несколько мутаций, лежащих на карте в области r II. По результатам совместного заражения бактерии их можно разбить на группы А и Б. Два разных мутанта из одной и той же группы (например, мутанты 205 и 320, схема II) не могут совместно лизировать бактериальную клетку. Два мутанта из разных подгрупп (например, мутанты 205 и 163) лизируют ее
Способ, благодаря которому были выделены эти два участка, соответствовал цис-транс-тесту. Это будет понятнее, если провести детальную аналогию. Гетерозиготой в данном случае служила бактериальная клетка, зараженная фагами; хромосомы фагов соответствовали хромосомам такой гетерозиготы. Лизис клетки был равносилен проявлению дикого генотипа, т. е. нормальной функции гетерозиготы. Появление дикого фенотипа при объединении двух фенотипически одинаковых мутантов могло указывать лишь на то, что область содержит две комплементарные единицы со сходной функцией. Однако провести дальнейшее подразделение таких единиц на более мелкие взаимодополняющие участки уже не удалось; совместное заражение бактерии фагами с мутациями в гомологических участках области r II давало мутантный, а не дикий фенотип. Это соответствовало поведению аллелей в транс-положении.
На основании того, что обе взаимодополняющие единицы области r II уже не содержат внутри себя комплементарных участков (отличаясь тем самым от области r II в целом), Бензер выделил их в категорию особых единиц - цистронов. Употребление термина "ген" тем самым ограничивалось, но термин не уничтожался; геном мог быть назван комплекс цистронов, объединенных одной и той же функцией (в данном случае ген r II содержал два цистрона - А и Б). Таким образом, в иерархии генетических единиц Бензера ген становился функциональной единицей, но более сложной, чем цистрон. Подразумевалось, что ген должен объединить не менее двух комплементарных единиц. В противном случае между геном и цистроном теряется всякое различие.
Для объяснения отношений между цистронами в пределах гена Бензер предложил в тех же работах следующую схему их деятельности: конечным продуктом гена является белок; конечным продуктом цистрона является субъединица белковой молекулы - полипептид; полипептидная цепь с начала до конца синтезируется под контролем одного и того же цистрона и сходит с него в виде готового "полуфабриката". Этим объясняется отсутствие внутри цистрона комплементарных участков. Однако "сборка" обеих полипептидных цепей гена r II происходит уже вне хромосомы; здесь возможно объединение цепей, образованных на разных цистронах, в одну белковую молекулу. Это делает понятным механизм взаимодополнения цистронов в цис-транс-тесте.
Схема Бензера, очень похожая на схему Льюиса, пока не имеет непосредственных экспериментальных доказательств; нет прямых данных о том, что под контролем цистрона образуется именно полипептидная молекула. Теперь стало очевидным, что между хромосомой и синтезирующимся белком лежит менее прямой и короткий путь, чем это предполагалось во время опубликования первых работ Бензера. Однако некоторые положения этой схемы были впоследствии развиты и конкретизированы.
Так, одним из выводов работы Крика и др. [22] было заключение, что считывание генетической информации (иными словами, образование первичного продукта цистрона, по-видимому м-РНК) начинается с определенной точки в начале цистрона и идет в одном и том же направлении, прерываясь лишь на границе другого цистрона. Основанием для такого вывода послужили следующие данные.
Обработка фагов акридинами вызывает в области r II мутации, равносильные, как считается, выпадениям или вставкам нуклеотидов в цистроне (в данном случае изучался цистрон Б). Мутации были хорошо выраженными, не растекающимися, т. е. функция цистрона утрачивалась полностью. При повторной обработке акридинами могли возникнуть другие мутации (мутации-супрессоры), в результате чего частично восстанавливался нормальный фенотип. Восстановление функции цистрона происходило лишь в том случае, когда мутация-супрессор появлялась недалеко от места первой мутации (что могло быть обнаружено при нанесении этих мутаций на генетическую карту).
Эти данные были истолкованы следующим образом. У мутантов со вставкой или нехваткой одного основания считывание генетической информации шло правильно до места мутации и затем, на протяжении всего цистрона ниже этого места, искажалось. Таким образом, на значительной части цистрона образовывался измененный продукт, и фаг обладал ясно выраженным мутантным фенотипом. Если же у такого мутанта (допустим, с нехваткой нуклеотида) возникла еще одна мутация (вставка лишнего нуклеотида немного ниже места первой мутации), то считывание информации менялось уже не на всем цистроне ниже места первой мутации, а лишь на промежутке между первой и второй мутациями (поскольку вставка нуклеотида исправляла нарушенный первой мутацией порядок оснований). Ниже этого места считывание вновь становилось правильным, и если промежуток был невелик, то цистрон вновь функционировал по дикому типу. Если же вторая мутация возникала на противоположном конце цистрона, то промежуток между ней и первой мутацией занимал почти весь цистрон; участок, работающий неправильно, был слишком велик, и мутантный фенотип сохранялся.
Такое объяснение предполагало, что считывание генетической информации совершается с определенной начальной точки и в одном направлении. Этот вывод подтвердили данные, полученные при изучении мутанта с выпадением пограничной области между обоими цистронами, так называемый мутант r II 1589 [36]. Если не было каких-либо дополнительных мутаций, он обладал нормальным фенотипом. По-видимому, в данном случае правая и левая границы делений проходили не внутри триплетов оснований, а между ними. Тем самым порядок оснований справа от делеции не был нарушен (вероятность столь удачного расположения делеции для триплетного кода довольно велика). Обычно мутации одного цистрона не влияют на функцию другого. Этот же мутант был замечателен тем, что последующие мутации цистрона А здесь меняли функцию и цистрона Б. Очевидно, при делеции выпадал генетически инертный участок, разъединяющий цистроны и у нормального фага не пропускающий "волну информации" из цистрона А в цистрон Б. Возможно, что в результате деятельности обоих цистронов мутанта r II 1589 образуется сразу одна неразобщенная цепочка белка с небольшим нарушением в том месте, где ранее сходились концы полипептидных цепочек.
Недавно были получены еще три мутанта с выпадением пограничной области между цистронами [37]. Функция цистрона Б у этих мутантов выпадала; однако акридиновые мутации-супрессоры, локализованные в цистроне А, восстанавливали ее.
Важен вопрос о том, насколько могут мутации, возникшие вследствие изменения лишь одного мутона, изменять продукцию цистронов фага. К сожалению, признак r II относится к числу морфологических, соответствующий белок не выделен и нельзя изучить его аминокислотный состав. Однако можно думать, что этот белок при замене небольшого числа аминокислот утрачивает свои функции лишь частично. В той же работе Крика и соавторов отмечалось, что мутанты, полученные под действием аналогов азотистых оснований (т. е., вероятно, с заменой одного нуклеотида, что приводило к неправильному чтению одного триплета и изменению одной аминокислоты), обычно в какой-то мере сохраняют функцию поврежденного цистрона. Более того, в цитированной работе Дрейка [37] цистрон Б с выпадением участка в 1/3-1/5 всей его длины еще сохранял нормальную функцию. Мутации же, полученные после обработки акридиновыми красителями (когда вследствие выпадения или вставки одного основания менялся весь порядок считывания ниже места мутации, и, следовательно, - вся последовательность аминокислот) почти всегда приводили к полной утрате функций цистрона.
Данные, полученные при изучении функциональных единиц у бактерий и грибов, дополнили сведения о деятельности цистрона. Средством для обнаружения подобных единиц у этих микроорганизмов, как и у фага, был цис-транс-тест. При изучении мутаций здесь имелась возможность судить о них не только по изменению морфологического признака, но и исследовать биохимию этих изменений, иногда - изучать изменения в строении молекул отдельных ферментов.
У саломонелл делимость генов на функциональные единицы, дополняющие друг друга в гетерозиготе, удалось выявить с помощью абортивной трансдукции. Во многих работах Демереца и других исследователей была раскрыта последовательность генов, контролирующих отдельные ферменты в цепи биосинтеза тистидина и триптофана [38-40] (подробнее о блоках синтеза аминокислот см. ниже). Исследования включали выделение и идентификацию ферментов. В этих работах выяснилось, что почти все исследованные гены состояли из нескольких комплементарных участков. Например, в цепи биосинтеза гистидина ген дегидрогеназы, катализирующий переход имидазолглицеринового эфира фосфорной кислоты в имидазолацетолевый эфир фосфорной кислоты, содержал четыре таких участка; ген, контролирующий превращение l-гистидинолового эфира фосфорной кислоты в l-гистидинол, - два участка. Любопытно, что комплементарность сохранялась и в опытах in vitro; бесклеточные экстракты двух мутантов с мутациями в соседних цистронах, порознь не обладавшие ферментативной активностью, при смешивании частично восстанавливали эту активность [41].
У пневмококков при изучении трансформации также была показана делимость локусов устойчивости к сульфонамидам и локуса, управляющего образованием полисахаридной капсулы [42, 43]. С помощью ДНК от одного малоустойчивого штамма удалось трансформировать другому, столь же малоустойчивому штамму, высокую степень устойчивости. У штамма, исследованного Хочкисом, в локусе устойчивости находились три участка со сходными функциями.
У нейроспоры для выделения функциональных единиц пользовались гетерокарионтами. Делимость генов на такие единицы была найдена в целом ряде случаев: у генов, контролирующих синтез триптофансинтазы [44], аденилосукциназы [45], дегидрогеназы глутаминовой кислоты [46], а также генов, участвующих в синтезе аденина [47], пантотеновой кислоты [24], изолейцина, валина [48] и аргинина [49]. Число функциональных единиц в гене было очень различным - от двух до десяти.
Сходное строение имеют и гены других грибов-аспергиллов [50].
Комплексные локусы с комплементарными друг другу участками были обнаружены также у дрожжей, на примере генов, контролирующих биосинтез аденина [51, 52].
Как уже говорилось, само выделение такой единицы, как цистрон, обязано отношениям комплементарности (межцистронная комплементарность). Следует упомянуть и о так называемой внутрицистронной комплементарности, наблюдающейся у бактерий и грибов. При объединении двух цистронов в транс-положении в гетерозиготе in vivo или смешивании соответствующих экстрактов in vitro происходит почти полное восстановление активности данного фермента. Некоторое, очень незначительное восстановление иногда наблюдается и при объединении разных мутантов одного и того же цистрона (от долей процента до нескольких процентов). При этом не все точки цистрона комплементарны друг другу. Механизм явления, видимо, отличается от механизма межцистронной комплементарности [53]. Очень большая разница в восстановленной активности фермента позволяет четко различить оба вида комплементарности; иначе пришлось бы вообще отказаться от выделения комплементарных единиц гена. В дальнейшем мы будем иметь в виду лишь межцистронную комплементарность.
Поражение у бактерий, грибов и фагов цистрона в разных его участках дает на первый взгляд фенотипически одинаковый результат - выпадение той или иной реакции, катализируемой определенным ферментом, со всеми последствиями этого. Однако представление о таком механизме работы цистрона по принципу "все или ничего" - лишь следствие особенностей учета результатов. Инактивации деятельности цистрона в результате мутации не наступает - образуется лишь более или менее "подпорченный" полипептид. Выше уже говорилось о различной "растекаемости" мутантов фага с поражением одного и того же цистрона в разных участках, о внешне нормальном функционировании цистрона, несмотря на делению, т. е. о различной фенотипической выраженности мутации. У бактерий и грибов оказалось возможным пойти дальше - не ограничиться характеристикой степени выраженности признака, а изучить особенности фермента, измененного благодаря мутации. Особенно подробно был изучен фермент триптофансинтетаза, как у нейроспоры, так и у кишечной палочки [54-56]. Этот сложный фермент катализирует превращение индолглицеролфосфата в индол, а индола (вследствие реакции с серином) - в триптофан.
Оказалось, что у мутантов, лишенных ферментативной активности, продолжает синтезироваться белок, серологически похожий на фермент; у этого белка, однако, тю сравнению с триптофансинтетазой были изменены некоторые физико-химические показатели, например константы тепловой денатурации и электрофоретической подвижности.
Другим ферментом, генетически хорошо изученным, является щелочная фосфатаза кишечной палочки [57, 58]. Здесь у мутантов также наблюдается синтез белка, похожего на щелочную фосфотазу, но имевшего небольшие серологические и физико-химические отличия. Интересно, что у некоторых ревертантов, обладающих ферментативной активностью, белок все же имел необычное строение [57-59]. Это свидетельствует о том, что на измененном цистроне мог синтезироваться фермент несколько иного строения, но сохраняющий в целом нормальную функцию.
* * *
Выше мы определили цистрон как наименьшую функциональную единицу, неделимую на дополняющие друг друга участки. Ген при этом становился комплексом нескольких цистронов, связанных общей функцией. Однако остается неясным, в какую категорию отнести локус хромосомы, контролирующий вполне определенный признак, но у которого делимость на дополняющие участки еще не обнаружена (или, может быть, вообще отсутствует).
Например, до сих пор не найдены комплементарные единицы внутри очень хорошо изученных сцепленных генов, контролирующих синтез трех разных ферментов у кишечной палочки - талактокиназы, галактозо-1-фосфат-уридил-трансферазы и галактозо-4-эпимеразы (эти ферменты превращают галактозу в глюкозо-1-фосфат). Сами гены комплементарны друг другу [60]. В этом случае между геном и цистроном нет никакой разницы.
4) Единица кодирования
Термин "кодон" был введен Криком. Кодоном можно назвать "группу оснований, кодирующих одну аминокислоту" [61]. Потребность в выделении такой единицы возникла лишь в последнее время, в связи с пристальным изучением механизмов генетической детерминированности белкового синтеза.
Кодон у фага Т4 содержит число оснований, кратное трем (вероятно, равное трем). Основным доказательством этого являются некоторые результаты работы Крика и др. [22]. Как уже говорилось выше, применяя акридин, у фага можно было получить мутации, рассматриваемые как вставки или выпадения одного основания. Если объединение двух мутаций в одном цистроне давало возврат к дикому фенотипу, то считалось, что это - мутация "разных знаков" (первая могла быть выпадением, а вторая - вставкой, или наоборот). Объединение двух мутаций-вставок или двух мутаций-выпадений дикого фенотипа не давало. Зато мутанты, содержащие три мутации одного и того же знака, были фенотипически дикими. Такой результат мог быть получен лишь в случае триплетного или кратного триплетному кода.
Нет никаких данных о том, отличается ли участок хромосомы "размером с триплет" какими-либо свойствами (кроме кодирования аминокислоты) от участков другого размера и строения; определение кодона исходит целиком из его функции. Как указывалось выше, внутри кодона возможен кроссинговер. По-видимому, кодон лучше относить не к генетическим, а к биохимическим понятиям.
4. Генетические блоки у микроорганизмов
До сих пор здесь рассматривались субгенетические единицы. Следует рассмотреть и генетические блоки, составляющие систему из нескольких генов. К сожалению, термин "цистрон" в последнее время стали употреблять слишком широко, часто вместо термина "ген" и именно применительно к таким системам. Поэтому здесь уместно коснуться этого вопроса. Кроме того, он имеет непосредственное отношение к тонкой организации генетического материала на уровне хромосомы.
Демерецем и его сотрудниками, а затем и другими исследователями были подробно изучены многочисленные мутанты "S. typhimuruim и кишечной палочки, нуждающиеся в гистидине и триптофане [62, 63]. Вначале казалось, что эти мутанты фенотипически одинаковы: все они не росли без добавления в среду указанных аминокислот. Затем, после картирования, выяснилось, что нарушения у бактерий занимают в хромосоме область, имеющую определенную длину. Мутации можно было разбить на несколько групп; каждая группа локализовалась в каком-то участке хромосомы. Далее, при биохимическом исследовании мутантов обнаружилось, что их фенотип также неодинаков. Все они не могли синтезировать гистидин или триптофан. Однако у каждой группы был нарушен синтез какого-то определенного фермента, благодаря чему синтез не доходил до конца.
Позже был обнаружен блок синтеза цистеина [64]. Интересно, что на хромосомной карте отдельные гены располагались в том самом порядке, в каком идут реакции при данном виде биосинтеза. Получалось нечто вроде конвейера, в котором каждое последующее вещество синтезировалось из предшественника рядом с местом возникновения последнего (рис. 5).
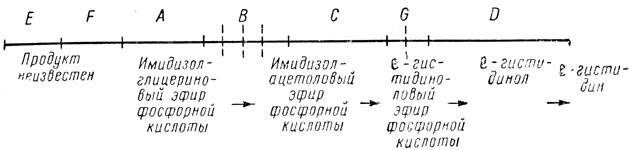
Рис. 5. Расположение генов в блоке синтеза гистидина у S. typhimurium. Буквами обозначены отдельные гены. Пунктиром показано деление гена В на четыре, а гена G - на два комплементарных участка
Такое расположение напоминало схему, предложенную Льюисом для объяснения отношений между локусами при псевдоаллелизме. Однако нет достаточных оснований считать всю область хромосомы, в целом ответственную за синтез аминокислоты, сложным геном, а соответствующие участки в ней - цистронами. Во-первых, фенотип мутантов каждого участка отличался от фенотипа мутантов другого участка: поражались совершенно разные ферментативные реакции. Во-вторых, участки были делимы: внутри каждого еще можно было выделить несколько комплементарных единиц. Таким образом, правильнее называть участки, отвечающие за синтез каждого фермента, генами, объединенными в обширный генетический блок.
Используя явление трансформации, блок синтеза триптофана удалось обнаружить и у сенной палочки [65]. Замечательно, что порядок расположения генов у этой грамположительной бациллы оказался таким же, как и у грамотрицательных бактерий кишечной группы. Вполне очевидно, что это расположение генов у бактерий не случайно; возможно, это связано с наиболее экономной регуляцией. Поэтому было бы чрезвычайно интересно обнаружить способ контролирования деятельности таких генетических блоков.
Уже давно известно о существовании так называемой ферментативной индукции, когда появление определенного вещества в питательной среде вызывает резкую активизацию синтеза соответствующего фермента, для которого это вещество является субстратом. Позже был открыт феномен подавления, репрессии, синтеза фермента продуктом данной ферментативной реакции [66]. Репрессия идет как при накоплении субстрата в клетке в результате жизнедеятельности, так и при добавлении субстрата в питательную среду. Подавляется синтез не только того фермента, который участвовал в возникновении данного вещества, но и всех ферментов, принимавших участие в образовании предшественников этого вещества.
Индукция и репрессия, возможно, являются одним из основных механизмов, регулирующих синтез ферментов в бактериальной клетке. Было заманчиво связать эти явления с особенностями пространственного расположения генов и создать общую теорию генетической регуляции синтеза ферментов у бактерий. Такая теория и была создана Жакобом и Моно.
Основанием для теории генетической регуляции Жакоба - Моно послужили наблюдения, сделанные на некоторых мутантах кишечной палочки [11]. Изучались мутанты с нарушениями метаболизма лактозы. Усвоение лактозы связано с деятельностью по крайней мере двух ферментов - галактозидпермеазы и β-галактозидазы. Первый из них регулирует поступление галактозидов в клетку, второй - их расщепление. Мутанты, у которых нарушен синтез этих ферментов, не могут расти на средах, содержащих лактозу в качестве единственного источника углерода. Соответствующие мутации располагались рядом, в области lac. Таким образом, гены обоих ферментов тесно сцеплены, хотя выпадение функции одного из этих генов не связано с выпадением функции другого.
Помимо мутаций, приводящих к нарушению структуры синтезируемого белка-фермента, существовали и другие мутации, также влияющие на деятельность этой генетической области.
β-Галактозидаза является адаптивным ферментом; однако существуют мутанты, у которых она синтезируется по конститутивному типу, т. е. все время, независимо от присутствия субстрата - β-галактозида.
В свою очередь, эти мутанты делились на две группы. Первая из них характеризовалась следующими признаками: 1) место мутации было удалено от области lac; 2) в гетерозиготе мутация была рецессивной (т. е. гетерозигота функционировала по адаптивному типу) и 3) действие мутаций было плейотропным (оба фермента области lac начинали синтезироваться по конститутивному типу).
Признаки конститутивных мутантов другой группы были иными: 1) мутация была сцеплена с областью lac; 2) в гетерозиготе мутация была доминантной (т. е. гетерозигота функционировала по дикому типу) и 3) действие мутации также было плейотропным (как и у предшествующей группы).
Жакоб и Моно объяснили эти факты следующим образом. Существуют по крайней мере три различных рода генов: структурные гены, гены-регуляторы и гены-операторы. Деятельность структурного гена в конечном счете приводит к синтезу определенного белка-фермента; у бактерий эти гены расположены "гуськом" (например, гены области lac; гены блоков биосинтеза аминокислот). Вследствие мутации структурного гена образуется белок измененного состава (например, так называемые белки CRM, образующиеся вместо ферментов β-галактозидазы и щелочной фосфатазы у соответствующих мутантов). Ген-регулятор образует продукт-репрессор, подавляющий деятельность структурных генов в отсутствие субстрата (существование такого продукта предполагалось и в прежних теориях, объясняющих механизм индуцированного синтеза ферментов). В присутствии субстрата репрессор временно инактивируется, и структурные гены, освобожденные от его контроля, начинают функционировать; образуется фермент. Удаленность гена-регулятора от структурных генов указывает на то, что репрессор - растворимый, выходящий в цитоплазму продукт. Это подтверждается также тем, что мутации гена-регулятора в гетерозиготах были рецессивны (растворимый репрессор неизмененного гена-регулятора мог "обслуживать" структурные гены обеих хромосом).
Ген-оператор служит посредником между геном-регулятором и всей группой структурных генов. На это указывает плейотропность мутаций как гена-регулятора, так и гена-оператора. Сигналом для действия гена-оператора ("выключающего" деятельность структурных генов) является поступление в цитоплазму активной формы репрессора. Механизм выключения оператором структурных генов неизвестен; можно лишь сказать, что он не связан с образованием цитоплазматического растворимого продукта (в гетерозиготе мутация гена-оператора доминантна; это значит что, неизмененный оператор не мог действовать на структурные гены, находящиеся на другой хромосоме). Оператор расположен рядом со структурными генами; по-видимому, для его действия на эти гены нужен непосредственный контакт. Участок хромосомы, объединяющий оператор и структурные гены, Жакоб и Моно предложили назвать опероном (рис. 6).
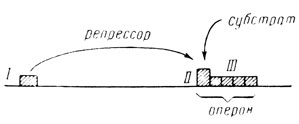
Рис. 6. Схема генетической регуляции Жакоба - Моно: I - ген-регулятор; II - ген-оператор; III - структурные гены
Схема генетической регуляции Жакоба - Моно получила в настоящее время широкое распространение. Ведутся интенсивные исследования биохимического механизма действия генов-регуляторов и операторов; однако обсуждение этих работ не входит в задачу настоящей главы. Здесь лишь хотелось заметить, что функциональная связь между различными участками наследственного материала, давно отмеченная генетиками, получает в настоящее время рациональное объяснение и "биохимическое воплощение".
5. Универсальность понятий о тонкой структуре гена
Быстрое увеличение числа новых терминов и понятий, - несомненно, не самый главный критерий успешности развития какой-либо отрасли науки. Однако рост любой дисциплины обычно сопровождается внедрением новой терминологии. Если судить только по этому признаку, то генетика микроорганизмов внесла крупный вклад в изучение строения и взаимосвязи генетических единиц: за последние 7-8 лет появились такие термины, как рекон, мутон, кодон, цистрон, оперон.
В связи с обилием новых понятий вспоминаются слова Оккама: "Essentia non sunt multiplicanda praeter necessitatem" (не следует умножать сущностей без необходимости). Эти понятия было необходимо ввести по крайней мере на определенном этапе развития генетики. Однако сейчас, вследствие дальнейшей "биохимизации" этой науки, некоторые из генетических терминов стали синонимами биохимических и, наверное, будут ими вытеснены. Так, термин "мутон" может быть заменен словом "нуклеотид", за которым стоят конкретные биохимические представления. "Рекон", вероятно, соответствует расстоянию между двумя нуклеотидами. Не ясно, как будут сосуществовать термины для функциональных единиц - "ген" и "цистрон". Уже сейчас у разных авторов можно встретить оба эти наименования применительно к одним и тем же участкам на генетической карте. В дальнейшем, по всей видимости, та путаница усугубится. Мы придерживались в предыдущих разделах терхминологии Бензера, подразумевая, что разница здесь скорее количественная, чем качественная: ген - это сложный цистрон, цистрон - простой ген. Может быть, теперь следует снова вернуться к добензеровским терминам и говорить в случае функциональных единиц не о цистроне и гене, а о простом и комплексном гене. Термин "ген" имеет большую историю, более привычен и нет оснований подменять его термином "цистрон".
Более существен другой вопрос: в какой мере сведения, полученные в опытах на микроорганизмах, применимы к высшим животным и растениям?
Нет необходимости повторять, что у всех живых существ, кроме некоторых вирусов, хранилищем генетической информации является ДНК. Основные этапы синтеза белка, вероятно, также сходны для многоклеточных и одноклеточных организмов. Менее ясно, одинаково ли совершается процесс генетической рекомбинации во всем мире живых существ.
Значительная часть гипотез о тонкой структуре гена у микроорганизмов основана на предположении, что рекомбинации у них не отличаются от рекомбинаций вследствие кроссинговера, происходящих за счет разрывов и воссоединения хромосом. Такой механизм, существующий у многоклеточных, трудно представить себе в случае, когда взаимодействуют целый геном и очень незначительная часть другого генома (т. е. при трансдукции и трансформации). Здесь кажется более уместной гипотеза "выбора копии". Согласно этой гипотезе комбинированная хромосома образуется за счет синтеза отдельных участков этой хромосомы, которые копируют соответствующие участки исходных хромосом обоих партнеров; хромосома-копия "перекидывается" с одной матрицы на другую. Однако точных данных о том, как совершается рекомбинация у микроорганизмов, нет [67].
Может быть поставлен вопрос, имеют ли все сделанные построения о величине генетических единиц универсальное значение, если рекомбинация у микроорганизмов идет иначе, чем у многоклеточных. Однако, если "перекидывание" носит статистически случайный характер, то основной принцип построения генетических карт не нарушается.
Об универсальности данных, полученных за последние 10 лет, свидетельствуют и соображения общего порядка. Сходство в строении генетического материала микроорганизмов не вызывает особого удивления. Аналогии между генетикой фага и нейроспоры не кажутся сомнительными, так как оба организма - "микробы". Между тем фаг похож на нейроспору немногим больше, чем на дрозофилу. Если позволительно сближать в этом смысле фаг и нейроспору, то отчего бы не делать этого в отношении фага и дрозофилы?
Рассмотрим, насколько применимы представления о тонком строении гена, полученные в опытах на микроорганизмах, к высшим организмам.
1) Единица рекомбинации
По техническим причинам у многоклеточных значительно труднее изучить нижние пределы делимости гена при рекомбинации, чем у микроорганизмов. Весьма возможно, что у последних кроссинговер может идти между двумя любыми нуклеотидами. В опытах на многоклеточных организмах получены другие данные. Расчеты, проведенные на дрозофиле, показали, что расстояние между рекомбинирующимися точками равно по меньшей мере 200 парам нуклеотидов [18]. В другой работе [68] наименьшее расстояние между двумя мутациями rosy у дрозофилы было не меньше 40 пар нуклеотидов. Трудно сказать, являются ли такие большие цифры следствием недостаточного числа скрещиваний, или у высших организмов участки хромосомы величиной в один или несколько нуклеотидов вообще не могут рекомбинироваться из-за каких-то особенностей строения.
Вопрос о величине рекона у многоклеточных остается открытым.
2) Единица мутации
У микроорганизмов точно установлено, что для мутации достаточно изменения лишь одного нуклеотида. Вероятно, это можно отнести и к высшим организмам. Уотсон и Крик в первых же публикациях своей теории строения молекулы ДНК допускали, в частности, возможность мутации при переходе азотистого основания из одного таутомерного состояния в другое. Ингрем [69] установил, что мутация серповидноклеточной анемии у человека обусловлена изменением всего лишь одной аминокислоты в молекуле гемоглобина. Поскольку простота изменения "отпечатка" предполагает и простоту изменения матрицы, то отсюда (еще до основных работ по аминокислотному коду) был сделан вывод о том, что данная мутация вызвана изменением одного или немногих нуклеотидов. Все результаты последних лет, полученные при изучении генетического кодирования, подтверждают этот вывод (вернее, нет никаких причин отвергать его).
3) Единица функции и надгенетические структуры. Единица кодирования
Делимость гена, локализация генов со сходными функциями в одном участке хромосомы и их взаимосвязь были известны у высших организмов значительно раньше начала работ по генетике микроорганизмов. Об эффекте положения, явлениях множественного аллеломорфизма и псевдоаллелизма говорилось выше. Примеры функциональной делимости генов у многоклеточных далеко не единичны. Явление псевдоаллелизма, например, известно, кроме дрозофилы, у кукурузы [70], хлопчатника [71, 72], тутового шелкопряда [73], мышей [74] и человека (генетика групп крови [75, 76]). Число ссылок на работы по псевдоаллелизму у многоклеточных, особенно у дрозофилы, можно было бы значительно умножить. Известно также много случаев, когда гены, влияющие на один и тот же признак, находятся в группе сцепления недалеко друг от друга. Возможно, некоторые из них являются псевдоаллелями, или связаны еще какими-то функциональными отношениями. Например, очень сложна и, несомненно, взаимосвязана система генов, влияющих на появление некоторых пигментов у кукурузы [77, 78]. Параллели между всеми этими данными и относительно хорошо разработанной схемой тонкого строения гена у микроорганизмов, конечно, возможны и многообещающи. Так, очень любопытным является предположение об аналогии между мутациями фага Т4 и выпадением межцистронных участков одной из мутаций человека, приводящей к появлению измененного гемоглобина (так называемого гемоглобина Lepore [79]). У данного гемоглобина полипептидные цепочки β и δ объединены в одну "гибридную". Возможно, что это объясняется выпадением пограничной области между двумя цистронами, контролирующими синтез полипептидов.
Совместное расположение генов, контролирующих синтез какой-либо аминокислоты у многоклеточных, пока не обнаружено. Может быть, расположение в виде звеньев цепочки, хотя и удобно для регуляции, но более уязвимо для всякого рода транслокаций, влекущих за собой эффект положения. С другой стороны, совместное расположение некоторых генов у дрозофилы можно было бы хорошо объяснить общностью цепи химических реакций, хотя эти реакции еще совершенно неизвестны.
Любопытно, применима ли к генетической системе высших организмов схема генетической регуляции Жакоба - Мано. Поскольку и у многоклеточных известно существование индуцируемых ферментов, то такая регуляция здесь не исключена. Жакоб и Вольман допускают, что у высших организмов операторами могут быть снабжены не цепочки генов, а каждый ген в отдельности.
Переходя к вопросу о количестве нуклеотидов в кодоне высших организмов, следует сказать, что поскольку нет способов для определения их числа, то здесь отсутствуют прямые экспериментальные данные. Если код действительно универсален, то число нуклеотидов в кодоне должно равняться трем.
Литература

|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'