
Глава III. Химический мутагенез (В. Г. Никифоров)
1. Введение
Если в природе происходит какое-либо интересное и важное явление, то человек редко удовлетворяется исследованием этого явления путем простого наблюдения. Рано или поздно наступает этап, на котором исследователь с помощью различных внешних воздействий пытается вмешаться в естественный ход событий, вызвав интересующее его явление искусственно. На первых порах ему бывает достаточно хотя бы как-нибудь повлиять на изучаемое явление, и внешние воздействия, применяемые исследователем, играют лишь роль метода исследования. Вмешиваясь в ход естественных процессов, человек всегда стремится не просто изучить их, но и научиться влиять на них в нужную для него сторону. Этим вызвано стремление найти такие внешние воздействия, применение которых являлось бы не только эффективным методом исследования, но и методом управления изучаемым явлением.
Именно по такому пути развивалось и развивается изучение мутаций. После того как было обнаружено, что стабильные единицы наследственности - гены способны изредка изменяться (мутировать), предпринимались многочисленные попытки вмешаться в этот процесс, т. е. искусственно индуцировать мутации. Впервые это удалось сделать с помощью рентгеновых лучей. Таким образом, генетики получили в свои руки мощный метод воздействия на генетическое вещество, а следовательно, и метод его исследования. Этот метод долгое время оставался единственным, так как, несмотря на неоднократные попытки, не удавалось индуцировать мутации химическими веществами. Под влиянием этого обстоятельства в 30-е годы генетическому веществу приписывали совершенно удивительную устойчивость. Тогда казалось, что оно может изменяться только под действием больших квантов энергии, вызывающих ионизацию. Однако в то же время в работах В. В. Сахарова [1] были получены первые положительные результаты по химическому мутагенезу. Сахаров индуцировал мутации у плодовой мушки, воздействуя на нее йодом. Затем в 1943 г. Олкерс нашел, что уретан (+КСl) вызывает разрывы хромосом в клетках растений [2]. В 1946 г. появилась работа Ауэрбах и Робсона [3], в которой сообщалось о мутагенном действии горчичного газа на плодовую мушку. В том же году Рапопорт индуцировал мутации у плодовой мушки с помощью формальдегида [4].
С тех пор было обнаружено много других химических мутагенов, количество которых увеличивается с каждым годом. Многие из них по своей эффективности не уступают рентгеновым лучам (рис. 1). Оказалось, что способность индуцировать мутации не является привилегией какого-нибудь одного класса химических веществ. Среди мутагенов встречаются и простые вещества типа азотистой кислоты или формальдегида и сложные органические соединения, например аналоги азотистых оснований.
![Рис. 1. Мутагенная активность некоторых алкилирующих соединений в сравнении с рентгеновыми лучами [5]. Мутагенному воздействию подвергались постмейотические стадии сперматогенеза взрослых самцов плодовой мушки. Алкилирующие соединения вводились в семенники в количестве 1,5o10-2 М за исключением случаев, обозначенных на рисунке](pic/000027.jpg)
Рис. 1. Мутагенная активность некоторых алкилирующих соединений в сравнении с рентгеновыми лучами [5]. Мутагенному воздействию подвергались постмейотические стадии сперматогенеза взрослых самцов плодовой мушки. Алкилирующие соединения вводились в семенники в количестве 1,5⋅10-2 М за исключением случаев, обозначенных на рисунке
При виде такого хаотического разнообразия возникает предположение о том, что мутации можно индуцировать практически чем угодно. Если последовательно развить эту мысль, то следует считать, что наследственное вещество весьма нестойко и любое воздействие, как-то "будоражащее" клетку, может привести к изменению в наследственном веществе. Если мутация действительно является таким неспецифическим ответом на внешние воздействия, то мутагены представляют незначительный интерес как метод изучения механизма мутаций, и имеется мало оснований ожидать, что с их помощью можно будет научиться управлять процессом возникновения мутаций. Такой крайне пессимистический взгляд, по-видимому, неверен. Сейчас накапливается все больше данных, свидетельствующих о том, что между химическими свойствами мутагена и характером вызываемых им генетических изменений наблюдается определенная специфическая связь. Прежде чем перейти к обсуждению данных такого рода, мы кратко ознакомимся с типами мутаций и с химическими свойствами мутагенных веществ.
2. Классификация наследственных изменений
Мутации отличаются друг от друга как по характеру изменения наследственного материала, так и по последствиям этих изменений, т. е. по характеру изменения фенотипа. Различают следующие виды мутаций: изменение кариотипа, хромосомные аберрации и генные мутации.
Изменением кариотипа называют изменение числа хромосом в ядре (гаплоидность, полиплоидность, анеуплоидность).
Хромосомные аберрации подразделяются на:
Разрывы хромосом.
Нехватки, или делеции. В результате такой мутации теряется участок хромосомы.
Дупликации, приводящие к удвоению участка хромосомы.
Инверсии. При инверсии участок хромосомы меняет свою ориентацию. Предполагается, что инверсия наступает после двух разрывов одной хромосомы, когда внутренний участок хромосомы разворачивается на 180° и разрывы воссоединяются.
Транслокации. При транслокации участки хромосом обмениваются местами. Такой обмен может произойти в результате контакта двух гомологичных или негомологичных хромосом, при котором возникают разрывы, после чего разорванные концы хромосом соединяются по-новому.
Генные мутации. При изучении высших организмов было принято называть генными, или точечными мутациями изменения, локализованные в определенной точке хромосомы, но не приводящие к заметному изменению в ее структуре. По такому определению множество мутаций попадает в одну группу только на том основании, что разрешающая сила методов исследования не позволяет установить характер изменения генетического материала. Поэтому естественно ожидать, что данная группа будет очень неоднородной и в нее попадут различные типы мутаций. И действительно, там, где удается провести тонкий генетический анализ внутри гена, оказывается, что генные мутации, приводящие к одному и тому же фенотипическому признаку и затрагивающие один и тот же ген, могут заключаться в самых разнообразных изменениях этого гена. Поэтому нам кажется, что было бы полезным не отождествлять термины генная и точечная мутации. Мы будем называть генными мутациями любые изменения внутри гена. Ген представляет собой участок ДНК, в котором зашифрована в виде последовательности азотистых оснований наследственная информация. По такой модели генная мутация заключается в изменении последовательности этих оснований. Точечными мы будем называть только те генные мутации, при которых изменяется одна пара оснований гена.
3. Химические свойства мутагенных веществ
Можно выделить следующие группы мутагенов: ингибиторы предшественников нуклеиновых кислот; аналоги азотистых оснований, включающиеся в нуклеиновые кислоты; алкилирующие соединения; окислители, восстановители и свободные радикалы; акридиновые красители.
Это весьма приблизительная классификация, возможно, что она не очень удачно отражает общность и различия в механизме действия мутагенов.
1) Ингибиторы предшественников нуклеиновых кислот
Эта группа мутагенов последнее время привлекает к себе большой интерес в связи с тем, что, по современным взглядам, именно ДНК играет роль наследственного материала [6-20]. Интересны они и с другой стороны. Большинство известных мутагенов являются агрессивными веществами, которые могут взаимодействовать и вызывать изменения почти во всех компонентах клетки. В связи с этим очень трудно определить, какая или какие первичные реакции, из многих возможных, ответственны за наблюдаемый биологический эффект. Многие же ингибиторы предшественников нуклеиновых кислот в химическом отношении весьма инертны; являясь структурными аналогами естественных субстратов, они блокируют активный центр фермента и не дают ему осуществлять свою функцию [21]. Поэтому подобные ингибиторы (табл. 1) могут действовать лишь на ограниченное число реакций в клетке.

Таблица 1. Ингибиторы предшественников нуклеиновых кислот
Конечно, может быть и так, что нарушение хода лишь одной реакции будет иметь для клетки столь же далеко идущие последствия, как и изменение многих ее компонентов. Эти последствия могут быть запутанными, но в этой запутанной картине по крайней мере более ясно, какая именно причина вызвала цепь последствий.
Несмотря на большой интерес к этим мутагенам, о механизме их действия известно пока довольно мало. Считается, что в результате подавления синтеза предшественников происходят нарушения и в синтезе ДНК, которые приводят либо к изменению последовательности оснований, либо к нарушению целостности ДНК. Возможно, что подавление синтеза нормальных предшественников вызывает синтез необычных оснований, которые затем включаются в ДНК и тем самым вызывают мутации. Включение необычных оснований в ДНК было обнаружено у бактерий в условиях голодания по тимину. Этим необычным основанием оказался N-метиладенин [22].
Однако не все ингибиторы химически инертны. Так, сильный мутаген азасерин, который подавляет синтез пуринов, является в то же время алкилирующим агентом (21]. Уретан также подавляет синтез предшественников и является алкилирующим агентом. Было, однако, установлено, что в опухолях Уокера тимин (но не урацил) предотвращает развитие аномальных митозов, вызванных уретаном [23]. Поэтому можно предположить, что в этом случае именно угнетение синтеза предшественников, а не прямое алкилирование ДНК является причиной мутагенного действия уретана.
2) Аналоги азотистых оснований, включающиеся в нуклеиновые кислоты
К ним относятся галогенсодержащие аналоги тимина - 5-бром-, 5-хлор- и 5-иодурацил. Эти аналоги включаются в ДНК на места тимина. Включается в ДНК и мутагенен 2-аминопурин. Некоторые производные урацила включаются не в ДНК, а в РНК. Часть из них оказалась мутагенной для вируса табачной мозаики, в котором наследственная информация закодирована в РНК.
Лучше всего изучено мутагенное действие 5-бромурацила и 2-аминопурина. О предполагаемом механизме их действия см. ниже.
3) Алкилирующие соединения
К этому классу соединений относится большая часть известных в настоящее время мутагенов (табл. 2). По числу групп, способных вступать в реакцию алкилирования, различают моно-, би- и полифункциональные алкилирующие соединения. Реакция алкилирования заключается в том, что алкильная группа замещает водород, присоединенный к нуклеофильному, т. е. слегка отрицательно заряженному центру. Большинство биологически важных реакций алкилирования происходит путем присоединения алкильной группы через кислород, азот или серу. Роль алкильных групп могут играть разнообразные органические радикалы, например метил (СН3), этил (С2Н5) и т. д.
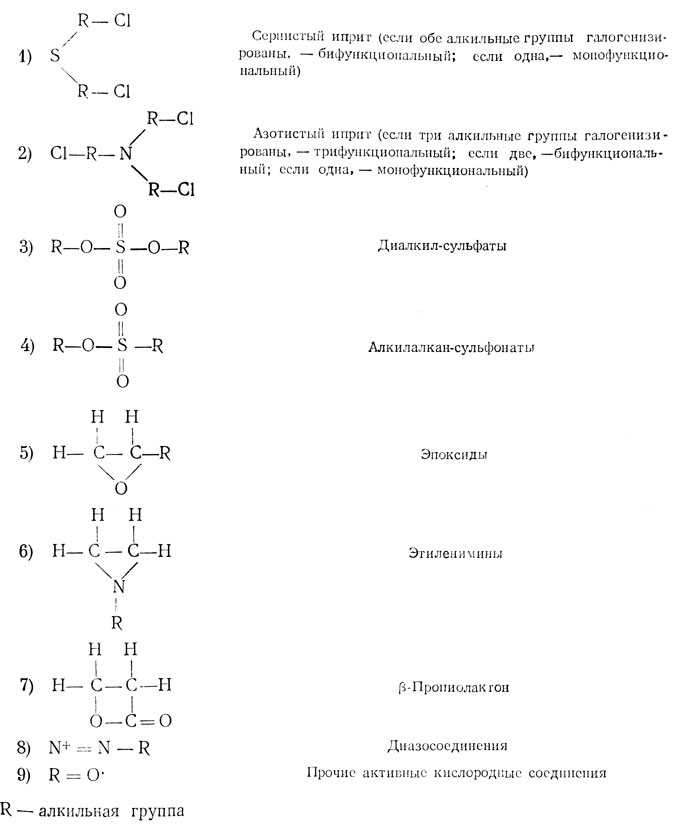
Типы алкилирующих соединений
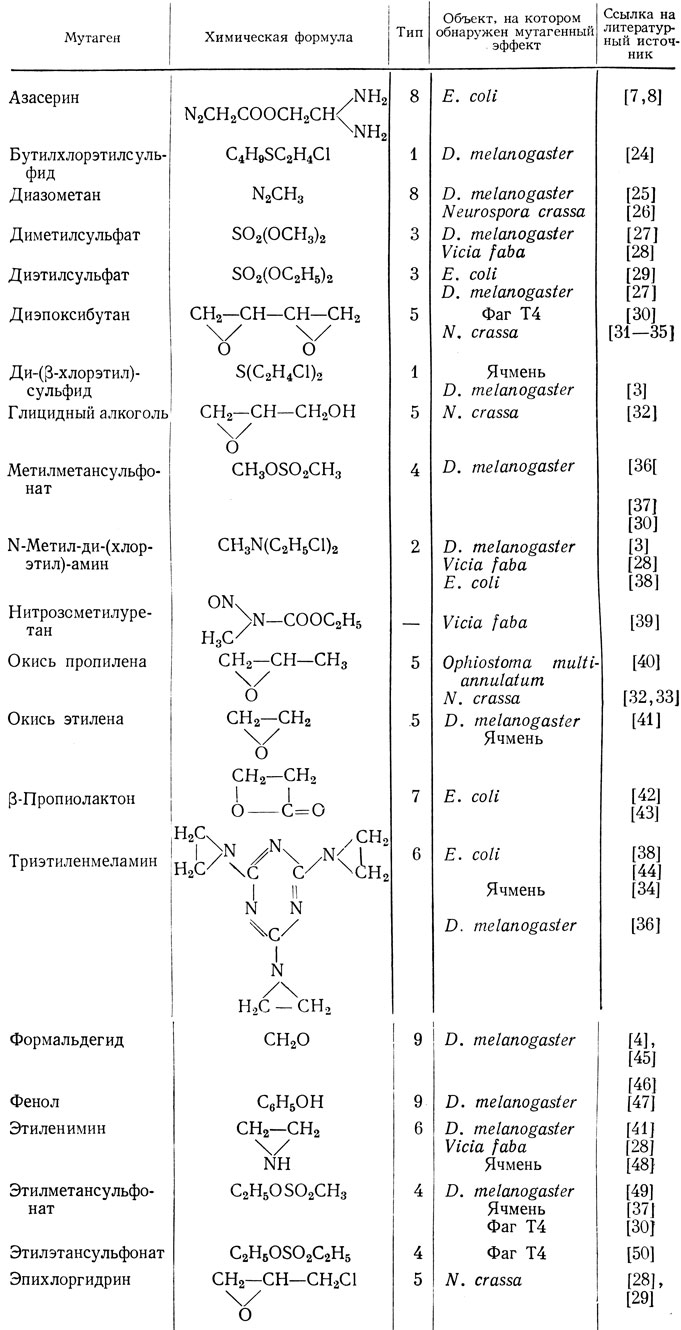
Таблица 2. Мутагенные алкилирующие соединения
Алкилирующие агенты реагируют со многими компонентами клетки, и в частности с белками, РНК и ДНК. Но и в этих веществах имеется много центров, которые могут быть алкилированы. Хорошей иллюстрацией многообразия эффектов алкилирования служит реакция с ДНК таких метилирующих и этилирующих агентов, как диметилсульфат, диэтилсульфат, метилметансульфонат (все они реагируют как монофункциональные агенты, даже если несут две алкильные группы). Эти агенты могут изменять ДНК по крайней мере пятью различными способами [20].
1. Наиболее активно алкилируются фосфатные группы. Образующийся при этом фосфатный триэстер нестабилен и обычно гидролизуется, освобождая свободную алкильную группу.
2. Фосфатный триэстер может иногда гидролизоваться между сахаром и фосфатом, в результате чего нить ДНК оказывается разорванной. Частота этого процесса в сравнении с освобождением свободной алкильной труппы неизвестна.
3. Алкилируются азотистые основания, главным образом гуанин. Возможно, что эта реакция протекает не прямо, а через трансалкилирование, когда алкильная группа переходит с фосфата на основание.
4. В результате алкилирования пуринов часто происходит гидролиз связи основания с сахаром, и пурин таким образом освобождается.
5. Депуринизация может привести к разрыву цепи ДНК, так как в отсутствие основания легче происходит гидролиз сахарофосфатной связи.
Укажем еще на одну реакцию алкилирующих соединений с ДНК. При обработке ДНК in vitro бифункциональными агентами происходит резкое уменьшение вязкости раствора. Это вызвано не разрывом молекул, как думали вначале, а тем, что бифункциональные агенты вызывают сшивки молекул ДНК между собой. Монофункциональные агенты не вызывают образования сшивок. Сшивание молекул ДНК было обнаружено и в клетках: в спермиях сельди, семги и лосося, а также в бактериях [51]. Этой реакцией иногда объясняют тот факт, что полифункциональные агенты подавляют рост раковых клеток гораздо эффективнее соответствующих монофункциональных агентов. Для индукции мутаций эта реакция, по-видимому, не играет существенной роли, так как известно много активных монофункциональных мутагенов, некоторые из которых активнее своего полифункционального аналога.
4) Окислители, восстановители и свободные радикалы
Окислителем является один из наиболее хорошо изученных мутагенов - азотистая кислота. При реакции азотистой кислоты с основаниями нуклеиновых кислот, содержащими аминогруппу, происходит окисление этой группы до азота по уравнению:
R - NH2 + HNO2 = R - ОН + N2 + H2O
Возникшие в результате этой реакции основания отличаются от исходных по способности образовывать специфические комплементарные пары. Так, гипоксантин, получающийся при дезаминировании аденина, образует комплементарную пару не с тимином, как аденин, а с цитозином. Таким образом, на месте аденина в результате дезаминирования оказывается основание, которое ведет себя как гуанин. Предполагается, что эта замена является источником точечных мутаций, индуцированных азотистой кислотой.
Кроме дезаминирования оснований азотистая кислота образует сшивки между комплементарными нитями ДНК, что препятствует их расхождению при тепловой денатурации [52]. Поэтому весьма разумным кажется предположение о том, что при репликации участок ДНК в районе сшивки не будет скопирован, т. е. возникнет деления.
К рассматриваемой группе относятся первый открытый химический мутаген йод, ионы металлов переменной валентности, например марганца, перекиси, кислород. О химическом механизме действия этих мутагенов известно очень мало. Отчасти это объясняется тем, что они являются сравнительно слабыми мутагенами, а главным образом тем, что эти соединения очень неспецифичны и могут вступать в очень большое число реакций. Последним обстоятельством объясняется также малочисленность наших сведений о молекулярном механизме мутагенного действия свободных радикалов. Они образуются в клетке при действии ионизирующих излучений и, по-видимому, играют определенную роль в их мутагенном действии. Свободные радикалы могут возникать в клетке и без облучения, путем восстановления перекисей, которые являются естественными метаболитами. Восстановителей же в клетке всегда достаточное количество, например, аскорбиновой кислоты.
5) Акридиновые красители
Эти соединения легко образуют комплексы с ДНК и РНК. Рентгеноструктурные и оптические данные свидетельствуют о том, что акридины вклиниваются между пурин-пиримидиновыми парами двойной спирали ДНК так, что плоскость красителя перпендикулярна оси спирали. В результате этого нить ДНК растягивается и молекула ДНК удлиняется [53]. Кроме такой внутренней посадки акридины способны к внешней посадке на отрицательно заряженные фосфатные группы нуклеиновых кислот. В настоящее время предполагается, что мутагенное действие акридинов вызвано тем, что, образовав комплекс с ДНК, они мешают ее нормальной репликации; в результате этого во вновь синтезированной ДНК либо не хватает, либо оказывается лишней одна или несколько пар азотистых оснований [54].
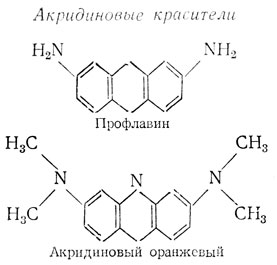
Возможно, что по механизму действия к акридинам примыкают канцерогенные ароматические углеводороды, типичные представители которых изображены ниже.
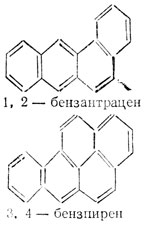
4. Специфичность мутагенов
После открытия химических мутагенов возник вопрос, отличаются ли они по характеру действия от уже известных и сравнительно хорошо изученных мутагенов - ионизирующих излучений. На первый взгляд казалось, что сходства между ними больше, чем различий, причем более всего походили на ионизирующие излучения алкилирующие соединения, которые на основании этого относятся к группе радиомиметических веществ, т. е. веществ, имитирующих действие излучений. О сходстве свидетельствуют следующие факты:
1. При помощи химических мутагенов удалось индуцировать все типы генетических изменений, которые вызываются ионизирующими излучениями (табл. 3).
![Таблица 3. Генетические эффекты, вызываемые у D. melanogaster действием рентгеновых лучей и различных химических агентов [45]](pic/000033.jpg)
Таблица 3. Генетические эффекты, вызываемые у D. melanogaster действием рентгеновых лучей и различных химических агентов [45]
Примечание. Наблюдается (+); не наблюдались (?).
2. Для многих мутагенов оказалось, что кривые "доза - эффект" имеют тот же вид, что и для радиации. Следует, однако, заметить, что из сходства кривых "доза - эффект" в данном случае нельзя сделать определенных выводов, так как химическое вещество в клетке может быть распределено неравномерно и поэтому "доза" химического вещества может не отражать его концентрацию вблизи тех молекул или структур, изменение которых приводит к мутации. Более убедительно говорят о сходстве излучений и химических мутагенов опыты, в которых изучались кривые "доза - эффект" для двух генетических эффектов, возникающих одновременно при действии горчичного газа. Речь идет о летальных мутациях, возникающих в результате разрыва хромосом в одной точке, и о транслокациях, которые возникают, если две хромосомы разорвались и обменялись оторванными кусками. Как и в случае рентгеновых лучей, частота транслокаций нарастала с дозой примерно как квадрат частоты леталей. Это следует из предположения, что леталь возникает в результате одного "удара", в то время как транслокация требует двух независимых "ударов" [55].
3. Разрывы хромосом, индуцированные химическими мутагенами, оказались похожими на разрывы, индуцированные рентгеновыми лучами. Этот вывод можно сделать на основе работы, в которой изучалось воссоединение разрывов хромосом, индуцированных ипритом, с разрывами, вызванными рентгеновыми лучами. В этой работе воздействовали на самцов плодовой мушки сначала рентгеновыми лучами, а затем ипритом, и наоборот. В обоих случаях частота транслокаций была больше аддитивной. Величина отклонения от аддитивности хорошо объяснена тем, что разрывы, индуцированные ипритом, с тем же успехом воссоединяются как сами с собой, так и с разрывами, индуцированными рентгеновыми лучами [56].
4. Было найдено, что иприты, так же как и рентгеновы лучи, более эффективны, если хромосомы предварительно облучить ближним инфракрасным светом [57].
5. В ряде случаев наблюдалось явление перекрестной устойчивости к действию химических мутагенов и радиации. Известно, что бактерии, выжившие после рентгеновского облучения в больших дозах, обладают повышенной устойчивостью к его действию. Точно так же можно получить бактерии, устойчивые к действию азотистого иприта. При этом оказывается, что бактерии, устойчивые к иприту, устойчивы также к облучению, и наоборот [58]. Как правило, устойчивость к "яду" является очень специфическим свойством, т. е. устойчивость к одному "яду" не обеспечивает устойчивости к другому. Поэтому возникновение перекрестной устойчивости свидетельствует о близком сходстве двух "ядов" [59].
Многие химические мутагены обладают сходством с радиацией и в физиологическом действии на клетку. Они вызывают обратимое слипание хромосом, а также задерживают начало митоза. Многие химические мутагены, так же как и радиация, являются канцерогенами.
Однако наряду со сходством наблюдались и существенные различия. Пожалуй, самое замечательное отличие горчичного газа от радиации, обнаруженное уже на самых ранних стадиях изучения химического мутагенеза, заключается в задержке проявления его мутагенного эффекта [60]. Задержка проявлялась в том, что после воздействия горчичным газом на плодовую мушку чаще наблюдались потомки с мозаичными участками тела, а площадь этих участков была меньше, чем после облучения рентгеновыми лучами. В случае мозаичности не все клетки тела обладают мутантным признаком. Возникает она в результате того, что мутация происходит уже после начала дробления оплодотворенного яйца. Чем позднее при этом произойдет мутация, тем меньше будет площадь тела, захваченная мозаичностью.
Задержанный мутагенный эффект наблюдался также для триэтиленмеламина, диэпоксибутана, формальдегида и некоторых других мутагенов.
Следующее отличие заключается в том, что период максимальной чувствительности клеток к действию химических мутагенов относится, как правило, к более ранним стадиям митотического цикла (рис. 2). Это было обнаружено на опухолях крыс [61], а также на растительных объектах [62].
![Рис. 2. Чувствительность опухолевых клеток крысы (опухоль Уокера 266) к действию рентгеновых лучей и азотистого иприта [61]](pic/000034.jpg)
Рис. 2. Чувствительность опухолевых клеток крысы (опухоль Уокера 266) к действию рентгеновых лучей и азотистого иприта [61]
Различия наблюдались и в чувствительности разных стадии сперматогенеза. Созревание мужских зародышевых клеток происходит следующим образом. Из исходных сперматогоний в результате серии делений развиваются сперматоциты первого порядка, обладающие диплоидным набором хромосом. Затем наступает первое мейотическое деление, в результате которого получаются гаплоидные сперматоциты второго порядка. После быстро протекающего второго деления образуются четыре гаплоидные сперматиды. Сперматиды уже без делений превращаются в зрелые спермии. Чувствительность стадий сперматогенеза изучают следующим образом. На самцов воздействуют мутагеном, затем через определенные промежутки времени их скрещивают, причем каждый раз с новыми самками. Таким образом получается несколько групп потомков одних и тех же самцов, но возникших от спермиев, находившихся в момент мутагенного воздействия на разных стадиях развития.
Для рентгеновых и γ-лучей, горчичного газа, триэтиленмеламина и некоторых других алкилирующих соединений разные стадии сперматогенеза у плодовой мушки проявили в общих чертах сходную чувствительность. Мутации (рецессивные сцепленные с полом летали) возникали с заметной частотой на всех стадиях сперматогенеза, причем зрелые спермии были более чувствительны, чем ранние сперматогоний, а пик чувствительности приходился на средние стадии: сперматиды, сперматоциты или ранние сперматогонии [5]. При воздействии рентгеновыми лучами больше всего мутаций возникало в поздних оперматидах, тогда как при воздействии горчичным газом или триэтиленмеламином - в поздних сперматогониях или ранних сперматоцитах [63].
Некоторые другие мутагены, например уретан [14], формальдегид, инъецируемый взрослым особям [64], и этилметансульфонат [49] эффективнее всего действуют на зрелые спермии; формальдегид, добавляемый в пищу (63], и хлорэтилметансульфонат [49] действуют исключительно или почти исключительно на стадии, предшествующие мейозу.
Химические мутагены отличаются от радиации еще и тем, что они, как правило, вызывают различные типы мутаций в иных пропорциях, чем радиация. В частности, при воздействии на плодовую мушку горчичным газом отношение числа хромосомных перестроек к частоте леталей, вызванных разрывами хромосом в одной точке, меньше, чем при воздействии радиации [55].
Существенное отличие заключается и в том, что ионизирующие излучения мутагенны для всех организмов, между тем известно довольно много случаев, когда вещество является активным мутагеном для одного организма, но совершенно немутагенно для другого. Например, уретан вызывает мутации у плодовой мушки, растений и бактерий, но не вызывает их у нейроспоры [65]. Такая специфичность проявляется и в его канцерогенном действии. Уретан вызывает рак легкого у мышей и крыс, но не вызывает его у кроликов и морских свинок. Частично это связано с тем, что в данном случае активным канцерогеном является не сам уретан [66], а продукт его превращения, который образуется не у всех млекопитающих. Еще более разительный пример представляет собой мутагенное действие формальдегида на плодовую мушку; когда формальдегид инъецируют взрослым особям, мутации возникают только у самцов [55].
Химические мутагены по своему действию отличаются не только от радиации, но и друг от друга; отсюда возникает вопрос о специфике действия каждого мутагена. Можно условно выделить два вида специфичности: специфичность в отношении результатов воздействия мутагена; специфичность в отношении механизма действия мутагена.
Под специфичностью в отношении результатов воздействия мы понимаем следующее. Каждую мутацию можно характеризовать вероятностью ее возникновения под действием данного мутагена, что зависит от условий обработки мутагеном, от таких факторов внешней среды, как температура, условия питания и т. д. Разные мутации под действием одного и того же мутагена при одних и тех же условиях могут возникать с различной частотой. Поэтому, чтобы детально охарактеризовать действие мутагена, необходимо знать частоты всех мутаций, которые этот мутаген способен индуцировать. Совокупность всех этих частот можно назвать спектром мутаций, или спектром действия мутагена.
Если спектры действия разных мутагенов отличаются друг от друга, то можно говорить о том, что эти мутагены имеют различную специфичность в отношении результатов действия. Если два мутагена обладают разной специфичностью, то это конечно еще не значит, что механизм их действия различен. Тем не менее изучение спектров действия мутагенов является косвенным подходом к выяснению молекулярного механизма их действия. С другой стороны, изучение специфичности в отношении результатов воздействия мутагенов имеет прямое отношение к проблеме направленного получения мутаций, т. е. индукции нужной нам мутации с частотой, превышающей или хотя бы сравнимой с суммарной частотой всех остальных (ненужных нам) мутаций. Другими словами, для получения направленного мутагенеза необходимо найти мутагены с очень узким, специфичным спектром действия.
1) Специфичность мутагенов в отношении результатов воздействия
Снять полный спектр действия мутагена даже на таком простом организме, как бактериофаг, сейчас практически невозможно. Поэтому специфичность мутагена приходится изучать лишь на отдельных участках его спектра. В соответствии с тем, на каком участке спектра и с какой разрешающей силой изучается специфичность результатов воздействия мутагена, можно выделить следующие виды этой специфичности: специфичность на хромосомном уровне (региональная специфичность); межлокусная специфичность; специфичность в отношении степени и характера поражения генетического материала; внутрилокусная специфичность: в отношении прямых мутаций (горячие точки) и в отношении обратных мутаций (аллель-специфичность).
а) Специфичность на хромосомном уровне, или региональная специфичность
Эта специфичность четко установлена в отношении разрывов хромосом растений. Большинство химических мутагенов выявляют в хромосоме "слабые области", которые чаще всего рвутся под их действием. Можно привести" такой пример. В мериетематичееких клетках корешков конских бобов (Vicia faba) имеются шесть пар хромосом: одна большая и пять малых. При γ-облучении отношение числа разрывов в большой хромосоме к числу разрывов в малых составляет 5:2. При обработке корешков ипритом это отношение равно 50:2 [67]. Цитологический анализ показывает, что разрывы, индуцированные ипритом, концентрируются в гетерохроматиновой области в районе центромеры большой хромосомы [62]. Другие химические мутагены так же рвут хромосомы растений в гетерохроматиновых областях [68, 69]. В противоположность этому, для ионизирующих излучений и для кислорода под высоким давлением не было обнаружено столь четкой избирательности действия [70].
Региональная специфичность проявляется не только в клетках растений. В культуре клеток китайского хомячка и в лейкоцитах человека разрывы, индуцированные такими агентами, как гидроксиламин и бромдезоксиуридин, распределены по длине хромосомы также не случайно [71-73].
При исследовании потомства самцов плодовой мушки, выращенных на пище, в которую добавляется формальдегид, было найдено, что перестройки, наблюдаемые при этом цитологически в гигантских хромосомах слюнных желез, реже встречаются в гетерохроматиновой области, чем при воздействии рентгеновых лучей [74]. Возможно однако, что это отличие от растений чисто кажущееся, так как в хромосомах растений можно обнаружить все перестройки, а у плодовой мушки перестройки с обоими разрывами в гетерохроматиновой области остаются незамеченными [55].
б) Межлокусная специфичность
Мутаген можно назвать специфичным в отношении некоторых локусов, если эти локусы мутируют под его воздействием чаще других и разбросаны по длине хромосомы более или менее случайным образом. Если же высокомутабильные локусы сконцентрированы в определенном районе хромосомы, то мутаген можно назвать специфичным в отношении этого района. Однако, чтобы выяснить, с каким видом специфичности мы имеем дело, изучения одной лишь "географии" высокомутабильных генов недостаточно. Допустим, что мы обнаружили группу тесно сцепленных высокомутабильных генов. Географическое расположение этих генов свидетельствует о том, что мутаген "отличает" район, в котором они находятся. Но может случиться так, что эти гены сохранят свою высокую мутабильность, даже если их разъединить, перенеся в различные участки хромосомы. Ясно, что в этом случае мутаген "отличает" не район, в котором находятся гены, а сами гены. В большинстве случаев такого функционального разграничения между региональной и межлокусной специфичностью провести не удалось.
Прежде чем перейти к индуцированному мутагенезу, укажем на данные, свидетельствующие о некоторой специфичности спонтанного мутационного процесса. Лучше всего она изучена на кукурузе. В табл. 4 показана частота спонтанных мутаций в локусах, контролирующих морфологию и пигментацию зерен кукурузы [75].
![Таблица 4. Частота спонтанных мутаций в генах, контролирующих морфологию и пигментацию зерен кукурузы [75]](pic/000035.jpg)
Таблица 4. Частота спонтанных мутаций в генах, контролирующих морфологию и пигментацию зерен кукурузы [75]
На кукурузе было обнаружено, что межлокусная специфичность спонтанного мутационного процесса находится под генетическим контролем. В качестве примера приведем двухэлементную систему "Ds-Ac", подробно изученную Мак-Клинток [76]. Она обнаружила, что в локусе, занимаемом элементом Ds (Dissociator), часто происходят разрывы, если только в другом локусе присутствует элемент Ac (Activator). На другие участки хромосомы элемент Ас не оказывает никакого влияния. Разрывы происходят в соматических клетках, причем время их возникновения зависит от количества элементов Ас в ядре. С увеличением числа элементов Ас разрывы в локусе Ds происходят на более поздних стадиях развития растения. Далее оказалось, что элемент Ds способен менять свое расположение на хромосоме. Это происходит только в присутствии элемента Ас на тех стадиях развития, во время которых в локусе, занимаемом Ds, могут происходить разрывы. Участок хромосомы, на который переместился элемент Ds, приобретает способность к частым разрывам.
Межлокусная специфичность спонтанного мутационного процесса была обнаружена и у Drosophila [77]. Гены, мутирующие с высокой частотой, получили название нестабильных. Название это неудачно, так как нестабильность характерна не для всех аллелей этих генов. Как правило, с высокой частотой происходят мутации из рецессивной мутантной формы в доминантную дикую форму гена, которая обычно стабильна. Поэтому правильней говорить о нестабильных аллелях.
Нестабильность некоторых аллелей была обнаружена в линии Drosophila virilis, тогда как в других линиях данного вида эти же аллели оказались стабильными. Интересно, что нестабильность проявлялась не на всех стадиях онтогенеза. После оплодотворения яйцо плодовой мушки проходит через восемь синхронных делений, в результате которых образуется 256 ядер. Примерно пять или восемь из них дают начало - зародышевым клеткам, а остальные - соматическим. Изучая размер участков тела мухи, затронутых мутацией, и пропорцию мутантов в потомстве мозаичных мух (мутантные потомки могут возникнуть только в том случае, если мутация затронула зародышевые клетки), можно приблизительно определить, на какой стадии онтогенеза возникла мутация. Для трех аллелей (а, b, с) гена mt таким способом было найдено, что во время первых восьми делений эти аллели стабильны. Аллель а становится нестабильным на более поздних стадиях онтогенеза. Нестабильность проявляется и в зародышевых, и в соматических клетках. Аллель с становится нестабильным только в соматических клетках. Аллель b остается стабильным в обоих типах клеток.
У микроорганизмов также обнаружена межлокусная специфичность спонтанных мутаций. Эта специфичность находится под генетическим контролем. Так, например, имеется штамм кишечной палочки с повышенной частотой мутаций к стрептомицин-устойчивости [78]. Это объясняется присутствием в этом штамме гена-мутатора, который расположен в половом факторе. Когда половой фактор, несущий этот ген, передается другим штаммам, то они приобретают свойство мутировать с высокой частотой к стрептомицин-устойчивости. Частота мутаций в других генах при этом не изменяется.
Межлокусная специфичность индуцированного мутагенеза интенсивно изучалась шведскими генетиками на ячмене [79, 80]. Некоторая межлокусная специфичность была ими обнаружена в системе генов неполегаемости под действием различных излучений. Признак неполегаемости контролируется по крайней мере 22 генами а, b, с... v. Мутации в этих генах приводят к возникновению крепкой соломы у ячменя. Чаще всего мутации возникают в локусах а, с, d, m (рис. 3).
![Рис. 3. Частота мутаций в локусах, контролирующих признак неполегаемости у ячменя [80]. Высота столбика обозначает число мутантов, у которых затронут данный локус: 1 - рентгеновы лучи; 2 - нейтроны; 3 - у-лучи; 4 - протоны](pic/000036.jpg)
Рис. 3. Частота мутаций в локусах, контролирующих признак неполегаемости у ячменя [80]. Высота столбика обозначает число мутантов, у которых затронут данный локус: 1 - рентгеновы лучи; 2 - нейтроны; 3 - γ-лучи; 4 - протоны
Разница в мутагенном спектре γ-лучей и некоторых химических мутагенов была обнаружена при сравнении частот мутаций устойчивости к мучнистой росе (паразитный гриб) и хлорофильных мутаций (табл. 5).
![Таблица 5. Частота хлорофильных мутаций и мутаций устойчивости к мучнистой росе [80]](pic/000037.jpg)
Таблица 5. Частота хлорофильных мутаций и мутаций устойчивости к мучнистой росе [80]
Было также найдено, что два основных типа хлорофильных мутаций, а именно мутации, приводящие к изменению зеленой окраски в светлозеленую, и мутации, дающие бесхлорофильные растения (альбиносы), возникают под действием разных мутагенов в разных пропорциях (рис. 4).
![Рис. 4. Соотношение частот различных типов хлорофильных мутаций у ячменя при действии химических мутагенов и радиации (79]: 1 - альбиносы; 2 - светло-зеленые; 3 - прочие](pic/000038.jpg)
Рис. 4. Соотношение частот различных типов хлорофильных мутаций у ячменя при действии химических мутагенов и радиации (79]: 1 - альбиносы; 2 - светло-зеленые; 3 - прочие
Межгенная специфичность изучалась также на шелковичном черве путем сравнения частот двух мутаций pe и re, которые влияют на окраску яиц, что позволяет просматривать большое количество потомков. Мутации рецессивны в происходят в тесно сцепленных, локусах; у организмов, имеющих генотип pe/pe яйца розовые, a re/re - красные. В потомстве обработанных мутагеном самцов дикого типа и необработанных самок, рецессивных по обоим генам, определялось отношение ре/re. В контрольных опытах это отношение равно 1 или больше. После облучения рентгеновыми лучами оно было всегда больше единицы, так же как и при обработке глициновым ипритом или нитромиком (окисью азотистого иприта HN2). Напротив, это отношение равнялось 0,6 в двух больших экспериментах с аланиновым ипритом и 0,07 при обработке амидом аланинового иприта. Разница в действии этих мутагенов очевидна, но интерпретацию ее осложняют некоторые странные свойства этой системы. Частоты мутаций были очень велики и в контроле. Потомство в последующих поколениях исследовалось очень мало, поэтому не исключена возможность того, что часть розовых или красных фенотипов, возникающих после обработки в виде мозаик, обязана временному влиянию мутагенов на действие гена. Кроме того, отношение ре/re всегда большее единицы при облучении самцов, становится меньше единицы при облучении самок. Это обстоятельство наводит на мысль о том, что отношение этих двух типов мутаций может зависеть от стадии сперматогенеза [55]. В пользу того, что спектр мутаций может зависеть от физиологического состояния обрабатываемых клеток, свидетельствуют опыты по индукции мутаций в семенах ячменя. Когда облучению подвергались набухающие семена, то среди выросших из них растений встречались хлорофильные мутации с редким фенотипом alboxantha. Если же облучению подвергались сухие семена, то этот фенотип не возникал даже при очень больших дозах [81].
О. Фахми и М. Фахми на плодовой мушке также получили данные, свидетельствующие, по их мнению, в пользу межлокусной специфичности. Сравнивая мутагенное действие излучений и химических веществ, они нашли, что распределение сцепленных с полом леталей, индуцированных триэтиленмеламином, существенно отличается от распределения леталей, индуцированных рентгеновыми лучами и возникших спонтанно. Разница наблюдалась главным образом на конце Х-хромосомы вблизи центромеры [82]. Как заметила Ауэрбах [55], это наводит на мысль о том, что разница в спектрах вызвана влиянием центромеры, поэтому было бы интересно определить распределение леталей в инвертированной хромосоме. Видимые мутации, индуцированные триэтиленмеламином и другими химическими мутагенами, распределялись сходным образом. Эти результаты позволяют предположить существование некоторой региональной специфичности. Однако утверждения авторов, подвергнутые обстоятельной критике Ауэрбах [55, 83], этим не ограничиваются. Первое утверждение заключается в том, что некоторые мутагены, такие, как триэтиленмеламин, фенилаланиновый иприт и хлорэтилметансульфонат (все алкилирующие соединения), вызывают больше видимых мутаций по сравнению с леталями, чем рентгеновы лучи [5]. Данных Фахми и Фахми недостаточно для статистической достоверности этого утверждения. В опытах, проведенных другими авторами, и фенилаланиновый иприт, и хлорэтилметансульфонат вызывали видимые мутации и летали примерно в той же пропорции, что и рентгеновы лучи [83]. Вообще же, всякие количественные опыты с видимыми мутациями у плодовой мушки нельзя считать достоверными до тех пор, пока они не проверены большим числом исследователей, так как частота видимых мутаций значительно варьирует, по данным разных авторов, и не является вполне объективным показателем.
Более интересно другое утверждение О. Фахми и М. Фахми. После воздействия некоторыми химическими мутагенами они обнаружили повторяющиеся видимые мутации, которые ранее не были описаны [5]. Они приписывают это тому, что некоторые алкилирующие соединения производят мутации в генах, которые ранее не мутировали ни спонтанно, ни под влиянием радиации. Многие из этих "новых" мутантов стерильны и поэтому могли быть не включены в опубликованные списки мутантов плодовой мушки. Другие имели весьма незаметное фенотипическое проявление и могли ускользнуть от внимания исследователей, не интересовавшихся открытием новых видимых мутаций. После отсева этих мутантов осталось несколько "хороших" мутаций, которые могут быть введены в гомозиготную линию, что позволяет применить к ним технику изучения мутаций в индивидуальных локусах. Эта техника состоит в том, что самки, рецессивные по мутантному гену, скрещиваются с самцами дикого типа, на которых воздействовали мутагеном. При этом уже в потомстве первого поколения самок обнаруживаются мутации в изучаемом локусе. Таким способом Фахми и Фахми индуцировали несколько "новых" мутаций с помощью фенилаланинового иприта. Рентгеновы же лучи не вызвали этих мутаций. Данных еще недостаточно для статистической достоверности, но их можно рассматривать как предварительные. Хотя Фахми и Фахми утверждают, что новые мутации возникают только под действием химических мутагенов и что специфическое действие этих мутагенов не распространяется на "обычные" мутации, их результаты дают основания лишь для более осторожных высказываний о том, что имеется некоторое распределение эффективности действия этих мутагенов и "новые" мутации лежат на краю этого распределения.
Много работ по межгенной специфичности мутагенов было проделано на микроорганизмах. Большая часть из них посвящена сравнению частот обратных мутаций в разных генах под действием различных мутагенов. Это очень существенное обстоятельство. Ген, как известно, может существовать во многих разных формах - аллелях. Выбор одной из них в качестве стандартного "дикого" типа условен, поэтому и условно также понятие прямых мутаций, т. е. мутаций, приводящих к изменению дикой формы гена. У микроорганизмов в качестве дикого типа, как правило, выбирают такую форму гена, в которой он наилучшим образом выполняет свою функцию. Тогда большая часть мутаций приводит к тому, что ген полностью или частично перестает выполнять эту функцию. Изучение большого числа независимо возникающих мутаций, затрагивающих один и тот же ген, показывает, что он обладает внутренней структурой и различные мутации изменяют его различные участки.
Обратными называют мутации, которые приводят к тому, что мутантный фенотип возвращается к дикому. Иногда реверсия к дикому типу наступает за счет мутации в другом гене. Такая обратная мутация называется супрессорной. Случается, что реверсия возникает в результате мутации в том же гене, что и прямая, но в другом его участке (внутригенная супрессия). И наконец, может наступить истинная реверсия, когда ген в точности возвращается к исходному состоянию.
Разницу между прямой и истинно обратной мутацией неплохо передает аналогия, высказанная Вестергаардом [84]. Если швырнуть в стенку 1000 будильников, то все они, вероятно, сломаются. Однако следует ожидать, что, хотя конечный результат всех поломок будет одинаков - будильники остановятся, - причины этой остановки, т. е. характер поломки механизма, у всех будильников будут разные. Возможно, что некоторое количество будильников будет повреждено столь незначительно, что если их слегка встряхнуть, то они снова пойдут. Но если сломать будильник можно, бросив его как попало, то для исправления его нужно встряхивать очень осторожно и "специфично".
Приведем типичный пример работы по изучению межгенной специфичности на бактериях (85]. В ней измерялись частоты мутаций gal- → gal+ и ser- → ser+ у восьми штаммов S. typhimurium, неспособных сбраживать галактозу, и шестнадцати штаммов, требующих для своего роста серии. Генетический анализ с помощью трансдукции показал, что все восемь gаl--мутаций являются несовпадающими аллелями одного гена, четырнадцать ser--мутаций - несовпадающими аллелями другого гена и один ser- представлял собой мутантный аллель третьего гена. Соотношение частот мутаций разных аллелей от минуса к плюсу в значительной мере варьировало от мутагена к мутагену, но ни для одного мутагена не было такой ситуации, чтобы все галактозные аллели мутировали чаще (или реже) всех сериновых аллелей. Таким образом, мутагены в данном случае различают не гены, а их определенные аллели или, возвращаясь к аналогии Вестергаарда, не разные марки будильников, а определенные типы поломок.
Ценность этой работы, а также некоторых других, не упомянутых нами, в значительной мере снижается тем обстоятельством, что в них не была исключена возможность того, что мутация к плюс-варианту произошла не путем точного исправления мутировавшего гена, а за счет супрессорной мутации.
Это обстоятельство было учтено в работах с нейроспорой, в которых детально изучались реверсии в локусе иноз, контролирующем синтез витамина инозитола, и в локусе ад, контролирующем синтез аденина. Когда действию мутагенов подвергался штамм нейроспоры, имеющий генотип ад- иноз-, т. е. неспособный синтезировать оба метаболита, то все изученные мутагены, за исключением ультрафиолетовых лучей, вызывали больше реверсий в адениновом локусе, чем в инозитоловом (табл. 6) [33].
![Таблица 6. Количество обратных мутаций двух аллелей у нейроспоры под действием разных мутагенных факторов [33]](pic/000039.jpg)
Таблица 6. Количество обратных мутаций двух аллелей у нейроспоры под действием разных мутагенных факторов [33]
Когда измерялась частота обратных мутаций для других аллелей этих же генов, то соотношение частот было другим, а в ряде случаев даже обратным, т. е. в инозитольном локусе возникало больше мутаций, чем в адениновом. Таким образом, здесь мы опять имеем дело не с межгенной специфичностью, так как мутаген "отличает" не гены, а их определенные аллели.
При индукции прямых мутаций у Penicillium chrysogenum с помощью ультрафиолетовых лучей и диэпоксибутана между этими мутагенами не было обнаружено той громадной разницы, которую они проявляли при реверсии в иноз и ад локусах нейроспоры [84]. Опыт проводился следующим образом. Конидии обрабатывались мутагенами в таких дозах, при которых можно было получить примерно одинаковую выживаемость. Затем обработанные конидии высевали на полноценную среду и разросшиеся колонии проверялись на наличие в них мутантов. В табл. 7 приведены полученные таким образом данные по частоте биохимически недостаточных мутаций. Из таблицы видно, что спектры мутагенного действия ультрафиолетовых лучей и диэпоксибутана практически не различаются.
![Таблица 7. Биохимически недостаточные мутации, индуцированные ультрафиолетовыми лучами и диэпоксибутаном при обработке конидий Penicillium chrysogenum [84]](pic/000040.jpg)
Таблица 7. Биохимически недостаточные мутации, индуцированные ультрафиолетовыми лучами и диэпоксибутаном при обработке конидий Penicillium chrysogenum [84]
Некоторая межгенная специфичность была обнаружена в опытах с фагом каппа, паразитирующим на клетках золотистого стафилококка. У этого фага легко наблюдается несколько типов мутаций, затрагивающих морфологию бляшек. Мутации были разделены на четыре группы: светлый центр бляшки, цветной ореол бляшки, бледный ореол или отсутствие ореола и пр. Мутации, затрагивающие один и тот же фенотип, отличаются друг от друга по месту поражения генетического материала. Как видно из табл. 8, соотношение частот появления бляшек разных типов в значительной степени менялось при действии разных мутагенов [86]. Следует заметить, что ценность этой работы умаляется тем, что неизвестно, какие и сколько генов контролируют морфологию бляшек этого фага.
![Таблица 8. Спектр мутаций, затрагивающих морфологию бляшек фага каппа, обработанного in vitro различными мутагенами [86]](pic/000041.jpg)
Таблица 8. Спектр мутаций, затрагивающих морфологию бляшек фага каппа, обработанного in vitro различными мутагенами [86]
Примечание. 1 - прозрачный центр бляшки; 2 - цветной ореол бляшки; 3 - бледный ореол или отсутствие ореола; 4 - прочие.
в) Специфичность мутагенов в отношении степени и характера изменения генетического материала
Большинство мутагенов "умеет" вызывать все типы мутаций: и хромосомные перестройки, и генные мутации. Однако соотношение этих типов может в значительной мере варьировать от мутагена к мутагену и меняться даже для одного мутагена в зависимости от дозы, стадии развития зародышевых клеток и пр. Одним из показателей специфичности в отношении степени поражения генетического материала служит отношение числа генных мутаций к числу хромосомных аберраций. Это отношение меняется в очень широких пределах. Так, этоксикофеин вызывает только хромосомные разрывы, практически не влияя на частоту генных мутаций, в то время как небулярны совершенно не рвет хромосом, зато эффективно индуцирует генные мутации. У фагов и бактерий такие мутагены, как 5-бромурацил и 2-аминопурин, вызывают исключительно точечные мутации, в то время как азотистая кислота индуцирует и делеции, и точечные мутации [87, 88].
Следует заметить, что специфичность мутагена в отношении степени изменения генетического материала может зависеть от того, какой организм подвергается его действию. Например, 5-бромдезоксиуридин, индуцирующий у микроорганизмов только точечные мутации, способен индуцировать разрывы хромосом в культуре клеток человека. Распад фосфора Р32, включившегося в ДНК, вызывает генные мутации у бактерий, но не у фагов, для которых распад фосфора всегда летален.
Существование специфичности такого рода наводит на мысль о том, что мутаген "различает" гены не только за счет различного сродства к разным генам. Можно предположить, что мутаген примерно с одинаковой вероятностью вызывает химические изменения во всех генах, но в некоторых из них почти все изменения приводят к мутации, в то время как в других большая часть изменений гена остается незамеченной. Поясним сказанное примером. Профлавин четко "различает" локусы rII и h фага Т4, вызывая больше мутаций в rII-области [89]; 5-бромурацил индуцирует мутации в этих генах примерно с одинаковой частотой. Известно, что 5-бромурацил вызывает замены пар азотистых оснований в ДНК. При замене одной пары оснований в ДНК на другую, как правило, происходит незначительное изменение в белке: одна аминокислота заменяется на другую. Профлавин же "вставляет" или "выдергивает" пары оснований в ДНК. Выпадение или вставление одной пары оснований приводит к тому, что считывание белка радикальным образом нарушается, в результате чего он чаще всего вообще не синтезируется [54].
Если механизм действия этих мутагенов вскрыт верно, то легко понять характер их воздействия на области rII и h. Ген h контролирует синтез белка оболочки фага. Поэтому при радикальных изменениях этого белка фаг либо вообще не будет образован, либо потеряет способность адсорбироваться на клетках. Лишь изредка изменение белка приведет к тому, что фаг приобретет способность адсорбироваться на новом хозяине. Иное наблюдается в rII-области; мутация в ней ведет не к изменению функции, а к ее потере. Поэтому те изменения, которые в гене h были летальны, в rII-области приводят к видимой мутации.
Ранее мы говорили, что рентгеновы лучи сравнительно с химическими мутагенами, индуцируют больше альбиносов, чем светло-зеленых мутаций у ячменя. Изменение этого отношения можно понять, если предположить, что мутации альбиносов и светло-зеленые мутации происходят в одних и тех же генах (но альбиносы возникают при их более радикальном изменении) и что радиация является более "грубым" мутагеном [84]. Это предположение может быть проверено стандартным тестом на аллелизм между альбиносами и светло-зелеными мутациями.
г) Внутрилокусная специфичность
Внутрилокусная специфичность в отношении прямых мутаций лучше всего изучена в rII-области фага Т4 [90]. В ней было индуцировано и получено спонтанно большое количество мутантов, многие из которых оказались "точечными". Каждая "точечная" мутация в rII-области занимает очень маленький участок генетической карты - менее 0,05% рекомбинаций, что составляет примерно 1/400 размера всей rII-области. По приблизительным оценкам, участок ДНК, затронутый "точечной" мутацией, состоит не более чем из десяти пар нуклеотидов, возможно даже и из одной пары. Учитывая эту неопределенность, мы взяли эпитет точечный в кавычки.
При построении карты точечных мутаций были обнаружены часто попадающиеся независимо возникшие мутанты, которые при скрещивании ;не дают рекомбинантов дикого типа; поэтому их помещают в одну точку карты. Разрешающая сила скрещивания в rII-области составляет примерно 0,02% рекомбинации. Можно утверждать (с той же степенью достоверности, как и при определении размера области, затронутой мутацией), что размеры точки не превышают 5-6 пар нуклеотидов ДНК. Иными словами, мутации, попавшие при картировании в одну точку, затрагивают участки ДНК, отстоящие друг от друга не далее чем на 5-6 нуклеотидов. Если бы все участки ДНК мутировали с одинаковой вероятностью, то следовало ожидать, что во все точки карты попадет примерно равное количество мутантов. На самом же деле этого не наблюдается. Из полутора с лишним тысяч спонтанных мутантов 517 попало в одну точку, 292 - в другую, в то время как остальные распределились между 249 точками. Точки с повышенной частотой мутаций были названы "горячими".
При сравнении карты спонтанных и индуцированных мутаций наряду с элементами сходства в спектрах наблюдаются и существенные отличия, проявляющиеся в том, что точки, "горячие" для одного мутагена, оказываются "холодными" для других (рис. 5).
![Рис. 5. Генетическая карта, показывающая расположение мутаций в rII-области фага Т4 [91]. Каждая мутация изображена в виде квадратика, расположенного в соответствующем сегменте карты](pic/000042.jpg)
Рис. 5. Генетическая карта, показывающая расположение мутаций в rII-области фага Т4 [91]. Каждая мутация изображена в виде квадратика, расположенного в соответствующем сегменте карты
Для таких мутагенов, как 5-бромурацил, 2-аминопурин, азотистая кислота и гидроксиламин, была выдвинута гипотеза о характере их молекулярного действия. Сейчас нет необходимости вдаваться в ее детали. Важно то, что согласно этой гипотезе перечисленные мутагены вызывают мутации, индуцируя замены пар оснований в ДНК: либо одной пары А-Т на Г-Ц, либо пары Г-Ц на А-Т. Если принять эту гипотезу, то существование "горячих" точек можно объяснить, исходя из двух предположений.
1. Если мутации, попавшие при картировании в одну точку, действительно тождественны, т. е. у них заменена одна и та же пара оснований ДНК, то необходимо признать, что частота замен данной пары зависит от того, какие пары оснований находятся рядом с ней.
2. Если, напротив, принять, что частоты замен данной пары оснований не зависят от ее соседей, то для объяснения существования горячих точек необходимо предположить, что не у всех мутантов, попавших при картировании в одну точку, заменена одна и та же пара оснований. Иными словами, при увеличении разрешающей силы скрещивания в 10 раз, мы обнаружили бы, что мутации, помещаемые сейчас в одну точку, на самом деле распределены по области ДНК, состоящей из 5-6 пар оснований.
В этом случае существование "горячих" точек можно объяснить тем, что изменение всех или почти всех оснований в них приводит к мутации, в то время как в "холодной" точке изменение большей части пар оснований не вызывает заметного изменения фенотипа. В настоящее время почти нет оснований сомневаться, что в ДНК возможны изменения, которые не приводят к заметному изменению функции гена. Действительно, не всякое изменение в белке, а следовательно, и в ДНК, программирующей его синтез, приводит к тому, что он теряет свою функциональную активность. Далее, разные мутации в одном и том же гене очень сильно отличаются по степени потери функции: от полной потери, до едва уловимой. Поэтому нет оснований полагать, что в этом же гене совершенно не возникают незаметные мутации.
На основании анализа спектров прямых мутаций в настоящее время не удается сделать выбор между этими двумя возможностями. Существенные данные для такого выбора представляют результаты изучения специфичности обратных мутаций. Точечные rII-мутации дают возврат к дикому типу как спонтанно, так и под влиянием различных мутагенов, причем реверсия наступает не за счет супрессорной мутации в другом гене. Обратные мутации, вызывающие реверсии к дикому типу мутантов, индуцированных бромурацилом, аминопурином, азотистой кислотой и гидроксиламином, происходят, как правило, в той же точке, что и прямая мутация. Это значит, что обратная мутация возникает не дальше 5-6 пар оснований от прямой. Если реверсия наступает за счет точного исправления ДНК, т. е. мутировавшая пара оснований заменяется на пару, стоявшую в этом месте у дикого типа, то согласно первому предположению следует ожидать, что частота реверсий у разных мутантов будет отличаться не меньше, чем частоты прямых мутаций. Согласно второму - нужно ожидать, что по частотам реверсий все мутанты, индуцированные бромурацилом, распадутся на два класса: один класс мутантов, у которых произошла замена пары А-Т на Г-Ц и другой - с заменой Г-Ц на А-Т. Внутри каждого класса частоты должны варьировать незначительно. Если же мутаген производит замены в обоих направлениях с одинаковой вероятностью, то все мутанты должны ревертироваться с равной скоростью.
Эксперименты по изучению обратных мутаций в rII-области свидетельствуют о том, что частоты реверсий меняются от мутанта к мутанту даже в большей степени, чем частота прямых мутаций. Таким образом, предположение о том, что реверсия наступает за счет точного исправления мутантной пары ДНК не совместимо со вторым объяснением существования горячих точек. Несмотря на большой разброс в частотах реверсий, в них наблюдается четкая закономерность, связывающая историю возникновения мутанта (т. е. характер мутагенной обработки, с помощью которой он был индуцирован) с его способностью давать реверсии под влиянием различных мутагенов. Оказалось, что мутации, индуцированные бромурацилом и гидроксиламином, дают низкий уровень реверсий под влиянием бромурацила и гидроксиламина, но зато высокий уровень при действии аминопурина. Мутации, индуцированные аминопурином, дают высокий уровень реверсий при воздействии аминопурина а примерно половина из них - также и при воздействии бромурацила и гидроксиламина. У остальных же мутантов, индуцированных аминопурином, возникал низкий уровень реверсий под действием бромурацила и гидроксиламина [92]. Из табл. 9 видно, что существует четкая "щель" между высокой и низкой частотой. Эти результаты свидетельствуют в пользу того, что, хотя на частоту переходов, индуцированных бромурацилом и гидроксиламином, и влияют соседи, эти мутагены все-таки четко различают пары А-Т и Г-Ц независимо от положения этих пар. Аминопурин же одинаково охотно производит замены пар оснований в обоих направлениях.
![Таблица 9. Частота реверсий rII-мутантов (Х10-7) под воздействием 2-аминопурина (2АП), 5-бромдезоксиуридина (5-БДУ) и гидроксиламина (ГА) [92]](pic/000043.jpg)
Таблица 9. Частота реверсий rII-мутантов (×10-7) под воздействием 2-аминопурина (2АП), 5-бромдезоксиуридина (5-БДУ) и гидроксиламина (ГА) [92]
Примечание. В табл. 9 приведена только часть данных, опубликованных в работе. Буквами обозначены: АР - мутанты, полученные под действием аминопурина, N - 5-бромдезоксиуридина, НВ - гидроксиламина; номерами без букв обозначены мутанты, возникшие спонтанно.
Имеются данные о том, что гидроксиламин в ДНК взаимодействует преимущественно с цитозином и поэтому чаще всего вызывает замены пар Г-Ц на А-Т [92].
Существует много rII-мутантов, которые не дают реверсий ни под действием бромурацила и гидроксиламина, ни под действием аминопурина, зато хорошо ревертируются акридинами. К мутантам такого типа относится примерно 80% спонтанных и все мутанты, индуцированные акридинами. Наоборот, мутанты, индуцированные бромурацилом, аминопурином и гидроксиламином, не дают реверсий при действии акридинов. Указанные факты говорят о том, что мутагены типа акридинов и мутагены типа бромурацила вызывают совершенно разные изменения в ДНК. Опыты Крика с сотр. [54] свидетельствуют о том, что акридины вызывают мутации, осуществляя вставки или выдергивая одну или несколько пар оснований.
Таким образом, исследования специфичности обратных мутаций позволяют определить характер изменения, возникшего в ДНК (табл. 10).
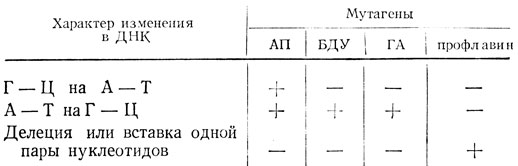
Таблица 10. Характер изменения в ДНК мутанта в зависимости от его способности давать реверсии под влиянием различных мутагенов
Примечание. Высокий уровень реверсий +; низкий уровень реверсий -.
При изучении других микроорганизмов не наблюдалась высокая специфичность при индукции прямых мутаций, какая наблюдается в rII-области. Лишь в некоторых генах было обнаружено несколько совпадающих аллелей. Это не значит, что в данных генах нет горячих точек, поскольку в них раскартировано слишком мало мутаций. Специфичность же обратных мутаций наблюдается гораздо чаще.
В качестве примера приведем работу Руднер [93], в которой изучалась частота реверсий к дикому типу двадцати трех триптофаннедостаточных мутантов S. typhimurium под действием химических мутагенов. Результаты этой работы приведены на рис. 6.
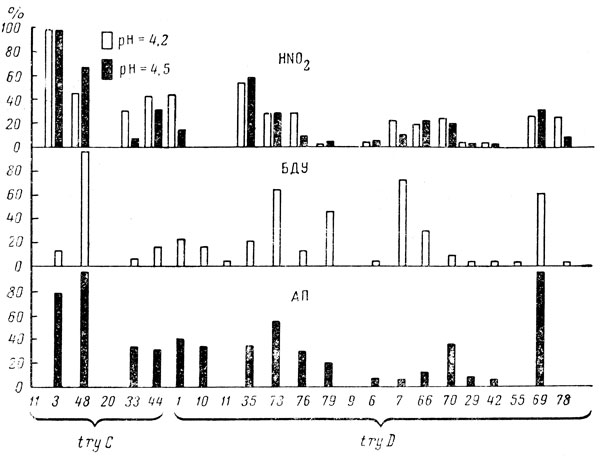
Рис. 6. Спектр обратных мутаций в локусах tryC и tryD. Частота реверсий мутанта try C-48 при действии аминопурина (частота 4,5⋅10-6) и бромдозексиуридина (частота 1⋅10-6) была принята за 100%. При действии азотистой кислоты за 100% принята частота реверсий мутанта try С-3
При картировании мутантов оказалось, что некоторые из них совпадают: например tryD-10 и tryD-11 занимают одну и ту же точку на генетической карте. Но характер их реверсии при действии различных мутагенов существенно различается: tryD-10 дает реверсии при действии аналогов оснований, a tryD-11 ими не ревертируется. Поэтому можно предположить, что у данных мутантов в одном и том же месте ДНК произошли разные химические изменения.
Некоторую внутрилокусную специфичность удалось наблюдать не только у микроорганизмов, но и у высших организмов, например в гене A, контролирующем пигментацию зерен кукурузы [94]. Если аллель ах гена А присутствует в гомозиготном состоянии, то образования пигмента антоциана не происходит. Аллель а1 обычно очень стабилен, но когда в другой хромосоме имеется доминантный аллель Dt, то аллель а1 часто мутирует к другим аллелям гена A, доминантным по отношению к а1 и вызывающим образование антоциана.
Изменение аллеля а1 происходит как в зародышевых, так и в соматических клетках. Соматические мутации приводят к образованию мозаиков: в алейроновом слое эндосперма наблюдаются мелкие пятна антоциана. На частоту мутаций других аллелей гена А аллель Dt такого влияния не оказывает. Поскольку эндосперм кукурузы содержит триплоидный набор хромосом, то можно изменять количество генов в ядре от одного до трех. С увеличением "дозы" аллеля Dt происходит нарастание числа мутаций аллеля а1 на одно семя следующим образом:

Мы познакомились с некоторыми фактами специфичности мутагенов. В случае rII-области этим фактам удалось дать истолкование на уровне химического взаимодействия с ДНК. Но мутация, как мы увидим в дальнейшем, это не просто акт взаимодействия мутагена с ДНК, а сложный процесс, протекающий в клетке; процесс, который в значительной мере зависит от характера обмена веществ в клетке. Поэтому специфичность результатов воздействия мутагенов может возникнуть не только на уровне взаимодействия с ДНК, но и на других этапах процесса возникновения мутации.
Ответить на вопрос о том, какие процессы в клетке влияют на возникновение мутаций, часто удается, выяснив, когда происходит мутация.
5. Образование мутаций и метаболизм клетки
В эпоху первых успехов радиационной генетики казалось, что мутация образуется во время облучения практически мгновенно. Однако позднее стало ясно, что это представление если и верно, то не для всех мутаций и не для всех мутагенов. Ярким примером того, что между моментом мутагенной обработки и установлением мутации может пройти значительное время, служат опыты по фотореактивации мутаций, индуцированных ультрафиолетовым светом. Фотореактивация заключается в том, что облучение видимым светом после облучения ультрафиолетовыми лучами уменьшает число индуцированных ими мутаций. Только через два часа после облучения спор Streptomyces ультрафиолетовыми лучами воздействие видимым светом перестает влиять на частоту мутаций [95]. Мутации становятся стабильными к действию видимого света до разделения ядер (насколько это видно в микроскоп). Возникает вопрос, связана ли эта задержка с тем, что мутация может стать стабильной только после или в результате определенных событий в клетке (деление, синтез определенных веществ и т. п.), или, может быть, задержка вызвана цепью реакций, ведущих от первоначального поражения генетического материала к окончательной мутации и требующих для своего протекания значительного времени, а скорость этих реакций не зависит от других событий в клетке. Этот вопрос относится вообще ко всем мутациям. Его можно свести к другому вопросу: когда происходит мутация? Действительно, нельзя сказать, когда произошло какое-либо событие, если мы не установили начало отсчета и единицу времени. Началом отсчета является мутагенная обработка. Если мутация не зависит от метаболизма клетки, то вопрос о единице времени не имеет существенного значения: время можно измерять в любых единицах, например в часах. Если же мутации связаны с метаболизмом клетки, то абсолютное время их возникновения мало интересно само по себе. В этом случае важно знать, одновременно с какими событиями происходит мутация в клетке, так как с изменением времени этих событий будет меняться и время возникновения мутаций, измеренное в абсолютных единицах.
1) Мутации и деление клеток
Наиболее ярким и важным событием в жизни клетки является деление. Опыты ряда исследователей показали, что для возникновения первичной мутации деление клетки не обязательно. Так, при хранении семян число мутаций в них нарастало со временем [96]. Сходные результаты были получены для спермиев плодовой мушки, хранящихся в семяприемных каналах самок, для сухих спор нейроспоры, для внеклеточного фага, обработанного такими мутагенами, как азотистая кислота, гидроксиламин и алкилирующие соединения. Однако во всех этих случаях, чтобы заметить мутацию, неделящимся исходным клеткам необходимо дать возможность разделиться для образования мутантного клона или организма. Поэтому в этих опытах не исключено, что в неделящейся клетке возникла лишь потенциальная мутация, которая реализуется в стабильную мутацию только в результате деления клетки.
Более определенные результаты были получены в опытах Райна, в которых изучались мутации у Е. coli от недостаточности по гистидину (his-) к независимости от него (his+). Когда культура his--бактерий рассевалась на агар, не содержащий гистидина, то бактерии не росли. Однако присутствующие в культуре his+-мутанты образуют колонии примерно через два дня. Но и после этого в течение по крайней мере нескольких недель на чашках продолжают появляться новые колонии, хотя и в малом количестве. Их число пропорционально времени [97]. Данное явление можно было бы объяснить тем, что новые колонии возникают за счет медленно растущих мутантов, присутствовавших в культуре еще до рассева на твердой среде. Однако эта возможность была исключена флуктуационным тестом Луриа и Дельбрюка, заключающимся в анализе разброса числа мутантов в большом количестве параллельных культур. Среднеквадратичное отклонение числа колоний, возникших в первые два дня в большом количестве параллельных культур, было в 100-1000 раз больше их среднего значения, что свидетельствует о возникновении ранних колоний от мутантов, присутствовавших в культуре до посева на твердую среду. Напротив, среднеквадратичное отклонение числа поздних колоний примерно равнялось их среднему числу. Это согласуется с тем, что поздние колонии произошли от мутантов, возникших уже на поверхности агара, когда бактерии находились в стационарном состоянии.
Общее число бактерий в стационарном состоянии не увеличивается заметным образом. Однако при этом не исключено, что в культуре происходит некоторое обновление клеток. Можно представить, что некоторые клетки лизируются, а другие - используют выделившийся при этом гистидин, делятся и восполняют таким образом убыль клеток. Опыты Райна говорят о том, что в стационарном состоянии такого обновления клеток не происходит [98]. Из этих опытов, таким образом, можно сделать вывод о том, что не только потенциальные, но и окончательные мутации могут возникать без деления клетки. Следует, однако, заметить, что, хотя бактерии в стационарном состоянии не делятся, в них тем не менее происходит обмен веществ и они используют источники углерода. Этот обмен веществ оказывает влияние на мутации, так как они не возникают, если неделящиеся клетки лишить источников углерода.
2) Роль репликации генов в возникновении мутаций
Другим важным событием в жизни клетки является репликация генов. При нормальной репликации с гена снимается точная копия. Однако можно представить, что в процессе копирования произойдет ошибка, в результате которой новый ген будет отличаться от старого. Такая мысль высказывалась еще на заре развития генетики [99], но долгое время считали, что мутация появляется в результате изменения старого гена, а при репликации происходит лишь простое копирование измененного гена. После того как Уотсон и Крик [100], основываясь на модели строения ДНК и модели ее репликации, предложили конкретный механизм спонтанных ошибок при репликации ДНК, широкое распространение получило противоположное мнение. Долгое время, например, считали, что у фагов можно индуцировать мутации только в тот период, когда они находятся в состоянии репликации [101].
Позднее удалось индуцировать мутации и в покоящемся фаге. Так как ДНК покоящегося фага не реплицируется и вообще, по-видимому, совершенно инертна, то можно утверждать, что потенциальные мутации могут возникать и без репликации ДНК. Также инертна и ДНК в спермиях плодовой мушки, в которых, как мы уже говорили, при хранении накапливаются мутации.
Роль репликации ДНК в процессе возникновения мутаций, по гипотезе Уотсона и Крика, заключается в следующем. При репликации нити родительской ДНК расплетаются и на каждой нити синтезируется новая комплементарная нить (полуконсервативная модель). Комплементарность, как известно, означает, что в двухнитчатой спирали ДНК в паре с аденином всегда находится тимин, а в паре с гуанином всегда стоит цитозин. Однако тимин, обычно существующий в кетоформе (рис. 7), с некоторой вероятностью может перейти в более редкую энольную форму. В энольной форме тимин может образовывать пару не с аденином, а с гуанином. Следовательно, если в момент репликации тимин окажется в энольной форме, то произойдет ошибка копирования. При этом, если тимин переходит в необычную форму в родительской ДНК, то в этом случае против него во вновь синтезируемую нить вместо аденина встанет гуанин. Как видно из схемы а на рис. 8 после второй репликации пара А-Т, стоявшая в исходной ДНК, заменится на пару Г-Ц. Этот случай был назван ошибкой при репликации. Если же тимин переходит в необычную форму в молекуле тимидинтрифосфата, то при синтезе новой нити ДНК, вместо того чтобы включиться в нее против аденина, тимин включится против гуанина. После второй репликации пара Г-Ц, стоящая в исходной ДНК, заменится на пару А-Т (рис. 8). Этот случай получил название ошибки при включении.
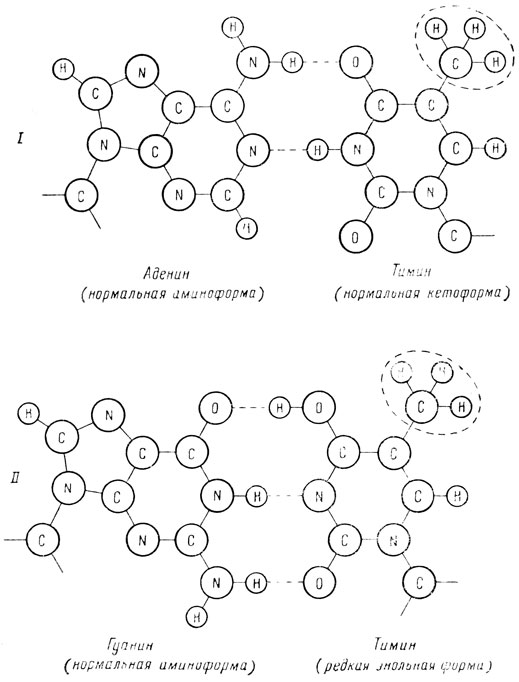
Рис. 7. Типы комплементарного спаривания тимина
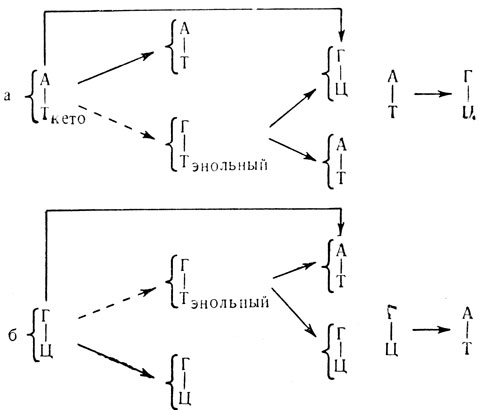
Рис. 8. Механизм мутаций при кетоэнолыюм переходе тимина и бромурацила: а - ошибка при репликации; б - ошибка при включении
Гипотеза Уотсона и Крика была расширена Фризом и применена к некоторым мутагенам. Так, Фриз предположил, что мутагенное действие 5-бромурацила, являющегося аналогом тимина, у которого вместо метильной группы имеется атом брома, также связано с кетоэнольным переходом. В обычной кетоформе бромурацил, как и тимин, образует комплементарную пару с аденином, а в энольной форме - с цитозином. Предполагаемый механизм мутаций совершенно аналогичен действию тимина. Поскольку 5-бромурацил чаще переходит в энольную форму, чем тимин, то и мутации он вызывает чаще, чем это происходит спонтанно [102]. Относительно некоторых других мутагенов Фриз предположил, что обработка ими приводит к переходу нормальных оснований, находящихся в ДНК, в производные, способные чаще нормальных оснований образовывать ошибочные спаривания. Например, гидроксиламин взаимодействует в ДНК преимущественно с цитозином, превращая его в производное, которое чаще, чем цитозин, может спариваться с аденином. В результате этого может произойти замена пары Г-Ц на А-Т. Таким образом, по гипотезе Фриза, предполагается, что при действии мутагенов типа гидроксиламина потенциальные мутации (изменение нормального основания в производное) происходят в покоящейся ДНК, а окончательная мутация возникает в результате ошибки при репликации, когда измененное основание образует неправильную пару.
Наибольшее количество данных в пользу гипотезы Уотсона - Крика - Фриза было получено в работах на фагах. Результаты этих работ свидетельствуют в пользу следующих трех основных выводов из этой гипотезы: 1) мутация состоит в замене одной пары оснований; 2) существуют два типа замен - при ошибках репликации и ошибках включения; 3) при мутациях затрагивается только одна нить ДНК.
Очевидно, что гипотеза Уотсона - Крика - Фриза не претендует на объяснение механизма всех типов мутаций, например хромосомных аберраций. Поэтому эта гипотеза не является альтернативной предположению о том, что мутация возникает путем изменения покоящейся ДНК. Кроме того, выполнение перечисленных выше следствий из гипотезы Уотсона - Крика - Фриза однозначно не доказывает ее. Выполнение этих следствий не является окончательным доказательством того, что мутация произошла вследствие ошибки при копировании ДНК.
Рассмотрим коротко экспериментальные доказательства указанных трех положений.
1. Существование мутаций, состоящих в замене одной пары оснований. Мы не будем останавливаться на этих данных, потому что они подробно рассмотрены в других обзорах [103, 104].
2. Гипотеза Уотсона - Крика - Фриза предполагает два механизма замен. Косвенным свидетельством их существования служат результаты опытов по реверсии rII-мутантов фага Т4, которые были кратко рассмотрены выше. В пользу их существования говорят также результаты кинетических опытов по индукции реверсий у триптофаннедостаточных мутантов S. typhimurium с помощью 5-бромдезоксиуридина [105]. В этих опытах в культуру try--бактерий, синтез тимина у которых был подавлен аминоптерином, добавляли 5-бромдезоксиуридин. Бактерии делились, происходил синтез ДНК, в которую включался 5-бромурацил. После определенного промежутка времени бактерии отмывались от аминоптерина так, что у них начинался синтез собственного тимина. Включение в ДНК бромурацила при этом прекращалось. Оказалось, что у некоторых штаммов try- ревертанты дикого типа продолжали появляться и после того как бромурацил перестал включаться в ДНК, в то же время у других штаммов возникновение ревертантов прекращалось. Именно такую картину можно ожидать на основании гипотезы Уотсона - Крика - Фриза. Мутации, возникающие вследствие ошибок репликации, должны происходить и после удаления мутагена из среды, так как включившийся в ДНК бромурацил продолжает вызывать ошибки и в том случае, когда его включение в ДНК прекратилось. Поэтому можно предположить, что у мутантов, продолжавших давать реверсии после прекращения включения бромурацила, в мутантной точке стоит пара А-Т. Напротив, ошибки включения могут происходить только в том случае, если бромурацил присутствует в среде и включается в ДНК-Поэтому можно считать, что у мутантов, не дающих реверсии после отмыва аминоптерина, в мутантной точке стоит пара Г-Ц.
Еще одно свидетельство в пользу гипотезы Уотсона - Крика - Фриза в рассматриваемой работе заключается в том, что стабильные мутанты начинают появляться только после второй репликации в присутствии бромурацила.
Сходные результаты были получены в работе [106] на фаге Т4. В ней изучались мутации е- → е+ в гене е, контролирующем синтез лизоцима. Мутации индуцировались следующим образом. Бактерии Е. coli, растущие на среде без бромурацила, зарат жались фагами, в ДНК которых почти весь тимин был замещен бромурацилом. При этом мутации е- → е+ возникали только у части е--мутантов. Этот результат позволяет предположить, что у мутантов, давших возврат к дикому типу, в мутировавшей точке стоит пара А-Т.
3. По модели Уотсона - Крика - Фриза, нормальная ДНК, в результате ошибки при репликации, кроме мутантной дает еще нормальную дочернюю ДНК. У фагов репликацией ДНК и ограничивается удвоение "хромосомы", состоящей из одной двунитчатой молекулы ДНК. Поэтому после ошибки репликации один из дочерних фагов должен быть мутантным, а другой дикого типа. Если мутация - ошибка репликации - происходит на поверхности агара, то следует ожидать, что мутантные колонии будут содержать, кроме мутантов, фаги дикого типа. Смешанные колонии могут появиться и в том случае, если мутаген не индуцирует ошибки репликации, а просто изменяет одну нить покоящейся ДНК.
Детальное изучение причин, вызывающих появление смешанных колоний у фагов Т4, было проведено в работе Грина и Крига [107]. Они индуцировали мутации, обрабатывая внеклеточный фаг этилметансульфонатом. Все возникшие при этом бляшки r-типа содержали, кроме мутантов, фаги дикого типа.
Если появление смешанных (крапчатых) бляшек вызвано тем, что мутаген вызвал мутацию в покоящейся ДНК внеклеточного фага, но затронул только одну нить, то кинетика появления мутантов должна иметь следующий вид: после первой репликации ДНК появятся мутации, а при дальнейших репликациях новых мутаций не возникнет.
Грин и Криг изучали кинетику появления мутантов следующим образом. В большое количество пробирок с бактериями они высевали обработанный мутагеном фаг в таком количестве, чтобы в среднем в каждой пробирке возникло меньше одной мутации. Тогда, зная темп деления мутантов, можно по их числу в пробирке определить, при какой репликации произошла мутация. Исследуя число мутантов в большом количестве пробирок, можно установить зависимость возникновения мутации от времени.
Оказалось, что мутации возникают не только после первой, но и после второй, третьей и последующих репликаций. Причем вероятность возникновения мутации одинакова при всех репликациях. Проще всего этот результат объяснить тем, что ДНК, обработанная мутагеном, переходит в состояние, в котором могут часто происходить ошибки при репликациях. К сожалению, этот вывод не однозначен. Можно предположить, что обработанная мутагеном ДНК переходит в метастабильное состояние, которое с определенной вероятностью превращается в мутантное. Разница между этими предположениями заключается в том, что когда мутации происходят вследствие ошибок при копировании ДНК, то мутантной становится вновь синтезированная ДНК, а родительская ДНК остается нормальной и может еще раз произвести ошибку. Таким образом, в этом случае в растущей культуре имеется постоянное число нитей ДНК, время от времени дающих новые мутации. Если же мутанты возникают в результате перехода метастабильного состояния в мутантное, то мутантной становится ДНК, обработанная мутагеном. Поэтому данная молекула уже не способна давать начало новым мутациям. В результате число молекул ДНК, способных давать новые мутации, уменьшается со временем по экспоненте. По гипотезе ошибок копирования вероятность возникновения мутаций остается постоянной во времени, а по гипотезе метастабильного состояния эта вероятность убывает по экспоненте. Однако разница между этими кривыми так мала (из-за малой частоты мутаций), что сделать выбор между ними по экспериментальным данным невозможно.
Если опыты Грина и Крига и не дают оснований, чтобы сделать выбор между этими двумя возможными объяснениями задержки появления мутантов, то они исключают третью, тривиальную возможность, которую, однако, часто бывает трудно проверить [108]. Эта возможность заключается в том, что мутаген при обработке внеклеточного фага лишь прикрепляется к ДНК, а потом, когда она проникает в бактерию, освобождается. Поэтому естественно, что в его присутствии все время появляются новые мутации. Чтобы проверить эту возможность, бактерии одновременно заражали двумя разными rII-мутантами. Одного из них, не дававшего реверсий под действием этилметансульфоната, перед заражением обработали этим мутагеном. Другого же, способного давать реверсии, не обрабатывали мутагеном. Если бы мутаген освобождался в бактерии, то при таком совместном заражении второй мутант смог бы дать реверсию. На самом же деле этого не наблюдалось.
При переходе от фагов к бактериям изучение расщепления нитей ДНК при мутациях затрудняется тем обстоятельством, что у бактерий может быть несколько ядер. Поэтому появление смешанных колоний может объясняться тем, что у родоначальницы этой колонии мутировало только одно ядро. Удалось, однако, найти зависимость между числом смешанных колоний и числом ядер [109]. При этом оказалось, что для большинства одноядерных бактерий при мутациях, индуцированных ультрафиолетовым светом, расщепление ДНК не наблюдается. Такую же ситуацию отметили и при индукции мутаций азотистой кислотой. В противоположность этому, мутации, вызванные распадом Р32, входящего в состав ДНК, дают расщепление.
У многоклеточных организмов, и в частности у плодовой мушки, наблюдаются мутации, проявляющиеся в виде мозаики мутантных и немутантных тканей. Это явление представляет собой аналогию со смешанными колониями у микроорганизмов. Большая часть мутаций, индуцированных в спермиях плодовой мушки рентгеновскими лучами, не приводит к мозаичности. Несколько больше мозаик возникает при обработке спермиев некоторыми химическими мутагенами [110].
Для того чтобы объяснить отсутствие мозаик при действии рентгеновых лучей существуют по крайней мере две возможности. Одна из них заключается в том, что при мутации одновременно комплементарным образом изменяются обе нити ДНК, в результате обе нити ДНК становятся мутантными. Мёллер и его сотр. [111] предполагают, что именно этим объясняется отсутствие мозаичности у плодовой мушки при индукции мутаций рентгеновскими лучами. Авторы считают, что рентгеновские лучи вызывают одновременный разрыв связей сахар - основание у обоих оснований комплементарной пары в ДНК. Затем эта пара за счет вращения вокруг оси ДНК меняет ориентацию на 180°, и связи с сахарами восстанавливаются (ротационная гипотеза). Таким образом, одновременно изменяются обе нити. Ни за, ни против этой гипотезы нет никаких химических данных. Другая возможность для объяснения отсутствия расщепления при мутациях состоит в том, что в молекуле ДНК, на которую подействовал мутаген, потомство дает лишь одна нить. Особенно вероятным кажется это объяснение для отсутствия расщепления при индукции мутаций у бактерий с помощью азотистой кислоты и ультрафиолетового света. И азотистая кислота, и ультрафиолетовые лучи вызывают образование сшивок между комплементарными нитями ДНК, которые мешают их расхождению при тепловой денатурации. Отсутствие расщепления ДНК у бактерий при мутациях, индуцированных ультрафиолетовыми лучами и азотистой кислотой, наблюдалось в тех условиях, когда бактерии получали много "ударов", т. е. ДНК была затронута в нескольких местах. Поэтому можно представить два следствия обработки данными мутагенами: первое состоит в том, что между нитями ДНК образуется сшивка, в результате чего одна из нитей при репликации не дает потомства; второе заключается в том, что в другом месте ДНК за счет дезаминирования оснований возникнет мутация. В этом случае расщепление не наблюдается.
Возможна и такая гипотеза: если энергия сшивки больше энергии связи основания с сахаром, то при репликации во время расплетания нитей может порваться связь одного из оснований с сахаром. На освободившееся место включится любое основание, что с большой вероятностью приведет к мутации. В другой же нити место сшивки помешает репликации. Поэтому будет синтезирована лишь мутантная ДНК.
Приведенные выше гипотетические объяснения нерасщепления ДНК при некоторых мутациях основаны на предположении, что мутация происходит в покоящейся ДНК. Объяснения, основанные на предположении, что мутации, не дающие расщепления, происходят в результате ошибки репликации выглядят очень искусственно. Поэтому отсутствие расщепления при мутации рассматривается как сильный довод в пользу того, что эта мутация произошла в результате изменения покоящейся ДНК. Однако не ясно, достаточно ли этого предположения для объяснения существования мутаций, не дающих расщепления. Дело в том, что мы не знаем, как организована ДНК в хромосомах организмов более сложных, чем вирусы. Электронномикроскопические исследования заставляют предположить, что хромосомы состоят из многих нитей. Многие исследователи, однако, предполагают наличие в них только одной двойной нити ДНК, скрученной таким образом, что создается впечатление многонитчатой структуры [112]. Было предложено несколько моделей хромосомы, в основе которых лежит предположение о существовании небольших звеньев, возможно, белковой природы, которые соединяют попарно между собой отдельные молекулы ДНК. Если верно одно из основных предположений этих гипотез о том, что ген представлен в хромосоме одной копией (одной двойной нитью ДНК), то нет оснований ожидать, что характер расщепления мутаций у организмов с подобной хромосомой будет существенно иным, чем у вирусов. Если же хромосома состоит из многих нитей ДНК, скрученных в жгут, то характер расщепления должен быть иной. Известно, что ДНК и у бактерий и у высших организмов реплицируется в соответствии с полуконсервативной моделью. Хромосома как целое также реплицируется в соответствии с полуконсервативной моделью, т. е. родительский материал поровну распределяется между дочерними хромосомами, а вторые половины хромосом синтезируются заново. Это значит, что вновь синтезированные нити ДНК распределяются между дочерними хромосомами поровну, при этом теоретически возможны три крайних случая.
1. Вновь синтезированные молекулы ДНК распределяются между дочерними хромосомами так, что каждая родительская молекула ДНК передает дочерней хромосоме только по одной нити (рис. 9, а).
Рис. 9. Возможные схемы репликации многонитчатой хромосомы. Каждая молекула ДНК изображена в виде пары столбиков и помечена номером. Нити родительской ДНК зачернены, дочерней ДНК заштрихованы. Номера со штрихами указывают на то, от какой родительской молекулы ДНК произошла данная дочерняя молекула. Кружком обозначена мутация, которая копируется при репликации
2. Вновь синтезированные молекулы ДНК распределяются между дочерними хромосомами случайным образом (но поровну). При этом обе нити родительской ДНК могут оказаться в одной хромосоме (рис. 9, б).
3. Хромосома сначала делится так, что молекулы ДНК распределяются поровну, а затем происходит репликация ДНК и половинки хромосом достраиваются до целой хромосомы (рис. 9, в). На возможность такого механизма указывает работа Ивенса и Севаджа [113].
Если рецессивная мутация возникает вследствие ошибки репликации или затрагивает лишь одну нить ДНК, то по первому механизму следует ожидать, что такая мутация вообще никогда не проявится. По второму или третьему механизму такая мутация проявится только через несколько репликаций после изменений, происшедших в одной нити ДНК.
Поэтому, если хромосома состоит из многих нитей, очень трудно понять частое возникновение мутаций, затрагивающих весь организм.
Если мутации возникают в результате ошибок при копировании ДНК, то можно ожидать, что частота таких мутаций в единицу времени должна возрастать с увеличением темпа репликаций. Эту зависимость Новик и Сцилард изучали в химостате - приборе, позволяющем регулировать темп деления клеток [114], в нем клетки растут в сосуде, через который протекает поток питательной среды (рис. 10). Скорость потока подбирается таким образом, чтобы поступление питательных веществ в сосуд с клетками было меньше максимальной скорости деления этих клеток в данной среде. Популяция в сосуде увеличивает свои размеры до тех пор, пока ее рост не ограничивается поступлением питательных веществ. Скорость деления клеток при этом равняется скорости поступления питательных веществ. Хотя клетки находятся в фазе экспоненциального роста, их число в сосуде остается постоянным, поскольку прирост популяции компенсируется вымыванием. Если вероятность возникновения мутации за время одного поколения клеток равна а, то отношение числа мутантов (m) к общему числу клеток (n) должно расти как
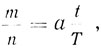
где t - время, а Т - период деления клеток. Новик и Сцилард изучали мутации устойчивости кишечной палочки к фагам Т5 и Т6. Варьируя периоды деления бактерий от 2 до 12 час, они нашли, что темп мутирования в единицу времени не зависит от периода деления. Проще всего это объяснить тем, что мутации не связаны с делением клеток и с репликацией ДНК, а просто накапливаются по мере "старения" ДНК. Этот вывод, однако, не Однозначен. Можно предположить, что мутации" происходят только во время репликации (не обязательно даже в результате ее) и продолжительность репликации ДНК пропорциональна периоду деления клетки. Это предположение кажется, весьма разумным потому, что ДНК синтезируется в кишечной палочке в течение почти всего периода между делениями [115].
Рис. 10. Схема химостата (объяснение см. в тексте)
В опытах Новика и Сциларда темп делений регулировался концентрацией питательных веществ. Как мы увидим в дальнейшем, от их концентрации может сильно зависеть частота мутаций. Не исключено, что и на мутации, которые изучали Новик и Сцилард, влияет концентрация питательных веществ.
Когда удалюсь заставить клетки делиться быстрее чем за два часа, то обнаружилась зависимость темпа мутаций от темпа делений [116]. Отсюда следует, что, возможно, устойчивость к фагам Т5 и Т6 возникает в результате двух классов мутаций: одни мутации появляются в результате ошибок при репликации, другие - в покоящейся ДНК. Ни одна из этих возможностей в опытах с химостатом не была изучена, поэтому опыты Новика и Сциларда оставляют вопрос открытым.
Очевидно, что удобнее всего изучать роль различных состояний ДНК в возникновении мутаций на таких системах, в которых имеются четко разделенные во времени периоды репликации и "покоя" ДНК. Такой системой являются вирусы, у которых во внеклеточном состоянии ДНК совершенно инертна, а в вегетативном состоянии интенсивно реплицируется. Удобны в этом отношении также клетки высших организмов. Синтез ДНК У них занимает лишь часть цикла деления. После окончания митоза, в начале интерфазы, не происходит синтеза ДНК (фаза G1). Затем наступает период синтеза ДНК (фаза 5), во время которой количество ДНК в интерфазном ядре удваивается, после чего синтез прекращается. За этой постсинтетической фазой (G2) следует новый митоз (рис. 11). Продолжительность этих фаз регулируется такими факторами, как уровень белкового синтеза, количество предшественников ДНК и т. д. [117]. Поэтому клетки высших организмов были бы идеальным объектом для изучения роли репликаций ДНК в возникновении генных мутаций. К сожалению, изучение генных мутаций в культуре клеток высших организмов находится в зачаточном состоянии и потому пока приходится ограничиваться изучением хромосомных аберраций, возникающих при воздействии мутагенов на разные стадии цикла ДНК.
Рис. 11. Цикл ДНК в митотических клетках (высших организмов: G1 - предсинтетическая стадия; S - стадия синтеза ДНК; G2 - постсинтетическая стадия
В результате этих экспериментов было установлено, что разрывы, а также воссоединения хромосом могут происходить после завершения синтеза ДНК, а именно в профазе и в конце интерфазы. Разрывы и воссоединения происходят и в фазе G1, т. е. до начала синтеза ДНК. Последнее утверждение убедительнее всего подтверждается опытами, в которых сравнивался выход аберраций в клетках, облученных один раз, с выходом аберраций в клетках, получивших ту же дозу, но в два приема [118]. Число двухударных аберраций, возникающих в результате воссоединения двух независимых разрывов хромосом, пропорционально квадрату числа разрывов, способных к воссоединению. Если разрывы, вызванные первой порцией облучения, успели воссоединиться (или потеряли способность воссоединяться) к моменту второго облучения, то новые двухударные аберрации смогут возникнуть только за счет воссоединения разрывов, вызванных второй порцией. В этом случае эффект двух последовательных облучений будет аддитивным. Если же ко времени второго облучения разрывы, вызванные первым облучением не успели воссоединиться, то поздние разрывы смогут воссоединяться не только сами с собой, но и с ранними разрывами. При этом эффект двух порций облучения будет больше аддитивного.
Оказалось, что в корешках конских бобов имеются два типа разрывов: одни воссоединяются примерно через минуту после облучения, другие - через один-два часа. Оба типа разрывов возникают и воссоединяются в фазе G1, когда синтез ДНК не идет. На воссоединение долгоживущих разрывов существенно влияет уровень белкового синтеза в клетке. Когда в течение всего промежутка времени между двумя облучениями суммарный синтез белка подавляется хлорамфениколом, то разрывы, индуцированные первым облучением, остаются открытыми и сохраняют способность воссоединяться с разрывами, индуцированными вторым облучением даже в том случае, если промежуток между облучениями длился более двух часов. На основании этих опытов было высказано предположение, что существует фермент, который залечивает разрывы.
Тем не менее есть данные, указывающие на то, что репликация ДНК может играть существенную роль в возникновении хромосомных аберраций. Речь идет о разрывах хромосом, индуцированных 5-фтордезоксиуридином. Этот аналог тимидина, попадая в клетку, фосфорилируется и превращается в 5-фтордезоксиуридиловую кислоту. Последняя является активным конкурентным ингибитором фермента тимидилат-синтетазы, осуществляющего превращение уридиловой кислоты в тимидиловую. Когда эта реакция подавлена, синтез ДНК не может продолжаться из-за отсутствия тимидинтрифосфатов.
Если корешки конских бобов помещают в раствор фтордезоксиуридина, то через три часа начинают появляться поврежденные хромосомы. Повреждений не наблюдается, если одновременно с фтордезоксиуридином клеткам давать тимидин. Не наблюдается повреждений хромосом и в том случае, когда тимидин дается клеткам спустя некоторое время после помещения их в раствор ингибитора. Все это свидетельствует о том, что повреждения хромосом возникли в результате того, что хромосомы вступили в митоз, не завершив синтеза ДНК, и что для исправления этих повреждений необходим синтез ДНК [11].
Последнее положение подтверждается еще и тем обстоятельством, что среди аберраций, возникших в присутствии фтордезоксиуридина, почти не наблюдается перестроек, которые образуются в результате воссоединения разрывов. В отличие от разрывов, индуцированных фтордезоксиуридином, разрывы, индуцированные рентгеновыми лучами, могут воссоединяться и в условиях подавления синтеза ДНК. Это видно из того факта, что при комбинированном воздействии рентгеновыми лучами и фтордезоксиуридином не отмечается относительного уменьшения хромосомных аберраций, возникающих в результате воссоединения разрывов [119].
Если фтордезоксиуридин индуцирует разрывы, подавляя синтез ДНК, то очевидно, что его действие будет эффективно только в том случае, если клетки будут захвачены им в фазе S. К сожалению, разные авторы расходятся в оценке продолжительности фазы S у корешков конских бобов: одни нашли, что фтордезоксиуридин индуцирует разрывы в конце фазы S, другие, - что он эффективен и в фазе G2 [119]. Таким образом, вопрос об образовании разрывов в результате прекращения синтеза ДНК остается открытым.
Тимидин, как мы говорили, залечивает разрывы, вызванные фтордезоксиуридином, причем залечивает даже в том случае, когда его дают клеткам за час до анафазы, когда суммарный синтез ДНК заведомо завершен. Это, однако, не означает, что при снятии подавляющего действия фтордезоксиуридина локальный синтез ДНК не может идти в том месте, где произошло повреждение хромосомы.
3) Мутации и синтез белка
Влияние синтеза белка на частоту мутаций было обнаружено в работе Уиткин [120]. Она изучала зависимость выхода мутаций от числа делений клетки. Число делений регулировалось количеством питательных веществ. Чем больше их было в среде, тем больше делений совершали клетки. Уиткин индуцировала мутации у триптофаннедостаточных Е. coli, облучая ультрафиолетовыми лучами бактерии, суспендированные в буфере. Затем бактерии высевались на минимальные среды с различным содержанием питательного бульона. После лаг-периода, продолжительность которого была примерно обратно пропорциональна питательности среды, бактерии начинали делиться. Оказалось, что, чем богаче среда, тем больше на ней возникало мутаций от триптофаннедостаточности к независимости от триптофана.
В дальнейшем выяснилось, что на богатых средах возникает больше мутантов совсем не потому, что клетки могли разделиться большее число раз. Когда облученные бактерии делились сначала один раз (в среднем) на бедной среде, а затем переносились на богатую среду, выход мутантов был малым, хотя они и делились много раз. Меняя соотношение концентраций бульона в бедной и богатой среде, Уиткин обнаружила, что выход мутаций зависит только от концентрации бульона в бедной среде. Изменяя время, проведенное бактериями на бедной среде, удалось установить, что "чувствительный период", во время которого на выход мутаций влияет питательность среды, оканчивается примерно через час после облучения. Продолжительность его не зависит от концентрации бульона.
В других опытах вместо бульона к минимальной среде добавлялась смесь всех аминокислот примерно в тех же пропорциях, что и в бульоне. На таких средах наблюдался тот же эффект, что и на средах с бульоном: выход мутаций был пропорционален концентрации аминокислот во время "чувствительного периода" и не зависел от концентрации после его окончания. От концентрации витаминов, пуринов и пиримидинов в среде, применяемой после облучения, выход мутаций не зависел. На основании этих и некоторых других данных Уиткин предположила, что концентрация аминокислот или бульона регулирует скорость белкового синтеза, который в свою очередь влияет на частоту мутаций.
Эта гипотеза подтвердилась в опытах с хлорамфениколом - антибиотиком, специфически подавляющим белковый синтез. Обработка бактерий этим антибиотиком во время чувствительного периода резко уменьшала выход мутаций. После окончания чувствительного периода (через час после облучения) хлорамфеникол уже не влиял на частоту мутаций.
Итак, из работы Уиткин можно сделать вывод, что мутации наступают не сразу в момент облучения ультрафиолетом. Образование стабильных мутантов прекращается примерно через час после облучения. Мутанты не возникают, если в течение этого часа не произойдет синтез белка.
В работе Хаас и Дудни [121] было обнаружено, что на выход мутаций, индуцированных ультрафиолетовыми лучами, влияет характер метаболизма бактерии не только после облучения, но и до облучения. Эти авторы нашли, что дрожжевые экстракты, добавленные к минимальной среде, в которой инкубировались предварительно синхронизированные бактерии, значительно повышают выход мутаций. Такое же действие оказывала смесь пуринов и пиримидинов, а также витамины рибофлавин и парааминобензойная кислота. Добавление аминокислот в среду, на которой бактерии росли до облучения, не влияло на частоту мутаций.
Выход мутаций зависел не только от характера среды, используемой перед облучением, но и от того, на какой стадии деления бактерий происходило это облучение. Наибольший выход мутаций наблюдался в том случае, когда бактерии облучались незадолго и во время деления ядра. Когда облучение происходило на стадии клеточного деления, выход мутаций значительно снижался. После завершения деления клеток вновь наступало увеличение выхода мутаций. Эти результаты указывают на тесную корреляцию между максимальной частотой мутаций и максимумом синтеза ДНК.
Самый важный факт, установленный в работе Хаас и Дудни, заключается в том, что выход мутаций не коррелирует с содержанием нуклеиновых кислот в бактериях в момент облучения. В культурах, инкубированных перед облучением на минимальной среде и на среде, содержащей пурины и пиримидины, было примерно одинаковое количество как ДНК, так и РНК, однако выход мутаций во второй культуре был гораздо выше, чем в первой. Эти результаты наводят на мысль о том, что мутации связаны не с прямым действием ультрафиолетовых лучей на ДНК, а вызваны взаимодействием с предшественниками нуклеиновых кислот. Возможно, что это взаимодействие приводит к тому, что предшественники, активированные ультрафиолетовыми лучами, участвуя в синтезе ДНК, вызывают ошибки при ее копировании. Если учесть данные Уиткин, подтвержденные Хаас и Дудни, то следует предположить, что включение активированных предшественников зависит от уровня белкового синтеза после облучения. Это предположение хорошо согласуется с тем, что за время чувствительного периода, обнаруженного Уиткин, происходит удвоение ДНК в культуре; поэтому кажется весьма вероятным, что именно продолжительность синтеза ДНК определяет продолжительность чувствительного периода.
Совсем по-другому можно интерпретировать результаты Уиткин, Хаас и Дудни в свете данных о роли синтеза белка и РНК в регуляции цикла ДНК. В экспоненциально растущей культуре бактерий, в отличие от клеток высших организмов, синтез ДНК продолжается в течение почти всего цикла деления. Однако и для бактерий удалось показать, что у них имеется цикл ДНК, в котором период синтеза сменяется небольшим периодом покоя. Если синтез ДНК начался, то он заканчивается независимо от того, идет или не идет одновременно с ним синтез белка и РНК. Но для начала нового цикла синтеза ДНК необходимо, чтобы происходил синтез белка и (возможно, или) РНК [115]. На цикл ДНК влияют те же факторы, что и на частоту мутаций (последующие опыты Хаас и Дудни указывают на зависимость частоты мутаций скорее от предшественников РНК, чем ДНК). Возможно, это не является случайным совпадением. Если в стадии синтеза и в стадии "покоя" ДНК ультрафиолетовые лучи с разной вероятностью вызывают ее изменения, то влияние синтеза белка после облучения и предшественников РНК до облучения может быть вызвано тем, что эти факторы регулируют соотношение длительности стадии "покоя" и синтеза.
6. Этапы мутационного процесса
Изучение временных связей мутационного процесса не вскрывает его деталей и не объясняет полностью специфичность мутагенов. Однако на основании сведений, почерпнутых в этих исследованиях, можно получить некоторые общие представления о ходе мутационного процесса и выделить некоторые его этапы. На каждом из этих этапов проявляется специфичность мутагена.
1. Мутаген должен проникнуть в клетку и добраться до "важных" молекул, изменение которых приведет к мутации. Проникающая способность мутагена зависит не только от скорости диффузии. Дело в том, что в клетке мутаген, как правило, способен реагировать с большим количеством "неважных" молекул. В результате этого значительная часть молекул мутагена по дороге к "важным" молекулам теряется в реакциях с многочисленными "неважными" молекулами. Поэтому, если два мутагена при одной и той же молярной концентрации дают разный мутагенный эффект, это вовсе не обязательно означает, что они взаимодействуют с ДНК с разной эффективностью (на одну молекулу мутагена). Проникновение и распределение мутагена внутри клетки практически не изучено. Возможно, что некоторая региональная специфичность может возникнуть уже на этом уровне, если мутаген неравномерно распределится в клетке вдоль хромосомы.
2. Внутри клетки мутаген может образовать мутагенное производное, более специфическое, чем исходный мутаген. В качестве примера метаболического превращения мутагена в организме можно указать на превращения азотистого иприта. В клетках печени крыс и кроликов имеется ферментная система, окисляющая метильную группу азотистого иприта HN2 в формальдегид, который также является мутагеном [122].
Мутаген может прямо не реагировать с ДНК. Его действие приведет к тому, что в клетке будет накапливаться какой-либо другой мутаген, который и вызовет мутацию. Так, по-видимому, действует цианистый калий, отравляющий фермент каталазу. В результате этого отравленный фермент не разлагает мутагенные перекиси, возникающие при метаболизме клетки. Не является прямым мутагеном также и фтордезоксиуридин, подавляющий фермент тимидилат-синтетазу, что приводит к голоданию клетки по тимину. Отсутствие тимина вызывает мутации.
3. Мутаген (или его производное) должен прореагировать с ДНК. Однако хромосома в большинстве случаев состоит не только из ДНК. В ее состав входят белки, по-видимому весьма специфически связанные с ДНК. Характер этой связи также может влиять на специфичность мутагена. Специфичность может быть вызвана, например, конкуренцией за мутаген между хромосомным белком и ДНК. Если белки в разных местах хромосомы обладают разным сродством к мутагену, то эти места будут отличаться и по вероятности взаимодействия ДНК с мутагеном.
О специфическом влиянии белка на характер взаимодействия мутагена с нуклеиновыми кислотами прямо указывает работа [123], в которой было обнаружено, что РНК вируса табачной мозаики (ВТМ) по-разному взаимодействует с азотистой кислотой в свободном состоянии и в составе вируса. В чистой РНК ВТМ происходит дезаминирование аденина, цитозина и гуанина, в том время как в целом вирусе, когда РНК связана с белком оболочки, дезаминируются только аденин и цитозин. В данном случае роль белка не сводится только к прикрыванию отдельных участков РНК, так как гуанин в РНК распределен вперемежку с другими основаниями и не образует больших блоков.
4. Мутаген реагирует с ДНК. Этот этап обычно называют первичной мутацией. О специфичности на этом этапе можно судить по химическим реакциям мутагена с ДНК в растворе, сравнивая их с биологическим эффектом, вызванным обработанной ДНК при попадании ее в клетку. Таким образом систематически изучались только мутации в белке оболочки ВТМ. Мутации индуцировали, обрабатывая азотистой кислотой РНК, выделенную из вируса. Эта РНК инфекционна. При заражении ею листьев табака образуется потомство вирусов, среди которых наблюдаются мутации. Менее "чистым" методом изучения первичных мутаций является индукция мутаций с помощью обработки мутагеном внеклеточного вируса, поскольку здесь на взаимодействие мутагена с ДНК может существенно влиять белок оболочки.
5. Результат первичной мутации часто требует стабилизации. Разные первичные мутации стабилизируются при различных условиях. Одним для стабилизации необходим синтез белка, другим нужна репликация ДНК, третьим просто требуется время, для того чтобы метастабильное состояние, возникшее в результате первичной мутации, превратилось в стабильное. Если мутаген не только индуцирует первичную мутацию, но и влияет на процессы, от которых зависит стабилизация мутации, то его специфичность может проявиться и на этом уровне. Известно, например, что некоторые мутации требуют для стабилизации белкового синтеза, тогда как другие не требуют его [124]. Если мутаген еще и подавляет синтез белка, то мутации второго типа, получат преимущество перед первыми.
6. После того как мутировавший ген окончательно перешел в новое мутантное состояние, он должен начать работать по-новому и внести, таким образом, изменения в биохимические процессы в клетке, ведущие к появлению нового, мутантного признака. Время, которое уходит на проявление нового признака, может в принципе зависеть от мутагена, причем по-разному для различных мутаций. В настоящее время не доказано существования специфичности на таком фенотипическом уровне, однако косвенные указания делают такую специфичность весьма вероятной. Известно довольно много химических и физических воздействий, приводящих к значительной модификации проявления признака организма и не затрагивающих при этом его генотипа. Некоторые воздействия осуществляют это очень специфично, т. е. влияют на одни мутации и не влияют на другие. Например, в присутствии 5-фторурацила некоторые rII-мутанты фага Т4 приобретают фенотипические свойства дикого типа [92].
Мутация представляет собой процесс, протекающий в несколько этапов, и это имеет особое значение для понимания неаддитивного действия мутагенов. Когда организм или клетки подвергаются одновременному или последовательному действию нескольких мутагенов, то часто мутагенный эффект не является суммой эффектов от каждого мутагена, примененного по отдельности. В большинстве случаев неаддитивность, по-видимому, возникает не на уровне взаимодействия с ДНК, так как частота мутаций мала и поэтому маловероятно, что два мутагена "встретятся" в одном и том же месте ДНК и помогут или помешают друг другу прореагировать с ней. Если интерференция мутагенов происходит не на уровне взаимодействия ДНК, то изучение неаддитивности может помочь в изучений специфичности действия мутагенов. В качестве примера такого подхода к проблеме можно привести следующую работу [125]: в штамме нейроспоры, недостаточном по аденину и инозитолу, диэпоксибутан четко различал эти локусы: индуцировал очень мало мутаций, в инозитольном локусе и много в адениновом. Ультрафиолетовые лучи индуцировали в инозитольном локусе чуть больше реверсий, чем в адениновом. Авторам казалось, что такой малоспецифичный в химическом отношении мутаген, как диэпоксибутан, вряд ли обладает специфичностью на уровне взаимодействия с ДНК. Более вероятно, что специфичность проявляется на более позднем уровне. В частности, возможно, что диэпоксибутан способствует протеканию реакций, которые приводят к началу синтеза аденина и мешает реакциям, приводящим к началу синтеза инозитола. На основании этой гипотезы следовало ожидать, что диэпоксибутан должен способствовать появлению адениновых мутаций независимо от того, были ли они индуцированы его собственным действием или каким-либо другим мутагеном. Проверяя эту гипотезу, авторы изучали возникновение мутаций под действием ультрафиолетовых лучей в клетках, которые сразу после облучения или непосредственно перед ним подвергались действию диэпоксибутана. В клетках, обработанных диэпоксибутаном, последующее облучение ультрафиолетовыми лучами вызывало гораздо больше адениновых реверсий, чем инозитольных. При этом в инозитольном локусе наблюдалась аддитивность действия двух мутагенов, в то время как в адениновом локусе комбинированная обработка давала существенно больше мутаций, чем сумма мутаций, полученных при действии этих мутагенов порознь (табл. 11). В настоящее время не ясно, как объяснить эти результаты. Обработка диэпоксибутаном после ультрафиолетового облучения не вызвала ожидаемого эффекта, что делает маловероятной первоначальную гипотезу авторов.
![Таблица 11. Эффект комбинированного воздействия двух мутагенов на нейроспору [125]](pic/000053.jpg)
Таблица 11. Эффект комбинированного воздействия двух мутагенов на нейроспору [125]
Одним из очень важных примеров неаддитивного действия двух обработок является взаимодействие мутаген - антимутаген. Антимутагены - вещества, понижающие частоту мутаций, индуцированных или возникающих спонтанно, - были открыты Новиком и Сцилардом в опытах с химостатом [114]. Среди антимутагенов, уменьшающих процент мутаций, индуцированных аналогами азотистых оснований, наибольшей активностью обладали рибонуклеозиды: аденозин, гуанозин, инозин. Эти антимутагены влияли, однако, не на все мутагены. Например, действие тетраметилмочевой кислоты и бензимидазола не подавлялось ими. Не влияли они и на действие ультрафиолетовых и γ-лучей.
Как и в случае неаддитивности вообще, прежде всего возникает вопрос, на какой стадии мутационного процесса антимутаген подавляет возникновение мутаций? Для антимутагенов, найденных Новиком и Сцилардом, этот вопрос остается пока открытым, хотя более вероятным кажется предположение, что действие этих антимутагенов проявляется до того, как мутаген вызовет изменения в ДНК.
Проще всего обстоит дело, когда антимутаген просто разрушает мутаген. Так, по-видимому, действует каталаза, которая разлагает мутагенные перекиси. Большинство известных антимутагенов действует более сложно. Тимин, добавленный в избытке, снимает мутагенное действие таких галогенозамещенных аналогов тимина, как 5-хлор-, 5-иод- и 5-бромурацил. Чем сильнее эти аналоги разбавлены тимином, тем меньше их включается в ДНК. Вероятность мутации от этого снижается. Антимутагенное действие тимина против 5-фтордезоксиуридина вызвано, по-видимому, тем, что он заменяет собой тот тимин, который клетка обычно синтезирует сама и который она не может синтезировать в присутствии фтордезоксиуридина.
Существование неаддитивного действия мутагенов открывает перспективный путь к осуществлению направленного мутагенеза. Для этого необходимо найти вещества - "узкие специалисты", которые специфически влияют не на весь мутационный процесс, а только на его отдельные этапы. Тогда нужную мутацию можно получить, используя комбинированное применение таких веществ.
Пока поиски эффективных комбинированных воздействий ведутся, как правило, вслепую. В ряде случаев они увенчались частичным успехом. В качестве примера можно привести работу, в которой получались высокоэффективные штаммы, производящие антибиотик эритромицин [126]. Результаты этой работы приведены в табл. 12. Из нее видно, что комбинированное действие этиленимина и ультрафиолетовых лучей увеличивает вероятность возникновения высокопродуктивных штаммов, в то время как комбинированное действие рентгеновых лучей с этиленимином уменьшает эту вероятность.
![Таблица 12. Отбор высокопродуктивных штаммов продуцентов антибиотика эритромицина при комбинированном воздействии мутагенов [126]](pic/000054.jpg)
Таблица 12. Отбор высокопродуктивных штаммов продуцентов антибиотика эритромицина при комбинированном воздействии мутагенов [126]
7. Заключение
Существует мнение, заключающееся в том, что процесс, подчиняющийся статистическим законам (таким является процесс мутаций), не управляем, а следовательно, не надежен и малопригоден для практического использования. Действительно, вероятностный характер процесса мутаций не позволяет предсказать, в какой именно клетке произойдет мутация. Однако для практической цели - выведения организмов с новыми свойствами - не важно, в какой именно особи произойдет нужное нам изменение. Важно, чтобы это событие происходило часто. Выше мы познакомились с некоторыми фактами, свидетельствующими о том, что соотношение частот различных мутаций в значительной мере меняется в зависимости от примененного мутагена. Особенно сильно это проявляется при индукции обратных мутаций у микроорганизмов.
Если предельно упростить и схематизировать задачу направленного мутагенеза, то ее можно сформулировать следующим образом. Чтобы с высокой частотой вызвать полезное нам изменение наследственных свойств, необходимо, во-первых, с большой вероятностью произвести изменение в одном или нескольких избранных местах хромосомы. Во-вторых, в этих избранных местах нужно вызвать не любое, а лишь нужное нам химическое изменение. За последнее время были достигнуты значительные успехи в осуществлении второй (более легкой) части задачи получения направленного мутагенеза. ДНК можно изменить многими способами, однако уже сейчас известны мутагены, изменяющие ДНК лишь одним или двумя способами. Известно довольно много о том, какие это изменения и почему мутаген предпочтительно индуцирует именно их.
Гораздо меньше нам известно о том, почему некоторые мутагены чаще производят изменения в определенных местах хромосомы. Для понимания и использования этого явления фундаментальное значение имеет тот факт, что мутация - это не просто акт взаимодействия мутагена с ДНК, а сложный процесс, протекающий в несколько этапов. Сложность процесса, конечно, создает большие трудности в его изучении, но именно сложность открывает большие возможности регуляции этого процесса, поскольку на частоту мутаций можно влиять не только на уровне взаимодействия с ДНК, но и на других этапах возникновения мутаций.
Литератуpa

|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'