
Глава IV. Генетика соматических клеток млекопитающих и человека in vitro (Н. Б. Варшавер)
1. Введение
Успехи в развитии генетики за последние 20 лет в значительной степени связаны с исследованиями в области генетики микроорганизмов, достижения которой способствовали разработке новой главы учения о наследственности - молекулярной генетики. Специфические методы, принципиально отличные от методов классической генетики, позволили путем прямых экспериментов показать главенствующую роль ДНК в наследственности, широко разработать проблемы биохимической генетики, вскрыть тонкую структуру гена. Наряду с этим происходило развитие и совершенствование методов культивирования клеток высших позвоночных. Применение полусинтетических питательных сред и попытки замены их на полностью синтетические среды создают все более контролируемые условия, позволяющие исследовать различные стороны жизнедеятельности клеток в точных условиях эксперимента. Отказ от выращивания вне организма кусочков тканей и использование для посева суспензии изолированных клеток дают возможность говорить скорее о культуре клеток in vitro, а не о культуре тканей, в которой до известной степени сохраняются сложные условия внутритканевого взаимодействия. Такие клеточные культуры в течение более или менее длительного срока (а иногда и неограниченно долго) сохраняют способность жить и размножаться вне организма. Каждая клетка обладает в этих условиях известной степенью автономности, о чем свидетельствует возможность получения культуры от одной клетки. Эти особенности дают основания сравнивать культуры клеток млекопитающих и человека с культурами микроорганизмов.
Применение при культивировании клеток млекопитающих методов, сходных с методами культивирования микроорганизмов, позволяет рассчитывать на то, что изучение генетики соматических клеток in vitro сможет явиться новой и важной главой генетики млекопитающих и человека. Перспективность этого направления становится еще более очевидной, если учесть значительные трудности и ограничения, неизбежные при применении методов классической генетики в отношении человека и животных, характеризующихся небольшим числом потомков и длительным циклом размножения.
Клетка in vitro представляет собой удобную модель для изучения как некоторых теоретических вопросов генетики, так и вопросов, имеющих большое значение для здравоохранения.
Кратковременность одной клеточной генерации, быстрая смена поколений и возможность получения огромного материала, насчитывающего миллионы и миллиарды клеток за короткий срок, позволяют точными количественными методами изучать закономерности мутационного процесса, естественного и индуцированного различными физическими и химическими факторами. Выявление различных биохимических маркеров клетки, создание селективных сред, позволяющих обнаруживать даже крайне редкие мутации, дают возможность исследовать биохимические этапы становления признака, связь между геном и ферментом.
Культивирование клеток млекопитающих и человека вне организма открывает большие возможности для исследования генетической опасности радиации и генетики злокачественного роста. Как будет показано ниже, особенности размножения клеток при длительном культивировании и частое возникновение в этих условиях злокачественности, позволяют изучить природу генетических изменений, лежащих в основе такого превращения, а также особенности обмена злокачественной клетки, ее реакции на воздействие лекарственных веществ и излучений. Большое значение приобретает генетика клеток in vitro для вирусологии при изучении проблемы взаимодействия вируса и клетки.
В задачу настоящей главы входит изложение основных достижений генетики соматических клеток, культивируемых вне организма. В связи с тем, что возможность успешного изучения клеток in vitro могла быть обеспечена лишь при условии разработки специальных методов культивирования, первый раздел посвящен рассмотрению методов, имеющих с этой точки зрения принципиальное значение. Во втором разделе будут изложены результаты исследования мутационного процесса, естественного и индуцированного различными мутагенами. Этот раздел включает наибольшее количество исследований. В третьем разделе будут приведены данные, показывающие возможность передачи генетической информации в клетках человека и млекопитающих in vitro. Подобные работы представляют особый интерес в связи с перспективой проведения генетического анализа.
2. Методы исследования
К основным методам, обеспечившим проведение генетических: исследований, следует в первую очередь отнести получение генетически однородных клеточных линий. Поскольку культуры клеток представляют собой популяции, ведущие начало от большого числа клеток, можно с уверенностью предположить, что они являются генетически гетерогенными. Задача заключается, следовательно, в том, чтобы научиться получать линии, происходящие от одной клетки, т. е. клеточные клоны, как это успешно осуществляется у бактерий.
Вторая задача состоит в отыскании условий, способствующих уменьшению степени генетической изменчивости в клетках культур (см. "Естественный мутационный процесс") путем поддержания относительной стабильности кариотипа и создания полностью синтетических питательных сред, позволяющих обеспечить максимально контролируемые и воспроизводимые условия эксперимента.
1) Получение клеточных клонов
Возможность деления одиночной клетки in vitro была отмечена еще в 20-х годах [1] в культуре саркомы Роуса. Позднее [2] мы находим описание деления одиночных клеток в культуре лейкоцитов морской свинки. Клетки, лежащие изолированно на далеком расстоянии от других клеток культуры, начинали делиться, однако, лишь после длительного латентного периода (лаг-периода). Это позволило предположить, что для вступления клетки в митоз необходимо наличие в культуральной среде каких-то метаболитов, которые клетки вырабатывают в процессе своей жизнедеятельности. В массовой культуре накопление продуктов обмена происходит значительно скорее, чем в культуре одиночных клеток. Одиночная клетка может начать деление лишь после того, как она сама выработает или до нее дойдут продукты обмена, выработанные другими клетками, присутствующими в культуре.
Лишь в конце 40-х годов стали появляться работы, в которых получение клеточных клонов являлось не побочным результатом эксперимента, а основной целью. Все работы по получению клеточных клонов можно разбить на две категории в зависимости от того принципа, который был положен в их основу - на метод изоляции и размножения одиночных клеток и метод последовательных разведений клеточной взвеси до очень низких концентраций клеток.
Сущность первого метода заключается в изоляции одиночной клетки с помощью микрокапилляра и последующей ее инкубации во флаконах Карреля [3, 4]. В первых исследованиях успешные результаты были получены только при использовании сред, на которых предварительно выращивалось большое количество клеток, что подтверждает гипотезу о необходимости присутствия определенных продуктов клеточного обмена для осуществления деления клетки. Однако и в этих условиях процент успешных опытов был невелик. Предложенные в дальнейшем упрощения техники изоляции клеток и усовершенствование питательных сред позволили повысить эффективность экспериментов, что дало возможность получить значительное число клоновых линий из различных клеточных культур нормального и злокачественного происхождения.
Второй метод [5-8] заключается в посеве сильно разведенной взвеси в чашки Петри, всего около 100 клеток на чашку. С целью обеспечения непрерывного поступления в культуральную среду продуктов клеточного обмена, клеточную взвесь высевали на своего рода "питающий слой", представляющий собой пласт клеток, предварительно подвергнутый воздействию рентгеновых лучей в дозах 2000-5000 р. Облучение в таких дозах подавляет клеточное размножение, в то время как процессы обмена в клетках продолжают совершаться в течение некоторого периода времени. Дегенерация начинается только через несколько дней. Клетки, посеянные на такой питающий слой, дают начало изолированным колониям, причем эффективность посева может достигать 100%.
В дальнейшем была показана возможность получения клонов без применения питающего слоя в результате уменьшения механических повреждений при посеве, создания оптимальных условий культивирования, улучшения физиологического состояния клеток и точного определения состава сред, обеспечивающих потребности одиночных клеток при размножении. Эти усовершенствования позволили успешно получать клеточные клоны не только из перевиваемых линий злокачественного происхождения, таких, как линия HeLa (карцинома шейки матки), но и из нормальных тканей человека (конъюнктива, печень, почки), причем были получены клоны как эпителио-, так и фибробластоподобных клеток [9, 10]. На рис. 1 представлены колонии, выросшие из одиночных эпителиоподобных клеток линии амниона человека (A-I).
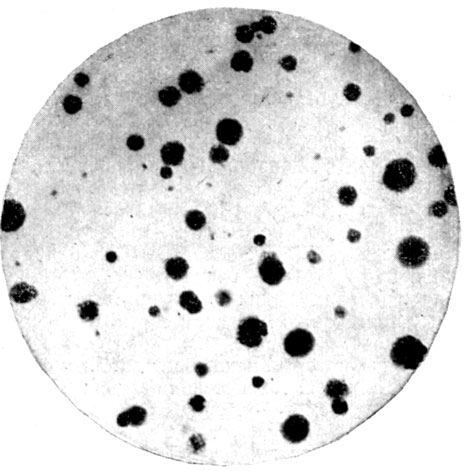
Рис. 1. Колонии, выросшие из одиночных эпителиоподобных клеток линии амниона человека А-1
Отказ от применения питающего слоя связан и со стремлением к упрощению методики, и с требованиями создания максимально контролируемых условий культивирования, поскольку использование питающего слоя связано с введением в культуральную среду большого количества веществ неизвестной химической природы.
Таким образом, в настоящее время разработаны достаточно удовлетворительные методы получения клеточных клонов. Метод изоляции одиночных клеток является более трудоемким, но и более точным. Его можно использовать в тех случаях, когда требуется получить одну или небольшое число клоновых линий. Метод последовательных разведений, хотя и допускает возможность ошибки (колония может происходить не из одной клетки), но вместе с тем дает в руки исследователя чрезвычайно простой метод получения массового материала, что имеет первостепенное значение для генетического исследования.
2) Культивирование диплоидных клеток
Многочисленные кариологические исследования (см. "Изменения кариотипа") показали, что перевиваемые клеточные линии и даже клеточные клоны относительно скоро после изоляции одиночной клетки обнаруживают изменчивость хромосомного набора. С другой стороны, первично эксплантированные эуплоидные клетки обладают ограниченным сроком жизни и в обычных условиях культивирования в большинстве случаев дегенерируют при пассажах через относительно короткое время. Высокая генетическая гетерогенность перевиваемых линий является обстоятельством, значительно затрудняющим генетические исследования, в частности исследования индуцированного мутационного процесса.
Попытка уменьшения степени генетической изменчивости, путем сохранения нормального диплоидного набора хромосом в последовательных пассажах, основана на той предпосылке, что анеуплоидия, возникающая в культурах, является следствием присутствия в средах каких-то ингибиторов, препятствующих нормальному протеканию митоза, в частности расхождению хромосом [11]. Задача, следовательно, сводится к подбору состава культуральной среды, который исключал бы или значительно уменьшал наличие различных токсических веществ и ингибиторов.
Основным отличием такой среды от обычных сред является замена в ней сыворотки взрослых животных эмбриональной коровьей сывороткой, богатой фетуином (α-глобулин).
Проведенные эксперименты показали, что при применении указанной среды и соответствующих методов обработки тканей и культивирования удается получить клеточные линии практически из любой ткани любого взрослого человека. Все клетки оказывались вытянутыми, фибробластоподобными, и сохраняли нормальный диплоидный набор в течение продолжительного времени (до года). Эпителиоподобные же клетки неизменно становились постепенно анеуплоидными.
Возможность произвольного получения культур не только из эмбриональных тканей имеет большое значение, так как позволяет изучать особенности клеток, взятых от индивидуумов с заведомо известными генетическими маркерами.
Предложенная в последнее время [12] более простая техника культивирования диплоидных клеток дает возможность чрезвычайно широко использовать этот метод для различных целей.
Так, помимо задач генетического исследования, необходимость культивирования эуплоидных клеток настоятельно диктуется задачами практической вирусологии, поскольку такие клетки могут успешно использоваться для выращивания в них вирусов и производства вирусных вакцин, безопасных для здоровья человека.
В методе, получившем в настоящее время апробацию Всемирной организации здравоохранения, в качестве исходного материала используются эмбриональные ткани и органы человека (кожа, мышцы, легкие, почки, сердце, тимус, щитовидная железа). Применяется среда Игла в солевом растворе Эрля с добавлением 10% телячьей сыворотки. Морфологический анализ показывает, что клетки диплоидных культур всегда характеризуются удлиненной веретенообразной формой и их удается сохранять приблизительно до 50-го пассажа (5-8 месяцев), после чего начинается фаза дегенерации. В течение этого времени хромосомный набор остается нормальным. Процент полиплоидных клеток бывает незначительным (не превышает 5), хромосомных перестроек не наблюдается.
Этот метод начинает использоваться в настоящее время во многих лабораториях различных стран мира, в первую очередь для производства вирусных вакцин, так как всесторонний анализ диплоидных культур выявил не только сохранение в них нормального кариотипа, но и отсутствие злокачественного превращения (см. "Изменения кариотипа"), часто наблюдающегося в перевиваемых линиях, что делает невозможным их использование в вакцинном производстве.
3) Синтетические среды
Знание химического состава сред для культивирования, имеющее, как уже отмечалось, большое значение для точного воспроизведения условий опыта, является необходимым условием при изучении биохимической генетики (ростовых потребностей клеток, изменений ферментативной активности).
За последние годы естественные среды (плазма, сыворотки, тканевые экстракты) все больше заменяются средами определенного состава, включающими необходимые аминокислоты, витамины, глюкозу и сбалансированный солевой раствор. Однако, как показывает опыт культивирования, в большинстве случаев неограниченного размножения клеток in vitro можно добиться только в том случае, если к данной среде добавить какую-нибудь биологическую жидкость, обычно сыворотку крови или эмбриональный экстракт, т. е. вновь внести в среду факторы, химическая природа которых известна не полностью.
В настоящее время имеется всего около 10 линий [13], которые удается поддерживать на полностью синтетической среде.
Вместе с тем функция сыворотки пока не вполне ясна. Основная масса белков клетки синтезируется, по-видимому, за счет присутствующих в среде свободных аминокислот, а сыворотка, вероятно, привносит какие-то неизвестные ростовые факторы.
Перенесение клеточной линии из среды, содержащей сыворотку, в безбелковую среду сопровождается, как это было показано на клоне мышиных фибробластов [14], резким изменением морфологии и уменьшением скорости роста. Несколько сублиний были, однако, успешно адаптированы к такой среде и в них постепенно восстанавливалась нормальная скорость роста.
Размножение линии мышиных клеток L на синтетической среде NCTC 107 удалось ускорить путем добавления сывороточного глобулина [15, 16].
Определение точного химического состава среды, обеспечивающего нормальный рост клеток, требует тщательного изучения их ростовых потребностей. Эти исследования, важные с точки зрения разработки новых методов, имеют большое значение для выявления мутантных форм с измененными потребностями в питательных веществах.
Работами ряда авторов было показано, что разные клеточные линии обладают специфическими для них потребностями в питательных веществах [17, 18]. Так, если потребности в аминокислотах человеческих клеток HeLa и мышиных клеток L качественно одинаковы, то оптимальные концентрации этих аминокислот в среде различны для двух линий.
Выявлены различия ростовых потребностей между эпителио- и фибробластоподобными клетками.
Если выращивание массовых культур на полностью синтетической среде весьма сложно, то размножение одиночных клеток в этих условиях представляет собой еще более трудную задачу, ввиду их большей "требовательности". Если, например, для роста массовых культур клеток мышиной лимфомы Р-338 необходимо присутствие в среде либо пирувата, либо l-серина, то для образования клонов необходимо присутствие обоих веществ [19].
Изучение роли отдельных компонентов сыворотки для размножения одиночных клеток (в большинстве работ исследовалась клоповая линия S3 HeLa) показало, что при длительном диализе макромолекулярная фракция сыворотки теряет свою активность [5,20-23]. Активность может быть восстановлена при добавлении таких важных для обмена клетки веществ, как холестерин, аскорбиновая кислота, дифосфопиридиннуклеотид и другие, причем наибольшей эффективностью обладает холестерин. По-видимому, при диализе происходит потеря каких-то важных малых молекул, необходимых для размножения клеток.
Анализ действия некоторых сывороточных белков показал, что цельная или диализированная сыворотка может быть исключена из среды, если взамен добавляются два очищенных сывороточных белка - альбумин и α-глобулин (фетуин), которыми особенно богата эмбриональная коровья сыворотка.
В результате этих исследований была предложена среда, не содержащая сыворотки и обеспечивающая достаточно высокую эффективность посева не только массовых культур, но даже одиночных клеток S3 HeLa при несколько более продолжительном времени генерации [21].
Описанные методы (клонирование, поддержание стабильного кариотипа, применение синтетических питательных сред) обеспечивают возможность получения достаточно однородных клеточных популяций. Однако быстрое размножение клеток в культуре даже при сравнительно низком уровне мутационного процесса в течение относительно короткого времени будет неизбежно приводить к генетической гетерогенности. Поэтому необходимо располагать дополнительными методами, которые позволили бы выявлять мутантные формы при их возникновении и периодически "очищать" клеточную линию от возникающих обратных мутаций или других нежелательных изменений.

Состав синтетической питательной среды
3. Мутационный процесс
Изучение закономерностей мутационного процесса в соматических клетках in vitro требует определения самого понятия клеточной наследственности в условиях вегетативно размножающейся популяции клеток. Необходимо при этом учитывать отсутствие в настоящее время методов, позволяющих проводить генетический анализ в клетках in vitro и составлять карты хромосом.
Основным критерием наследственного признака клетки должна, таким образом, служить длительность сохранения его в популяции в ходе размножения. Если речь идет о мутантном признаке, выявленном в результате воздействия какого-либо внешнего агента, например химического вещества, то наследственным может считаться лишь тот признак, который не исчезает при удалении вызвавшего его фактора, т. е. не представляет собой только физиологическую реакцию клетки на внешний возбудитель. Необходимо подчеркнуть, что за единицу измерения длительности следует принимать не абсолютную продолжительность времени, а время, выраженное в числе клеточных поколений, поскольку только продолжительность генерации может служить мерилом скорости мутационного процесса в популяции.
Вторым критерием наследственного изменения клетки могут быть различные изменения хромосомного набора (числовые и структурные изменения хромосом). Это открывает по сравнению с микроорганизмами дополнительные возможности изучения мутационного процесса.
С другой стороны, всякое изменение фенотипа клетки, отвечающее критериям клеточной наследственности, может свидетельствовать о возникшей мутации, обусловленной не только изменением числа хромосом, или хромосомными аберрациями, но и точковой мутацией.
В связи с этими особенностями при изучении мутационного процесса в культуре тканей пользуются двумя методами, а именно: методом учета различных изменений кариотипа (поли- и гетероплоидия, хромосомные аберрации) и методом учета изменений фенотипа клетки, в основе которых предположительно лежат точковые мутации.
В результате проведенных с помощью второго метода исследований было выявлено несколько видов мутаций: 1) морфологические мутации; 2) биохимические мутации (потребности в питательных веществах, изменения ферментативной активности); 3) мутации резистентности (к химическим веществам, физическим факторам, вирусам).
1) Естественный мутационный процесс
Изменения кариотипа (поли- и гетероплоидия, хромосомные аберрации)
При изучении закономерностей возникновения и характера изменений хромосомных наборов в клетках in vitro необходимо учитывать две качественно различные категории культур. В первично эксплантированных тканях в первые 1-2 дня после эксплантации митозы почти не наблюдаются. Затем митотический индекс начинает возрастать [24]. Длительность исходного лаг-периода зависит от ряда условий: метода приготовления клеточной суспензии для посева, состава среды и т. д. При дальнейших пересевах митотический индекс постепенно снижается, и обычно культура, как бы истощив запас привнесенных клетками из организма необходимых метаболитов, дегенерирует.
Однако в ряде случаев после периода затухания культура вновь приобретает способность к размножению. Немногие выжившие клетки начинают активно делиться, митотический индекс возрастает, значительно превышая исходный уровень первичной культуры. Такая клеточная линия, именуемая "перевиваемой", оказывается способной к неограниченному размножению в культуре при последовательных ее пересевах. Известен ряд линий, происходящих от разных животных и из разных тканей, которые в течение многих лет культивируются в различных лабораториях мира.
Приобретение способности к неограниченному размножению in vitro наблюдалось как в клетках культур, происходящих из злокачественных новообразований, так и в клетках нормальных тканей. При этом клетки нормальных тканей приобретали в отдельных случаях способность вызывать развитие опухолей при имплантации их животным, т. е. претерпевали злокачественное превращение [25-31]. Это повторение in vitro процесса малигнизации нормальных клеток, протекающего in vivo, послужило одной из важнейших причин того огромного интереса, который проявляют исследователи к культуре тканей как модели для изучения феномена малигнизации. В свете все возрастающего внимания к изучению роли генетических факторов в этиологии и патогенезе рака и уже имеющихся обширных данных по изменению хромосомных наборов в опухолевых клетках in vivo вполне понятно, что при изучении мутационного процесса в соматических клетках in vitro основное внимание уделяется исследованию различных изменений хромосомных наборов.
Усовершенствование методов изучения хромосом млекопитающих путем применения предфиксационной обработки клеток гипотоническими растворами позволило значительно улучшить качество препаратов и провести детальное исследование кариотипа клеток, культивируемых вне организма.
Анализ хромосомных наборов в первично эксплантированных культурах показывает, что, несмотря на наличие различных аномалий, свидетельствующих об относительно высоком уровне генетической изменчивости (о чем будет сказано ниже), большинство клеток содержит число хромосом, нормальное для данного вида животных. Вследствие этого первичные культуры представляют собой удобный объект для изучения кариотипа в норме и его изменений при различных наследственных заболеваниях или при воздействии мутагенных факторов. Преобладание диплоидных клеток в культурах на ранних сроках после эксплантации описано для клеток различного тканевого и видового происхождения [32-35]. На рис. 2 и 3 представлены соответственно нормальные хромосомные комплексы человека и китайского хомячка.
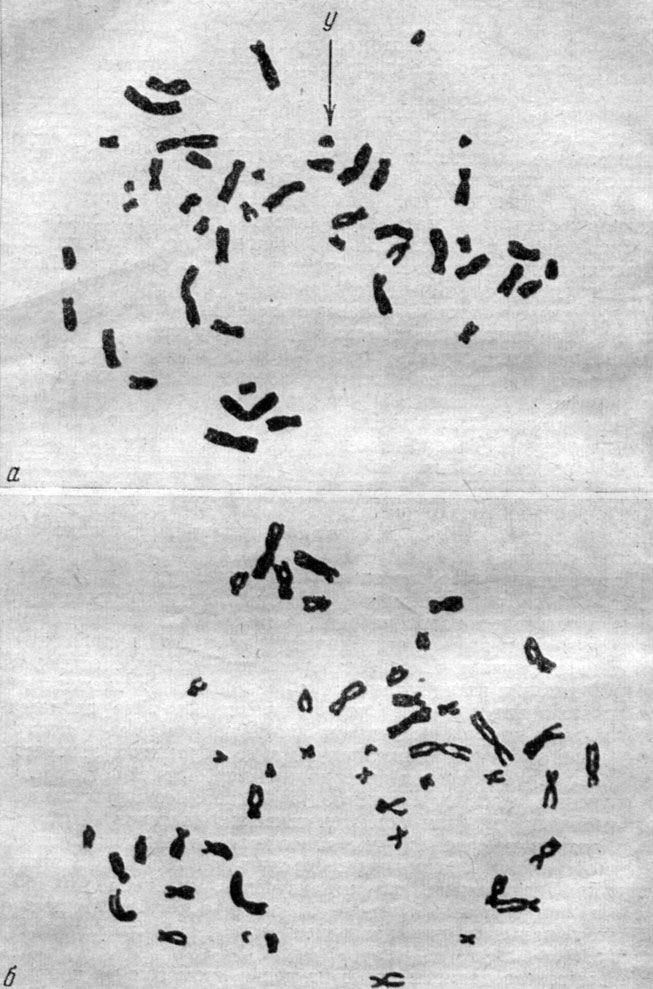
Рис. 2. Нормальный хромосомный набор человека: а - мужчины, б - женщины
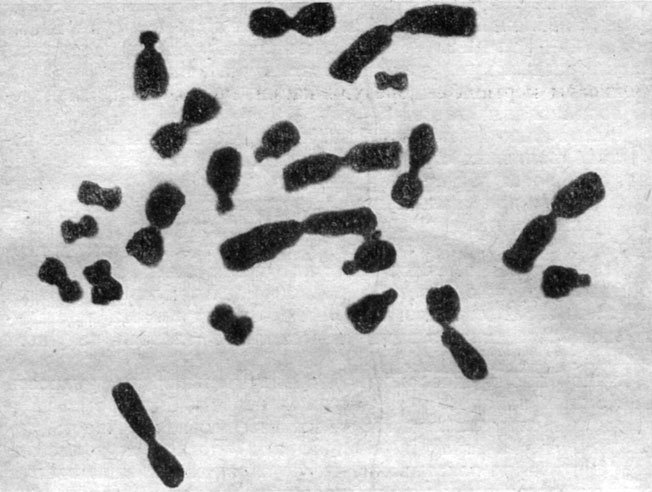
Рис. 3. Нормальный хромосомный набор китайского хомячка
Изучение динамики изменения кариотипов при пассировании первично эксплантированных культур эмбриональных тканей мыши, морской свинки и собаки [26, 36] показало, что во всех случаях в ранних пассажах преобладают диплоидные клетки. Однако при применении обычных, а не специальных методов, позволяющих сохранить диплоидность, уже в первом пассаже наряду с диплоидными встречаются также поли- и анеуплоидные клетки (2n + 1,2n + 2,2n - 1 и т. д.), причем удельный вес таких клеток в разных культурах оказывается различным.
Описаны картины эндоредупликации, приводящие к появлению полиплоидных клеток [37].
Помимо поли- и гетероплоидии наблюдается значительное количество различных структурных аномалий хромосом, которые обнаруживаются как при анализе ана- и телофаз (мосты, фрагменты), так и при анализе метафаз (кольцевые хромосомы, метацентрики при наличии в нормальном кариотипе только телоцентриков, и наоборот). Это свидетельствует о том, что в первичных культурах имеются все типы хромосомных аберраций, известные у других животных и растений. Хромосомы, отличающиеся по своей морфологии и размерам от хромосом нормального комплекса данного вида животных или человека, получили название хромосом-маркеров.
Можно было предположить, что значительная изменчивость хромосомных наборов и структурные перестройки хромосом в первичных культурах отражают генетическую изменчивость, существующую в клетках in vivo. Однако имеющиеся в настоящее время данные показывают, что в условиях культивирования клеток вне организма число хромосомных аномалий значительно возрастает даже в эуплоидных клетках по сравнению с условиями in vivo.
При изучении морфологии митозов в первичных культурах установлено, что в тканях, обработанных при эксплантации трипсином, процент аномальных митозов, свидетельствующих о возникновении хромосомных перестроек (мосты, фрагменты и т. д.), значительно выше, чем в тканях, которые подвергались механическому измельчению. Таким образом, уже на первых этапах культивирования, при применении обычных методов обработки тканей, в действие включается мутагенный фактор. Вполне вероятно предположение о существовании и других неучтенных мутагенных факторов.
Изучение динамики изменения кариотипа в ходе последовательных пассажей, а также морфологии митозов подтверждает вывод о том, что в самих условиях культивирования заложены какие-то факторы, способствующие повышению уровня генетической изменчивости.
Как было упомянуто выше (см. "Методы исследования"), можно считать, что в культуральных средах содержатся вещества, нарушающие нормальный ход митоза и препятствующие расхождению хромосом в анафазе. Подобные аномалии митоза наряду с широко распространенными многополюсными митозами приводят к появлению клеток с несбалансированными гетероплоидными числами хромосом. Таким образом, в культуре ткани непрерывно создаются условия для возникновения генетической изменчивости, и термин "естественные" мутации можно применять только условно.
Изменение хромосомных наборов в ходе культивирования эмбриональной кожи мыши, по данным Леван и Бизеле [26], показано в табл. 1.
![Таблица 1. Диплоидия и полиплоидия в культурах ткани кожи мыши [26]](pic/000060.jpg)
Таблица 1. Диплоидия и полиплоидия в культурах ткани кожи мыши [26]
Как видно из приведенной таблицы, несмотря на наличие колебаний в проценте диплоидных клеток в разных опытах, в ходе последовательных пассажей наблюдается закономерное снижение удельного веса диплоидных клеток и возрастание процента полиплоидов. Различные пассажи отражают определенные этапы в жизни изучаемых культур. Так, в опыте 76 16-я генерация совпадает с возобновлением интенсивного размножения.
В этот период диплоидные клетки отсутствуют, а точный подсчет хромосом показывает преобладание клеток с гетероплоидными наборами. Время вытеснения диплоидных клеток совпадает с периодом приобретения клетками способности к неограниченному размножению в культуре.
В настоящее время имеются многочисленные работы, посвященные изучению кариотипа перевиваемых линий. Исследовались клеточные линии из разнообразных тканей как нормального, так и злокачественного происхождения, тканей, принадлежащих разным видам животных, взятых от различных возрастных групп (38-44).
Наиболее типичной особенностью перевиваемых линий, вне зависимости от их видового и тканевого происхождения, является более или менее широкий спектр изменчивости чисел хромосом с преобладанием гетероплоидных наборов и почти полным или полным отсутствием эуплоидов (в отличие от первичных культур). На рис. 4 и 5 представлены гетероплоидные клетки из линии HeLa человека и китайского хомячка. При наличии такой вариации для каждой линии характерно какое-то специфическое распределение с частым преобладанием одного модального (или "стволового") числа хромосом. Описаны случаи бимодального распределения чисел хромосом [45, 46]. Кариологическая картина может быть достаточно стабильной и может сохраняться в течение продолжительного времени при стандартных условиях культивирования.
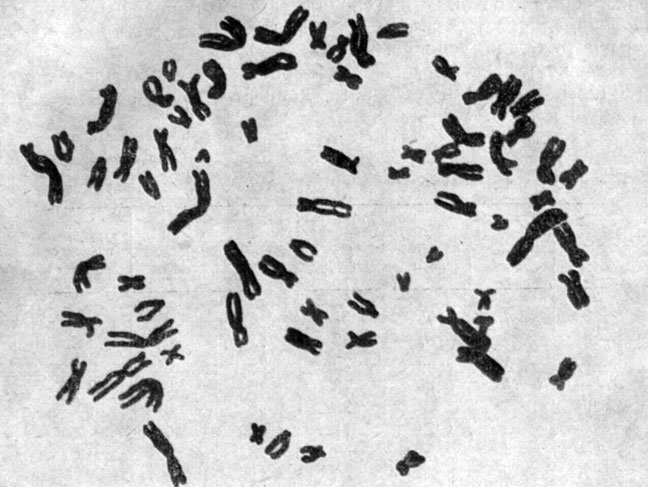
Рис. 4. Гипертриплоидный набор хромосом в клетках человека (линия НеLа)
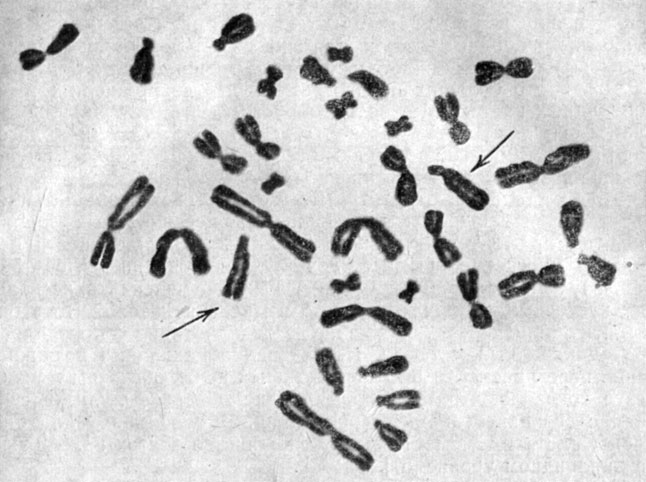
Рис. 5. Гипертриплоидный хромосомный набор китайского хомячка
Своеобразная картина изменчивости кариотипа в перевиваемых линиях аналогична той, которая наблюдается в злокачественных новообразованиях in vivo [46-49]. Это обстоятельство, наряду со способностью к неограниченному размножению в культуре и при имплантации животным, делает сходство между злокачественными опухолями и перевиваемыми культурами клеток еще более выраженным. Оно указывает, что в основе их возникновения лежат, вероятно, какие-то общие механизмы.
Помимо изменений числа хромосом в клетках перевиваемых линий выявлены еще более значительные отклонения от нормы по сравнению с первичными культурами, свидетельствующие о многочисленных структурных изменениях хромосом [32, 50, 51]. Обнаружены следующие перестройки хромосом: хроматидные обмены, хроматидные делеции, мосты, фрагменты и другие аномалии.
Широкое распространение различных изменений кариотипа в перевиваемых клеточных линиях ставит вопрос о значении гетероплоидии и структурных аномалий хромосом для адаптации клеток in vitro и о механизме их возникновения.
Как было уже сказано, большинство первично эксплантированных клеток обладает ограниченным сроком жизни и погибает в непривычных для них условиях существования вне организма, будучи неспособными к ним адаптироваться. Любые факторы, обусловливающие увеличение уровня генетической изменчивости в клеточной популяции и создающие тем самым наследственную гетерогенность, являются потенциально полезными, поскольку повышается вероятность появления генотипов, более ценных с точки зрения возможности адаптации клеток. Постепенное вытеснение диплоидных клеток и замена их гетероплоидными в перевиваемых линиях свидетельствует, по мнению многих авторов [26, 52, 53], о больших приспособительных возможностях гетероплоидных клеток. Можно предположить, что гетероплоидные клетки обладают более высокой "буферностью" системы, благодаря чему возникающие вредные генетические изменения имеют меньше возможностей для проявления.
Следует, однако, отметить, что, хотя гетероплоидная трансформация наблюдается в большинстве перевиваемых линий, имеются примеры длительного сохранения диплоидности без применения специальных методов культивирования [32, 54-56]. Так, изучение динамики кариологических изменений в нескольких клеточных линиях китайского хомячка показало, что в одной из линий через 292 дня после эксплантации наблюдалось 86% диплоидных метафаз. Исследование механизма возникновения перевиваемости в культуре тканей почек обезьяны макаки резус показало, что трансформация не обязательно была связана с возникновением гетероплоидии. В одной из линий она произошла в тот момент, когда большинство клеток находилось на диплоидном уровне [57].
Таким образом, правильнее говорить, что возможность адаптации клеток in vitro определяется различными видами генетической изменчивости. Вполне оправданно предположение, что клетки организма, попадая в необычные, хотя и более упрощенные условия культивирования, оказываются к ним неприспособленными. Даже в гетероплоидных клетках злокачественных тканей при эксплантации in vitro происходят значительные сдвиги (изменение модального числа хромосом,распределение числа хромосом и т. д.), отражающие, по-видимому, приспособительные процессы [58, 59]. Распространение гетероплоидии объясняется не только ее адаптивной ценностью, но и наличием в условиях культуры факторов, непрерывно ее порождающих (аномалии митозов).
Зависимость процессов адаптации клеток в культуре от их генетической структуры особенно ясно выступает в тех случаях, когда под влиянием различных внешних воздействий меняются условия, в которых клетки растут и размножаются. Стабилизация кариологических признаков линий в ходе культивирования с преобладанием модального числа хромосом и часто специфической кариограммы, само по себе свидетельствует, очевидно, о процессах отбора, протекающих в клеточной популяции, которые благоприятствуют размножению определенных кариотипов. Показано, что соотношение в культуре различных хромосомных наборов может претерпевать сдвиги под влиянием внешних условий [60-66].
Изучение влияния различных сывороток человека на распределение чисел хромосом в сублиниях клеток HeLa показало, что при добавлении в среду инактивированной сыворотки наблюдается сдвиг в сторону больших чисел по сравнению с распределением чисел хромосом при культивировании клеток в среде с активной сывороткой. Сыворотки от разных индивидуумов также оказывали влияние на вариацию чисел хромосом.
Структура клеточной популяции может изменяться при изменении длительности интервалов между пересевами. Процессы отбора были наглядно проиллюстрированы при смешении в равных количествах клеток двух сублиний мышиных фибробластов, отличающихся друг от друга как по модальному числу хромосом, так и по скорости роста. При этом наблюдалось постепенное вытеснение высокополиплоидных, медленно растущих клеток, которое, однако, никогда не бывало полным. Отсюда можно сделать заключение что, в какой-то момент жизни культуры такие клетки обладают определенным селективным преимуществом.
Приведенные данные показывают, таким образом, что клеточные популяции in vitro состоят из генетически разнородных элементов, которые находятся в состоянии подвижного равновесия. Гетерогенность линий подтверждается также различиями кариологических и других особенностей в клонах, выделенных из одной линии [67, 68]. Преобладание и длительное сохранение геномов, характеризующихся определенным числом хромосом и в отдельных случаях хромосомными маркерами, свидетельствует о каком-то их селективном преимуществе. Изменение внешних условий вызывает сдвиги в клеточной популяции, вытеснение геномов, которые по тем или иным причинам оказываются неприспособленными к новым условиям существования и замещение их новыми адаптивно более ценными геномами.
Изменения фенотипа клетки
Морфологические мутации. Клетки культур по своей морфологии могут быть отнесены к двум основным типам - эпителио- и фибробластоподобным. На основании изучения поведения морфологического типа при длительном культивировании, исследования потребностей таких клеток в определенных компонентах питательной среды, чувствительности к действию трипсина и других особенностей, можно сделать вывод о том, что различия в морфологии определяются как генетическими факторами, так и факторами среды, главным образом компонентами культуральных сред. Если фибробластоподобные клетки устойчиво сохраняют свою морфологию при разных составах среды, то эпителиоподобные клетки при увеличении содержания человеческой сыворотки или в присутствии эмбрионального экстракта начинают сильно вытягиваться и приобретают удлиненную форму, напоминающую фибробласты. Эта особенность не является, однако, стабильной: при возвращении в среду с обычным содержанием сыворотки клетки вновь приобретают типичную эпителиоподобную морфологию. Изменения морфологического типа клеток, стабильно сохраняющиеся в популяции при размножении, которые, следовательно, могут рассматриваться как мутационные изменения, описаны для различных перевиваемых клеточных культур как нормального, так и опухолевого происхождения [69-72]. Так, возникновение фибробластоподобных мутантов наблюдалось в популяции эпителиоподобных клеток линии Чанг (печень человека). Морфологически различные клоны были выделены из человеческих линий опухолевого происхождения (HeLa и 588).
Биохимические мутации. В отличие от микроорганизмов, в клетках млекопитающих пока было обнаружено относительно небольшое количество мутантов с измененными ростовыми потребностями. Это объясняется, вероятно, гораздо более "специализированными" потребностями клеток, способных размножаться лишь при ограниченных колебаниях в составе среды. Всякие значительные отклонения, например удаление из среды какой-либо аминокислоты или витамина, могут вызвать столь серьезные нарушения обмена, что они приведут к летальному эффекту. Эти особенности определяют, очевидно, трудности подбора полностью синтетических питательных сред для культивирования клеток млекопитающих, о которых было упомянуто выше.
В двух клонах линии HeLa были показаны отличия в ростовых потребностях клеток [73]. Оба клона характеризовались 100%-ной эффективностью образования колоний одиночными клетками в присутствии питающего слоя как при низких, так и при высоких концентрациях сыворотки (5-30%). В отсутствие питающего слоя клон S1 продолжал давать 100%-ную эффективность посева при низкой концентрации сыворотки, в то время как клон S3 практически не образовывал колоний. Описаны также отличия потребностей в питательных веществах между фибробласто- и эпителиоподобными клетками культур [9]. Одиночные фибробластоподобные клетки образовывали колонии лишь в том случае, если в среду добавляли эмбриональный экстракт, или клетки выращивали на питающем слое.
Эти исследования, выявившие различия ростовых потребностей клеток культур, тем не менее не смогли точно установить необходимые ингредиенты среды в виде определенных химических соединений. В первом случае речь идет о питающем слог, т. е. о клетках, хотя и не делящихся, но в которых протекает активный обмен и которые выделяют в окружающую среду большое количество разнообразных веществ; во втором случае - необходимым добавлением к среда является эмбриональный экстракт.
Более определенные результаты были получены в устойчивой к аметоптерину сублинии клеток лейкоза L 5178, которая характеризовалась увеличенными потребностями в фолиевой кислоте [74].
Следует отметить, что метод изучения клонов, с целью выявления мутантных форм, не является достаточно чувствительным, поскольку частота мутаций в популяции может быть очень низка. Значительно перспективнее метод выращивания клеток в массовой культуре на селективной среде, которая обеспечивает рост только мутантных клеток с измененными ростовыми потребностями.
При изучении генетики микроорганизмов селективные среды нашли чрезвычайно широкое применение для выявления обратных мутаций от ауксотрофности к прототрофности, представляющей собой нормальный "дикий тип". Путем высевания популяции ауксотрофов на минимальную среду, обеспечивающую рост только прототрофов, удается обнаружить их возникновение даже в случае очень низкой частоты мутирования от ауксо- к прототрофности. В отличие от микроорганизмов, клетки млекопитающих следует, очевидно, рассматривать как ауксотрофы, поскольку, как правило, они могут расти только на полноценной среде, обеспечивающей поступление всех необходимых для жизнедеятельности клеток веществ, которые не способны сами их синтезировать из более простых элементов.
Таким образом, в обоих случаях минимальная среда будет являться селективной с той точки зрения, что она позволяет выявлять все мутантные прототрофные типы, автоматически отметая все немутировавшие ауксотрофные клетки; но у микроорганизмов мутации к прототрофности будут представлять собой обратные мутации к дикому типу, а в клетках млекопитающих это будут прямые мутации, поскольку диким типом является ауксотрофность.
Такой селективной минимальной средой может считаться, например, среда, где глюкоза заменялась на d(+)-ксилозу, d-рибозу или лактат, в присутствии которых клетки обычно дегенерируют [75, 76]. Путем выращивания выживших на такой среде единичных колоний удалось выделить из линии HeLa и линии клеток конъюнктивы человека мутантные сублинии, способные использовать одно из этих веществ вместо глюкозы в качестве единственного источника углеводов.
Две мутантные сублинии клеток крысиной саркомы Иенсена, не требующие для своего роста аспарагина, были выделены путем выращивания на селективной среде без аспарагина [77, 78]. Была получена также субкультура линии кроличьих фибробластов, клетки которой способны расти в селективной среде, куда взамен обычно присутствующих 5% куриного эмбрионального экстракта и 10% лошадиной сыворотки, добавлялось только 2% дипнализированной лошадиной сыворотки [79].
Изменения ферментативной активности. В немногочисленных исследованиях, посвященных изучению наследственных различий ферментативной активности в клетках in vitro, можно наметить два основных подхода: 1) изучение активности различных ферментов в клоновых линиях с целью выявления мутантного по ферментативной активности фенотипа и 2) изучение биохимической основы фенотипов, мутантных по другим признакам, в частности по признакам резистентности к химическим веществам или ростовым потребностям. Кроме того, имеются работы, в которых исследуется активность ферментов в клетках культур, взятых от больных с наследственной недостаточностью определенных ферментов.
Стойкие изменения активности щелочной фосфатазы были описаны в клонах, выделенных из линии HeLa [80] и линии Чанг [81].
Различия в уровне анаэробного гликолиза описаны в клеточных линиях подкожной соединительной ткани мышей СЗН, вызывающих образование сарком [82]. Все культуры с высокой саркомообразующей способностью характеризовались высоким коэффициентом гликолиза, культуры с низкой злокачественностью - низким коэффициентом. Выявлены различные уровни активности аргиназы и β-глюкуронидазы в трех субклонах той же линии мышиных клеток [72, 83].
Показано, что в клетках in vitro, взятых от больных с наследственной акаталазией [84] и наследственной недостаточностью активности глюкозо-6-фосфатдегидрогеназы [85], наблюдалось соответственно отсутствие и сильное уменьшение активности этих ферментов.
Мутации резистентности. Наряду с кариологией закономерности возникновения наследственной резистентности (главным образом к химическим веществам) являются наиболее разработанными вопросами генетики клеток in vitro. Это объясняется, вероятно, как интересом, который представляет анализ действия на клетки некоторых препаратов, имеющих терапевтическое значение, особенно применяемых при лечении злокачественных опухолей, так и относительной простотой выявления и размножения мутантных форм.
Основной метод выявления резистентных клеток и получения устойчивых к какому-либо определенному веществу или вирусу клеточных линий сводился к воздействию данного вещества или вируса на растущую культуру в дозах, вызывающих гибель основной массы клеток и допускающих размножение только клеток, резистентных к такому воздействию. Данный метод, несмотря на его относительную простоту и удобство, имеет тот существенный недостаток, что химические вещества или вирусы - селективные факторы выявления резистентности - могут обладать самостоятельным действием на физиологию клетки и ее наследственность; это будет создавать дополнительный источник изменчивости (см. "Индуцированный мутационный процесс"). Кроме того, такой метод не дает ответа на вопрос, является ли наблюдаемая устойчивость следствием прямой адаптации клетки в ответ на воздействие химического вещества или вируса, или она только позволяет выявить предсуществовавшие в клеточной популяции мутантные резистентные формы, возникшие независимо от данного воздействия. В настоящее время имеются, однако, косвенные данные, подтверждающие последнюю гипотезу. Эти данные основаны на сравнительном изучении резистентности к определенному агенту клонов, полученных из одной и той же родительской линии, которые культивировались в отсутствие данного агента. Так, из линии АМК (перевиваемая линия обезьяньей почки, которая была контаминирована мышиными клетками L, полностью заместившими исходные клетки) выделены клоны с высокой и низкой чувствительностью к антибиотику пуромицину [86]. Клоны с различными уровнями резистентности к вирусу полиомиелита были выделены из линии HeLa [87]. Эти особенности сохранялись в популяции при размножении, и, следовательно, представляли собой наследственные признаки. Полученные данные показывают, таким образом, что варианты с разной степенью чувствительности возникали в популяции без воздействия антибиотика или вируса.
Мутации резистентности к химическим веществам. Были изучены мутации резистентности к различным химическим веществам: аналогам пуриновых и пиримидиновых оснований, аметоптерину, аминоптерину, различным антибиотикам, сахарам.
Резистентность к пуриновым аналогам изучалась на перевиваемых линиях различного видового и тканевого происхождения [88-94]. Исследования показали, что возникающая устойчивость представляет собой наследственный признак; это было прослежено на протяжении большого числа пересевов в отсутствии селективного агента.
В большинстве случаев изменение резистентности возникало в результате одноступенчатой мутации. Так, в линии АМК клетки, выживающие при концентрации 1 мкг/мл 8-азагуанина, не повреждались и дозой в 100 раз большей. Клетки с промежуточными уровнями устойчивости не были обнаружены. Исключение составляет резистентность к 8-азагуанину в линии мышиной лимфоцитарной опухоли, которая возникала путем трех больших последовательных скачков.
Возникающая к определенным аналогам устойчивость оказалась специфической. Так, субкультуры клеток костного мозга человека Detroit-98, резистентные к 8-азагуанину, были чувствительны к 8-азагуанозину. Исследование субкультур перевиваемой линии клеток свиной почки, устойчивых к 2,6-диаминопурину по отношению к его структурным аналогам (аденину, гуанину, ксантину, гипоксантину, меркаптопурину), показало, что для большинства соединений не наблюдалось перекрестных реакций. Хорошо выраженная устойчивость отмечалась только в отношении 6-метилпурина. Таким образом, резистентность к 2,6-диаминопурину не распространяется на другие пурины.
Изучение пуринового обмена в мутантных субкультурах линии АМК путем определения активности фосфорилаз и по включению меченых С14-пуринов показало, что клетки, резистентные к 2,6-диаминспурину, не содержат заметных количеств аденозин-5-фосфатпирофосфорилазы и не способны включать аденин, но не отличаются от родительских клеток по отношению к гипоксантину. Напротив, мутанты, устойчивые к 6-меркаптопурину, не содержат инозин-5-фосфатпирофосфорилазу и могут включать (как источник пуринов) аденин, но не гипоксантин. Мутантные линии Detroit-98 отличались по своей способности использовать те или иные аналоги в качестве источника пуринов и по активности ферментов пуринового обмена. Так, в одной из сублиний активность пирофосфорилазы инозиновой кислоты полностью отсутствовала. Определение частоты возникновения мутаций резистентности к пуриновым аналогам в разных линиях по методу Луриа и Дельбрюк [95] показало, что она колеблется в довольно широких пределах от 5,0⋅10-4 на клетку за одно клеточное поколение в случае резистентности к 8-азагуанину в линии Detroit-98 до 1,5⋅10-6 в случае резистентности к 2,6-диаминопурину в линии АМК.
При возникновении устойчивости к антибиотику пуромицину наблюдались иные закономерности. После шестикратного воздействия на растущую культуру перевиваемой линии АМК пуромицином в концентрации 8 мкг/мл была получена резистентная линия, клетки которой могли расти в присутствии антибиотика в концентрации 12 мкг/мл, но которые погибали при концентрации 40 мкг/мл.
Клетки, устойчивые к более высоким концентрациям пуромицина, были отобраны из этой линии после культивирования в среде, содержащей 40 мкг/мл.
Обнаружение клеток с четырьмя различными уровнями чувствительности приводит к выводу, что в данном случае возникновение устойчивых клеток включает несколько последовательных мутаций, а не одно генетическое изменение. При этом резистентность к пуромицину весьма стабильна.
Оценка частоты мутаций устойчивости к пуромицину показала, что изменения от меньшей чувствительности в клетках родительской линии к низкому уровню устойчивости происходят с частотой, равной 3,6⋅10-6 на клетку за одно поколение. Частота мутаций от низкой к высокой резистентности равнялась 0,8⋅10-4. Резистентная к актиномицину субкультура была получена в линии HeLa [96] путем многократного воздействия антибиотика. Клетки этой субкультуры выживали только в среде, содержащей данную концентрацию антибиотика, и погибали при более высоких концентрациях. Этот факт также свидетельствует в пользу многоступенчатого механизма возникновения резистентности к актиномицину. Резистентные к митомицину клетки были выделены из линии L-мыши [97].
Из клоновой линии S3 HeLa был выделен вариант, устойчивый к воздействию 2-дезокси-D-глюкозы [98]. В отличие от родительской линии, рост которой был полностью блокирован при эквимолярных концентрациях 2-дезокси-D-глюкозы и глюкозы, устойчивая линия росла при молярном отношении этих веществ соответственно 101. Резистентные клетки росли в среде, не содержащей 2-дезокси-D-глюкозу, в два раза медленнее, чем чувствительные клетки. Увеличение резистентности путем мелких скачков отмечено также по отношению к аметоптерину в клеточной линии мышиной лимфоцитарной опухоли [94], в клоновых линиях лейкоза L 5178 [74], в линии клеток мышиной саркомы in vitro [99].
Некоторые авторы исследовали связь между изменением резистентности к некоторым веществам и изменениями кариотипа. Используя с этой целью сублинии клеток свиной почки, обладающие определенными хромосомными маркерами, из них затем выделяли устойчивые к аминоптерину и 2,6-диаминопурину варианты [100]. В полученных резистентных линиях наблюдалось отсутствие по сравнению с исходными клетками нескольких мелких хромосом. Как устойчивость, так и особенности кариотипа сохранялись в последующих пассажах. Это позволило предположить, что устойчивость к химическим веществам связана в данном случае с потерей факторов чувствительности, локализованных в утерянных хромосомах. В ряде других линий также обнаружен параллелизм между изменениями чувствительности к химическим веществам и изменениями кариотипа. Такое явление наблюдалось в различных популяциях, устойчивых к аминоптерину клеток HeLa по сравнению с исходной линией [90]. Сдвиг модального числа хромосом был обнаружен в резистентных к дезоксикортикостерону и тестостерону сублиниях HeLa по сравнению с родительской чувствительной линией [101, 102].
Таким образом, проведенные эксперименты и наблюдения позволяют сделать вывод о том, что устойчивость или, соответственно, чувствительность к различным химическим веществам является наследственно обусловленным признаком клетки, который сохраняется в популяции в отсутствие селективного агента. В отдельных случаях клетки с измененной резистентностью отличались от исходной культуры по своему кариотипу, но в большинстве случаев в основе подобных изменений лежали, по-видимому, точковые мутации. Возникновение устойчивости осуществляется как путем одноступенчатых мутаций, резко изменяющих степень резистентности, так и путем мелких скачков. Устойчивость клетки к химическим веществам является специфической и обычно не распространяется на другие вещества, даже близкие по своему химическому строению.
Мутации резистентности к вирусам. Результаты исследований показали, что в клеточных линиях как перевиваемых, так и первичных, существуют различные по своей восприимчивости к вирусам формы, более или менее длительное время сохраняющие присущий им уровень чувствительности [87, 103-107]. Так, устойчивые к вирусу болезни Ньюкастля субкультуры клоновой линии S3 HeLa сохраняли резистентность на протяжении длительного периода наблюдения, продолжавшегося в течение сотен клеточных поколений. Аналогичные данные описаны для выделенной из линии HeLa клоновой культуры [108], резистентной к вирусу полиомиелита. Расчеты показали, что частота мутаций в данном случае была равна 8⋅10-5 на клетку за одно клеточное поколение.
Морфологическое исследование клеток, устойчивых к вирусному воздействию, выявило интересную закономерность. Оказалось, что фибробластоподобные клетки обнаруживают большую устойчивость к воздействию вируса, чем эпителиоподобные клетки. Это наблюдение справедливо для клеток различного происхождения (клетки HeLa, перевиваемые синовиальные клетки человека, первично эксплантированная эмбриональная ткань мышей) по отношению к действию разных вирусов (полиомиелита, полиомы, болезни Ньюкастля). Закономерности, лежащие в основе такой связи, пока неясны. Неизвестно, обусловливают ли морфологические особенности фибробластоподобных клеток более трудное проникновение вируса в клетку, или особенности внутриклеточного обмена препятствуют размножению вируса.
Изучение кариотипа линий с измененной восприимчивостью к вирусам выявило в ряде случаев изменение модального числа хромосом по сравнению с исходной линией. В трех исследованных клановых линиях клеток HeLa (одной чувствительной и двух резистентных к вирусу полиомиелита) модальные числа были соответственно равны 78-80, 70-72 и 76. Имеются данные об уменьшении модального числа хромосом в резистентной к вирусу полиомиелита сублинии, полученной из чувствительной культуры перевиваемых клеток миндалин макаки резус [109].
Таким образом, проведенные исследования показали, что различия в чувствительности к воздействию вирусов обусловлены генетически, а клетки с различной чувствительностью представляют собой мутантные формы.
Изучение генетических основ восприимчивости клетки к вирусу имеет первостепенное значение для понимания одной из важнейших проблем современной вирусологии - проблемы взаимодействия вируса и клетки и противовирусного иммунитета. Кроме того, разработка методов получения и селекции клеток, наиболее пригодных для культивирования в них вирусов, имеет значение для практической вирусологии.
Радиорезистентность. Следует упомянуть еще об одном генетическом маркере - радиочувствительности клетки. Хотя число работ в этом направлении пока весьма ограничено, изучение закономерностей возникновения и природы этого признака чрезвычайно важно прежде всего с точки зрения изучения возникновения устойчивости к облучению клеток злокачественных опухолей.
На линии L мыши было показано [110-113], что клетки, выжившие после однократного рентгенооблучения в дозе 1000 р или фракционированного облучения в дозе 5000 р, распределенной на 5 месяцев (3 раза по 1000 р и затем 2000 р), оказались более резистентными при последующем облучении, чем родительские линии. Пострадиационное уменьшение числа клеток и угнетение клеточного размножения были менее выражены, восстановление культур наблюдалось на более ранних сроках. Проверка радиорезистентности через 25-30 клеточных поколений показало ее сохранение в культуре. В данном случае, как и в случае мутаций резистентности к химическим веществам и вирусам, можно допустить, что радиорезистентность возникла в результате спонтанной мутации.
Изучение различных физиологических особенностей резистентных клеток (аэробный гликолиз, активность каталазы, интенсивность дыхания) не выявило отличий по сравнению с нормальными чувствительными клетками. Однако анализ хромосомного набора показал во всех изученных резистентных линиях небольшое уменьшение модального числа хромосом, утрату длинной метацентрической и появление более короткой метацентрической хромосомы [114].
Клетки одной резистентной к рентгеновым лучам линии оказались также более резистентными к УФ-лучам по сравнению с чувствительной родительской линией.
* * *
Подводя некоторые итоги, можно констатировать, что за относительно короткий срок накоплено большое количество данных об естественном мутационном процессе в клетках млекопитающих in vitro. Это главным образом относится к исследованиям, посвященным изменениям хромосомных наборов. Однако выявление достаточного числа признаков клеток, служащих генетическими маркерами, и наличие методов, обеспечивающих возможность проведения генетических работ, позволяют рассчитывать на успешное продолжение и расширение исследований естественного мутационного процесса в культуре клеток.
2) Индуцированный мутационный процесс
Влияние различных мутагенных факторов изучалось, так же как и в случае естественного мутационного процесса, главным образом на примере различных типов аномалий хромосомных наборов. Кроме того, исследовалось действие мутагенов на жизнеспособность клетки. Нет сомнения в том, что жизнеспособность представляет собой весьма сложный комплекс явлений, и, как будет показано ниже, в качестве критерия жизнеспособности был избран, в известной мере условно, лишь наиболее легко повреждаемый процесс, а именно клеточное деление. Были сделаны также попытки установления возможной связи между летальным повреждением клетки и возникновением изменений кариотипа.
Ионизирующие излучения
Изучение влияния ионизирующей радиации на наследственность человека представляет собой одну из важных задач современной радиобиологии. Перспектива все возрастающего использования энергии атома в мирных целях и расширение космических полетов требуют точного определения степени опасности излучений для человека и мер защиты против их вредного действия.
Клетки, культивируемые вне организма, дают возможность прямого исследования действия радиации на мутационный процесс в соматических клетках млекопитающих и человека. Хорошо известно, что если вредные мутации, возникающие под влиянием радиации в половых клетках, представляют опасность для последующих поколений, то генетические повреждения, возникающие в соматических клетках, могут вызвать тяжелые, заболевания непосредственно у человека, который подвергся облучению.
Изменения кариотипа. Как было упомянуто, в большинстве работ исследовались индуцированные аномалии хромосомного аппарата. Использование перевиваемых клеточных линий для этой цели затруднено ввиду наличия в них огромного разнообразия кариотипов и высокой частоты естественно возникающих аберраций. Первично эксплантированные клетки и диплоидные штаммы представляют в этом отношении значительно более удобный и ценный объект вследствие Относительно большей стабильности хромосомных наборов и близости этих клеток к тканям in vivo.
При изучении хромосомных мутаций, возникающих под влиянием радиации, применяются два метода учета: анализ повреждений в метафазах и в ана- и телофазах.
Первый метод более точен, так как позволяет учитывать не только клетки, несущие хромосомные аномалии, но и число, а также локализацию возникающих аберраций. Однако его трудоемкость ограничивает возможность получения большого материала. Второй метод более прост и дает возможность исследовать значительно большее число делящихся клеток, но менее точен, так как обычно позволяет регистрировать лишь число аномальных ана- и телофаз, но не число самих хромосомных аберраций. Это в некоторой степени снижает процент учитываемых аномалий.
Изучение действия излучений на клетки в культуре показало, что в них возникают все типы хромосомных мутаций, известные у других животных и растительных объектов, а именно: мутации, изменяющие число хромосом (поли- и гетероплоидия) и хромосомные аберрации. На рис. 6 представлены различные типы аберраций (разрывы, обмены) в клетках линии V2 китайского хомячка.
![Рис. 6. Хроматидные разрывы (а) и обмены (б) в клетках линии V2 китайского хомячка [128]](pic/000064.jpg)
Рис. 6. Хроматидные разрывы (а) и обмены (б) в клетках линии V2 китайского хомячка [128]
Упоминания об изменении числа хромосом под влиянием ионизирующей радиации немногочисленны. Отмечено увеличение процента полиплоидных клеток в первично эксплантированных культурах лейкоцитов человека [115] и изменение модального числа хромосом в перевиваемой линии амниона человека после γ-облучения [116]. Изменение числа хромосом под влиянием рентгеновых лучей обнаружено в эуплоидных клетках человека [117].
Наибольшее число работ посвящено изучению закономерностей возникновения хромосомных аберраций. В этих исследованиях был установлен факт, имеющий первостепенное значение, - необычайно высокая радиочувствительность хромосом млекопитающих, во много раз превышающая радиочувствительность хромосом ряда других объектов, например насекомых. В табл. 2 представлены данные по чувствительности хромосом человека к рентгеновым лучам.
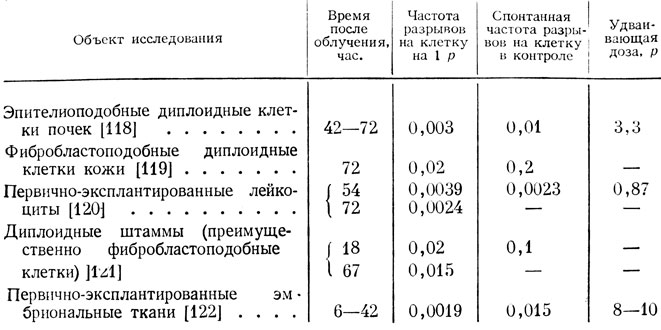
Таблица 2. Чувствительность хромосом человека (по данным разных авторов)
Результаты исследований и расчетов, даже при наличии известных расхождений между данными различных авторов, убедительно показывают высокую частоту мутаций на клетку на 1 р и соответственно низкую величину удваивающей дозы, т. е. дозы, вызывающей увеличение частоты естественно возникающих мутаций в два раза. Колебания в полученной частоте аберраций на 1 р можно, вероятно, отнести за счет условий опыта и методов учета (разные ткани, сроки исследования после облучения, анализ метафаз или анафаз). Так, расчет удваивающей дозы, основанный на регистрации числа аномальных ана- и телофаз [122, 123], дает минимальную величину частоты возникающих аберраций и, соответственно, более высокое значение удваивающей дозы тю сравнению с методом учета аберраций в метафазах. Более высокая частота аберраций наблюдается в диплоидных клетках, претерпевших определенное число пассажей, чем в первично-эксплантированных культурах, в которых частота естественных мутаций также ниже, чем в диплоидных штаммах.
Данные относительно различной радиочувствительности клеток в зависимости от их происхождения из разных тканей и от разных индивидуумов противоречивы и немногочисленны. Исследование действия γ-лучей от источника Со60 (дозы 136 рад) на эмбриональные ткани человека показало, что клетки мозговой ткани обладают несколько большей радиочувствительностью, чем клетки легочной ткани, а клетки мужских эмбрионов более радиочувствительны, чем клетки женских эмбрионов [124]. Эти результаты, однако, не являются вполне достоверными и их можно считать лишь ориентировочными, свидетельствующими об определенной тенденции. По данным других авторов [121], различий в радиочувствительности клеток от разных индивидуумов обнаружить не удалось.
Изучение зависимости частоты хромосомных аберраций от дозы рентгеновых лучей показало, что для простых разрывов (одноударные аберрации) характерно линейное возрастание частоты с увеличением дозы и отсутствие пороговой дозы [120, 121, 125, 126].
Дозовая кривая для двухударных аберраций обнаруживает экспоненциальную зависимость, и возрастание частоты перестроек происходит пропорционально квадрату дозы (изохроматидные аберрации, интерстициальные делеции, обмены).
Анализ данных, полученных в различных исследованиях [121, 127, 128], показывает закономерное изменение типов аберраций в зависимости от времени, прошедшего с момента облучения. Как видно из табл. 3, на ранних сроках исследования (через 6-18 час.) наблюдается появление аберраций только хроматидного типа. Через 25 час. появляются хромосомные аберрации, через 30 час. обе категории присутствуют приблизительно в равных количествах. Через 67 час. были обнаружены преимущественно хромосомные аберрации.
![Таблица 3. Сравнительная частота хроматидных и хромосомных аберраций в соматических клетках человека через различные промежутки времени после рентгеновского облучения [121]](pic/000065.jpg)
Таблица 3. Сравнительная частота хроматидных и хромосомных аберраций в соматических клетках человека через различные промежутки времени после рентгеновского облучения [121]
Эти данные показывают, что, очевидно, преобладание тех или иных видов аберраций зависит от фазы митотического цикла, на котором клетка находилась в момент облучения. По принятой в настоящее время классификации, весь митотический цикл можно подразделить на четыре фазы: фаза G1, предшествующая синтезу ДНК, фаза синтеза - S, постсинтетическая фаза G2 и фаза видимой части митоза - М.
После периода угнетения митотической активности под влиянием облучения первыми клетками, вступающими в митоз, являются те клетки, которые в момент облучения находились в постсинтетической фазе G2, когда ДНК и хромосомы были удвоены. Этим объясняется преобладание хроматидных аберраций в первые часы после облучения. Постепенно в митоз начинают вступать клетки, находившиеся при облучении в синтетической (S) и предсинтетической (G1) фазах, т. е. в стадии редупликации и стадии, предшествующей редупликации хромосом. Этим объясняется упомянутая выше смена со временем хроматидных аберраций на хромосомные.
Кроме изменения типов встречающихся хромосомных повреждений отмечается также постепенное снижение общей частоты аберраций [120, 128, 129]. Подобное снижение частоты аберраций свидетельствует, по-видимому, о максимальной радиочувствительности постсинтетической фазы G2. Однако в его основе могут лежать и некоторые другие причины: 1) часть возникающих аберраций не может быть учтена на поздних сроках, если из-за летальности они вызывают гибель клетки уже в первом пострадиационном митозе; 2) возникающие разрывы могут восстанавливаться и не будут учтены, в результате частота аберраций на поздних сроках после облучения окажется заниженной по сравнению с фактической.
Приведенные данные показывают, таким образом, что расхождения разных авторов в определении частоты аберраций на клетку на 1 р могут объясняться, в частности, различиями в сроках исследования.
Очень важно сравнить действие радиации на генетический аппарат клеток человека и млекопитающих in vivo и in vitro. Имеется ли достаточный параллелизм между ответом на облучение клеток культур, находящихся в простых по сравнению с организмом условиях, при относительной их дедифференциации и дифференцированными клетками в сложных условиях взаимодействия целостного организма.
В связи с этим представляет интерес выяснение вопроса о параллелизме между общей радиочувствительностью организма определенного вида животных и радиочувствительностью его тканей in vitro. Показано [130], что клетки человека, кролика и хомячка в культуре располагаются по степени радиочувствительности хромосом в такой же последовательности, как и организмы этих видов по общей радиочувствительности. Так, LD50 для человека равна ~ 400 р, кролика - 800 p и хомячка - 900 р. Соответственно, в клетках человека in vitro (фибробласты эмбриональных тканей) среднее число хромосомных нарушений на 100 клеток на 1 р равнялось 0,141, у кролика - 0,053, у хомячка - 0,036.
При исследовании клеток костного мозга через 2-30 час. после тотального облучения самцов китайского хомячка рентгеновыми лучами в дозах 25-100 р [131] было найдено, что через 2 часа частота аберраций на клетку на 1 р составляла 0,005. Это достаточно близко совпадает с величиной 0,003, найденной ранее [118] для эпителиоподобных клеток in vitro. Остальные закономерности, характерные для клеток культур, а именно типы возникающих аберраций и снижение их частоты со временем, были обнаружены и после облучения in vivo. На этом основании можно сделать вывод о том, что эпителиоподобные клетки in vitro имеют приблизительно такую же чувствительность, как быстроделящиеся ткани in vivo, в то время как фибробластоподобные клетки значительно более радиочувствительны.
Таким образом, имеющиеся данные подтверждают правомочность сравнения эффекта излучений in vivo и iv vitro и возможность использования клеток в культуре для изучения индуцированного мутационного процесса и роли генетических последствий облучения в летальном эффекте радиации и злокачественном превращении.
Изменение жизнеспособности клетки. Изучение действия радиации на культуры тканей выявило чрезвычайно широкий диапазон радиочувствительности различных функций и структур клетки [132-136]. Как было указано выше, наиболее уязвимыми оказались процессы клеточного размножения и наиболее радиорезистентными - общая метаболическая активность и рост клетки. Описанный метод выращивания одиночных клеток на питающем слое [7] основан на следующих наблюдениях: облученные большой дозой рентгеновых лучей клетки переставали делиться, но в них продолжал протекать обмен веществ, они росли и достигали гигантских размеров [116, 137-139]. Потеря клеткой репродуктивной способности была избрана в качестве критерия летальности, так как с точки зрения клеточной популяции в целом она является летальным поражением. Метод выращивания клонов от одиночных клеток позволяет вести точный количественный учет "репродуктивной смерти" клеток по потере ими способности образовывать колонии. Зависимость выживания клеток в культуре от дозы рентгеновых лучей изучалась на различных типах клеток, а именно: на эпителиоподобной гетероплоидной линии HeLa, эпителиоподобных перевиваемых линиях клеток человека нормального происхождения (конъюнктива, печень, аппендикс), первично-эксплантированных эпителио- и фибробластоподобных клетках человека нормального происхождения [7, 119, 140-145]. Изучение кривых выживания [рис. 7] показало, что для всех анеуплоидных клеток, вне зависимости от их происхождения из нормальных или злокачественных тканей, характерен многоударный тип механизма летального действия с числом ионизации, равным ~ 2. Была вычислена величина D0(LD37), т. е. дозы, необходимой для снижения выживаемости клеток в линейной части кривой до 37%, которая оказалась равной ~ 100 р.
![Рис. 7. Кривая зависимости выживания эпителиоподобных клеток S3 HeLa от дозы. Ордината - доля выживших клеток; абсцисса - доза рентгеновых лучей (в р) [5]](pic/000066.jpg)
Рис. 7. Кривая зависимости выживания эпителиоподобных клеток S3 HeLa от дозы. Ордината - доля выживших клеток; абсцисса - доза рентгеновых лучей (в р) [5]
Для первично эксплантированных эпителиоподобных диплоидных клеток человека также характерна "двухударная" кривая с D0 равной 166 р. В отличие от эпителиоподобных клеток, диплоидные фибробластоподобные клетки обладали значительно более высокой радиочувствительностью и D0 была равна 50-96 р.
В ряде исследований было также показано, что радиочувствительность клеток может варьировать в зависимости от их происхождения из разных тканей и от разных видов.
Так, более высокая радиорезистентность (D0 = 280 рад) в отношении уγ-лучей наблюдалась в перевиваемых гетероплоидных клетках линии L-мыши, чем в перевиваемых линиях человеческих клеток (HeLa, НЕр2, Detroit и др.), а также в клетках костного мозга мыши in vivo [146, 147].
Разная степень радиочувствительности была отмечена для диплоидных клеток, происходящих из эмбриональных почек и легких человека и клеток кожи детей до 9 лет, которые культивировались в течение нескольких месяцев [148]. Величина летальной дозы (D0) колебалась в пределах от 41 до 480 рад (1 рад = 1,42 р) для разных культур. Колебания радиочувствительности могли отражать как различия в чувствительности исходных тканей, так и изменение соотношения двух морфологических типов клеток (эпителио- и фибробластоподобных) в ходе культивирования (исследования проводились в разные сроки культивирования).
Как показывают сводные данные, приведенные в табл. 4, результаты, полученные разными авторами, свидетельствуют об очень высокой степени радиочувствительности клеток млекопитающих и человека к летальному действию радиации и сходстве результатов облучения in vivo и in vitro. Летальная доза колеблется приблизительно в пределах от 50 до 170 р. Имеющиеся расхождения объясняются по-видимому, различиями радиочувствительности тканей, а также в ряде случаев условиями опыта. Так, разная радиочувствительность в четырех перевиваемых раковых линиях человека наблюдалась в зависимости от фазы роста популяции, на которой происходило облучение культуры [150].
![Таблица 4. Действие ионизирующей радиации на клетки млекопитающих [149]](pic/000067.jpg)
Таблица 4. Действие ионизирующей радиации на клетки млекопитающих [149]
Выявленный в результате проведенных исследований значительный параллелизм между высокой степенью чувствительности клеток in vitro к мутагенному и к летальному действиям радиации позволяет высказать некоторые предположения относительно причин, вызывающих репродуктивную смерть клеток, и о характере поражений, обусловливающих их гибель.
В основе репродуктивной смерти клеток могут лежать три главные причины: 1) нарушение митотического аппарата клетки, не позволяющее клетке разделиться; 2) нарушение синтеза ДНК, мешающее редупликации ДНК и хромосом, в норме предшествующего делению и 3) летальные изменения генетического аппарата (потери хромосом, хромосомные аберрации, точечные мутации).
Известно, что летально пораженные клетки могут проделать Несколько делений; этот факт указывает на то, что митотический аппарат клетки во многих случаях, по-видимому, не является ответственным за летальный эффект.
Работы, проводившиеся на различных клеточных линиях человека (HeLa, U12, FL и др.), мыши и китайского хомячка, показали, что синтез ДНК также является крайне радиорезистентным процессом. В исследованиях применялись методы авторадиографии и прямое определение содержания ДНК.
Облучение клеток U12 в дозе 500 р вызывает почти полную остановку митозов, которые, хотя и возобновляются через 13-20 час, являются абортивными и не приводят к увеличению числа клеток [151, 152]. Однако такая доза радиации не оказывала немедленного действия на синтез ДНК, который снижался позднее, но не приостанавливался полностью. По данным других авторов, рентгеновы лучи в дозах до 4000 р, необратимо повреждающие митоз, лишь временно уменьшали интенсивность синтеза ДНК, который после определенного лаг-периода возобновлялся. Доза 1000 р не вызывала появления лаг-периода. Через определенный промежуток времени синтез ДНК вновь прекращался после достижения двойного уровня ДНК в клетке, соответствующего предмитотическому содержанию. Таким образом, вторичная остановка синтеза определялась не прямым действием радиации, а была обусловлена неспособностью летально поврежденных клеток вступать в митоз и переходить затем ко второму циклу синтеза [153].
Проведенные расчеты [140, 143] показали, что величина D0 = 96 р (для клеток S3 HeLa), свидетельствующая о наличии очень радиочувствительного аппарата, эквивалентна поглощению только 10-12 кал на клетку. Даже при 100%-ной эффективности это количество энергии может разрушить только ~ 2⋅107 атомных связей. Поскольку разрывы будут распределяться случайно, очевидно, что число таких разорванных связей в каждой отдельной структуре будет чрезвычайно мало, т. е., по-видимому, каждая разрушенная структура играет важную роль в жизнедеятельности клетки и в случае ее разрушения или инактивации она невозместима.
С другой стороны, форма кривых выживания, показывающая, что число ионизации, вызывающих летальный эффект, невелико (часто встречается двухударная кривая) свидетельствует о том, что жизненно важные структуры, являющиеся мишенью летального действия, присутствуют в клетках в небольшом числе повторений - реплик. Все эти соображения, а также данные о высокой радиорезистентности метаболических процессов в клетках культур подтверждают представление о наибольшей уязвимости генетического аппарата, поражение которого приводит к гибели клетки.
Решающая роль поражения ядра в летальном эффекте радиации подтверждается также опытами выращивания клеток в среде, содержащей Н3-тимидин [154, 155]. Было установлено, что выживание клеток S3 HeLa является функцией дозы радиоизотопа и его удельной активности. Н3-Тимидин - специфический предшественник ДНК - включается только в ядро. Однако, как показывают радиоавтографы, степень включения бывает различной и зависит от вариабильности цикла генерации клетки и времени инкубации клеток в среде, содержащей Н3-тимидин. При авторадиографическом изучении установлено, что степень подавления образования колоний зависит от степени включения радиоизотопа. Очевидно, летальный эффект следует отнести за счет действия β-радиации на ядро.
Каков же характер генетических изменений, обусловливающих гибель клетки? Летальный эффект может определяться как точковой мутацией специфического гена или нескольких генов, регулирующих жизненно важные процессы, так и различными аномалиями кариотипа (потери хромосом, хромосомные аберрации). Летальность за счет генной мутации наиболее характерна для гаплоидных клеток. В диплоидных клетках возникающая генная мутация имеет возможность проявиться либо если она доминантна, либо если в гомологичной хромосоме имеется рецессивный аллельный ген. Что касается перевиваемых клеточных линий, в которых преобладают гетероплоидные клетки с числами хромосом, превышающими диплоидные, и в большинстве случаев каждая хромосома представлена двумя и большим числом реплик, проявление летальной мутации потребовало бы одновременного мутирования более чем одного аллельного гена. Теоретически не исключено, однако, что и в таком кариотипе какая-либо хромосома комплекса может присутствовать в гаплоидном числе.
Расчет величины чувствительного объема, т. е. объема того участка клетки, попадание в которой ионизирующей частицы вызывает биологический эффект [140], для клеток S3 HeLa (D0 = 96 р) показывает, что он равен примерно 1 мк3, что во много раз превышает обычно принимаемые объемы гена. Кроме того, двухударная форма кривой выживания также свидетельствует против существенной роли генных мутаций в летальном действии радиации и в пользу значения хромосомных повреждений. Все эти данные могут, однако, рассматриваться лишь как косвенные; вопрос о характере изменений, лежащих в основе гибели клетки, остается в значительной степени невыясненным.
При изучении летального действия радиации на клетку, важное значение имеет анализ процессов восстановления повреждений, которые могут сильно менять учитываемые результаты. Как было указано выше, хромосомные повреждения способны восстанавливаться, причем это восстановление может происходить еще до первого пострадиационного деления. Фактически улавливаемое число повреждений представляет собой, следовательно, только часть возникающих повреждений [156-158].
Полученные результаты имеют существенное значение для учета восстановления способности клеток опухолевых тканей к размножению при радиотерапии рака.
Проведенные исследования, показавшие на основе прямых экспериментов крайне высокую радиочувствительность хромосом человека и млекопитающих, позволяют, таким образом, дать количественную оценку действия радиации на наследственность человека и определить степень вреда, наносимого человечеству в результате увеличения темпа мутационного процесса под влиянием повышения фона искусственной радиации.
УФ-лучи
В отличие от действия ионизирующих излучений, эффект УФ-лучей изучен сравнительно мало.
Было исследовано влияние Уф-облучения на жизнеспособность клеток клоновой линии S3 HeLa [159, 160] и других перевиваемых линий человека. В качестве биологического дозиметра использовался фаг Т2, поскольку на этом объекте детально изучена зависимость инактивации фага от дозы. Фаговые частицы добавлялись в клеточную суспензию, которая облучалась Уф-лучами, и высевалась на газон кишечной палочки. Об эффекте судили по количеству стерильных пятен (бляшек) на газоне.
Результаты проведенных экспериментов показывают, что характер кривых выживания клеток, определяемых по способности образовывав колонии, сходен для УФ и рентгеновского облучения (D0 = 108 эре/мм2).
Табл. 5 дает сравнительную характеристику кривых выживания клеток HeLa и фага Т2. Эти данные позволяют сделать некоторые выводы относительно природы летального эффекта, вызванного облучением в клетках млекопитающих [160].

Таблица 5. Характеристика кривых выживания клеток HeLa S3 и фага Т2 при облучении УФ и рентгеновыми лучами
Таблица и кривые рис. 8 показывают, что если резистентность фага Т2 в отношении рентгеновых лучей в 400 раз превышает резистентность клеток 53, то в отношении УФ-лучей клетки 53 оказываются в 4 раза более резистентными.
![Рис. 8. Сравнение действия УФ- и рентгеновых лучей на клетки S3 НеLа и фаг Т2. Абсцисса: слева - доза УФ лучей (в эрг/мм2); справа - доза рентгеновых лучей (в кр). Ордината - выживаемость (в %) [160]](pic/000069.jpg)
Рис. 8. Сравнение действия УФ- и рентгеновых лучей на клетки S3 НеLа и фаг Т2. Абсцисса: слева - доза УФ лучей (в эрг/мм2); справа - доза рентгеновых лучей (в кр). Ордината - выживаемость (в %) [160]
Известно, что УФ-лучи вызывают преимущественно точечные мутации. У гаплоидного фага любая точечная мутация, затрагивающая жизнеспособность, имеет возможность проявиться, и этим объясняется более высокая чувствительность фага к УФ-облучению по сравнению с гетероплоидными клетками S3, где, как указывалось выше, основную роль в летальном поражении должны играть различные повреждения хромосом. Это последнее обстоятельство определяет высокую чувствительность гетероплоидных клеток к рентгеновым лучам, обусловливающим появление большого количества хромосомных разрывов. Кроме того, объем чувствительного участка (хромосомный материал) клеток млекопитающих значительно больше, чем у фага Т2, что определяет большую эффективность попадания энергии и, следовательно, более высокую радиочувствительность клетки [160].
Молекулярные основы радиочувствительности
Данные о значении структурных повреждений хромосом в летальном поражении клетки радиацией позволяют поставить вопрос о значении молекулярной структуры ДНК в определении радиочувствительности клетки.
При культивировании различных клеточных линий (Detroit-98 человека, клетки китайского хомячка) в среде, содержащей 5-хлор-, 5-бром- или 5-йоддезоксиуридин в концентрациях до 3⋅10-5 М, в условиях нехватки тимидина происходит замещение тимина в ДНК на галоидсодержащий аналог без потери жизнеспособности клеток [161-167].
Изучение поглощения УФ-лучей при 260 ммк и плотности ДНК при культивировании в присутствии аналога показало, что после первого цикла редупликации происходит включение аналога в одну цепь ДНК, в результате чего образуется "гибридная" молекула. После второго цикла редупликации возникали молекулы, в которых аналог был включен в обе цепи.
Клетки, содержащие ДНК, в которой тимин в обеих цепях замещен на галоидсодержащий аналог, оказываются значительно более чувствительными к летальному действию рентгеновых и УФ-лучей. Все три аналога (хлор-, бром- и йоддезоксиуридин) повышают радиочувствительность клеток, однако степень сенсибилизации различна. Наибольший эффект давали йод- и бромдезоксиуридин. Было вычислено, что при выращивании клеток (D98/AG) в течение четырех дней в среде, содержащей 2⋅10-6 М 5-хлор-, 5-бром- или 5-йоддезоксиуридин, с последующим облучением D0 была соответственно равна для рентгеновых лучей 110, 100 и 75 р (в контроле 180 р) и для УФ-лучей 175, 27 и 140 эрг/мм2 (в контроле 280 эрг/мм2).
Помимо повышения радиочувствительности в отношении летального действия радиации была также выявлена [168] сенсибилизация мышиных клеток L и двух клеточных линий китайского хомячка в отношении мутагенного действия излучений.
В табл. 6 показана зависимость возрастания частоты хроматидных разрывов от дозы рентгенооблучения для нескольких сублиний клеток L.
![Таблица 6. Количество хроматидных разрывов через 24 часа после рентгенооблучения в сублиниях L-M, обработанных 5-бромдезоксиуридином (5 мкг/мл) в течение 24 и 48 час. [168]](pic/000070.jpg)
Таблица 6. Количество хроматидных разрывов через 24 часа после рентгенооблучения в сублиниях L-M, обработанных 5-бромдезоксиуридином (5 мкг/мл) в течение 24 и 48 час. [168]
* (В скобках указано число исследованных метафаз.)
Полученные результаты показывают, что в контрольных клеточных линиях китайского хомячка, не подвергавшихся воздействию 5-бромдезоксиуридина, частота хроматидных разрывов возрастает линейно с увеличением дозы, частота обменов пропорциональна квадрату дозы. После воздействия аналогов наблюдается линейная зависимость от дозы как одиночных разрывов, так и обменов.
Анализ распределения разрывов в хромосоме I выявил, что оно происходит не случайно (рис. 9). Так, 29,5% из 200 наблюдавшихся разрывов было сосредоточено в участке, расположенном вблизи центромера. Поскольку воздействие бромдезоксиуридина в концентрациях, применявшихся в данной работе, не вызывало само по себе повышения частоты разрывов, то очевидно, что избирательное распределение разрывов связано с комбинированным действием радиации и химического вещества, обусловившего преимущественную сенсибилизацию определенных участков хромосом.
![Рис. 9. Схема хромосомы I китайского хомячка. Показана относительная частота повреждений в различных участках хромосомы после воздействия на клетки бромдезоксиуридином (5 мкг/мл в течение 12 час.) и рентгеновыми лучами в дозе 250 рад [168]](pic/000071.jpg)
Рис. 9. Схема хромосомы I китайского хомячка. Показана относительная частота повреждений в различных участках хромосомы после воздействия на клетки бромдезоксиуридином (5 мкг/мл в течение 12 час.) и рентгеновыми лучами в дозе 250 рад [168]
Таким образом, эти исследования показывают, что изменение химической структуры ДНК в результате замещения тимина на галоидсодержащие аналоги вызывает изменение радиочувствительности и, следовательно, подтверждают представление о том, что наиболее уязвимым является наследственный аппарат, поражение которого в результате облучения определяет гибель клетки.
Следует отметить, что помимо теоретического интереса вопрос о роли повреждения ДНК в летальном поражении клеток радиацией и возможности сенсибилизации ДНК путем произвольного изменения ее химической структуры может иметь большое значение в радиотерапии рака, так как позволяет получить большой эффект при меньших дозах облучения.
Химические мутагены
В культуре тканей изучалось мутагенное действие 5-бромдезоксиуридина, гидроксиламина, ДНК и озона.
На клеточных линиях мыши и китайского хомячка было показано [169-171], что под влиянием 5-бромдезоксиуридина и гидроксиламина в хромосомах возникают различные аномалии. 5-Громдезоксиуридин вызывает удлинение участков центромеров и вторичных перетяжек, а также хроматидные разрывы. Гидроксиламин обусловливает появление хромосомных разрывов. В отличие от рентгеновых лучей, вызывающих случайное распределение разрывов между хромосомами и по длине хромосом, действие названных химических агентов отличается избирательностью. Так, разрывы, возникающие под влиянием 5-бромдезоксиуридина, сосредоточиваются в теломерах, в то время как гидроксиламин поражает участки, прилегающие к центромерам. На рис. 10 представлена схема одной из хромосом китайского хомячка и распределение в ней разрывов, возникающих под влиянием 5-бромдезоксиуридина, гидроксиламина и рентгеновых лучей. Эта схема показывает, что различные участки хромосомы обнаруживают разную чувствительность по отношению к химическим агентам.
![Рис. 10. Схема хромосомы I китайского хомячка. Показана относительная частота повреждений в различных участках хромосомы после воздействия а - бромдезоксиуридином (25 мкг/мл в течение 24 час); б - гидроксиламином (5 мкг/мл в течение 48 час); в - рентгеновыми лучами (250 рад) [170]](pic/000072.jpg)
Рис. 10. Схема хромосомы I китайского хомячка. Показана относительная частота повреждений в различных участках хромосомы после воздействия а - бромдезоксиуридином (25 мкг/мл в течение 24 час); б - гидроксиламином (5 мкг/мл в течение 48 час); в - рентгеновыми лучами (250 рад) [170]
Распределение разрывов под влиянием двух изученных мутагенов различно, что указывает на специфичность их действия. Было установлено, что при культивировании клеток в присутствии 5-бромдезоксиуридина происходит его включение в молекулу ДНК и постепенное замещение тимина на 5-бромдезоксиуридин [171]. Известно также, что гидроксиламин является мутагеном, оказывающим специфическое действие на цитозин [172].
Избирательность действия этих веществ на хромосомы, по-видимому, объясняется неравномерным распределением вдоль молекулы ДНК пар оснований: одни участки более богаты аденином и тимином, другие - цитозином и гуанином. Неодинаковое взаимодействие химического вещества с тем или иным основанием может объяснить избирательность его действия как мутагенного фактора. Мутагенное действие озона было показано на перевиваемой линии человека КВ. После пропускания газовой смеси, состоящей из озона и кислорода, в течение 5-10 мин. через сосуд с растущими клетками в них отмечается увеличение числа хромосомных аномалий [173]. На примере хромосомных делеций показано, что частота их возникновения в зависимости от длительности воздействия возрастает экспоненциально. Можно предположить, что повышение частоты хромосомных аберраций под влиянием озона объясняется образованием при его распаде в воде свободных радикалов ОН и НО2, которые, как известно, возникают также после облучения клетки ионизирующими излучениями и обладают высокой биологической активностью.
Имеются некоторые данные относительно мутагенного действия гетерологичной ДНК на клетки млекопитающих [174, 175]. При культивировании куриных фибробластов в среде, содержащей мышиный эмбриональный экстракт, а клеток эмбрионов мыши - в присутствии куриного эмбрионального экстракта, наблюдались морфологические и числовые изменения хромосом. Опыты по воздействию гетерологичной телячьей ДНК (непосредственно после экстрагирования и после воздействия УЗ-волнами) на растущие куриные фибробласты также показали возникновение разнообразных хромосомных аномалий (хромосомные перестройки, полисомия). Эти результаты дают основания предположить, что в гетерологичных эмбриональных экстрактах активным (хотя, возможно, и не единственным мутагенным фактором) является ДНК.
Мутагенное действие вирусов
Вопрос о влиянии вирусов на хромосомный аппарат клетки начал изучаться лишь в самое последнее время. Вместе с тем эта проблема имеет важное значение с точки зрения понимания природы взаимодействия вируса и клетки. Хорошо известны различные формы этого взаимодействия. Так, многие вирусы, репродуцируясь в клетке, вызывают ее гибель (цитопатическое действие). Наряду с этим известны также примеры длительного сосуществования вируса и клетки, когда вирус размножается в клетке хозяина, не вызывая ее дегенерации. Наконец, особое место занимает взаимодействие онкогенных вирусов с клеткой, вызывающее клеточную трансформацию, которая сказывается как в изменении морфологии, так и в приобретении клеткой способности к неограниченному размножению, приводящей к развитию злокачественных новообразований. Все это делает задачу изучения мутагенного действия вируса крайне настоятельной, как в случае взаимодействия клетки с онкогенными вирусами, так и при воздействии другими вирусами, в частности, в связи с вопросом об отдаленных последствиях инфекции. Необходимость подобных исследований диктуется также все расширяющимся применением так называемых "живых" вакцин с профилактическими целями, когда при вакцинации в организм вводится не инактивированный, а лишь ослабленный (аттенуированный) вирус;
Число работ, в которых изучалось действие вирусов на кариотип клетки, крайне невелико. Были исследованы вирусы герпеса, кори и два онкогенных вируса - обезьяний вакуолизирующий вирус SV40 и вирус, полиомы.
Влияние вируса герпеса изучали на гипердиплоидных клетках китайского хомячка [176], вируса кори - на клетках перевиваемой линии человека НЕр-2 и in vivo на лейкоцитах больных корью [177, 178].
Во всех случаях было отмечено значительное повышение частоты хромосомных аберраций. Так, при исследовании крови больных корью показано, что от 33 до 72% клеток (у разных больных) несли разрывы хромосом (преимущественно изохроматидные), в то время как в контроле частота разрывов составляла 2-5,4%.
В культуре НЕр-2 отмечено увеличение процента полиплоидных клеток и хромосомных аберраций через 72 часа после заражение вирусом кори. При этом разрывы распределялись по длине хромосомы случайно. Под влиянием вируса герпеса в культуре клеток китайского хомячка также отмечалось увеличение частоты хромосомных аберраций (преимущественно хроматидного типа). Однако в этом случае наблюдалась избирательная концентрация разрывов в районе центромеров и вторичных перетяжек хромосом 1 и 2, а также в центромерном районе субтелоцентрических хромосом.
Исследование действия онкогенного вакуолизирующего вируса обезьян SV40 на первично эксплактированные клетки слизистой оболочки рта и кожи взрослых людей [179], наряду с морфологической трансформацией клеток и увеличением скорости роста, показало возникновение различных хромосомных аберраций: дицентриков, нехваток в хромосомах 21, 22 и Y-хромосоме, ацентриков и т. д. Это позволяет предположить, что наблюдающийся феномен не является обратимым фенотипическим изменением, поскольку он сопровождается изменениями хромосомного аппарата. Измененные клетки обладают, по-видимому, селективным преимуществом, поскольку они постепенно вытесняют нормальные клетки.
Аналогичные данные получены при воздействии вируса SV40 на диплоидные культуры почек человеческих эмбрионов и новорожденных [180]. Среди трансформированных клеток отмечено появление анеуплоидии, главным образом за счет моносомии по той же группе хромосом (21, 22) и квазидиплоидии, при которой моносомия компенсировалась трисомией по другим хромосомам.
Изменения хромосомного аппарата (полиплоидия, хроматидные разрывы) наблюдались также в клетках китайского хомячка под влиянием вируса полиомы [181, 182].
В ходе культивирования клеток число хромосомных аномалий снижалось, однако они все же возникали в трансформированных клетках даже после исчезновения инфекционного вируса. Невозможность выявления вирусной ДНК не свидетельствует, по мнению многих авторов, об ее отсутствии в клетке. Предполагается, что она находится не в свободном, а в интегрированном с геномом клетки виде и является постоянно присутствующим мутагеном.
Таким образом, приведенные данные ясно показали, что в процессе взаимодействия с клеткой некоторые вирусы могут изменять ее генетический аппарат, вызывая появление различных аномалий кариотипа. Имеет ли это явление широкое распространение, или оно связано только с действием немногих вирусов, покажут будущие исследования. Во всяком случае, нельзя не учитывать возможность подобного действия, так как повышение частоты возникновения мутаций в соматических клетках, причем не обязательно летальных, может приводить к накоплению вредных изменений в организме.
4. Передача генетической информации
Помимо уже разработанных методов исследования, позволивших получить интересные данные относительно закономерностей естественного и индуцированного мутационного процесса, перед генетикой соматических клеток открылись бы дальнейшие широкие перспективы, если бы была показана возможность проведения в клеточных популяциях in vitro генетического анализа, позволяющего составлять генетические карты и локализовать возникающие мутации.
С этой точки зрения любые данные о возможности передачи генетической информации от клетки к клетке через ДНК, интактные хромосомы или в результате процесса слияния клеток, имитирующего половой процесс ("гибридизация" клеток), представляют принципиальный интерес.
1) Генетическая трансформация
Явление генетической трансформации, впервые открытое в 1928 г. у пневмококков [183], явилось прямым доказательством роли ДНК в наследственности и до самых последних лет было известно только у бактерий. Изучение различных генетических маркеров в клетках in vitro (в первую очередь биохимических мутантов) и создание клеточных линий, резко контрастирующих по определенным признакам, дали основания искать пути к изучению генетической трансформации в клетках высших организмов.
Основным условием проведения подобных исследований является наличие достаточно чувствительных методов обнаружения трансформантов, и в первую очередь селективных питательных сред, которые позволили бы элиминировать нетрансформированные клетки и улавливать появление трансформированных, даже если частота их возникновения крайне низка.
Работы, в которых изучалась возможность получения трансформации в клетках млекопитающих in vitro, можно разбить на две категории в зависимости от метода регистрации трансформации - по изменению свойств популяции в целом или по изменению свойств отдельных клеток.
Среди первой группы работ следует отметить исследования [184, 185], проводившиеся на первичных культурах костного мозга человека, где в качестве генетического маркера использовались различные типы гемоглобинов: гемоглобин S(HbS) и гемоглобин А(НbА).
Культуру костного мозга от больного серповидноклеточной анемией (гемоглобин S + 8% фетального гемоглобина F) подвергали воздействию ДНК, меченной Н3, из костного мозга здорового человека (гемоглобин А). Авторадиограммы показали включение меченой ДНК в цитоплазму, ядро эритробластов и некоторых других клеток. Электрофоретический анализ гемолизатов клеток культур, обработанных ДНК, и гемолизатов периферической крови донора и реципиента ДНК выявил, что клетки, которые генетически были способны синтезировать только полипептидные цепи αА, βS и γ, характерные для HbS и HbF, после включения ДНК из клеток, синтезирующих полипептиды αА, βA и γ, характерные для НbА, начинали синтезировать как полипептиды αА, βS и γ, так и полипептиды βA, а возможно, и измененную α-полипептидную цепь.
Формирование измененного гемоглобина наблюдалось также при обратной комбинации донора и реципиента.
Для изучения изменений восприимчивости мышиных макрофагов из перитонеального эксудата к вирулентному штамму вируса гепатита использовались клеточные экстракты [186, 187]. Макрофаги линии мышей Принстон (PRI) разрушаются под влиянием этого вируса, в то же время макрофаги линии СЗН обнаруживают устойчивость. Макрофаги PRI не теряли чувствительности при культивировании с экстрактами из резистентной линии СЗН, а устойчивые макрофаги СЗН приобретали чувствительность в присутствии экстрактов из макрофагов чувствительной линии PRI. В них наблюдалась значительная дегенерация и размножение вируса, который в обычных условиях не размножается в клетках линии СЗН. Чувствительность оказывалась как бы доминантной по отношению к резистентности, что совпадает с данными [188] о доминировании чувствительности к вирусу гепатита над резистентностью у мышей.
Поскольку ДНК-аза не снимала полностью активность экстрактов, нельзя с уверенностью говорить о том, что ответственной за изменение чувствительности является ДНК.
Использование в упомянутых работах первично эксплантированных клеточных культур, а также разрушение клеток для электрофоретического анализа в первом случае и разрушение клеток под влиянием вируса - во втором не позволяли проследить наблюдавшиеся изменения в последующих клеточных поколениях и тем самым определить, имеем ли мы дело с наследственным изменением признака.
Во второй группе работ использовались перевиваемые клеточные линии, которые давали возможность размножать измененные варианты в случае их возникновения. Наличие генетических маркеров в таких линиях и создание селективных условий опыта позволили вести учет изменений не популяции в целом, а отдельных клеток.
В одной из работ в качестве генетического маркера для изучения феномена трансформации была избрана резистентность к 8-азагуанину [189]. Использовались клеточная линия лейкоза мышей Р388, высокочувствительная к этому пуриновому аналогу, и полученные из нее резистентные клоновые сублинии, способные расти в среде, содержащей в 4000 раз более высокую концентрацию 8-азагуанина по сравнению с концентрацией, токсичной для родительской линии.
В первой серии опытов чувствительные клетки Р388 инкубировались в течение различных сроков (от 3 час. до 18 дней) в среде, содержащей ДНК из клеток резистентных сублиний, после чего они высевались в чашки Петри на среду, содержащую 8-азагуанин в токсичных для родительской линии концентрациях. В контроле, не подвергавшемся воздействию ДНК, резистентные колонии либо вовсе не появлялись, либо число их было невелико. В культурах, обработанных ДНК, число колоний, способных расти в присутствии высоких концентраций 8-азагуанина, было значительно выше. Размножение выживших колоний в течение ряда клеточных поколений (до 40 генераций) в отсутствие 8-азагуанина и последующее испытание показали сохранение резистентности. Степень резистентности была, однако, значительно ниже, чем в устойчивой сублинии, из которой извлекалась ДНК. Это можно объяснить тем, что резистентность обусловлена в данном случае не одним, а несколькими генами. Как известно, при трансформации у микроорганизмов, в основном, передается один ген, поэтому для достижения высокого уровня резистентности в данном случае потребовалось бы несколько повторных воздействий и, соответственно, несколько актов трансформации.
Интерпретация этого исследования значительно затрудняется, однако, тем, что во второй серии экспериментов при одновременном (а не последовательном). воздействии ДНК и 8-азагуанина были получены противоречивые результаты, поскольку увеличение числа выживших колоний наблюдалось не только под влиянием ДНК, экстрагированной из резистентной линии, но и под влиянием ДНК. из чувствительной линии. Обработка ДНК-азой не снимала наблюдаемого эффекта. На этом основании высказано предположение о том, что увеличение числа выживших колоний после воздействия ДНК, возможно, определяется не целостной молекулой ДНК, а ее компонентами. Воздействие отдельными основаниями: аденином, гуанином, тимином, цитозином и урацилом показало, что эффект аденина аналогичен эффекту интактной ДНК и вызывает увеличение числа колоний, выживающих в присутствии 8-азагуанина. Испытание резистентности выживших клеток после инкубации их в отсутствие аналога показало, что в отличие от клеток, полученных в первой серии опытов, эти клетки полностью сохраняли свою чувствительность, не приобретая резистентности.
По-видимому, механизм действия ДНК различен в разных условиях воздействия. В случае предварительной инкубации клеток с ДНК и последующего добавления 8-азагуанина наблюдается явление, в значительной степени напоминающее феномен генетической трансформации у бактерий, что подтверждается сохранением резистентности при размножении клеток. Во втором случае, очевидно, имеет место какой-то неспецифический защитный эффект ДНК, предохраняющий клетку от вредного действия 8-азагуанина, но не изменяющий ее наследственность в сторону приобретения резистентности.
Наиболее убедительные результаты были получены на мутантных клетках костного мозга человека линии Detroit-98 (D 98) [190, 191]. Среди ряда полученных мутантных линий, резистентных к различным аналогам пуриновых оснований, в качестве реципиента ДНК была выбрана культура клеток, устойчивая к 8-азагипоксантину. Эти клетки (D 98/АН) характеризуются полным отсутствием активности пирофосфорилазы инозиновой кислоты и способности использовать гипоксантин в качестве источника пуринов. Донором ДНК служили родительская клоновая линия D 98S и линия D 98/AG, устойчивая к 8-азагуанину, активно превращающие гипоксантин в соответствующее пуриновое основание ДНК.
Путем создания селективной среды (HAT), где в качестве единственного источника пуринов использовался гипоксантин, были обеспечены условия, при которых могли делиться и образовывать колонии только клетки, обладающие нормальной активностью пирофосфорилазы инозиновой кислоты, и автоматически элиминировались клетки, неспособные использовать гипоксантин. Для изучения процесса трансформации клетки D 98/АН подвергались воздействию ДНК, извлеченной из культур D 98S или D 98/AG, после чего они высевались в чашки Петри, содержащие селективную среду HAT. Клетки реципиента не могли размножаться в такой среде, и колонии образовывали только клетки, в которых либо произошла реверсия к нормальной активности фермента путем обратной мутации, либо трансформация под влиянием ДНК, в результате чего клетки приобрели способность использовать гипоксантин.
В табл. 7 приведены результаты опытов. Изучалась передача способности использовать гипоксантин от доноров с нормальной активностью пирофосфорилазы инозиновой кислоты (ПИК+) к реципиентам, у которых отсутствует активность фермента (ПИК-) [190]. Сходство полученных результатов с явлением генетической трансформации подтверждается следующими фактами: 1) специфичностью действия ДНК донора (трансформация возникает только в ответ на ДНК ПИК-положительных, но не ПИК-отрицательных клеток); 2) ДНК-аза полностью снимает трансформирующую активность ДНК, в то время как действие РНК-азы неэффективно; 3) число трансформантов возрастает с увеличением дозы ДНК.

Таблица 7. Генетическая трансформация в клетках D98
Примечание. В 1 мл взвеси содержалось 500000 клеток.
Изучение трансформированных линий показало восстановление в них способности использовать гепоксантин в качестве источника пуринов, чувствительность к различным пуриновым аналогам и нормальную активность пирофосфорилазы инозиновой кислоты, характерные для клеток донора.
Таким образом, проведенные исследования выявили принципиальную возможность получения генетической трансформации в клетках млекопитающих при условии подбора достаточно чувствительных селективных систем и тем самым открыли пути для изучения передачи информации на молекулярном уровне.
2) "Гибридизация" клеток
В 1960 г. впервые было описано возникновение "гибридных" клеток в смешанной культуре двух мышиных линий [192]. Такие гибридные клетки характеризовались суммарным числом хромосом и наличием хромосомных маркеров от обоих родительских линий. В последующих работах [193-196] было проведено детальное исследование условий возникновения "гибридов", их судьбы в смешанной клеточной популяции и их свойств.
Исходными родительскими клетками служили клетки двух клоновых сублиний, происходящих из перевиваемой линии подкожной жировой ткани мышей. У клеток первого клона модальное число составляло 55 хромосом. Все хромосомы были телоцентрическими, причем в клетках присутствовал один типичный маркер - очень длинный телоцентрик (рис. 11, а). Первый клон обладал высокой злокачественностью при прививке мышам, что выражалось в высоком проценте прививаемости и большой скорости роста опухоли.
![Рис. 11. Хромосомные наборы клеток из перевиваемой линии подкожной жировой ткани мышей: а - клона № 1 (54 хромосомы; в том числе одна очень длинная телоцентрическая); б - клона № 2 (61 хромосома, в том числе 12 двуплечих); в - гибридной клетки М (122 хромосомы, в том числе 14 двуплечих и одна длинная телоцентрическая) [194]. Отклонения от модальных чисел на рисунках объясняются присутствующей в данных культурах вариацией числа хромосом](pic/000074.jpg)
Рис. 11. Хромосомные наборы клеток из перевиваемой линии подкожной жировой ткани мышей: а - клона № 1 (54 хромосомы; в том числе одна очень длинная телоцентрическая); б - клона № 2 (61 хромосома, в том числе 12 двуплечих); в - гибридной клетки М (122 хромосомы, в том числе 14 двуплечих и одна длинная телоцентрическая) [194]. Отклонения от модальных чисел на рисунках объясняются присутствующей в данных культурах вариацией числа хромосом
Модальное число хромосом клеток клона № 2 было равно 62; они характеризовались наличием большого числа метацентриков с модальным числом 13 и отсутствием длинного телоцентрика (рис. 11, б). Клон № 2 отличался низкой канцерогенностью.
При совместном культивировании клеток обоих клонов, которые были смешаны первоначально в равных количествах, через 3-4 месяца (в разных опытах) появлялся новый тип клеток, названный типом М. Эти клетки характеризовались модальным числом хромосом, равным 115-116, присутствием длинного телоцентрика и модальным числом метацентриков - 13 (рис. 11, в). Такие "гибридные" клетки обладали явным селективным преимуществом по сравнению с родительскими, т. е. обнаруживали своего рода гетерозис, столь распространенный у гибридов. Если вначале клетки М были единичными, то постепенно их число возрастало. Клетки, клона № 2 также характеризовались известным селективным преимуществом по сравнению с клетками первого клона, через 5-8 месяцев совместного культивирования клеточная популяция почти целиком состояла из клеток М и клеток второго клона. Имплантация в этот период клеток из данной культуры животным показала высокую степень прививаемости (6 из 7 животных и 12 из 12 соответственно в двух опытах) и скорость роста опухоли, характерные для первого клона.
В 15 клоновых линиях, полученных как из смешанной популяции in vitro, так и из опухолей после прививки мышам смешанной клеточной культуры, кариологические и биологические характеристики были сходными. Во всех случаях клетки М обладали высокой канцерогенностью клеток первого клона, хотя некоторые морфологические и биологические особенности напоминали клетки второго клона. Свойства клеток М сохранялись на протяжении всего периода наблюдения (около года).
Вопрос о механизме возникновения клеток с высокой плоидностью пока не вполне ясен. Однако их возникновение наиболее вероятно путем слияния клеток.
Имеются данные о появлении гибридных клеток в смешанной культуре клеток L (подкожная соединительная ткань мышей СЗН) и клеток МTl (индуцированная вирусом полиомы опухоль молочной железы мышей SWR). Новый тип клеток характеризовался гибридным кариотипом и обладал выраженным селективным преимуществом, в результате чего по прошествии нескольких недель исходные родительские клетки были вытеснены [197].
Для изучения антигена гистосовместимости у гибридных клеток, 1⋅106 гибридных клеток, клеток L и МТl инокулировались мышам СЗН, SWR и гибридам F1, СЗН × SWR. Результаты приведены в табл. 8.
![Таблица 8. Проявление антигена гистосовместимости у гибридных клеток (по каждой клеточной линии было изучено по 5 мышей) [197]](pic/000075.jpg)
Таблица 8. Проявление антигена гистосовместимости у гибридных клеток (по каждой клеточной линии было изучено по 5 мышей) [197]
Как и следовало ожидать, клетки L успешно росли у мышей СЗН, клетки МТl - у мышей SWR. Гибридные клетки давали опухоли только у гибридных мышей, но ни в одной из родительских линий, что подтверждает наличие у них антигенов гистосовместимости от обоих родителей.
Таким образом, в результате своеобразного процесса гибридизации обе родительские формы привносят в гибридную клетку свою генетическую информацию, благодаря чему клеточные гибриды сочетают в себе свойства родительских клеток. При этом наблюдается своего рода доминирование одних признаков над другими, как, например, высокой злокачественности над низкой.
* * *
Приведенные в обзоре данные показывают, что за сравнительно короткий срок в области генетики соматических клеток млекопитающих и человека in vitro достигнуты значительные результаты. Не все разделы этой проблемы разработаны в настоящее время в одинаковой степени. Наибольшее развитие получили исследования, посвященные естественному и индуцированному мутационному процессу, особенно действию радиации на клетки. Это диктуется в первую очередь задачей исследования генетических факторов, лежащих в основе злокачественного превращения, и оценки генетических последствий облучения.
Имеются, однако, все предпосылки, для того чтобы рассчитывать на успешное развитие исследований и в других разделах. Это связано с тем, что в настоящее время показана принципиальная возможность применения в отношении клеток млекопитающих и человека, культивируемых вне организма методов, давших столь блестящие результаты при изучении генетики микроорганизмов.
Литература

|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'