
1.2. Картирование и генетика большого комплекса гистосовместимости человека - системы HLA
За последние годы представления о генетическом строении локуса HLA уточнены и расширены. Методом хромосомной гибридизации [Van Somersen М., 1974; Franke U., Pellegrino M., 1977], безусловно, доказано, что он локализуется на 6-й аутосомной хромосоме человека и занимает расстояние, равное примерно 1,6 сантиморганам*. Композиция комплекса HLA и его взаимосвязь с другими генетическими маркерами, расположенными на 6-й хромосоме, показаны на рис. 1. На том же конце хромосомы, по одну сторону от центромеры, расположены гены, кодирующие эритроцитарные системы Chido и Rogers, малик-энзим (МЕ-1), фосфоглюкомутазу-3 (PgM3), супероксидисмутазу-2 (SOD2), мочевой пепсиноген-5 (Pg5), гипоксалазу (GLO) и некоторые факторы комплемента Bf [van Rood J. et al., 1976].
1(Сантиморган (сМ) - мера расстояния в единицах кроссинговера, широко распространенная в генетике и молекулярной биологии.)
В самом комплексе HLA выделяют 5 генетических структурных единиц - сублокусы А, В, С, D и DR.
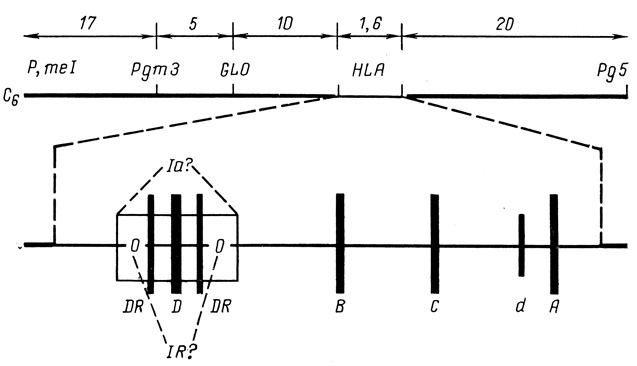
Рис. 1. Схема строения HLA-системы (по данным литературы). Средняя линия - картирование генетических маркеров хромосомы Сб (короткого плеча), нижняя - картирование субъединиц HLA. Наверху - расстояние между маркерами в сантиморганах
Антигены, принадлежащие к первым трем и последним сублокусам, выявляются серологическим путем и обозначаются как SD-детерминанты (Serologicaly determined). Антигены сублокуса HLA-D выявляются посредством реакции смешанной культуры лимфоцитов (MLC) и получили название LD-детерминант (Lymphocyte determined). К 1980 г. почти полностью выявлены антигены, входящие в сублокус HLA-A (20 детерминант) и HLA-B (40 детерминант). Суммарная частота генов каждого из этих сублокусов составляет почти единицу (без сотых долей); это означает, что их композиция известна практически полностью. Аллельные специфичности, входящие в остальные сублокусы, известны пока не полностью. Суммарная частота генов, идентифицированных к началу 80-х годов, составляла для сублокуса HLA-C 0,55; для HLA-D - 0,8 и для HLA-DR - 0,75. Это означает, что в каждом из последних трех сублокусов HLA имеются аллельные специфичности, пока не идентифицированные. В табл. 2 представлен полный перечень антигенов гистосовместимости (аллелей), входящих в состав каждого из сублокусов HLA, как это было определено на 8-м Уоркшопе (1980).
Система HLA является, по-видимому, самой полиморфной системой человека, в которой каждый из сублокусов представлен серией аллельных генов с разной степенью частоты распределения в человеческих популяциях (см. разделы 1.6 и 1.7).
В соответствии с основными генетическими закономерностями каждый индивидуум является носителем не более двух аллелей каждого из сублокусов (по одному на каждой из парных аутосомных хромосом). В гаплотипе (набор аллелей на одной хромосоме) присутствует по одному аллелю каждого из сублокусов HLA. Поскольку каждый из аллелей имеет на клеточной мембране функциональное представительство в виде антигена гистосовместимости, они могут быть выявлены с помощью специальных реакций (см. главу 2), которые получили общее название типирования антигенов гистосовместимости. При этом, если индивид гетерозиготен по всем аллелям HLA-комплекса, у него в серологическом типировании (для А, В, С, DR-сублокусов) выявляется не более 8HLA антигенов и при LD-типировании не более 2 антигенных детерминант локуса HLA-D. Если индивид гомозиготен по некоторым позициям, у него выявляется меньшее число антигенов, однако при серологическом типировании это число не может быть меньше 4, а при LD-типировании меньше 1.
Для клинического рутинного типирования до последнего времени особое значение имело выявление антигенов сублокусов HLA-A и HLA-В, как наиболее изученных, для которых получены значимые клинические ассоциации. Если у типируемого субъекта выявлены 4 возможных антигена HLA-A и HLA-B, эта ситуация получила название "full house" ("полный дом" антигенов); среди европейцев примерно 65 - 70% населения являются "full house" (рис. 2).
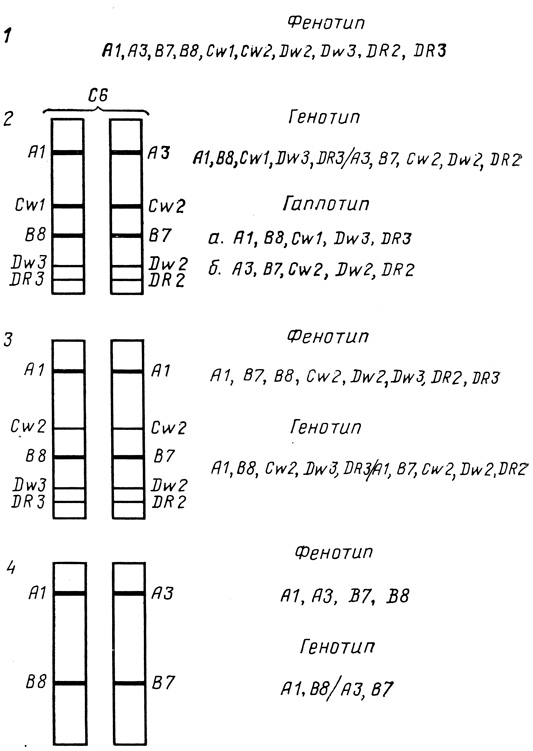
Рис. 2. Схема генетических взаимоотношений, выявляемых при тканевом типировании. 1 - фенотип одного индивида, выявляемый серологическим и клеточным типированием; 2 - генотип показывает картирование аллелей на аутологичных хромосомах, гаплотип представляет собой набор аллелей на одной хромосоме; 3 - гомозиготность по сублокусам HLA-A и HLA-C; 4 - full house в рутинном клиническом типировании
Отличительной популяционной особенностью HLA-системы, как это все более вырисовывается, является ее чрезвычайный полиморфизм. Разнообразие аллельного представительства дает такое число возможных вариантов их сочетаний, которое практически необозримо. Простой математический расчет, произведенный только для сублокусов HLA-A и HLA-B, убеждает в популяционной генерогенности HLA-системы. Поскольку сублокус А включает 20 аллельных генов, а сублокус В - 40, то число возможных гаплотипов А - В равно 800; в популяции они могут формировать 800 гомозиготных 800 · 799/2 = 639 200 гетерозиготных комбинаций, т. е. всего около 640 тыс. вариантов. В соответствии с этим расчетом идентичный А-В генотип мог бы встретиться с частотой 1 : 64 000. Включение в этот несложный расчет остальных сублокусов HLA увеличивает число возможных комбинаций до необозримого количества. Однако практика показывает, что вследствие феномена неравновесного сцепления (см. раздел 1.6) субъектов, идентичных по крайней мере по HLA-A и HLA-B сублокусам, можно встретить значительно чаще, чем показывает теоретический расчет.
Таблица 2
Полный перечень антигенов HLA (согласно заключению 8-го Международного Уоркшопа)
| Сублокусы | ||||
| HLA-A | HLA-B5 | HLA-Cwl | HLA-Dw1 | HLA-DR1 |
| HLA-A2 | HLA-B7 | HLA-Cw2 | HLA-Dw2 | HLA-DR2 |
| HLA-A3 | HLA-B8 | HLA-Cw3 | HLA-Dw3 | HLA-DR3 |
| HLA-A9 | HLA-B12 | HLA-Cw4 | HLA-Dw4 | HLA-DR4 |
| HLA-A10 | HLA-B13 | HLA-Cw5 | HLA-Dw5 | HLA-DR5 |
| HLA-A11 | HLA-B14 | HLA-Cw6 | HLA-Dw6 | HLA-DRw6 |
| HLA-Aw19 | HLA-B15 | HLA-Cw7 | HLA-Dw7 | HLA-DR7 |
| HLA-Aw23(9) | HLA-Bw16 | HLA-Cw8 | HLA-Dw8 | HLA-DRw8 |
| HLA-Aw24(9) | HLA-B17 | HLA-Dw9 | HLA-DRw9 | |
| HLA-A25(10) | HLA-Bw18 | HLA-Dw12 | HLA-DRw10 | |
| HLA-A26(10) | HLA-Bw21 | HLA-Dw11 | ||
| HLA-A28 | HLA-Bw22 | HLA-Dw12 | ||
| HLA-A29 | HLA-B27 | |||
| HLA-Aw30 | HLA-Bw35 | |||
| HLA-Aw31 | HLA-B37 | |||
| HLA-Aw32 | HLA-Bw38(w16) | |||
| HLA-Aw33 | HLA-Bw39(w16) | |||
| HLA-Aw34 | HLA-B40 | |||
| HLA-Aw36 | HLA-Bw40 | |||
| HLA-Aw43 | HLA-Bw42 | |||
| HLA-Bw44(12) | ||||
| HLA-Bw45(12) | ||||
| HLA-Bw46 | ||||
| HLA-Bw47 | ||||
| HLA-Bw48 | ||||
| HLA-Bw49(w21) | ||||
| HLA-Bw50(w21) | ||||
| HLA-Bw51(5) | ||||
| HLA-Bw52(5) | ||||
| HLA-Bw53 | ||||
| HLA-Bw54(w22) | ||||
| HLA-Bw55(w22) | ||||
| HLA-Bw56(w22) | ||||
| HLA-Bw57(17) | ||||
| HLA-Bw58(17) | ||||
| HLA-Bw59 | ||||
| HLA-Bw60(40) | ||||
| HLA-Bw61(40) | ||||
| HLA-Bw62(15) | ||||
| HLA-Bw63(15) | ||||
| HLA-Bw4 | ||||
| HLA-Bw6 | ||||
Система гистосовместимости человека прошла определенный путь развития в филогенезе и поэтому имеет много общего в строении с системами гистосовместимости других млекопитающих. Рис. 3 дает представление о филогенетических аспектах проблемы HLA. Как видно, локусы HLA-A и HLA-B являются аналогами концов D и К системы гистосовместимости мышей Н-2 [Bach J., van Rood J., 1976] и подобны аналогичным генетическим структурам животных других видов, в том числе обезьян [van Es А., 1980].
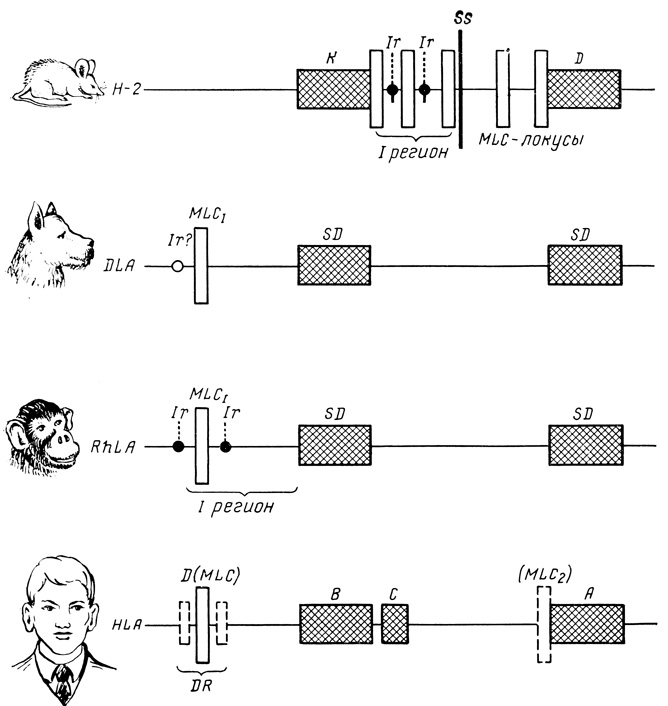
Рис. 3. Филогенетические аспекты строения HLA-системы (по данным литературы). Пояснение в тексте
В отличие от мыши, но в полном сходстве с другими представителями животного царства структуры, ответственные за стимуляцию лимфоцитов в смешанной культуре (HLA-D), у человека расположены вне интервала А - В.
Сублокус С расположен внутри интервала А - В в непосредственной близости от локуса В, что было определено после обнаружения кроссинговера между HLA-B и HLA-C [Hansen М. et al., 1975; Waltz H., Rose M., 1977]. В наименовании последнего из ныне известных сублокусов HLA-DR отражена его тесная генетическая связь с сублокусом HLA-D (D-related). Этот сублокус пока не картирован (как не обнаружен до сих пор кроссинговер между D и DR), и не получено безупречных доказательств его неидентичности с детерминантами сублокуса HLA-D. Однако принципиально иная техника выявления антигенов HLA-DR (серологическая) дает основание сформулировать концепцию о существовании сублокуса HLA-DR как самостоятельной структурной единицы внутри HLA-комплекса.
В филогенетическом отношении детерминанты HLA-DR, по-видимому, наиболее близки Iа-антигенам мышей. У мышей в системе Н-2 выделяется район 1, содержащий гены, контролирующие силу иммунного ответа (Immune Response gene), экспрессию на В-лимфоцитах Iа-антигенов, генерацию и активацию хелперных факторов [David С., 1979].
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'