
1.4. Современные представления об отдельных HLA-сублокусах
Концепция о первых двух сублокусах HLA-A и HLA-B полностью сформировалась к началу 70-х годов, она достаточно освещена а отечественной литературе [Зарецкая Ю. М., 1974; Петров Р. В., 1976] и претерпела лишь уточняющие изменения в последнее десятилетие. Основные изменения в представление об этих "старых" сублокусах внесены благодаря расшифровке феномена "расщепления" и существования "сплитов" (см. раздел 1.5). Поэтому, давая лишь краткую характеристику сублокусам HLA-A и В, мы основное внимание сосредоточим на "молодых" сублокусах - HLA-C,D и DR.
1.4.1. Сублокусы HLA-A и HLA-В
В соответствии с заключением 8-го Уоркшопа в составе сублокуса HLA-A насчитывается 20 аллельных специфичностей; в составе сублокуса HLA-B - 40 аллельных генов. В данных сублокусах практически все гены известны, а антигены, ими кодируемые, определены.
Для уточнения и стандартизации антигенов сублокусов HLA-А и HLA-B в 1974 г. по инициативе П. Терасаки был организован, а в последующие 5 лет реализован международный клеточный обмен. В разные лаборатории мира рассылались одни и те же лимфоциты, которые типировались локальными сыворотками. Этот обмен, в котором участвуют около 300 лабораторий мира, значительно продвинул вперед и уточнил представления о первых трех локусах HLA и стандартизировал реагенты, открывающие данные антигены. Были выработаны следующие критерии, на которых строится выявление или уточнение новой антигенной специфичности [Loon J. et al., 1980]:
1. Если 95% лабораторий идентифицируют одну и ту же специфичность на "слепых" для них клетках, эта идентификация должна рассматриваться истинной. Оставшиеся 5% лабораторий в этом случае должны искать причину расхождения или в несовершенной технике типирования, или в неточной спецификации локальной сыворотки.
2. Если некоторые из локальных сывороток обнаруживают определенные расхождения в реакциях внутри одной специфичности, это может свидетельствовать о "расщеплении" специфичности; таким путем были выявлены так называемые сплиты (см. 1.5).
3. Реактивность с клетками только некоторых локальных сывороток может свидетельствовать об идентификации новой специфичности, характерной для определенной этнической группы.
Международный клеточный обмен показал, что внутри сублокусов HLA-A,B и HLA-B легко, с 95% согласованностью, определяются следующие специфичности:
Сублокус HLA-A - Al, А2, A3, А9, А10, All.
Сублокус HLA-B - В7, В8, В12, В13, В14, В27.
1.4.2. Сублокус HLA-C
Группа скандинавских авторов [Sandberg L. et al., 1970] обнаружила и описала сыворотку, названную Sa-AJ (позднее W-20, теперь анти-Cw1), которая давала добавочные позитивные реакции на панели тест-клеток, несущих антигены В5, В15, В27 или В22, не будучи специфичной к этим антигенам. Было высказано предположение, в дальнейшем подтвердившееся, что сыворотка AJ открывает самостоятельный HLA-сублокус, тесно связанный с сублокусом В. Убедительным доказательством существования нового локуса явилось обнаружение кроссинговера между сублокусом В и гипотетическим AJ [Low В. et al., 1974; Hansen H. et al., 1975; Waltz A., Rose M., 1977].
При использовании "capping"-тexники было показано, что антигены сублокуса, названного впоследствии HLA = С, расположены отдельно от антигенов двух первых сублокусов [Mayr W. et al., 1973].
По данным Уоркшопа 1980 г., сублокус HLA = С в настоящий момент включает серию из 8 аллельных генов с суммарной частотой генов, равной примерно 0,7. Аллели сублокуса HLA = С дают наиболее частые ассоциации с аллелями HLA = В-сублокуса, в непосредственной близости к которому HLA = С и картирован (табл. 4).
Таблица 4
Ассоциации HLA-C-аллелей с HLA-B-сублокусом
| Сублокус HLA-C | Сублокус HLA-B (по К. Bender, 1979) |
| Cw1 | B5, Bw22, B27 |
| Cw2 | B12, B27, B40 |
| Cw3 | B15, Bw22, B40 |
| Cw4 | B12, B15, Bw35 |
| Cw5 | B12, B18 |
| Cw6 | B13, B37, Bw47, Bw50 |
1.4.3. Сублокус HLA-D
В отличие от остальных сублокусов HLA, детерминанты, входящие в сублокус HLA-D, идентифицируются не серологическим путем, а с помощью реакции смешанной культуры лимфоцитов (Mixed Lymphocyte Culture - MLC). Основной принцип взаимодействия в MLC состоит в следующем:
а) две лимфоидные популяции, идентичные по большому комлексу гистосовместимости (МНС), при конфронтации в культуре не реагируют одна против другой посредством бластообразования;
б) две неидентичные по МНС лимфоидные популяции, находясь в культуре, реагируют друг на друга, образуя бласты.
До конца 60-х годов исследователи считали, что бластообразование в описанных выше условиях индуцируется различиями по SD-детерминантам в обеих реагирующих популяциях (точнее, различиями между HLA-A и HLA-B-антигенами, единственными тогда известными).
Однако с начала и до середины 70-х годов были получены 4 труппы фактов, которые легли в основу доказательства существования самостоятельного локуса HLA, детерминирующего бластообразование в MLC [Keuning J., 1978]:
1) негативная MLC между SD-неидентичными сибсами;
2) позитивная MLC между SD-идентичными сибсами;
3) позитивная MLC между SD-идентичными неродственниками;
4)негативная MLC между SD-неидентичными неродственниками.
Благодаря наблюдениям на многодетных семьях, где удалось получить "MLC -" между SD-неидентичными сибсами и "MLC+" между SD-идентичнымв сибсами и тем самым показать, что новый локус "перемещается" при кроссинговере, он был картирован в пределах HLA, вне интервала А - В снаружи от локуса В [Eijsvoogel V. et al., 1972; Dupont В. et al., 1974] - см. рис. 1. Позднее дистанции В - D была определена и оценена в ~0,7 - 0,8 сМ [Mickelsen Е. et al., 1976; Lamm L. et al., 1977].
Вместе с тем было обнаружено, что различия по сублокусу HLA-A в определенных, условиях могут оказывать незначительное влияние на бластообразование в MLC. Исходя из этого был постулирован "минорный" MLC-локус вблизи региона HLA-A (Dupont В. et al., 1974; Bijnen A. et al., 1977].
Для идентификации (типирования) и изучения особенностей HLA-D-детерминант нужна специальная строго контролируемая модель, которая была найдена при постулировании существования а в дальнейшем и при получении гомозиготных типирующих клеток (Homozygous Typing Cells - НТС). Получение НТС может служить примером "логического" открытия, основанного на дедуктивном приеме. Проводим цепь логических рассуждений, занявших, примерно десятилетие (1968 - 1978), которое закончилось созданием коллекции НТС и использованием их в типировании детерминант локуса HLA-D:
- идентичность двух клеточных популяций по сублокусу HLA-D можно обнаружить только в негативной MLC ("MLC -"); - если стимулирующие (типирующие клетки) гетерозиготны по сублокусу D, то вероятность получения "MLC -" практически нереальна; даже если стимулирующие (S) и реагирующие (R) клетки имеют общую HLA-D-детерминанту, то положительная MLC-реакция на вторую "необщую" детерминанту будет перекрывать и маскировать "MLC -", следовательно, стимулирующие клетки (они же типирующие) должны быть гомозиготными по сублокусу HLA-D;
- для того чтобы исключить влияние SD-антигенов, необходимо, чтобы типирующие клетки были гомозиготными по SD- и LD-сублокусам, т. е. НТС должны нести абсолютно гомологичные хромосомы С6.
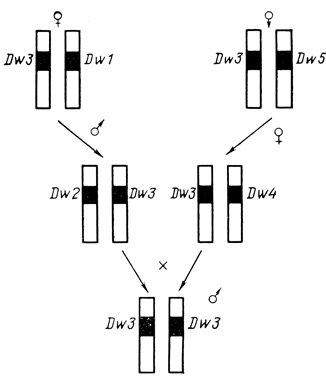
Рис. 5. Путь образования НТС при браках между двоюродными братьями сестрами. Первый ряд - сибсы-девочки имеют общую хромосому (Dw3); второй ряд - их дети (мальчик и девочка) наследуют общую хромосому Dw3; третий ряд - ребенок от брака между кузенами (второй ряд) наследует от отца и матери общую хромосому Dw3, становясь гомозиготным; он является живым носителем гомозиготных типирующих клеток
В принципе, существует очень ограниченное число возможностей образования и путей отбора НТС. Опишем два из них, наиболее реальных.
НТС можно обнаружить в семьях, где родители не являются родственниками, но имеют общий гаплотип HLA-A,B,C. Многие аллели HLA-D-локуса имеют высокое неравновесное сцепление (см. 1.6) с определенными аллелями HLA-B (см. табл. 17). Поэтому можно предполагать, что идентичность родителей по НLА-А,В,С-сублокусам сопровождается идентичностью по HLA-D-сублокусу. Дети таких родителей могут унаследовать от отца и матери эту одинаковую хромосому, став носителями гомозиготных клеток, которые можно использовать как НТС. На этом пути выявление НТС связано с широкой программой скрининга многодетных семей, поиском гаплоидентичных родителей, постановкой реципрокных MLC между детьми и родителями. Если клетки обоих родителей не будут реагировать на лимфоциты одного из детей, можно с большой долей уверенности заключить, что этот ребенок - носитель гомозиготных клеток (табл. 5).
Таблица 5
Схема выявления гомозиготных клеток в семье, где родители гаплоидентичны
| Генотипы родителей и детей | Результаты MLC (родители - R-клетки; дети - S-клетки) | ||||
| R | S | ||||
| aa | ac | ab | bc | ||
| Отец: ab | |||||
| Мать: ac | ab | - | + | - | + |
| Дети: aa, ab, ac, bc | ac | - | - | + | + |
Каждый из родителей, будучи носителем идентичной хромосомы "а", негативен в MLC с двумя детьми, однако только с гомозиготным ребенком "аа" они в MLC негативны оба.
Истинными НТС оказываются клетки от детей-потомков близкородственных браков; этот путь имеет большую вероятность при близкородственных браках и отражен на рис. 5. В таком случае НТС образуются в результате дрейфа определенной хромосомы по поколениям одной и той же семьи и суммирования ее в одном индивиде. Данный путь - надежный источник образования и выявления НТС, однако затруднен вследствие редкой частоты близкородственных браков в цивилизованных странах.
Самая большая, по-видимому, коллекция НТС, включающая 22 образца, открывающих 8 HLA-D-специфичностей, находится сейчас у голландских исследователей, в Лейденском центре Евро- транспланта [Keuning J., 1978].
В соответствии с заключением 8-го Уоркшопа в локусе HLA-D идентифицировано 12 аллельных специфичностей с общей суммарной частотой гена, равной 0,8 (приблизительно), однако все эти специфичности пока несут в номенклатуре индекс "w" (см. табл. 2).
1.4.4. Сублокус HLA-DR
Открытие локуса и формирование представлений о нем происходило очень интенсивно и заняло пятилетие - с 1973 до 1978 г. Базисным экспериментом, вызвавшим представления об этом сублокусе, явились элегантные опыты van A. Leeuwen с соавт. (1973),. показавшие, что определенные антитела, содержащиеся в сыворотке беременных женщин и не являющиеся HLA-A- и HLA-B- антителами, способны ингибировать MLC-реакцию. Суть эксперимента, из которого следовали выводы, давшие толчок новому направлению в учении об HLA, отражена в табл. 6. Исследователи отобрали несколько сывороток беременных женщин, содержащих цитотоксины неизвестной природы, и способные ингибировать MLC-реакцию, когда лимфециты от донора сыворотки использовались как респондирующие клетки. Ингибирование могло быть следствием двух возможностей:
а) антитела блокируют детерминанты отвечающих клеток;
б) антитела взаимодействуют с детерминантами стимулирующих: клеток.
Первая возможность казалась маловероятной, так как в этом случае неизвестные антитела следовало оценить как аутоиммунные (у здорового донора!); оставалось допустить, что неизвестные антитела блокируют детерминанты стимулирующих клеток.
Следующим шагом явилась постановка MLC в таком варианте, что стимулирующие клетки подбирались идентичными респондирующими по SD антигенами.
Таблица 6
Пример из эксперимента A. van Leeuwen с соавт. (1973) по выявлению антител, направленных к MLC-детерминантам (адаптировано
)
| Отвечающие клетки (А2, A3, В7, В40) | Стимулирующие клетки (А2, A3, В7, В40) | MLC (в АВ-сыворотке) | MLC (в сыворотке MRs. Sch.) | Флюоресцеин-окрашенные лимфоциты. % |
| MRs. Sch. | Pm* | 3 300 | Ингибиция (400) | 17 |
| MRs. Sch. | σm | 14 000 | 8000 | 4 |
| То же | Nm | 9700 | Ингибиция (1100) | 17 |
| " | Rm | 10 000 | 6400 | 9 |
| " | Sm | 4 200 | 2800 | 7 |
| " | Tm | 5 200 | 700 | 7 |
| " | Um | 13 500 | Ингибиция (1300) | 16 |
| " | Vm | 26 500 | Ингибиция (1100) | 17 |
*(m - обработаны митомицином С.)
В этом случае MLC также ингибирована в ряде вариантов, однако ингибирование не могло быть направлено на SD-детерминанты, так как они одинаковы у S- и R-клеток. Реальным был вывод, что в данной ситуации происходит блокада MLC-детерминант неизвестными антителами, а следовательно, существуют "классические" серологические антитела к MLC-детерминантам. Авторы дополнили этот эксперимент "сандвич-методом" с использованием флюоресцентного окрашивания, в котором стимулирующие клетки, обработанные ингибирующей сывороткой, покрылись "вторым слоем" антиглобулина, конъюгированного с флюоресцеином. В исходных суспензиях 16 - 17% клеток реагировали с сывороткой и "светились", присоединяя антитела и конъюгат. Фракция светящихся клеток точно соответствовала фракции В-лимфоцитов, содержащихся в суспензии. Отсюда следовал вывод, что "некие" антигенные детерминанты, выявляемые серологически на В-лимфоцитах, подобны или очень близки по структуре MLC-детерминантам.
По аналогии с мышиной системой гистосовместимости, где гены, контролирующие MLC-специфичные антигены и открываемые на В-лимфоцитах, были картированы в регионе I локуса Н-2 и получили название Iа-антигенов (I-associated) [С. David et al., 1979]. Аналогичные детерминанты человека также получили название la-подобных детерминант и назывались так до 1977 г. Уоркшоп, проходивший в 1977 г., выработал номенклатуру 1а-антигенов человека, присвоив всей группе антигенов символ DR (D-related). До 1980 г. все антигенные детерминанты DR-локуса имели обозначение DRw, а после Уоркшопа в Лос-Анжелесе (1980) значительная часть из них получила индекс DR (см. табл. 2).
Принципиально важен в изучении DR-детерминант момент, до сих пор не получивший вполне ясного заключения, являются ли D- и DR-детерминанты одним и тем же иммуноглобулиновым субстратом, но идентифицируемым двумя разными методиками или это разные иммуноглобулиновые субстраты.
Для решения этого вопроса возможны следующие методические подходы, часть из которых уже реализована:
- установление кроссинговера между сублокусом HLA-D и HLA-DR, что явилось бы прямым и безусловным доказательством их неидентичности;
- доказательство положительной ассоциации какого-либо антигена HLA-D с несоответствующим ему антигеном HLA-DR, что тоже было бы косвенным подтверждением неидентичности сублокусов;
- установление (в популяционных исследованиях) коэффициента корреляции между носителями определенного HLA-D-анти- гена и соответствующего ему HLA-DR-антигена; высокий коэффициент корреляции можно расценивать как серьезный аргумент в пользу идентичности данных антигенных детерминант.
Рассмотрим последовательно каждый из этих методических подходов.
До 1977 г. было получено безусловное доказательство чрезвычайной близости антигенных детерминант D и DR как у человека, так и у макак резусов [Balner Н., 1979], однако рекомбинаций между этими двумя сублокусами до 1980 г. обнаружить не удавалось.
Недавно N. Sucmu-Foca et al. (1978) описали материнский гаплотип, в котором HLA-Dw7 ассоциировал с HLA-DR2 (вместо DR7). Ребенок, который получил почку от матери, продуцировал цитотоксические антитела против В-лимфоцитов, несущих DR2, и не образовывал антител против DR7. Это наблюдение подтверждает, что антигены, вызывающие антителообразование, неравнозначны тем, которые вызывают в MLC пролиферативный эффект.
В период подготовки 8-го Уоркшопа исследователи усиленна собирали материал в рамках 3-го из методических подходов. В табл. 7 приведены результаты исследований, представляющие собой суммирование кооперативных усилий многих лабораторий мира.
Таблица 7
Коррелятивная связь между HLA-D и HLA-DR специфичностями на неродственной панели кавказоидов (адаптировано В. Dupont et al., 1980)
| HLA-D | HLA-DR | n | D+DR+ | D+DR- | D-DR+ | D-DR- | R |
| Dwl | DR1 | 420 | 51 | 4 | 22 | 343 | 0,772 |
| Dw2 | DR2 | 421 | 71 | 4 | 17 | 329 | 0,845 |
| Dw3 | DR3 | 421 | 61 | 8 | 27 | 325 | 0,735 |
| Dw4 | DR4 | 419 | 53 | 7 | 81 | 378 | 0,494 |
| Dw5 | DR5 | 419 | 42 | 6 | 29 | 342 | 0,676 |
| Dw6 | DRw6 | 409 | 16 | 68 | 9 | 316 | 0,275 |
| Dw7 | DR7 | 419 | 76 | 13 | 26 | 304 | 0,739 |
| Dw8 | DRw8 | 342 | 17 | 8 | 13 | 304 | 0,588 |
| Dw9 | Не сделано | ||||||
| Dw10 | DR4 | 303 | 10 | 7 | 83 | 203 | 0,149 |
Как видно из табл. 7, не все известные к настоящему времени DR-антигены находятся в высокой коррелятивной связи с соответствующими Dw-антигенами, хотя для некоторых из них (Dwl, Dw2, Dw3, Dw5 и Dw7) обнаружена очень высокая позитивная ассоциация с HLA-D-аналогами. У антигена DR4 как в рандом-популяции, так и при семейных обследованиях обнаружено включение в него Dvv, но при значительном повышении над Dw4 [Dupont В. et al., 1980]. Хотя после 8-го Уоркшопа появилось больше оснований считать локус HLA-DR самостоятельным, но очень тесно ассоциированным с локусом HLA-D. Все же этот вопрос нельзя считать окончательно выясненным, тем более что имеются серьезные методические трудности в его решении и не открыты все аллельные специфичности, входящие как в локус HLA-D, так и HLA-DR.
Кроме того, при семейном анализе, проведенном для 8-го Уоркшопа, была обнаружена более высокая ассоциация Dw- и DR-антигенов, чем на рандомизированной панели [Dupont В. et al., 1980]. Таким же не до конца выясненным моментом является и генетическая позиция сублокуса HLA-DR. Его картируют в регионе D, но его положение не раскрыто точно - справа или слева от гена D, так же как неизвестно расстояние, на котором он находится от этого гена (см. рис. 1).
Самым интересным фактом в DR-локусной серологии явилось обнаружение больших антигенных групп, которые полностью включают отдельные DR-специфичности [Park М. et al., 1980, подробнее см. 1.5]. Эти супертипичные группы были названы МТ1 - МТ3; кроме того, представлены для дальнейшей разработки на ближайшие годы супергруппы МТ4 - МТ6, включающие ряд DR w-специфичностей.
Начиная с 1977 г. появились факты, представленные главным образом группой Терасаки [Saito S. et al., 1977; Park M. et al., 1978] и группой Ван-Руда [van Rood J. et al., 1977], заставляющие подозревать, что система DR полиморфна и включает по крайней мере 2 сублокуса.
В панели 8-го Уоркшопа находились несколько сывороток, которые, по мнению исследователей, их представивших [Park М., Terasaki Р., 1980], открывали 4 новые специфичности - Те21-Те24, принадлежащие второму DR-сублокусу. Эти новые специфичности оказались негативно ассоциированы одна с другой,, но позитивно ассоциированы с некоторыми уже известными DR-специфичностями. Была обнаружена и одна семья с возможным кроссинговером между HLA-DR и новым сублокусом по гаплотипу DR7-Te24. Этот материнский гаплотип был унаследован шестью детьми, два из которых не имели Те24.
За истекшее четырехлетие (1977 - 1980) достигнут значительный прогресс в исследовании HLA-DR-сублокуса, который стал ощутимым на 8-м Уоркшопе.
Изучение DR-специфичностей методически сложно главным образом по двум причинам:
- получение хороших aHTи-DR-peareHTOB крайне затруднительно, так как сильные DR-антитела, как правило, сопровождаются сильными антителами HLA-A,B,C [Baricordi О. et al., 1977], поэтому сыворотки, их содержащие, требуют адсорбции и специальной обработки;
- чтение результатов реакции более сложно, нежели для остальных SD-локусов. В 1977 г. на Уоркшопе, посвященном Iа (или DR)-aнтигeнам, лишь несколько лабораторий из числа участвующих представили данные, подлежащие анализу. Более половины из 124 лабораторий при воспроизведении результатов типирования одними и теми же сыворотками имели коэффициент корреляции меньше 0,4. В 1979 - 1980 гг. тест на воспроизводимость результатов типирования был выполнен более чем половиной лабораторий - участников 8-го Уоркшопа - с коэффициентом корреляции 0,75 и выше [Park М. et al., 1980].
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'