
2.2. Методы клеточных взаимодействий
В основе почти всех методов клеточных взаимодействий, используемых клинической иммуногенетикой, лежит феномен бластооб- разования в смешанной культуре лимфоцитов, открытый канадской исследовательницей Барбарой Бейн [Bain В. et al., 1964]. Реакция смешанной культуры лимфоцитов (mixed lymphocyte culture - MLC) позволила осуществить тонкое дифференцированное изучение комплекса HLA и, в частности, одной из его субъединиц - локуса HLA-D. Ряд других методов клеточных взаимодействий - клеточно-опосредованный лимфолизис (Cell-mediated Lympholysis - CML), тест примирования лимфоцитов (Primed Lymphocyte Typing) - основывается на методе MLC или содержит его как составную часть.
2.2.1. Смешанная культура лимфоцитов (MCL)
Принцип метода изображен на рис. 10, из которого видно, что две популяции различающихся генетически лимфоцитов взаимодействуют между собой в культуре in vitro. Одна из популяций обрабатывается митомицином С или облучается, в результате чего теряет способность к бластообразованию и включению тимидина (3НТ), однако, не теряя антигенных свойств, сохраняет способность к стимуляции (стимуляторы; S-популяция).
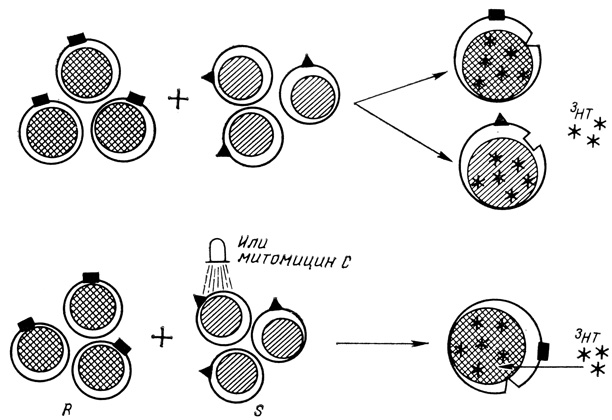
Рис. 10. Смешанная культура лимфоцитов; принцип реакции. Вверху - двунаправленный вариант, внизу - однонаправленный. Пояснение в тексте
Клетки, отвечающие на стимуляцию (респондеры, R-популяция), через несколько дней трансформируются в бласты и включают тимидин, добавляемый в культуру. Интенсивность реакции измеряется с помощью радиационной метки по включению 3Н-тимидина.
Известны несколько вариантов реакции смешанной культуры лимфоцитов, из которых здесь предлагаются два: традиционный и микровариант, реализуемый в планшетах Cook (рис. 11).
Рис. 11. Оборудование для микровариантов MLC и CML. 1 - планшет круглодонный е 96 лунками; 2-автоматическая пипетка ('Pipetman') с программой для разных объемов; 3 - автоматическая пипетка ('Sigma') для определенного объема; 4 - наконечник для пипетки одноразового использования; 5 - ламинарный бокс
Традиционный вариант MLC (модификация Ф. С. Барановой):
- лимфоциты выделяют на фиколл-урографиновом градиенте, как описано выше. Первую отмывку производят в PBS (NaCl - 8,0 г, Na2HP04 - 1,15 г, KH2PO4 - 0,2 г, KC1 - 0,2 г на 1л H2O); две последующие производят в среде 199 с 5%-АВ-сыворотки (пул от 15 доноров);
- отвечающие клетки ресуспендируют в среде 199 с 10% сывороткой АВ и доводят концентрацию клеток до 0,6 x 106 в 1 мл;
- выделенные таким же образом стимулирующие клетки в концентрации 5 - 106 в 1 мл обрабатывают митомицином С (60 γ/мл) фирмы "Serva" и инкубируют 40 мин при 37°С в водяной бане. После инкубации клетки отмывают 3 раза средой 199 с 5% сывороткой АВ, ресуспендируют в среде 199 с 10% сывороткой АВ, доводя концентрацию до 0,6 x 106 в 1 мл;
- 0,5 мл отвечающих клеток и 0,5 мл стимулирующих клеток смешивают в центрифужной пробирке, прибавляют 0,04 мл 10 мл р-ра Hepes ("Serva") и инкубируют 144 ч; опыт ставят в трех параллелях (триплет);
- за 24 ч до окончания инкубации в пробирки добавляют 3Н-тимидин 1μCi (3,7x104 БК), на пробу удельной активности 5mСi/мМоль (18,5x107 БК/мМоль) и продолжают инкубацию;
- по окончании инкубации клетки переносят на миллипоровые фильтры (0,6 - 0,9 микрон), промывают физиологическим раствором (37°С) и охлажденным 5% раствором трихлоруксусной кислоты (4°С). Фильтры сушат и помещают во флаконы с 5 мл сцинтилляционной жидкостью (5 г РРО и 0,5 г РОРОР - на 1 л толуола)*. Активность включения 3Н-тимидина замеряют на β-счетчике; результат выражают в абсолютных включениях радиоактивной метки в 1 мин или в индексе стимуляции (ИС) по формуле:
*(РРО - 2,5-фенол-оксазол; РОРОР - (1,4-ди-2-15-фенолоксазолитбензол).)
Среднее значение СРМ в трех опытных образцах
ИС = Среднее значение СРМ в трех контрольных образцах/Контрольными образцами служат спонтанные культуры отвечающих клеток.
Микровариант MLC в планшетах Cook. На 8-м Уоркшопе выработаны требования, стандартизирующие микровариант MLC, в соответствии с которыми он излагается ниже [Dupont В. et al., 1980]:
- лимфоциты выделяют в градиенте изопак-фиколла и ресуспендируют в среде RPMJ-1640*, доводя концентрацию до 5х105 в 1 мл;
*(Можно использовать среду 199, смешанную с человеческой сывороткой группы АВ (5% сыворотки, взятой от нескольких индивидов).)
- клетки-стимуляторы обрабатывают митомицином С или обучением;
- 5x104 репондеров и столько же стимуляторов помещают с помощью микропипетки типа Pipetman в каждую лунку круглодонного микропланшета Cook;
- планшеты инкубируют в термостате с автоматической подачей 5% CO2 в течение 120 ч; затем в каждую лунку вносят lμmCi 3Н-тимидина при специфической активности тимидина 6 Ci/мМоль; все манипуляции проводят пипеткой Pipetman;
- через 16 ч после внесения тимидина культуры из каждой лунки автоматической пипеткой переносят на миллипоровые фильтры и промывают физиологическим раствором, а затем 5% трихлоруксусной кислотой; удобно использовать специальные "харвестеры" для переноса культуры на миллипоровые фильтры;
- активность включения тимидина определяют, как описано выше.
2.2.2. Клеточно-опосредованный лимфолизис (CML)
CML используется в иммуногенетических исследованиях сравнительно недавно (с 1972 г.), однако в последнее время становится все более популярной техникой, позволяя детально изучить роль эфферентного звена трансплантационного иммунитета и завоевывая признание как информативный метод иммунологического мониторинга. Принцип метода изображен на рис. 12. В основе метода лежит техника, предложенная J. Lightbody (1971), которая вкратце сводится к следующему.
1. CML начинается с обычного HLC-теста, в котором происходит распознавание отвечающими клетками "стимуляторов", сенсибилизация отвечающих клеток и формирование сенсибилизированных киллеров.
2. Вторая фаза, в которой сенсибилизированные киллеры смешиваются с меченными 51Сr клетками-мишенями, состоит в деструкции последних эффекторными клетками-киллерами; клетки- мишени могут иметь генотип такой же, как "стимуляторы" в первой фазе MLC, а могут быть клетками "третьего" партнера", наделенными общими со "стимуляторами" антигенными детерминантами или без них.
3. Количество радиоактивного хрома, высвобождающегося из разрушенных клеток-мишеней и выходящего в культуральную среду, служит мерой интенсивности киллер-эффекта.
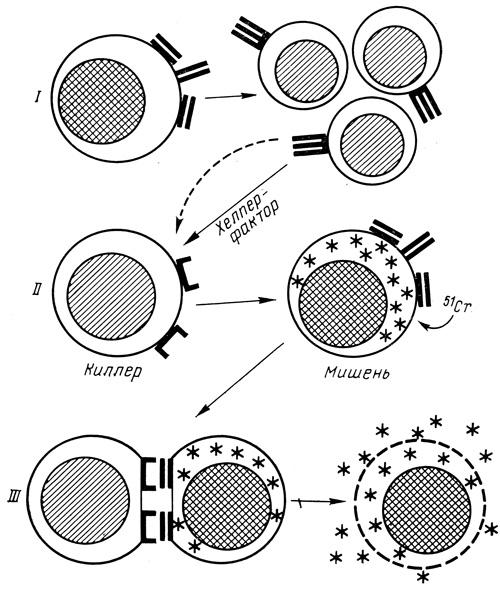
Рис. 12. Принцип клеточно-опосредованного лимфолизиса (CML). I ряд - сенсибилизация отвечающих клеток, образование киллеров; II ряд - взаимодействие киллеров с мишенью; III ряд - разрушение клетки-мишени; выход 51Cr культуральную среду
Здесь описано три варианта CML: традиционный вариант [Lightbody J. et al., 1971] в модификации Л. П. Алексеева (1979), микровариант в планшетах Cook, прямая CML (Direct-CML -D-CML.
Традиционный вариант [Алексеев Л. П., 1979].
Метод разделен на несколько этапов.
Получение киллеров:
- периферические лимфоциты обеих популяций (R-клетки и S-клетки) выделяют обычным путем, в градиенте плотности отмывают трижды в среде 199 с 5% АВ-сывороткой (10 мин, 150 g);
- 1x106 R-клеток (0,8 мл) смешивают в центрифужных пробирках с 2x106 S-клеток (0,2 мл), обработанных митомицином С, и инкубируют 144 ч при 37°С;
- клетки центрифугируют при 150 g в течение 10 мин, а осадок ресуспендируют в среде 199 с добавлением 20% телячьей сыворотки (среда 199 + т. е.), доведя концентрацию до 1x106 в 1 мл;
- одну из проб оставляют для исследования уровня MLC, остальные используют как готовые киллеры.
Получение мишеней:
- выделенные обычным путем лимфоциты ресуспендируют в среде 199 с 20% АВ-сывороткой и инкубируют с фитогемагглютинином (0,003 мг/мл Wellcome) в течение 72 ч при 37°С; концентрация клеток 1x106 в 1 мл;
- клетки центрифугируют 10 мин при 150 g, осадок ресуспендируют в среде 199 с 5% АВ-сывороткой и доводят концентрацию клеток до 2x104 в 1 мл;
- к взвеси добавляют 51Cr 100 μCi/мл (3,7x106 БК/мл) и инкубируют 40 мин при 37°С;
- клетки трижды отмывают в среде 199 с добавкой 5% АВ-сыворотки (150 g, 10 мин) и осадок ресуспендируют в среде 199 с 5% АВ-сывороткой,. доведя концентрацию до 2x104 в 1 мл.
Постановка реакций:
- 5x105 киллеров (0,5 мл) смешивают с 1x104 мишеней (0,5 мл), инкубируют 4 ч (37°С) и центрифугируют при 150 g 10 мин;
- суспернатант отсасывают и на ?-счетчике подсчитывают импульсацию, вызываемую 51Cr; подсчет ведут в 0,5 мл супернатанта;
- уровень цитолиза подсчитывают по следующей формуле:
экепер. выход 51Cr - спонтанный выход 51Cr/максим, выход 51Cr - спонтанный выход 41Cr × 100.
Спонтанный выход хрома измеряется на мишенях, инкубированных 4 ч (37°С) без клеток-киллеров; максимальный выход хрома - на мишенях, полностью разрушенных замораживанием-оттаиванием; все пробы осуществляются в триплетах.
Микровариант CML в планшетах [по Mawas С., 1976]:
- фаза получения киллеров осуществляется как MLC в круглодонных планшетах, но смешивают в равных количествах R- и S-клетки по 2x105 па каждую лунку и инкубируют при 37°С;
- через 5 сут клетки собирают пастеровской пипеткой в пробирку, подсчитывают с трипаном голубым число живых и доводят концентрацию до 10x106 в 1 мл;
- клетки-мишени в течение 3 дней культивируют с ФГА;
- в день постановки реакции клетки-мишени отмывают (300 g) и ресуспендируют в культуральной среде, распределяя по 1 мл в пробирки и доводя до 1x106 в 1 мл;
- добавляют в каждую пробирку с клетками-мишенями по 200 μCi51Cr(7,4x106 БК) и инкубируют 1 ч при 37°С; отмывают клетки 3 раза; осадок ресуспендируют и доводят до концентрации 1x10 в 1 мл (живых);
- тест реализуется в круглодонных микропланшетах; для этого распределяют в каждую лунку 0,7 - 1x106 клеток-киллеров (0,1 мл) и 1x104 клеток-мишеней (0,1 мл); общий объем суспензии в каждой лунке 0,2 мл, добавляют в каждую лунку по 0,05 мл среды и инкубируют (37°С) 4 ч;
- планшеты центрифугируют при 800 g на центрифуге Beckman в течение 10 мин; супернатант из каждой лунки переносят в пробирки и подсчитывают на γ-счетчике;
- фазу получения киллеров (MLC) проводят на среде RPMJ-1640 с добавлением 20% человеческой плазмы; для фазы киллинга употребляют среду MEM с добавлением 20% человеческой плазмы, предварительно прогретой.
Прямая CML (D-CML). Прямая CML является техникой, созданной специально для клинических целей, нашедшей использование при иммунологическом мониторинге. Схема этой реакции изображена на рис. 13.
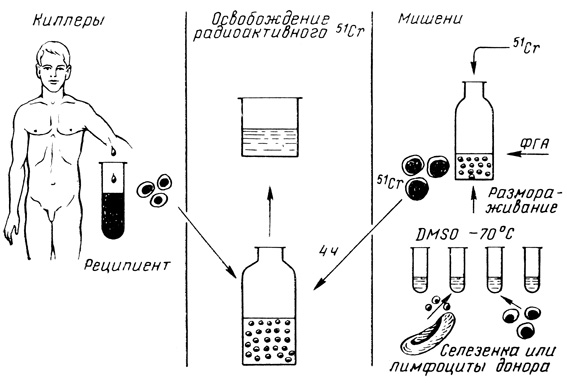
Рис. 13. Прямая CML (D-CML). Слева - образование клеток-киллеров in vivo; справа - приготовление клеток-мишеней из селезенки или крови донора; криоконсервации, обработка ФГА, включение радиоактивной метки; в центре - клеточно-опосредованный лимфолизис
Основное отличие от традиционной CML состоит в том, что стадия образования киллеров (фаза сенсибилизации) протекает не in vitro, a in vivo, т. е. в организме человека, сенсибилизированного пересадкой аллогенного органа или ткани. Вследствие воздействия аллогенной ткани лимфоциты реципиента сенсибилизированы к тканевым антигенам донора и не нуждаются в специальной обработке in vitro, продолжительность теста значительно сокращается во времени, так как предварительно следует подготовить только мишени.
В качестве мишеней используют лимфоциты, полученные из периферической крови или, чаще, из селезенки донора (см. 2.1.2) и замороженные любым из описанных выше способов (см. 2.1.3).
2.2.3. Антителозависимая клеточно-опосредованная цитотоксичность (Antibody-dependent-cell mediated Cytotoxicity - ADCC)
Этот тип клеточных реакций сходен по механизмам действия с описанной выше CML. Принцип реакции изображен на рис. 14. Компонентами реакции являются клетки-мишени (донорские клетки или аллогенные лимфоциты), сыворотка (аллогенная или реципиента), предположительно содержащая антитела, направленные к детерминантам клеток-мишеней, и клетки-эффекторы (лимфоциты реципиента или аллогенные лимфоциты).
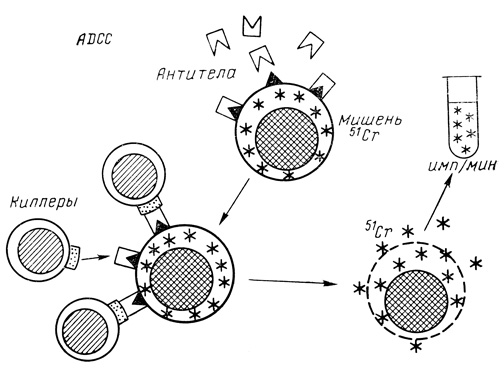
Рис. 14. Принцип ADCC. Пояснение в тексте
Клетками-эффекторами в данном типе взаимодействия служат так называемые К-клетки, находящиеся в периферической крови. В отличие от клеток-киллеров в CML они осуществляют цитотоксический эффект без предварительной сенсибилизации, однако проявление цитотоксического действия К-клеток возможно только через посредство антител, направленных к детерминантам клеток-мишеней [Lightbody J., Rosenberg J., 1974; Jeannet M., Vassali P.,1976]. Специфический лизис измеряется по высвобождению 51Cr, если исследуемая сыворотка содержит антитела к детерминантам мишеней.
Детерминантами-мишенями в ADCC могут быть практически специфичности всех HLA-локусов, включая HLA-D, HLA-DR, а также детерминанты, лежащие вне HLA-системы [Kovithavongs Т. et al., 1975; Dickmeiss Е., Nielsen J., 1976; Mikulska, Bielling, 1977].
Наибольшее распространение эта сложная реакция получила в иммунологическом мониторинге для выявления В-клеточных антител. В связи с этим было предложено несколько модификаций, предусматривающих обогащение суспензии клеток-мишеней В-лимфоцитами, адсорбцию сывороток на тромбоцитах [Schuelke J. et al., 1977] и т. д.
Помимо всего, учитывается ряд других особенностей реагирования в данной системе. Исследуемая сыворотка должна быть декомплементирована, так как в противном случае реакция может пойти по типу антитело-опосредованной комплементзависимой цитотоксичности. Предполагается также, что клетки-эффекторы могут вызвать определенную деструкцию мишеней по типу CML.
В конечном итоге весь набор проб в тесте антителозависимок клеточно-опосредованной лимфоцитотоксичности следующий:
- мишени + эффекторы + испытуемая сыворотка (опытная проба);
- мишени (контрольная проба, т. е. спонтанное высвобождение 51Cr);
- мишени + эффекторы (контрольная проба на активность эффекторов);
- мишени + испытуемая сыворотка (сывороточный контроль).
Ниже приведен протокол реакции ADCC, рекомендованный для Интертрансплант-Уоркшопа 1979 г. (Балатон-Фёред, Венгрия):
- лимфоциты выделяют обычным образом и ресуспендируют в RPMI-1640 + 10% эмбриональной телячьей сыворотки; обрабатывают суспензию карбонильным железом для удаления моноцитов; добавляют аммония хлорид или H2O для лизиса оставшихся эритроцитов;
- в суспензию клеток-мишеней добавляют 51Cr в форме р-ра Na2CrO4 100 - 200µCi мл (3,7x106 - 7,4x106 БК/мл) и инкубируют 40 - 60 мин;
- клетки трижды отмывают в RPMI +0,1% HSA, ресуспендируют в той же среде и доводят до 2x108 в 1 мл; 50 µl суспензии меченых клеток помещают в пробирку и в дальнейшем подсчитывают изотопную активность на γ-счетчике для выявления полного изотопного "усвоения"; остальное раскапывают в лунки планшета по 50 µl суспензии (1x105 клеток на лунку);
- суспензия клеток-эффекторов доводится до 2x107 кл в 1 мл и в. каждую лунку помещают 50 µl суспензии (или 100 µl), соотношение эффекторов и мишеней 10:1 (или 20:1);
- инкубация продолжается 4 ч во влажной атмосфере термостата с 5% CO2 (длительность инкубации может быть продолжена до 8 ч);
- приготовляют в пробирках несколько разведений испытуемой сыворотки (1:25; 1:100) и добавляют в лунки до 50 µl каждого разведения: и неразведенную сыворотку; окончательная постановка теста выглядит, как показано в табл. 23.
Таблица 23
Постановка ADCC. Все варианты проб, µl
| Вариант | Среда | Разведенная сыворотка | Клетки-эффекторы | Клетки-мишени |
| Опытная проба (10:1) | 50 | 50 | 50 | 50 |
| Опытная проба (20:1) | - | 50 | 100 | 50 |
| Спонтанное высвобождение | 150 | - | - | 50 |
| Сывороточный контроль | 100 | 50 | - | 50 |
| Сывороточный контроль* (негативный) | 100 | 50 | - | 50 |
| Позитивная проба** с эффекторами | 50 | 50 | 50 | 50 |
| Эффекторный контроль (10:1) | 100 | - | 50 | 50 |
| Эффекторный контроль (20:1) | 50 | - | 100 | 50 |
*(Вместо испытуемой сыворотки закапывают пул АВ-сывороток.)
**(Вместо испытуемой сыворотки закапывают моноспецифическую HLA-сыворотку, направленную против мишеней (не эффекторов).)
- инкубация панелей продолжается 4 ч во влажной атмосфере с 4% CO2; длительность инкубации может быть продолжена до 8 ч;
- после инкубации половину объема из каждой лунки (100 μl) осторожно отсасывают автоматической пипеткой и помещают в пробирки для подсчета импульсации 51Cr; активность подсчитывают на γ-счетчике;
- вычисления следующие:
% высвобождения 51Cr = 2 × Аоп - фоновая активность/В - фоновая активность × 100;
% цитотоксичности = Аоп - Асп/100 - Асп × 100, где Аоп - % высвобождения 51Cr в опытных пробах; Асп - % спонтанного высвобождения; В - полное усвоение изотопа.
Как положительный результат рассматривается 5% и выше цитотоксичность после 4 ч инкубации.
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'