
2.3. Методы получения и идентификации В-лимфоцитов
Иммуногенетическое изучение антигенов гистосовместимости, открываемых на В-лимфоцитах человека, началось в 1973 г. Поэтому многие методы, используемые в В-серологии, находятся еще в состоянии модификации и становления. Основную трудность представляет до сих пор получение суспензии, достаточно обогащенной В-лимфоцитами. В периферической крови человека, единственном прижизненно доступном источнике лимфоцитов, содержится всего 5 - 20% В-лимфоцитов, что недостаточно для производства основных реакций, выявляющих антигенные детерминанты В-клеток. В конечном счете точность идентификации антигенов HLA-DR-локуса определяется степенью обогащенности и чистой В-клеточной суспензии.
2.3.1. Выделение В-клеток посредством Т-розеткообразования
Принцип метода изображен на рис. 15. Главным его этапом является обработка лимфоцитов периферической крови бараньими эритроцитами, с которыми основная масса Т-лимфоцитов образует розетки, осаждаемые затем центрифугированием. Эта процедура приводит к относительному увеличению числа В-лимфоцитов в суспензии и достижению тех значений, при которых определение антигенов становится достоверным. Модификации метода предусматривают различную обработку бараньих эритроцитов, в том числе ультрафиолетовым облучением или химическими веществами (папаин, АЕТ) для увеличения их способности к розеткообразованию. Ниже приводится модификация сепарации В-клеток с помощью папаинизированных эритроцитов.
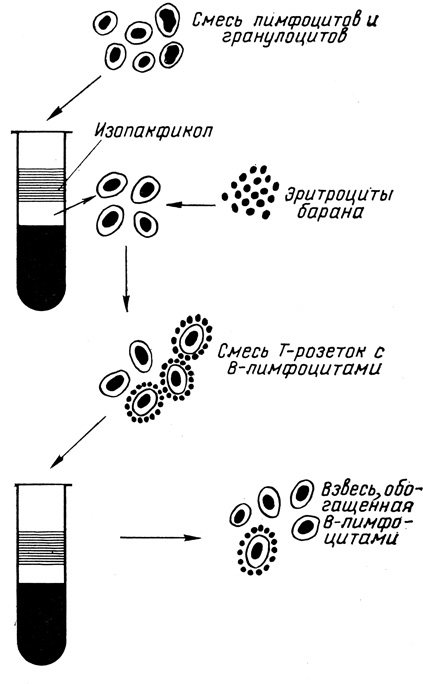
Рис. 15. Обогащение клеточной суспензии В-лимфоцитами с помощью Т-розеткообразования, принцип метода. Пояснение в тексте
Выделение В-лимфоцитарной взвеси путем обработки папаинизированными эритроцитами барана [Wilson A. et al., 1975]:
- периферическую кровь дефибринируют стеклянными бусами и разводят фосфатным буфером (ФБ) до рН 7,2 в соотношении 1 часть крови и 2 части ФБ;;
- две части разведенной крови наслаивают на одну часть фиколла в центрифужной пробирке (∅12 - 14 мм) и центрифугируют при 500 g в течение 20 мин;
- "облачко" собирают и промывают в ФБ с 10% эмбриональной телячьей сывороткой (ФБ + ЭТС); осадок ресуспендируют в 1,5 - 2 мл ФБ + ЭТС;
- около 30 мл порошка карбонильного железа добавляют в суспензию и инкубируют 30 мин (37°С);
- карбонильное железо собирают магнитом и суспензию вновь наслаивают на урографин-фиколл, центрифугируют в тех же условиях;
- "облачко" собирают, отмывают в ФБ + ЭТС и осадок ресуспендируют в ФБ + 50% телячьей сыворотки; сыворотка предварительно инактивирована и адсорбирована бараньими
эритроцитами; доводят концентрацию клеток до 5x106 в 1 мл.
Обработка бараньих эритроцитов папаином:
- эритроциты барана отмывают трижды в ФБ, ресуспендируют и "упаковывают" центрифугированием при 800 g 5 мин;
- приготовляют папаин-цистеиновую смесь: 1 часть 0,25% папаина (Merck, Sigma), 1 часть 3,6% Na2HP04, 2 части 0,2% L-цистеина-НСl (смесь готовят ex tempore!);
- смешивают равные объемы эритроцитов и цистеин-папаиновой смеси, которые предварительно нагревают в водяной бане до 37°С, инкубируют в ней 8 мин; центрифугируют (800 g, 5 мин) и отмывают в ФБ; осадок ресуспендируют в ФБ и хранят при 4°С.
Все операции проводят в пластиковых пробирках во избежание прилипания папаинизированных эритроцитов к стеклу.
Розеткообразование:
- приготовляют смесь ФБ и ЭТС; сыворотку предварительно инактивируют нагреванием при 56°С 30 мин и 2 раза адсорбируют равным объемом осадка бараньих эритроцитов; смешивают ФБ и ЭТС в равных объемах;
- приготовляют 0,5% р-р папаинизированных эритроцитов барана;
- равные объемы лимфоцитов (5x106/мл) и папаинизированных эритроцитов смешивают, инкубируют при комнатной температуре 15 мин, центрифугируют 5 мин при 230 g и оставляют без перемешивания на 1 ч при 4°С;
- осадок осторожно ресуспендируют вращением пробирки; розетки и клетки, не образовавшие розеток, подсчитывают;
- суспензию осторожно наслаивают на фиколл-урографин пипеткой с широким концом и 20 мин осторожно прокручивают на центрифуге при 500 g;
- "облачко" в интерфазе, состоящее в основном из В-клеток, собирают и отмывают один раз в ФБ + 10% телячьей сыворотки; осадок ресуспендируют в ФБ + 10% ЭТС и доводят концентрацию клеток до 2x106 в 1 мл;
Чрезвычайно сходен с вышеописанным метод получения обогащенной В-клеточной суспензии через Т-розеткообразование с бараньими эритроцитами, обработанными AET (2-aminoethil-isothiouromum bromide). Данный метод [Pellegrino М. et al., 1976] широко используется в типирующих лабораториях Скандиа-транспланта. Чистота В-клеточных суспензий, получаемых этими методами, колеблется от 65 до 90% [van Rood J., 1976].
2.3.2. Сепарация В-лимфоцитов на колонках с синтетической ватой (по P. Terasaki, лаборатория тканевого типирования UCLA, персональный протокол)
Описанные выше методы широко употребимы, однако они довольно трудоемки и требуют для выделения 5 - 6 ч как минимум. P. Terasaki ввел в сепарацию В-клеток новый прием - пропускание клеточной суспензии через "колонку" с нейлоновой ватой - основанный на разной степени адгезии лимфоцитов на волокнах ваты. Этот метод дает более чистую клеточную суспензию В-лимфоцитов, однако требует несколько большего количества крови.
Описание методики:
- дефибринированную кровь разводят в отношении 1 : 2,5 средой 199 и выделяют лимфоциты в градиенте фиколл-урографина; доводят до концентрации 2x106 в 1 мл, разводя средой 199, содержащей 5% телячьей сыворотки, забуференной Hepes (199 + ТС + Н) и подогретой до 37°С;
- в качестве колонки используют пластиковые трубки диаметром 5 мм и длиной 6 - 8 см; один конец трубки срезают под углом 45°, запаивают и отрезают конец трубки, чтобы получилось отверстие диаметром 2 мм;
- 50 мг нейлоновой ваты тщательно разволокняют и набивают ею рыхло колонку; вату смачивают р-ром Хенкса, который подается снизу колонки, чтобы вышли пузырьки воздуха;
- колонку промывают последовательно 10 - 15 мл р-ра Хенкса, 5 мл среды 199, нагретой до 37°С, и 1 - 1,5 мл смеси 199 + ТС + Н, также подогретой до 37°С;
- 0,5 мл суспензии лимфоцитов по каплям приливают в колонку; затем колонку помещают в горизонтальном положении на чашку Петри и инкубируют 30 мин (37°С);
- в штатив ставят 5 пробирок; колонку помещают вертикально над пробиркой № 1 и промывают по каплям 5 мл (199 + ТС + Н), затем колонку последовательно промывают над остальными пробирками, уменьшая на 1 - 2 мл промывочной жидкости над каждой колонкой; при промывании колонки над пробирками № 3 и 4 ее несколько раз осторожно "поглаживают" и выдавливают всю жидкость из колонки над пробиркой № 5.
Установлено, что содержание В-лимфоцитов нарастает от пробы к пробе, так что в пробирке № 1 содержатся в основном Т-лимфоциты, а в пробирке № 5 - В-лимфоциты. Чистота В-клеточной суспензии 80 - 90%.
2.3.3. Получение суспензии В-лимфоцитов методом проточного электрофореза
Разделение cубпопуляций лимфоцитов из периферической крови можно проводить, используя принцип проточного электрофореза. Данный метод основан на различной подвижности клеток в электрическом поле, возникающей вследствие неравноценной силы электрического заряда, несомого лимфоцитами различного типа. Принцип метода [Zeiller К. et al., 1975] состоит в том, что суспензия лимфоцитов периферической крови подается в вертикальную камеру прибора для проточного электрофореза, в которой создается электростатическое поле (рис. 16). Клетки, несущие отрицательный заряд, отклоняются к положительному электроду. Угол отклонения зависит от величины отрицательного заряда клетки, определяющего ее электрофоретическую подвижность, и скорости потока камерного буферного раствора, который увлекает клетки в вертикальном направлении. В нижней части камеры имеются отсеки для сбора отдельных клеточных фракций. За нулевую точку отсчета принимается угол отклонения эритроцитов, с которым сравнивается угол отклонения всех опытных фракций. Клетки, найденные в близлежащих справа фракциях, рассматриваются как обладающие большой электрофоретической подвижностью; клетки, найденные в крайних справа фракциях, обладают малой электрофоретической подвижностью.
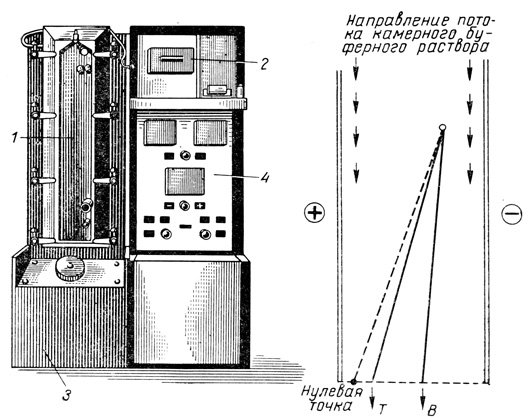
Рис. 16. Прибор для разделения клеток в проточном электрофорезе ('Elfor-VaP-5'). 1 - разделительная камера; 2 - подача клеточной суспензии в камеру; 3 - пробирки- приемники; 4 - пульт управления. Справа - принцип разделения клеток с помощью препаративного клеточного электрофореза (схема)
Эксперименты, проведенные нами [Войлокова Р. Я. и др., 1979], показали, что, проходя через камеру, лимфоциты распределяются на 12 - 15 фракций.
Между более подвижными и менее подвижными клетками имеется "переходная зона" (в которой содержится как Т-, так и В-лимфоциты). Более подвижные клетки на 80 - 93% состоят из Т-лимфоцитов. Лимфоциты, обладающие малой электрофоретической подвижностью, относятся преимущественно к В-лимфоцитам.
2.3.4. Сравнение эффективности различных методов получения обогащенных В-лимфоцитами клеточных суспензий
Совместно с Т. X. Расуловой и Р. Я. Войлоковой мы провели сравнительный анализ эффективности различных методов получения обогащенных В-лимфоцитами клеточных суспензий. Эффективность метода оценивали по нескольким параметрам, характеризующим как "чистоту" В-клеточной суспензии, так и "производительность" метода (длительность обработки одной суспензии, количество суспензий, могущих быть обработанными одновременно).
Оценку насыщенности В-клетками суспензии ("чистоты") производили тремя методами: с помощью комплементзависимой цитотоксической пробы, используя полиспецифическую сыворотку против В-клеток (предоставлена для Интертрансплант-Уоркшопа 1979 г. Е. Thorsby); по количеству клеток, несущих IgG-рецепторы (В-лимфоциты), обрабатывая суспензию кроличьей антиглобулиновой сывороткой и применяя иммунофлюоресцентное окрашивание [Лежнева, 1968]; по контаминации суспензии Т-лимфоцитами, выявляемыми розеткообразованием с эритроцитами барана (ЭБ).
Важным моментом в оценке производительности метода является показатель "выхода" В-клеток из клеточной суспензии (табл. 24), так как он связан с количеством венозной крови, которое в некоторых клинических ситуациях может быть лимитированным.
Таблица 24
Характеристика эффективности различных методов получения В-клеточных суспензий (по Ю. М. Зарецкой, Т. X, Расуловой, Р. Я. Войлоковой)
| Метод | Частота В-клеточной суспензии | Производительность метода | ||||
| количество клеток, чувствительных к анти-В-сыворотке, % | количество клеток, несущих Fc-рецепторы, % | количество клеток, образующих T-розетки с эритроцитами барана, % | выход В-клеток из ЛПК-суспензии, % | продолжительность разделения ЛПК-Суспензии, ч | количество образцов крови, обрабатываемых одновременно одним человеком | |
| Розеткообразование с ЭБ, обработанными папаином | 72,66±1,96 (27) | 55,5±1,46 (14) | 11,83±0,84 (18) | 16,65±0,72 (20) | 2,5 | 4 |
| Розеткообразование с ЭБ, обработанными АЕТ | 75,2±0,9 (17) | 60,3±2,7 (10) | 8,0±0,77 (15) | 11,4±0,94 (17) | 1,5 | 4 |
| Проточный электрофорез (на VAP-5) | 88,0±0,73 (40) | 70,7±2,15 (15) | 8,4±1,94 (10) | 3,0±0,45 (31) | 1,0 - 1,5 | 1 |
| Разделение на колонке с нейлоновой ватой | 79,0±4,5 (11) | 66,8±2,74 (11) | 9,0±0,9 (11) | 2,97±0,45 (11) | 1 | 2 |
Примечание. В таблице учтено время после получения суспензии ЛПК на градиенте изопак-фиколла.
Результаты, представленные в табл. 24, показывают, что наибольшая чистота суспензии может быть достигнута при сепарации клеток с помощью проточного электрофореза, однако производительность этого метода невелика из-за невозможности обрабатывать сразу несколько клеточных суспензий.
По-видимому, при массовых исследованиях наиболее рациональным является метод сепарации на колонке с нейлоновой ватой, дающий высокую чистоту суспензии, занимающий наименьшее время и позволяющий одному человеку обрабатывать одновременно не менее двух суспензий.
2.3.5. Идентификация В-клеточных детерминант методом комплементзависимой цитотоксичности
Наиболее распространенным вариантом лимфсцитотоксической реакции на B-лимфоцитах является "удлиненная" техника, предложенная J. van Rood (1975), которая осуществляется так же, как метод, описанный для лимфоцитов периферической крови (см. 2.1.1), но время обеих инкубаций удлинено вдвое, составляя для первой (клетки + анти-В-сыворотка) 1 ч и для второй (клетки + сыворотка + комплемент) 2 ч. В качестве прижизненного красителя предпочтительнее использовать эозин.
Чтение реакции может быть затруднено вследствие неполного удаления тромбоцитов из сыворотки после адсорбции или неполного удаления карбонильного железа из клеточной суспензии. В случае нечеткой реакции производят дополнительное прокручивание сыворотки (см. главу 3) или повторную обработку магнитом клеточной суспензии.
2.3.6. Идентификация В-клеточных детерминант посредством техники двойного окрашивания
Для распознавания В-лимфоцитов в обогащенной суспензии все большее распространение завоевывает техника двойной окраски флюоресцеином, предложенная J. van Rood (1976). Метод основан на одновременном свечении зеленого изотиоцианата и красного этидиум-бромида (родамина).
Кратко сущность метода сводится к следующему: суспензия лимфоцитов, полученная из периферической крови человека, обрабатывается иммунным ?-глобулином, связанным с флюоресцеином, в результате чего B-клетки оказываются "помеченными" и таким образом могут быть идентифицированы. Далее вся суспензия подвергается воздействию анти-В-сыворотки и комплемента и затем обрабатывается этидиум-бромидом, который проникает в "мертвые" клетки. В результате в поле зрения люминесцентного микроскопа видны светящиеся зеленым цветом "живые" В-лимфоциты, светящиеся красным "мертвые" В- и Т-клетки и неокрашенные живые Т-, О- и К-клетки. Мертвые В-клетки различают от Т-клеток по наличию на их мембране зеленого светящегося "ободка" изотиоцианата.
Описание методики:
- 4 мл гепаринизированной крови разводят фосфатным буфером(ФБ) в соотношении 1:2 и 4 мл разведенной суспензии наслаивают на фиколл-урографиновый градиент;
- центрифугируют 15 мин при 1000 g; мононуклеары собирают из "интерфазы", трижды отмывают в ФБ, содержащем 1% БСА (ФБ + БСА); ресуспендируют осадок в ФБ + БСА, доводя концентрацию до 4 - 6x106 на 0,5 мл;
- добавляют 2 капли (0,05 мл) козьего античеловеческого иммуноглобулина, разведенного 1:3, и инкубируют его 5 мин при 37°С;
- трижды отмывают в ФБ + БСА и осадок ресуспендируют в этой же смеси, доводя концентрацию до 8x106 мл, после чего суспензия клеток готова к цитотоксической реакции с анти-В-сывороткой;
- анти-В-сыворотку раскапывают под вазелиновое масло в планшеты Moller по 0,5 μl в каждую лунку;
- добавляют в лунки по 0,5 суспензии мононуклеаров и инкубируют 60 мин при 20°С;
- добавляют 2,5 свежего кроличьего комплемента и инкубируют 2 ч при 20°С;
- добавляют 0,5 μ1 разведенного этидиум-бромида ("Sigma") (см. ниже);
- чтение реакции производится после наложения на планшет покровного стекла на инвертированном люминесцентном микроскопе.
Приготовление родамина: 10 мг родамина ("Sigma") разводят в 100 мл 5% ЕДТА на физиологическом растворе; исходный раствор для реакции разводят в соотношении 1:70.
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'