
2.1. Методы идентификации и использования лимфоцитов периферической крови
Основным методом иммуногенетического исследования лимфоцитов периферической крови (ЛПК) остается "комплемеитзависимая цитотоксичность". Все ее варианты основаны на использовании микротехники, предложенной американским исследователем П. Терасаки [Mittal К., Mickey М., Singal D., Terasaki P., 1968], который ввел в употребление специальное микрооборудование для реализации данной реакции (рис. 7).

Рис. 7. Микрооборудование для КЗЦТ по П. Терасаки. 1 - шестиствольный шприц для раскапывания сывороток; 2 - шприц для раскапывания комплемента; 3 - одноствольный шприц с диспенсером; 4 - планшет Терасаки; 5 - планшет Меллера для техники двойной флюоресцентной окраски; 6 - пластиковые микропробирки для розлива сывороток (1 мл) и комплемента (2 мл)
2.1.1. Комплемент-зависимая цитотоксичность (КЗЦТ)
Принцип метода заключается в двухэтапном воздействии на ЛПК вначале иммунной сыворотки, содержащей антитела известной специфичности, а затем комплемента (сыворотка кролика или смесь сыворотки кролика и человека). Если лимфоциты, несущие определенный HLA-антиген, "распознаются" сывороткой, то имеет место реакция клеточного лизиса, улавливаемая по проникновению в клетку прижизненного красителя. Реализация метода имеет несколько модификаций, из которых наиболее используемая - "двухступенчатый метод", предложенный Национальным институтом здоровья в Бетезде (NIH-метод).
Выделение лимфоцитов [по Boyum А., 1968]:
- 4 - 5 мл венозной крови дефибринируют в конической колбе со стеклянными бусами (∅ 0 2 - 3 мм) равномерным встряхиванием в течение 7 - 8 мин до образования сгустка фибрина; лимфоциты донора выделяют из гепаринизированной крови (100 ед. гепарина на 10 мл крови);
- 2 мл дефибринированной или гепаринизированной крови смешивают с равным объемом среды Хенкса и наслаивают осторожно пастеровской пипеткой на градиент плотности изопак-фиколла или верографин-фиколла (плотность смеси 1,076 - 1,077); операцию проводят в пробирке ∅ 1,2 - 1,5 см, куда помещают 2,5 мл смеси верографин-фиколла;
- центрифугируют 30 - 40 мин при 200 g; отсасывают осторожно "белое облачко" лимфоцитов, образовавшееся в интерфазе, и переносят его в мерную центрифужную пробирку;
- добавляют 2 объема трис-буфера и центрифугируют 10 мин при 200 g; надосадочную жидкость удаляют, а осадок ресуспендируют в растворе Хенкса (0,3 - 0,5 мл), доводя концентрацию лимфоцитов до 2 - 4 x 106 в 1 мл. Суспензия лимфоцитов готова для реакции.
Постановка реакции:
- типирующие сыворотки раскапывают в лунки планшетов Терасаки под вазелиновое масло и замораживают (-20°С) до момента использования; перед использованием размораживают при комнатной температуре;
- лимфоцитарную взвесь раскапывают микрошприцем Терасаки (№705) в планшеты по 1 μl на лунку и инкубируют при 22°С 30 мин вместе с типирующей сывороткой;
- в каждую лунку добавляют 5 μl свежеразмороженного кроличьего комплемента и инкубируют при комнатной температуре 1 ч;
- резко стряхивают планшеты для удаления вазелинового масла и закапывают в каждую лунку 1 μl трипана голубого; через 10 мин избыток краски удаляют стряхиванием и учитывают реакцию; клетки, "убитые" цитотоксическими антителами, окрашены в голубой цвет и имеют нечеткие контуры вследствие начавшегося лизиса;
- при использовании эозина вместо трипана голубого планшеты после инкубации с комплементом не стряхивают; в каждую лунку закапывают 3 μl 5% эозина; через 2 - 3 мин закапывают 5 μl формальдегида (40%), планшет накрывают покровным стеклом и через 15 мин, когда клетки осядут на дно, "читают" реакцию под инвертированным микроскопом;
- интенсивность цитотоксической реакции оценивают по следующей шкале:
8 - 100 - 81% гибель клеток - сильно выраженная положительная реакция
6 - 80 - 41% гибель клеток - выраженная положительная реакция
4 - 41 - 31% гибель клеток - положительная реакция
2 - 30 - 20% гибель клеток - сомнительная реакция
1 - 20 - 0% гибель клеток - отрицательная реакция 0 - реакция не читаема.
Приготовление реактивов:
- верографин-фиколловый градиент: приготовляют 8% водный раствор фиколла (ficoll), мол. масса 400 000 (фирмы "Serva"), на дистиллированной воде и 32,8% водный р-р урографина (urografin 76%, Leiras); делают смесь верографин-фиколла в соотношении 10 : 24, плотностью 1,076 - 1,077.
- трисовый буфер: 20,6 г триса [hydroxi-methyl-aminometan NH2C(CH2OH)3], мол. масса 121,14, растворяют в 50 мл H2O и доводят рН раствора до 7,2 - 7,4, добавляя 1NHC1; после этого добавляют 500 мл H2O.
- трипан голубой: 300 мг порошкообразного trypan blue растворяют в 100 мл дистиллированной H2O для приготовления маточного раствора (0,3%); приготовляют гипертонический раствор Хенкса, растворяя 2,55 г NaCl в 100 мл раствора Хенкса; перед использованием в цитотоксическим тесте смешивают 3 объема 0,3% трипана голубого с 1 объемом гипертонического раствора Хенкса.
- эозин: приготовляют 5% р-р эозина в H2O; перед использованием р-р центрифугируют.
- формальдегид: приготовляют 40% р-р формальдегида; р-р должен содержать на дне сосуда CaCO3 для фиксации Н+; перед использованием формальдегид центрифугируют и доводят рН до 7,0.
2.1.2. Комплемент-зависимая цитотоксичность на спленоцитах
Изложенный выше вариант КЗЦТ обычно используется для идентификации лимфоцитов, полученных прижизненно. При иммуно- генетических исследованиях в трансплантологической клинике нередки случаи, когда реализация КЗЦТ на периферических лимфоцитах от умершего донора невозможна. В лаборатории иммуногенетики НИИТиИО Минздрава СССР был разработан способ [Долбин А. Г., Гаврилова Т. В., 1977] реализации теста для целей тканевого типирования донора на спленоцитах, выделенных из трупной селезенки через несколько часов после ее извлечения или после консервации в течение 24 ч при низкой температуре (от -10 до -12°).
Описание методики:
- капсулу селезенки отпрепаровывают ножницами и из середины отделяют небольшие кусочки пульпы, которые помещают в чашку Петри со средой 199;
- кусочки размельчают ножницами и пропускают через 20-миллиметровый шприц; полученную суспензию фильтруют через четырехслойную марлю и отстаивают 15 - 20 мин, в течение которых оседают нелимфоидные форменные элементы;
- надосадочную жидкость собирают; центрифугируют 15 мин при 250 g; супернатант удаляют, осадок промывают средой 199 и центрифугируют в тех же условиях, супернатант удаляют;
- клетки ресуспендируют в свежей среде 199 и доводят концентрацию до 2-3 x 104 в 4 мл;
- полученную суспензию наслаивают на градиент фиколл-изопака по Boyum (см. 2.1.1), проводят выделение лимфоцитов;
- ход и учет цитотоксической реакции традиционный (описан в 2.1.1).
2.1.3. Использование криоконсервированных лимфоцитов периферической крови
Лимфоциты, консервированные замораживанием, широко применяют во многих методах клинической иммуногенетики. В основном используют два приема замораживания - при температуре -70°С и в жидком азоте (-196°С); наиболее употребимым криопротектором является DMSO (Dimethyl-sulfoxide).
Криоконсервация при -70°С:
- выделение лимфоцитов осуществляют в градиенте плотности верографин-фиколла, как описано выше; на заключительном этапе осадок ресуспендируют в криоконсервирующей среде, доводя концентрацию клеток До 2,5 x 10 6- - 2,5 x 105 клеток в 1 мл;
- для приготовления криоконсервирующей среды смешивают 7 частей среды 199, 1 часть раствора DMSO и 2 части сыворотки АВ-группы, взятой от нескольких индивидов и проверенной на отсутствие цитотоксических антител;
- лимфоциты, ресуспендированные в криоконсервирующей среде, разливают с помощью автоматической пипетки в конические полиэтиленовые пробирки для микробиологических исследований по 0,015 мл;
- пробирки помещают в стоячем положении в пенопластовые пеналы с толщиной стенок 1 см и пеналы хранят в холодильнике при -70°С;
- разморозку производят быстрым трением пробирок между ладонями или помещением их в водяную баню при 37°С.
Клетки, консервированные подобным образом, могут быть использованы в реакциях лимфоцитотоксичности для определения коэффициента серопозитивности, в прямой реакции клеточно-опосредованного лимфолизиса (см. далее).
Таблица 21
Жизнеспособность лимфоцитов, консервированных замораживанием при -70°С
| Концентрация лимфоцитов в 1 мл | Лимфоциты нежизнеспособные (%) | |||
| Срок консервации | ||||
| 2 нед | 1 мес | 2 мес | 3 мес | |
| 2,5x106 | 7,3±0,35 | 7,7±0,57 | 11,6±0,27 | 14,5±0,26 |
| 2,5x105 | 5,4±0,35 | 6,4±0,51 | 8,2±0,20 | 11,7±0,24 |
| 2,5х104 | 3,9±0,37 | 4,9±0,42 | 6,8±0,24 | 6,9±0,46 |
Мы провели проверку жизнеспособности лимфоцитов, консервированных подобным образом в реакции комплементзависимой лимфоцитотоксичности [Зарецкая Ю. М. и др., 1978].
Определение жизнеспособности клеток, замороженных на различные сроки, производили в обычном тесте с трипаном голубым; результаты представлены в табл. 21.
Мы наблюдали увеличение числа погибших клеток с увеличением срока консервации и уменьшение гибели с уменьшением концентрации клеток. "Рабочими" концентрациями для лимфоцито-токсической реакции являются 2,5x106 и 2,5x105.
В табл. 22 приведены данные о выявлении HLA-антигенов на лимфоцитах после различных сроков криоконсервации. Результаты показывают, что HLA-антигены, выявленные до консервации, определяются, как правило, после криоконсервации в течение 3 мес. Случаи недовыявления (№ 10, 1 - 2 мес) или ложного выявления (№ 2, 1 мес; № 4, 2 нед; № 8, 3 мес) не являлись стабильными, так как клетки ложно реагировали только с 1 - 2 сыворотками из "батареи".
Криоконсервация в жидком азоте (-198 °С). При заморозке ЛПК в жидком азоте используют как программное замораживание на специальных аппаратах (рис. 8), так и методы беспрограммного замораживания. Один из этих методов, предложенный для 8-го Уоркшопа С. Bland и V. Jeysey (1980), приводится ниже:
- венозную кровь дефибринируют стеклянными бусами и центрифугируют для отделения аутологичной сыворотки, которую затем используют как разбавитель при замораживании клеток;
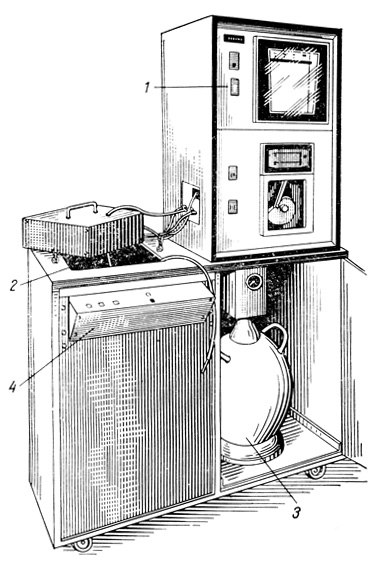
Рис. 8. Аппарат для программной заморозки в жидком азоте ('Planer - LTD', Великобритания). 1 - контролирующее и записывающее устройство; 2 - замораживающая камера для помещения объекта; 3 - сосуд Дьюара с жидким азотом; 4 - пульт управления
- осажденные клетки перемешивают с двумя объемами фосфатного буфера, наслаивают на смесь изопак-фиколла и выделяют лимфоциты обычным путем;
- клетки, изъятые из интерфазы, ресуспендируют в фосфатном буфере и отмывают дважды (1000 g, в течение 15 мин);
- после отмывания клетки ресуспендируют в аутологичной сыворотке (или, если ее мало, в сыворотке мужчины АВ-группы крови);
- два объема DMSO смешивают с тремя объемами раствора Хенкса и охлаждают в течение 5 мин;
- один объем смеси добавляют, помешивая, к трем объемам суспензии клеток в аутологичной сыворотке и суспензию немедленно разливают в пластиковые пробирки (1 мл) или флакончики из силиконизированного стекла того же объема;
- пробирки или флакончики помещают в цилиндр (рис. 9) из полистерена, который вставляют в горловину резервуара с жидким азотом (объем резервуара 35 л) и оставляют на ночь;
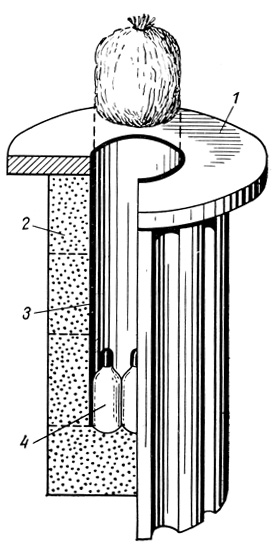
Рис. 9. Морозильный цилиндр для консервации в жидком азоте. Общий вид и разрез. 1 - фанерный обод по горловине рефрижератора; 2 - корпус из полистерена со стенками толщиной 50 мм, составленный из склеенных секций; 3 - картонная трубка; 4 - емкости, подлежащие замораживанию
- замороженные пробирки пересыпают в сосуды с жидким азотом для хранения;
- при размораживании пробирки погружают в водяную баню (37°С), непрерывно встряхивая, избегая нагревания содержимого;
- в пробирку добавляют примерно 1 мл Хенкса по каплям, непрерывно помешивая в течение 15 мин, суспензию осторожно центрифугируют 600 g) в течение 3 мин и удаляют супернатант, содержащий DMSO; клетки не менее двух раз отмывают в фосфатном буфере и ресуспендируют в 100% телячьей сыворотке до 4x106 кл/мл.
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'