
4.3. Роль субъединиц HLA в индуцировании киллерной активности лимфоцитов
В 1953 г. классическими экспериментальными исследованиями М. Simonsen et al. было показано, что аллотрансплантат в период криза отторжения густо инфильтрован всеми типами лимфоидных клеток и некоторыми типами лейкоцитов. Исследования отторгающегося трансплантата человеческой почки [Stroms S. et al., 1975] в основном подтвердили участие клеток лимфоидного ряда в осуществлении эффекта отторжения. Клетки, реализующие эффект цитотоксического действия на антигенно отличные структуры, получили название клеток-эффекторов, или клеток-киллеров (от to kill - убивать).
Изучить киллерную функцию лимфоцита в деталях, выяснить ее зависимость от определенных генетических структур HLA не представлялось возможным до создания специальной модели, которая получила название CML (описание см. в 2.2.2).
CML рассматривают как модель in vitro клеточных взаимоотношений, разыгрывающихся в живом организме при отторжении трансплантированного органа; она представляет собой один из самых сложных типов иммуногенетических отношений в системе клеточных коопераций.
4.3.1. Кинетика клеток, реализующих киллерный эффект
До последнего времени анализ клеток, инфильтрирующих трансплантат во время отторжения, был затруднен из-за сложности их изоляции из цельного органа, требующей дезагрегации органа и обработки его энзимами. Заметным прогрессом явилось "изобретение" губки-матрикса [Roberts Р., Науrу А., 1976; Roberts Р., 1977], на которой выращивается трансплантируемая ткань и которая затем имплантируется в организм реципиента. Через определенный срок губка-матрикс извлекается, клетки, инфильтрующие трансплантат, "выдавливаются" из нее и проверяются в тест-системе, предусматривающей лизис клеток-мишеней соответствующей специфичности, т. е. килинг-эффект.
Несмотря на принципиальный прогресс этого метода, он не может быть использован на человеке. Поэтому в оценке кинетики киллерного эффекта приходится ориентироваться на экспериментальные данные, производя экстраполяцию их на человека с определенным допуском.
В экспериментальных моделях была изучена кинетика клеток-киллеров при первичном и вторичном ответе на трансплантат [Roberts Р., 1977]. Табл. 41 отражает сроки появления киллеров в различных иммунокомпетентных органах при первичной и вторичной пересадке. Наибольшее количество клеток-киллеров при обоих видах пересадки скапливается в трансплантате; они же и развивают наибольшую эффекторную активность.
Таблица 41
Кинетика появления киллеров и их активность в модельных экспериментах на мышах (по P. Roberts, 1977)
| Орган, из которого извлечены киллеры | Время, появления, дни | пик киллерной активности, дни | Максимальный выход 51Cr (%) | Остаточная активность, нед. |
| Первичная пересадка | ||||
| Трансплантат | 1 - 2 | 7 - 8 | 80 | 5 |
| Регинарные лимфатические узлы | 2 - 4 | 8 - 9 | 25 | 5 |
| Селезенка | 2 - 4 | 9 - 10 | 40 | 5 |
| Тимус | Следы | Следы | Следы | |
| Периферическая кровь | 12 | 20 | 12 | 4 |
| Нерегинарный лимфатические узлы | 4 - 5 | 15 | 10 | 4 |
| Костный мозг | Следы | Следы | Следы | |
| Вторичная пересадка | ||||
| Трансплантат | 3 | 7 - 8 | 70 | 2 |
| Регинарные лимфатические узлы | 0 - 1 | 3 - 4 | 30 | 5 |
| Селезенка | 0 - 1 | 3 - 4 | 20 | 5 |
| Периферическая кровь | 2 - 3 | 4 - 15 | Двухфазность 40; 20 | 3 |
| Нерегинарный лимфатические узлы | 0 - 1 | 4 - 5 | 12 | 5 |
4.3.2. Клеточно-опосредованный лимфолизис (CML). Механизмы реализации киллинг-эффекта
До 1975 г. на человеческих лимфоцитах в экспериментах, которые вполне заслужили название классических [Eijsvoogel V. et al., 1973; Trincheri G. et al., 1973], была показана генетическая и функциональная дихотомия LD-SD-детерминант комплекса HLA в индукции данного феномена, что не представляется удивительным с точки зрения двухфазности его реализации (см. рис. 12). В соответствии с "LD-SD-дихотомией" сенсибилизация будущих клеток-киллеров и последующая их пролиферация индуцируется различием по LD-детерминантам между отвечающими и стимулирующими клетками, т. е. эту фазу иммунной активности индуцирует локус HLA-D. Дальнейший киллинг-эффект и деструкция клеток мишеней обусловлены различием по SD-детерминантам между киллерами и мишенями (или отвечающими и стимулирующими клетками), при этом сами SD-детерминанты служат мишенями, против которых непосредственно направлена активность клеток-киллеров.
В последующие годы детализированы отдельные звенья, но некоторые из них до сих пор остались дискутабельными.
Модифицировано положение о роли LD-сублокуса в развитии CML: показано, что несовместимость по MLC-сублокусу не обязательна для развития цитотоксических киллеров [Mawas С. et al., 1975; Goulmy Е. et al., 1975; Long M. et al., 1976].
В основных чертах остается непоколебленной догма о том, что цитотоксические лимфоциты направлены против HLA-SD (А-, В-, С-антигенов). Вместе с тем возник вопрос: не являются ли LD-антигены тоже мишенями для деструкции в киллинг-эффекте? С. Mawas et al. (1975), используя повторную стимуляцию, пришли к выводу, что HLA-D-детерминанты не могут служить мишенями в CML-эффекте, в то время как Т. Kristensen et al. (1976) нашли, что HLA-D-антигены являются CML-мишенями, хотя и слабыми.
Л. П. Алексеев [Зарецкая Ю. М., Алексеев Л. П., 1978] получил доказательства в пользу этого последнего положения. Исследование было выполнено на лимфоцитах 16 неродственных индивидуумов с установленным HLA-А,В,С-фенотипом. Были использованы следующие варианты постановок:
1. Клетки-мишени и стимулирующие клетки (в фазе MLC) полностью идентичны, так как взяты от одного индивидуума.
2. Мишени и стимуляторы идентичны по HLA-A,B,C, но различны по HLA-D (положительная MLC-реакция).
3. Мишени имеют 1 - 3 общие HLA-SD-детерминанты со стимуляторами (вариант 3-го партнера).
4. Мишени и стимуляторы не имеют общих HLA-A,В,С-антигенов (табл. 42).
Наибольший киллинг-эффект отмечен в первой комбинации. Выраженная деструкция наблюдалась и во второй комбинации, однако она была значительно меньше, чем при генотипической идентичности. Следует считать поэтому, что LD-детерминанты являются частичными мишенями для развития цитотоксического эффекта клеток-киллеров.
В группе 3 киллинг-эффект имел место, однако очень низкий. Из этих опытов следует, что для полноценного развития цитолиза, необходим весь комплекс SD-детерминант, присутствовавших на стимуляторах и участвующих в сенсибилизации.
Следует заметить, однако, что это положение небесспорно и есть данные как за него, так и против.
Таблица 42
Исследование CML в неродственных комбинациях (по Л. П. Алексееву, 1978)
| Степень HLA-совместимости между стимуляторами мишенями | Количество случаев | Средний уровень CML, % |
| Генотипическая HLA-идентичность | 23 | 50,4±4,12 |
| Идентичность по HLA-SD-AГ | 18 | 29,1±3,82 |
| Общность по отдельным HLA-SD-AГ (3-й партнер) | 32 | 4,9±0,79 |
| Полная HLA-SD-несовместимость | 18 | 1,7±0,65 |
С. Mawas (1973) представил доказательства, что полноценный киллинг-эффект может развиваться даже в том случае, когда 3-й партнер не имеет общих детерминант со стимулирующими клетками.
После открытия локуса DR на В-лимфоцитах были представлены доказательства возможности выступления DR-детерминант в роли мишеней, против которых направлен киллерный эффект Т-лимфоцитов [Albrechtsen D. et al., 1979]. Мишенями служили бласты двух видов, получаемые под действием ФГА (Т-бласты) и под действием Epstein-Barr-вируса (В-бласты). Киллерный эффект был положительным между по HLA-A,B совместимыми, но по DR-несовместимыми партнерами, если в качестве мишеней использовали EB-virus-бласты, на которых представлены DR-антигены.
Роль DR-антигенов как мишеней в CML подтверждают исследования С. Feighery, P. Stastny (1979), в которых киллинг-эффект был "заблокирован" антисывороткой, направленной к HLA-DR-антигенам.
Поскольку в настоящее время нет методики, которая позволила бы точно отграничить эффект, оказываемый HLA-D-детерминантами, от эффекта, оказываемого HLA-DR-детерминантами, эти свежие факты можно трактовать как подкрепляющие концепцию об LD-мишенях в киллинге (см. выше), так и в пользу концепции об исключительности положения SD-антигенов как мишеней в киллинг-эффекте.
Так или иначе, но точка зрения о комплексном характере мишени в CML, включающем как SD-, так и LD-детерминанты, находит адептов и имеет экспериментальное обоснование [Зарецкая Ю. М., Алексеев Л. П., 1978; Peate Е., 1977].
Если принять точку зрения о HLA-А,В,С-антигенах как об основных мишенях для цитотоксических лимфоцитов, то они должны рассматриваться как наделенные различной иммуногенностью. Во время 7-го Международного Уоркшопа (Оксфорд, 1977) исследователи, активно работающие в области CML, подтвердили заключение о том, что HLA-A2, В7, В8 и Bw35 следует оценивать как "сильные" мишени для киллеров, в то время как HLA-A1, A3, A11 и Awl9 как "слабые" [Kristensen Т. et al., 1975].
4.3.3. Взаимодействие клеточных популяций в CML. Постулирование сепаратного локуса CML
Сложность процессов сенсибилизации и деструкции, развертывающихся в CML, привела к попыткам созданая схем и моделей, объясняющих взаимодействие клеточных популяций и роль отдельных генетических структур HLA в реализации их активности.
Первая из таких схем предложена J. Bach в 1973 г., а затем Уточнена и усложнена автором в последующие годы [Bach J. et al., 1976].
Согласно J. Bach (рис. 22), генерация цитотоксических клеток происходит при взаимодействии двух функционально различных субпопуляций Т-клеток. Одна из них, представленная предшественниками Т-хелперов, распознает LD-антигены, что приводит к пролиферации этой клеточной популяции. Другая, представленная предшественниками антиген-специфических цитотоксических лимфоцитов, активируется в результате распознавания специфических cytotoxic-детерминант (CD), что обозначается как "сигнал 1". Взаимодействие активированных: Т-клеток-хелперов с активированными цитотоксическими лимфоцитами ("сигнал 2") приводит к функциональному "дозреванию" цитотоксических лимфоцитов, которые осуществляют деструкцию клеток-мишеней, т. е. киллинг-эффект.
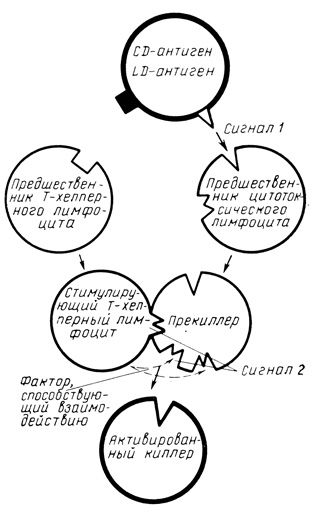
Рис. 22. Схема взаимодействия клеточных популяций в CML (адаптировано из J. Bach, 1973; J. Bach et al., 1976). Пояснение в тексте
Если "сигнал 2" отсутствуе, что имеет место при LD-иден- тичности реагирующих лимфоидных популяций, то CD-стимулированные цитотоксических предшественники не превращаются в клетки-киллеры (возможно, превращаясь в супрессоры).
Концепцию о двойственное популяций, участвующих в CML, разделяет С. Mawas (1975), который показал, что при киллинг-эффекте нормальной интенсивности может встречаться низкореактивная MLC, т. е. эти две функции не находятся в прямой количественной зависимости и, по-видимому, осуществляются различными клеточными популяциями.
Используя схему J. Bach как основу, Teh [Teh Н., Teh S., 1980] вводят в цепь процессов А-клетку (макрофаг), считая, что дозревание цитотоксических киллеров происходит под воздействием: антиген-неспецифического фактора, синтезируемого клетками-хелперами после взаимодействия с А-клетками. Этот фактор, названный костимулирующим, равноценен "сигналу 2". Экспериментальные данные свидетельствуют о том, что он является строго видоспецифическим [Woolnough J., Lafferty К. 1979].
В описанных схемах CD-детерминанты рассматриваются как некая функционально-иммунологически активная субстанция, вопрос о которой, как говорилось выше, является все еще дискутабельным: в это понятие включают как истинные SD-сублокусьг HLA, так и комплекс LD-SD-сублокусов (см. 4.3.2).
Вместе с тем с 1975 г. накапливаются факты, не укладывающиеся в первоначальную концепцию об ограничении пусковых механизмов CML-участком хромосомы между LD- и SD-локусами. К Первое наблюдение касалось различий в поведении клеток от I идентичных по HLA-А,В,С-сублингов и идентичных по HLA-A,B,C К неродственников. В последнем случае можно обнаружить положительную CML [Schapira A., Jeannet М., 1974] в отличие от первой ситуации, где CML негативна [Sondel P., Bach F., 1976].
Исследования, проведенные Л. П. Алексеевым (1978) на HLA-A,В,С-идентичных неродственниках также свидетельствовали о возможности развития позитивной CML в такой ситуации (см. табл. 42).
Эту группу опытов можно объяснять с двух точек зрения: во-первых, включением D-детерминант (если они различны у неродственников) в объект активности киллеров (D-детерминанты как мишени для CML) и, во-вторых, наличием самостоятельного локуса CML, который при использовании клеток от сиблингов не может себя проявить, а при использовании клеток от неродственников включает индуцирующие механизмы, приводящие к полноценному киллинг-эффекту.
В пользу 2-го объяснения свидетельствуют данные голландских авторов [Goulmy Е. et al., 1975], наблюдавших положительную CML на клетках неродственников, идентичных по SD- и LD-сублокусам. Концепция о существовании сепаратного CML-локуса находит много сторонников [Bach J. et al., 1976;Mawas С. et al., 1976; Kristensen T. et al., 1976; Hsu S. et al., 1979].
Вопрос о картировании этого гипотетического локуса естественно еще более сложен. Современная фактология CML располагает равными шансами для "внедрения" сепаратного локуса CML как в интервал HLA-A - HLA-B, так и для вынесения его за пределы HLA-комплекса. Вместе с тем есть пока неоспоримые, хотя и немногочисленные, доказательства, что в случае расположения CML-мишеней вне HLA-комплекса на них распространяется феномен MHS-ограничения (MHS-restriction).
Феномен MHS-рестрикции был открыт на мышах в 1974 г. и состоит в том, что опосредованный через Т-клетки киллинг-эффект развивается на модифицированные вирусом хориоменингита лимфоидные клетки только в том случае, если клетки-киллеры и клетки-мишени являются сингенными или семиаллогенными, т. е. несут общий набор Н2-антигенов или половину его [Zinkernagel R., Doherty P., 19751.
Феномен MHS-ограничения, или "двойного распознавания", оказался свойствен человеку.
Две группы авторов [Goulmy Е. et al., 1976; Storb R. et al., 1977] показали, что HLA-ограниченный киллер-эффект против полового фактора HY может встречаться in vitro и in vivo. Лимфоциты женщины, страдавшей апластической анемией и получившей костный Мозг от своего HLA-идентичного брата, приобрели способность разрушать лимфоциты HLA-идентичного брата и некоторых других Мужчин; анализ фенотипов мишеней показал, что во всех случаях активного киллинга они включали антиген HLA-2; при HLA-2- негативности эффект отсутствовал.
В данном случае мишенями для киллинга служили субстанции, связанные с Y-хромосомой, однако эффект был "привязан" к HLA через антиген HLA-A2.
Аналогичная активность может иметь место и в ситуации in vivo [Goulmy Е. et al., 1978; Storh R. et al., 1978]. Авторы выдвигают гипотезу о наличии двойных CD-детерминант, или Histocompatibility associated membrane (НАМ), в которых различают НАМ-главные и НАМ-минорные [Bradley В., Festenstein Н., 1978; Bradley В. et al., 1979]. Описанный вид MHS-рестрикции против HLA- и не-НLА-детерминант не встречается спонтанно, а индуцируется in vivo после воздействия сильных стимулов (многочисленные гемотрансфузии, отторжение трансплантата и т. п.).
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'