
5.1. Роль большого комплекса гистосовместимости в выживаемости аллогенного трансплантата
В отношении групповых факторов АВ0 трансплантация аллогенного органа подчиняется тем же законам, что соблюдаются при переливании крови.
Степень гистосовместимости между донором и реципиентом при осуществлении аллогенной трансплантации почки или любого другого органа определяется на основе тканевого типирования и выявления HLA-фенотипов донора и реципиента.
Основное правило, обеспечивающее безусловный успех трансплантации, - выбор донора, идентичного с реципиентом по антигенам тканевой совместимости. С иммуногенетических позиций Можно выделить несколько групп, в которых выроятность идентичности будет резко различаться.
1. При пересадке между сиблингами, т. е. между двумя индивидуумами, связанными братско-сестринским родством, вероятность идентичности очень высока (1 : 4): у детей одних и тех же родителей существует значительная вероятность наличия одинаковых гомологичных хромосом, определяющих тканевую совместимость, поэтому в больших семьях имеется по 2, 3 и даже иногда 4 ребенка, имеющих практически одинаковый набор трансплантационных антигенов.
2. При пересадке между родителем и ребенком эта вероятность значительно ниже, чем в первой группе. Если мать и отец совсем не имели общих антигенов, то получается наихудший для этого вида сочетаний вариант: набор антигенов ребенка наполовину отличается от набора каждого из родителей. Если мать и отец имели общие антигены, ребенок получает набор антигенов, в значительной степени одинаковый с каждым из родителей.
3. При пересадке между индивидами, не связанными кровным родством, вероятность идентичности по трансплантационным антигенам очень мала (см. 1.2).
Однако наиболее распространенным видом клинической трансплантации является последний - пересадка между неродственниками, при которой используется так называемая кадаверная почка, изъятая из трупа после "мозговой" или клинической смерти донора.
До настоящего времени в большинстве стран практически рутинное типирование основано на идентификации антигенов сублокусов HLA-A и HLA-B, т. е. четырех антигенов гистосовместимости.
В некоторых типирующих центрах введена "шкала совместимости", рекомендованная Рабочим совещанием в Лос-Анджелесе (1970), в которой степень несовместимости обозначена буквами (табл. 43).
Идеальным случаем для неродственной селекпии является совместимость В: практически при трансплантациях почки допускается совместимость C-D; в ургентных (неотложных) случаях при пересадке по жизненным показателям допустима совместимость Е; абсолютное противопоказание к трансплантации - наличие совместимости F.
Таблица 43
Оценка совместимости (сублокусы HLA-A, В)
| Группа | Описание |
| A | Идентичность (генотипическая или фенотипическая) |
| B | Все донорские антигены присутствуют у реципиента; реципиент имеет антигены, отсутствующие у донора |
| C | Донор имеет 1 антиген, отсутствующий у реципиента |
| D | Донор имеет 2 антигена, отсутствующие у реципиента |
| E | Донор имеет 3 антигена, отсутствующие у реципиента |
| F | Реципиент имеет предшествующие антитела донорской специфичности |
В каждом из буквенных индексов различают: A1 - между сибсами; А2 - между родителем и ребенком; А3 - между группах).
К 1980 г. в некоторых крупных трансплантационных объединениях производится типирование HLA-DR-антигенов для перспективной селекции. В этом случае выявляются по 2 антигена у донора и реципиента.
При оценке эффективности произведенных пересадок, которую учитывают по актуариальной выживаемости трансплантатов, выделяют те же группы. При этом категорию В рассматривают как "трансплантаты, пересаженные при 0 несовместимостей", категорию С - как "трансплантаты, пересаженные при 1 несовместимости" и т. д.
5.1.1. HLA-A- и В-сублокусы и выживаемость аллогенного трансплантата почки
До 1975 г. было опубликовано 20 сообщений из трех больших европейских объединений, однозначно показавших значение совместимости по HLA-A и В-сублокусам для повышения выживаемости пересаженных почек в Европе. Самым большим материалом располагал Франстрансплант совместно с Лондонской трансплантационной группой, где анализировалась выживаемость 918 кадаверных трансплантатов [Dausset J. et al., 1974]. Здесь впервые была представлена статистически значимая группа трансплантатов, имеющих 4 общих совместимости с реципиентом (full house), двухгодовая выживаемость которой на 30% превышала выживаемость трансплантатов, полностью несовместимых.
В противоположность этому данные Международного регистра, суммирующие результаты пересадок, произведенных в Америке, Канаде, Европе и Азии, до 1975 г. показывали лишь слабое влияние HLA-A- и В-сублокусов на выживаемость почечного аллотрансплантата [Barnes A. et al., 1975]. Ниже мы коснемся причин этих расхождений, вначале проанализировав ряд исследований конца 70-х годов, способствовавших утверждению единственно правильной точки зрения.
После 1975 г. самый большой материал был опубликован голландскими исследователями, которые обобщили и проанализировали результаты более 3000 пересадок, произведенных в Евротранспланте [van Rood J. (edit.), 1978; von Rood J. et al., 1979]. Особенностью этого анализа являлось представление большой группы (около 250) неродственных трансплантатов, пересаженных при 0 несовместимостей. Пятилетняя выживаемость в группе полностью совместимых трансплантатов составляла 55%, в то время как в группе полностью несовместимых - 40%, с преимущественной разницей в 15% (рис. 23).
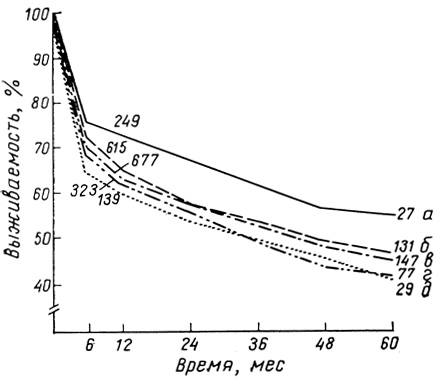
Рис. 23. Выживаемость более чем в 3000 аллогенных почечных трансплантатов по данным Евротранспланта (адаптировано из J. van Rood et al., 1979). a - трансплантаты, пересаженные при нулевой несовместимости; б - при одной; в - при двух; г - при трех; д - при четырех несовместимостях. Цифры означают число трансплантатов
Большой материал Евротранспланта убеждает, что не только выживаемость трансплантатов, но и выживаемость реципиентов зависит от совместимости по HLA-A, В-сублокусам между реципиентом и донором.
Пятилетняя выживаемость реципиентов в случае полной совместимости составляла 85%, тогда как в случае полной несовместимости - только 57% [van Rood J., 19791.
Голландские исследователи обратили внимание на то, что значение совместимости по сублокусам HLA-A и HLA-B особенно важно для пациентов с преформированными антителами. Первые факты, подтверждающие это положение, были получены еще в 1972 - 1974 гг., и последующие погодовые анализы их подтвердили [van Rood J. et al., 1977]. При наличии предсуществующих антител двухгодичная разница в выживаемости между группой "полностью совместимой" и "полностью несовместимой" составляла 25%.
Аналогичный материал был представлен Лондонской трансплантационной группой [Festenstein A., Demant Р., 1979]. Авторы показали, что разница в выживаемости между "полностью совместимой" и "полностью несовместимой" группой трансплантатов на всех сроках составляла около 20%; при этом вначале она была несколько меньше, но начиная с 6-го месяца после операции постепенно превышала 20% (табл. 44).
Мы совместно с А. Г. Долбиным и Е. А. Лобановой провели исследование значения совместимости по сублокусам HLA-A и В для выживаемости и функционирования почечного аллогенного трансплантата, используя материал НИИ трансплантологии и искусственных органов Минздрава СССР. Операции были проведены в 1976 - 1977 гг. с конечной точкой учета выживаемости в мае 1978 г.; в анализ включены случаи с "full house" у обоих партнеров.
Материал был подвергнут двоякому анализу:
- оценивали клинический статус больных и особенности посттрансплантационного периода в зависимости от степени антигенных различий между донором и реципиентом (ранний посттрансплантационный период 1 - 3 мес);
- определяли актуариальную выживаемость в группах трансплантатов, различающихся по степени гистосовместимости.
Таблица 44
Влияние степени совместимости по HLA-A, В-сублокусам на выживаемость трансплантата почки (по Н. Festenstein, P. Demant, 1978)
| Степень совместимости (общие антигены) | Процент выживаемости (в скобках -o число трансплантатов) по месяцам | ||||
| 1 | 3 | 6 | 12 | 18 | |
| 4 | 87 (47) | 76 (39) | 74 (34) | 62 (32) | 60 (26) |
| 3а* | 73 (75) | 67 (54) | 66 (47) | 60 (46) | 59 (40) |
| 3b | 75 (109) | 58 (82) | 52 (63) | 46 (56) | 45 (50) |
| 2 | 72 (193) | 52 (137) | 47 (96) | 42 (84) | 38 (75) |
| 1,0 | 69 (78) | 55 (54) | 41 (43) | 40 (29) | 33 (28) |
*(3а - два общих антигена в сублокусе В и одна несовместимость по сублокусу А; 3b - два общих антигена в сублокусе А и одна несовместимость по сублокусу В; 3а против 3b, начиная с 12 мес, достоверно выше (р < 0,05).)
Пациентами являлись больные, оперированные по поводу хронической почечной недостаточности с отрицательным специфическим кросс-матчем*.
*(Об иммунодепрессивной терапии см. в главе 7.)
Таблица 45
Зависимость частоты и сроков развития кризов отторжения от степени гистосовместимости между донором и реципиентом (по Ю. М. Зарецкой, Е. Д. Лобановой, А. Г. Долбину)
| а. Кризы отторжения за 1-й месяц | ||||
| Степень несовместимости | Количество обследованных больных (n) | Острый криз отторжения по декадам (число пациентов и % от n) | ||
| 1 | 2 | 3 | ||
| I группа (1 + 2 несовместимости) | 27 | 5 (18,5%) | 3 (11,1%) | 5 (18,5%) |
| II группа (3 + 4 несовместимости) | 26 | 9 (34,6%) | 3 (11,5%) | 3 (11,5%) |
| б. Удаления и необратимые отторжения за 3 мес. | ||||
| Число несовместимостей по сублокусам HLA-A и В | Общее число трансплантантов (n) | Удаление или необратимое отторжение (число и % от n) | ||
| 1 | 7 | 1 | 14 | |
| 2 | 20 | 6 | 30 | |
| 3 | 18 | 7 | 39 | |
| 4 | 8 | 5 | 63 | |
Диагностика криза отторжения основывалась на комплексе клинико-лабораторных и иммунологических показателей.
Как следует из представленных данных {табл. 45, а)у острые кризы развивались в 2 раза чаще в 1-ю декаду после трансплантации при расхождении в гистосовместимости по 3 — 4 антигенам, чем при расхождении в гистосовместимости по 1 — 2 антигенам.
В табл. 46, б представлены данные о трансплантатах, удаленных вследствие отсутствия функции или погибших из-за необратимого отторжения. Обращает на себя внимание, что с увеличением степени несовместимости, увеличивается фракция трансплантатов, утерявших функцию и удаленных по этой причине или отторгнувшихся.
Анализ актуариальной выживаемости (рис. 24) показывает, что «отсев» трансплантатов в первые 3 мес значительно выше в группе трансплантатов с 3 — 4 несовместимостями (разница 14%). В дальнейшем различия в выживаемости между группами возрастают, составляя к 9 мес 19%. В более поздние сроки процент выживаемости в «хорошо» совместимой группе остается стабильным, в то время как в «плохо» совместимой наблюдается тенденция к его снижению. Разница в 11/2-годовой выживаемости между группами на московском материале составила 24%,
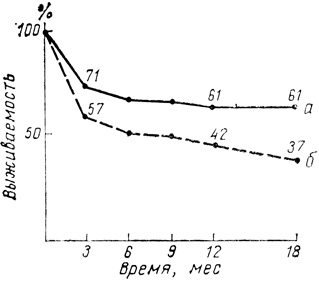
Рис. 24. Полутора годовая выживаемость аллогенных почечных трансплантатов (по данным НИИТиИО Министерства здравоохранения СССР). а - трансплантаты, несовместимые по 1- 2 антигенам; 5 - трансплантаты, несовместимые по 3 - 4 антигенам. Все случаи full house
Таким образом, московский материал показал, что степень антигенных различий между донором и реципиентом влияет как на частоту ранних острых кризов отторжения (которая значительно увеличена в группе трансплантатов с низкой степенью гистосовместимости между донором и реципиентом), так и на выживаемость трансплантатов.
П. Терасаки и сотр. [Opezl G. et al., 1977] впервые представили американский материал, подтверждающий европейские данные о значении совместимости по сублокусам HLA-A и В для судьбы кадаверного трансплантата.
При анализе продолжительности жизни более 5000 трансплантатов авторами была выявлена статистически значимая корреляция между числом HLA-несовместимостей (сублокусы А и В) и выживаемостью трансплантата. Разница в выживаемости «полностью совместимой" группы и группы, имевшей 4 несовместимости, составляла к одному году 11 %, а к двум годам 12% (это несколько ниже, чем в Европе, однако статистически достоверно).
Американские исследователи отметили, что влияние совместимости по HLA-A-, В-антигенам проявляется по-разному в зависимости от группы крови АВО, пола и возраста.
Последний Уоркшоп, прошедший в 1980 г., явился дополнительным аккордом в этом споре. Группа П. Терасаки представила объединенный северо-американский материал, показавший большую выживаемость за первые 6 мес хорошо совместимых трансплантатов по сравнению с плохо совместимыми, однако разница не была статистически значимой [Terasaki P. et al., 1980; Opelz G., Terasaki P., 1980].
Практически важным для клиники является вопрос о дифференциальном влиянии сублокусов HLA-A и HLA-B на эффективность трансплантаций. Это положение можно пояснить такой клинической ситуацией, когда два рецепиента имеют по 3 общих антигена с донором, однако один имеет расхождение в сублокусе HLA-A, а другой - в сублокусе HLA-B; для какого же из реципиентов прогноз предпочтительнее? До 1975 г. было показано на европейском материале [van Hooff Е. et al., 1974; Dausset J. et al., 1974], что совместимость по сублокусу HLA-B более значима для дальнейшей судьбы трансплантата, нежели совместимость по сублокусу HLA-A. Более поздние европейские данные подтвердили это положение (см. табл. 44).
В отличие от этого американские авторы [Opelz G. et al., 1977] отмечают несколько большую дифференциальную значимость сублокуса А (табл. 46).
Почему SD-ссвместимость (HLA-A и HLA-B) более эффективна в Европе, чем в Америке? Была высказана точка зрения [van Rood J. et al., 1977], что одной из причин является большая этническая гетерогенность американской популяции (смешение рас белой, черной, желтой, красной), итогом которой является нарушение "привычного" для кавказоидов неравновесного сцепления между генами различных сублокусов HLA и не учтенное влияние локусов, роль которых еще не ясна.
Таблица 46
Дифференциальная эффективность сублокусов HLA-A и HLA-B в выживаемости трансплантатов почек
| Число несовместимых антигенов | Число пациентов | Выживаемость трансплантатов, мес. | ||
| 6 | 12 | 24 | ||
| 0 в сублокусе А | 663 | 56±2 | <>50±2 | 42±2 |
| 1 в сублокусе В | ||||
| 0 в сублокусе В | 473 | 56±2 | 47±2 | 40±2 |
| 1 в сублокусе А | ||||
| 0 в сублокусе А | 290 | 54±3 | 47±3 | 41±3 |
| 2 в сублокусе В | ||||
| 0 в сублокусе В | 123 | 45±5 | 40±5 | 34±4 |
| 2 в сублокусе А | ||||
Другая причина, как нам кажется, состоит в том, что европейские данные представляют материал, как правило, одного трансплантационного объединения, где приняты единые правила типирования на основе единой сывороточной панели и, следовательно, более точные критерии сценки степени расхождения между донорам и реципиентом.
Суммация материала разных американских центров, не входящих в единую систему, нивелирует значение закономерности, которая должна была бы проявиться па более гомогенном методическом материале.
Из анализа приведенных кривых выживаемости по разным трансплантационным центрам следует 2 практически важных следствия:
1. В ранние сроки после трансплантации (до 3 мес) перестает функционировать около 1/3 аллогенных почечных трансплантатов; этот период наиболее критический для судьбы пересаженного органа, а затем процент гибели значительно снижается.
2. При "полной" и хорошей совместимости по сублокусам А и В происходит гибель значительной фракции трансплантатов, наоборот, при "полной несовместимости" имеется определенная фракция трансплантатов, хорошо функционирующих долгое время.
Последнее обстоятельство говорит в пользу того, что сублокусы HLA-A и В не являются единственным определяющим фактором для конечной судьбы пересаженного органа, а имеются и другие генетические структуры, совместимость по которым оказывает значительное влияние на выживаемость трансплантата.
5.1.2. Значение HLA-DR-сублокуса в выживаемости аллогенного почечного трансплантата
Несмотря на то что сублокус HLA-DR был открыт сравнительно недавно, его изучение в научно-теоретическом, равно как в клиническом, аспекте продвигалось чрезвычайно интенсивно, чему способствовали 7-й (Оксфорд, 1977) и 8-й (Лос-Анжелес, 1980) Уоркшопы, главным предметом изучения которых был HLA-DR локус.
В табл. 47 представлены сводные данные трех европейских групп, произведших оценку значения DR-совместимости по показателю функциональной активности трансплантатов в течение 6 мес после пересадки.
Суммарный материал этих групп достаточен для анализа и показывает, что 6-месячная выживаемость и функционирование трансплантатов, пересаженных при одной DR-несовместимости с реципиентом, на 20% выше, чем в том случае, когда трансплантат был пересажен при 2 DR-несовместимостях.
Таблица 47
DR-совместимость и полугодовое функционирование трансплантатов (европейские данные)
| Трансплантационная группа | Функционирующие трансплантаты при несовместимости по DR | ||
| 0 | 1 | 2 | |
| Martins-da-Silva М. et аl., 1978 (Женева) | % | 22/25 (88) | 12/23 (52) |
| Albrechtsen D. et al., 1978 (Осло) | 2/2 | 15/24 (62) | 14/31 (45) |
| Ting A., Morris P., 1978 (Оксфорд) | 4/4 | 32/40 (80) | 27/40 (67) |
| Всего... | 6/6 | 69/89 (76) | 53/94 (56) |
Примечание к табл. 47 и 48. В числителе - число функционирующих, в знаменателе - общее число пересаженных трансплантатов, в скобках - проценты.
J. van Rood и соавт. (1979) учли при анализе добавочно к DR-совместимости также и HLA-А,В-совместимость (табл. 48). Фракция функционирующих трансплантатов, пересаженных при 1DR-несовместимости с реципиентом, на 30% выше, чем фракция трансплантатов, пересаженных при 2DR-несовместимостях; это соотношение сохраняется при разной степени совместимости по HLA-A, В-сублокусам, однако конкретные цифры выше при хорошей степени совместимости по HLA-A,B.
Материалы по 11/2 - 2-летней выживаемости трансплантатов, совместимых по HLA-DR-сублокусу, представили и исследователи из Евротранспланта [Persijn G. et al., 1978; van Rood J. et al., 1979]. Совместимость no l DR-антигену (без учета совместимости пo HLA-A и В) обеспечивала 80% выживаемости трансплантатов и течение 2 лет. Если же пересаживали почку, несовместимую по обоим DR-антигенам, то выживаемость составляла около 60%, т. е. добавочная совместимость по HLA-А, В-сублокусам была при этом позитивным фактором.
Таблица 48
Функционирование трансплантатов в различных HLA-A, В, С и DR-совместимых комбинациях (адаптировано из J. van Rood et al., 1979)
| HLA-A и В-сублокусы: число несовместимых антигенов | Функционирующие трансплантаты при DR-несовместимых антигенах | Всего | ||
| 0 | 1 | 2 | ||
| 0 | - | 10/12 (83) | 3/4 (75) | 13/16 |
| 1 | 3/3* (100) | 16/18 (88) | 5/10 (50) | 24/31 |
| 2 | 1/3 (33) | 7/11 (64) | 4/12 (33) | 12/26 |
| 3 | 1/1 | 1/1 | 2/3 | 4/5 |
| 4 | - | - | 1/1 | 1/1 |
| Всего... | 5/7* (71) | 34/42 (81) | 15/30 (50) | 54/79 |
*(Группа не может быть учтена из-за ее малочисленности.)
Подробное исследование значения DR-совместимости для выживаемости ренального трансплантата проведено Оксфордской группой [Ting A. et al., 1980] на 152 реципиентах, типированных по 7 первым DR-антигенам. Результаты показывают (рис. 25), что разница в выживаемости между хорошо и плохо совместимыми трансплантатами составила почти 30% за 2 года.
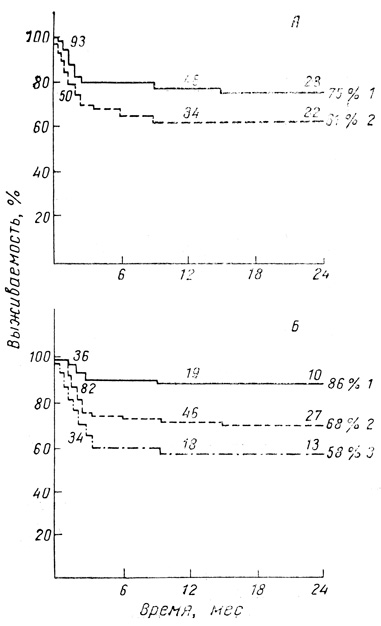
Рис. 25. Значение DR-совместимости для выживаемости аллогенного почечного трансплантата (адаптировано из A. Ting и P. Morris, 1980). А: 1 — 2 или 1 DR-идентичности, 2 — 0 DR-идентичностей; Б: 1 — 0 DR-несовместимости, 2 — 1 DR-несовместнмостеЙ; 3 — 0 DR-несовместимости
Из результатов, представленных выше, вытекают два важных следствия:
1. Совместимость только по 1 DR-антигену обеспечивает высокую выживаемость (около 80%) почечного трансплантата, которая может превысить эффект несовместимостей по остальным HLA-сублокусам.
2. Совместимость по DR-сублокусу (полная или частичная) резко снижает отсев пересаженных почек в первые 3 мес после операции, являясь своего рода протективным фактором, оберегающим от ранних кризов отторжения — основной причиной количественного снижения эффективности аллогенных трансплантаций.
С целью проверки результатов, полученных в отдельных центрах, в 1979 г. по инициативе P. Terasaki [Terasaki P. et al., 1978] был создан Интернациональный пул DR-типированных реципиентов, получающих DR-типированную почку. Результаты кооперативного исследования были обсуждены на 8-м рабочем совещании. На конечном этапе работы (январь 1980 г.) пул включал более 2500 реципиентов с четырех континентов (Европы, Америки, Азии, Африки). Значение DR-совместимости для выживаемости почетного трансплантата учитывалось по актуариальному методу за 6 мес. Такое обширное международное исследование имеет свои pro и contra.
К негативным моментам, способным закамуфлировать истинный результат, принадлежат следующие:
- подсчитана актуариальная выживаемость только за 6 мес (время кооперативной работы участвующих лабораторий), которая могла не отразить всех различий между группами, выявляющихся нередко в более поздние сроки;
- сведены воедино результаты, полученные в разных лабораториях мира, находящихся на разных уровнях тканевого типирования DR-антигенов.
Вместе с тем последний момент может оказаться в определенном смысле положительным, если он находится в соответствии с результатами, полученными на "однородном" материале лучших типирующих и трансплантационных центров; в этом случае его можно рассматривать как универсальный. Результаты были суммированы P. Terasaki (1980) и G. Opelz и P. Terasaki (1980) при учете как числа несовместимостей, так и числа общих антигенов между трансплантатом и реципиентом.
При анализе общих данных (от 756 до 639 трансплантатов) было обнаружено, что 6-месячная выживаемость почек, имевших 2 общих DR-антигена с реципиентом, была на 20% выше, чем полностью DR-несовместимых. Анализ данных лучших центров (378 трансплантатов) показал, что выживаемость трансплантатов, имеющих 2 общих DR-антигена, составляет 80% против 55% для трансплантатов, не имеющих общих антигенов (рис. 26).
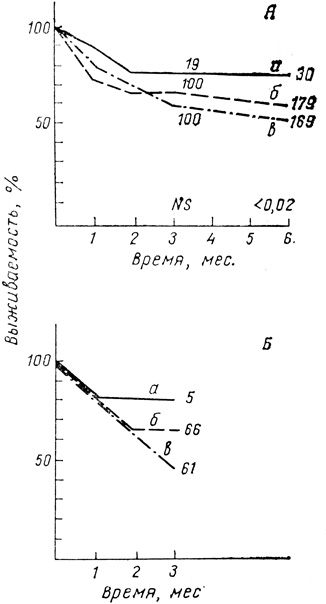
Рис. 26. Значение DR-совместимости для выживаемости почечного неродственного трансплантата (адаптировано из G. Opelz и P. Terasaki, 1980). А - анализ по числу совместимостей; Б перспективный анализ (а - две совместимости; б - одна; в - нуль). Цифры у кривых - число случаев
При дифференциальном анализе выявлено, что очень важная перспективная селекция по DR-локусу, произведенная с Северной Америке, оказалась весьма плодотворной: 3-месячная выживаемость полностью DR-совместимых трансплантатов была более чем на 30% выше полностью DR-несовместимых трансплантатов (в анализе учтено 132 почки) (рис. 26, Б). Таким образом, 8-й Уоркшоп подтвердил большую перспективность селекция, основанной на DR-типировании для повышения эффективности аллогенной пересадки почки.
Это заключение имеет важное клинико-практическое следствие: сублокус HLA-DR па сегодняшний день представляется намного менее полиморфным, чем сублокусы HLA-A и В (даже несмотря на первые факты, свидетельствующие о его дихотомии; см. 1.4.4); высокая частота DR-генов, известных к настоящему времени, служит веским аргументом в пользу постулата о его незначительной полиморфности.
Поэтому подбор совместимой пары донор - реципиент, основанный на результатах DR-типирования, является гораздо менее сложной задачей, чем подбор по HLA-A и В-сублокусам. Следовательно, внедрение селекции по HLA-DR-сублокусу повлечет за собой сокращение учтенного пула реципиентов до 200 - 300 человек и значительно увеличит эффективность использования каждой донорской почки.
5.1.3. Гемотрансфузии и эффективность аллогенных пересадок
Гемотрансфузии, введенные в клиническую трансплантологию как фактор терапевтический, могут сейчас рассматриваться как фактор иммуногенетический (в определенной степени), так как их результатом является образование антител к различным субъединицам HLA-комплекса (см. 3.2), которые развивают функциональную активность, модулирующую реакции трансплантационного иммунитета.
Первое наблюдение о пролонгирующем влиянии гемотрансфузии на выживаемость аллогенного трансплантата было сделано Калифорнийской группой в 1972 г. [Opelz G. et al., 1973], обнаружившей, что пациенты, которые не получали гемотрансфузии, имели значительно менее благоприятный исход трансплантаций, чем пациенты, многократно трансфузируемые. Эти данные, встреченные с определенным недоверием, были впоследствии подтверждены.
Установление протективного влияния гемотрансфузии на прогноз почечного аллотрансплантата повлекло за собой более детальную расшифровку феномена, в частности получение ответа на следующие вопросы:
а) существует ли зависимость доза - эффект для данного явления;
б) каково влияние предсуществующих антител, образующихся в результате трансфузий
Из 25 поименованных лабораторий (табл. 49) только 3 не отметили статистически значимого улучшающего влияния гемотрансфузий на выживаемость кадаверного трансплантата почки; из 8 лабораторий, изучавших зависимость доза - эффект, ни одна его не отметила. Из 13 лабораторий, сообщивших о влиянии преформированных антител, 5 отметили определенное отягощающее влияние на протективный эффект гемотрансфузий SD-антител, в то время как 3 его не заметили; большинство лабораторий не отметили вредного влияния В-антител, а некоторые отметили определенный enhancement-эффект.
Таблица 29
Гемотрансфузии и выживаемость аллогенного почечного трансплантата; сводные данные 1977 - 1978 гг. (адаптировано из A. van Es, 1980)
| Группа, год, город | Одногодовая выживаемость, % | Эффективность трансфузий | Влияние антител (преформированных) | |||
| число трансфузий | ||||||
| 0 | 1 - 5 | 6 - 10 | >10 | |||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Opelz G. et al., 1976 (Лос-Анджелес) | 31 | 49 | 48 | + | SD вредны | |
| Fuller, 1977 (Бостон) | 25 | 51 | + | SD (или В-клеточные) ухудшают эффект трансфузий | ||
| Vincenti et al., 1978 (Сан-Франциско) | 33 | 58 | + | SD (или В-клеточные) не вредны | ||
| Poleski et al., 1977 (Миннеаполис) | 26 | 75 | + | Иммунологический enhancement | ||
| Freeman et al., 1978 (Иова-Сити) | 45 | 60 | + | Нет иммунологического enhancement | ||
| Регистр, 1977 (Чикаго) | 44 | 58 | 60 | 64 | + | |
| Stiller et al., 1978 (Лондон-Канада) | 40 | 71 | + | Иммунологический enhancement | ||
| Senger et al., 1978 (Оттава) | 75 | 65 | - | |||
| Sachs et al., 1976 - 1977 Festenstein et al. (Лондон) | 40 | 78 | 63 | + | ||
| Hulme, Snell et al., 1970 (Лондон-Портсмут) | 18 | 62 | 77 | + | ||
| Briggs et al., 1978 (Глазго) | 28 | 77 | + | SD не вредны | ||
| Wiliams, Morris, 1978 (Оксфорд) | 58 | 74 | - | |||
| Bore et al., 1978 (Ливерпуль) | 37 | 85 | + | |||
| van Hoof et al., 1976 (Лейден) | 17 | 67 | 85 | 70-80 | + | SD не вредны |
| Persijn et al., 1978 (Лейден) | 18 | 83 | + | SD не вредны | ||
| Solheim et al., 1977 (Осло) | 49 | 56 | 75 | + | SD не вредны | |
| Brynger et al., 1977 (Гетеборг) | 43 | 60 | + | |||
| Safwenberg et al., 1977 (Упсала) | 40 | 45 | - | |||
| Hirsberg et al., 1977 (Лунд-Мальмё) | 33 | 52 | 45 | + | SD не вредны | |
| Kock et al., 1978 (Хельсинки) | 65 | 54 | - | |||
| Jeannet et al., 1978 (Базель - Женева) | 42 | 59 | 67 | + | ||
| Buhlman et al., 1978 (Цюрих) | 36 | 70 | 78 | 80 | + | |
| Sirchia et al., 1977 (Милан) | 50 | 70 | + | В-клеточные вредны | ||
| Soulillou et al., 1977 (Нант) | 35 | 75 | + | В-клеточные не вредны | ||
| Descamps et al., 1978 (Париж) | 70 | + | ||||
Заключительный ретроспективный анализ влияния гемотрансфузий на выживаемость кадаверного трансплантата был опубликован G. Opelz и P. Terasaki, родоначальниками этой проблемы, в 1980 г. Они проанализировали громадный материал (2580 трансплантатов), представленный центрами США и Канады, и пришли к выводу, что данный фактор имеет превалирующее значение для выживаемости почечного трансплантата (рис. 27). Авторы ответили на ряд вопросов, остававшихся до сих пор не ясными:
1. На большом материале удалось показать прямую зависимость доза - эффект - чем выше число трансфузий (20), тем выше выживаемость.
2. Прирост выживаемости за счет множественных гемотрансфузий был оценен в 30%.
3. Наиболее высоким оказался эффект от трансфузий эритроцитарной массы, обедненной лейкоцитами.
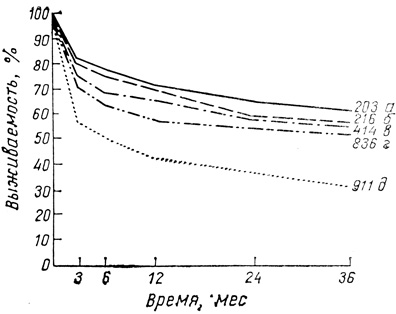
Рис. 27. Выживаемость первичных неродственных трансплантатов в зависимости от числа предшествующих гемотрансфузий (адаптировано из G. Opelz и P. Terasaki, 1980). а - 20 гемотрансфузий; б - 11 - 20; в - 6 - 10; г - 1 - 5; д - 0. Цифры у кривых - число трансплантатов
Авторы не подтвердили положительного влияния цитотоксических антител на выживаемость: их наличие снижало эффект гемотрансфузий, а при большом их содержании (широком спектре) улучшающий эффект гемотрансфузий сводился на нет.
При всех достоинствах ретроспективного анализа он может быть подвергнут критике по ряду моментов, главный из которых невозможность точно учесть число гемотрансфузий и гемодиализов у реципиентов. Поэтому голландскими трансплантологами [Persijn G. et al., 1979] была сделана попытка оценить значение разбираемого фактора перспективно.
В анализе были учтены только голландские пациенты, оперированные в одном из 6 центров Евротранспланта. Это позволило абстрагироваться от таких факторов, как различия в хирургической технике, нефрологическом лечении, иммунологических воздействиях, поскольку они были идентичными во всех участвующих в анализе центрах. Группы реципиентов были подобраны одинаково по степени несовместимости. Результаты показали, что одна специально произведенная гемотрансфузия "отмытой" (бедной лейкоцитами) крови повышала двухгодовую выживаемость трансплантата с 32 до 79%.
В результате всех упомянутых выше работ положение о протективном влиянии предварительных гемотрансфузий на выживаемость аллогенного почечного трансплантата можно считать доказанным; в ряде трансплантационных центров обязательные гемотрансфузии введены как условие предоперационной подготовки реципиентов [Opelz G., Terasaki P., 1980].
Причины, обусловливающие разобранный выше протективный эффект гемотрансфузий, ясны в принципе и мало расшифрованы в деталях. С иммуногенетических позиций гемотрансфузии могут привести к двоякому результату:
1. Образованию примерно у 40% пациентов НLА-А,В,С-антител (см. 3.2.1), которые рассматриваются большинством исследователей как фактор, отягощающий почечный прогноз, но, правда, использование "обедненной лейкоцитами крови" и "упакованной" крови значительно уменьшает возможность иммунизации против HLA-A,В,С-антигенов.
2. Образованию примерно у 60% пациентов B-антител.
Показано нами и Y. Iwaki (1978) (см. 3.2.2), что часть реципиентов, относимая к "классическим" нереспондерам, формируя не антитела, выявляемые на T-лимфоиитах, а В-антитела.
Не связан ли протективный (enhancement) эффект с В-антителами? Ряд факторов, полученных в последние годы, не противоречит этой концепции. Самое значительное наблюдение, подтверждающее гипотезу, то, что трансплантат может быть безопасно пересажен в большинстве случаев, когда преформированные антитела направлены к B-лимфоцитам (см. 3.2.2). Нами показано, что наличие В-антител перед трансплантацией не снижает фракции нормально функционирующих трансплантатов в первые месяцы после операции.
Было выдвинуто представление о том, что формируемые В-антител а суть "блокирующие", покрывающие антигенные сайты (sites) на трансплантате и защищающие тем самым клетки трансплантата от убивающего и разрушающего действия клеток-киллеров (см.3.2.2).
Вместе с тем гипотеза об образовании enhancement-антител трудно согласуется с протективным эффектом однократной гемотрансфузии, поскольку ее результатом может явиться в лучшем случае образование только слабых блокирующих антител. В Как сейчас предполагают [van Rood J. et al., 1979; Opelz G., Persijn G., 1980], индукция "неотвечаемости", вызванная гемотрансфузиями, имеет двухступенчатый механизм: первый этап осуществляется за счет продукции антител или образования комплексов антиген - антитело, а второй, более поздний, - за счет активности Т-супрессоров. Удалось показать, что у значительной части реципиентов после трансфузии "упакованных" или отмытых эритроцитов имеет место заметное увеличение функции Т-супрессоров начиная с трех недель после трансплантации.
5.1.4. Другие факторы гистосовместимости, влияющие на выживаемость аллогенных трансплантатов
Разобранные выше факторы, связанные с большим комплексом гистосовместимости, детально изучены, подтверждены во многих лабораториях и количественно оценены. Вместе с тем имеются отдельные сообщения, которые заставляют предполагать, что в перспективе появится еще ряд иммуногенетических "моментов", которые будут рассматриваться как "модификаторы" судьбы пересаженного органа и некоторые из них по своему удельному весу окажутся более значимыми, чем уже разобранные.
Прежние наблюдения о положительной связи негативной MLC с продолжительностью жизни трансплантата, равно как и новые данные о протективном влиянии совместимости по HLA-DR-сублокусу (5.1.2), тесно связанному с HLA-D-сублокусом, подводят к логическому выводу о значительной роли сублокуса HLA-D в определении судьбы пересаженного аллогенного трансплантата.
Н. Festenstein и сотр. в 1978 г. пересадили 29 трансплантатов, совместимых по 3 - 4 антигенам сублокусов HLA-A и В и идентичных по HLA-D-локусу: в 7 случаях между партнерами имела место "MLC-", а в остальных - выраженная "MLC+". Полуторагодовая разница в выживаемости трансплантатов двух групп соответствовала примерно 40% в пользу MLC-группы. Данная линия исследований завершилась экспериментом A. van Es (1979), который показал на макак-резусах, что при негативной MLC трансплантат почки без иммуносупрессии функционирует около 35 дней (средние данные), а в тех же условиях при позитивной MLC - только около 12 дней.
Между тем не всегда отрицательная MLC свидетельствует об HLA-D-идентичности между партнерами. J. van Rood (1977) показал, используя для типирования гомозиготные типирующие клетки, что в случае HLA-D-идентичности между партнерами-неродственниками негативная MLC имеет место в 25% случаев, слабопозитивная - в 44% и выраженная позитивная - в 31 % случаев. Следовательно, все-таки необходимо дифференциальное ТИПИрование HLA-D-детерминант.
В последние годы оживилось внимание к H-Y-системе, которая рассматривалась как слабая система гистосовместимости. Было отмечено, что трансплантаты, в частности почечные, намного лучше выживают в реципиентах-мужчинах, чем в реципиентах-женщинах. На большом материале (494 кадаверных трансплантата) Лондонская трансплантационная группа [Festenstein H., Demant Р., 1978] , показала, что 3-летняя выживаемость в группе, где пересажен^ (мужская почка женщине, почти на 25% ниже, чем при обратной комбинации.
Оказалось, что H-Y-антиген имеет рестрикцию (см. 4.3.3) к самым "иммуногенным" HLA-антигенам - HLA-A2 и HLA-B7 (Goulmy Е. et al., 1978; van Rood J. et al., 1979], и эффект H-Y-гена на выживаемость трансплантатов может сочетаться с эффектом действия некоторых HLA-генов. Распространяется ли рестрикция sex-антигена на другие антигенные структуры, пока неясно.
Недавно произошло "переоткрытие" Lewis-системы, которая обнаружила признаки гистосовместимости, влияющей на выживаемость аллогенного трансплантата. A. Orial и сотр. (1978) отметили, что у Lewis-негативных реципиентов почечные трансплантаты выживают хуже вследствие возникновения несовместимости по Lewis-фактору. Данное обстоятельство следует учитывать при пересадке органа от донора белой расы реципиенту негроиду, у которых частота Lewis-гена очень низка.
Эти факты значительно интенсифицировали составление коллекции иммунных сывороток, содержащих антитела к Lewis-фактору.
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'