
6.3. Гипотеза о гене иммунного ответа (IR) у человека
Различные гипотезы, объясняющие прямое включение HLA-детерминант в патогенез заболеваний (6.2.2), не могли объяснить случаев, составлявших большинство, где позитивные ассоциации не столь высоки, как взаимосвязь HLA-B27 с группой ревматоидных заболеваний.
Было обращено внимание на некоторые особенности ассоциаций HLA с болезнями, которые позволяли выдвинуть и другие гипотезы, объясняющие возможные механизмы взаимосвязи.
6.3.1. Постулирование IR-гена
К особенностям ассоциаций, описанных в разделах 6.2.1 и 6.2.3, отнесены следующие:
1. Как правило, положительные ассоциации обнаружены с аллелями локуса HLA-B (см. табл. 54); связь же с антигенами HLA-A-локуса чаще всего вызвана высоким неравновесным сцеплением между HLA-A и В-генами (А1 - В8, А3 - В7). Для некоторых болезней обнаружена более высокая позитивная ассоциация с антигенами локуса HLA-D, чем с HLA-B. По-видимому, таких ассоциаций значительно больше, но выявление их доступно пока очень малому числу лабораторий мира.
2. Большинство из перечисленных выше болезней являются в той или иной степени иммунопатиями, в которых присутствует аутоиммунный или иммунодефицитный компонент.
3. При некоторых болезнях имеет место "популяционная" подмена в позитивной ассоциации одного антигена другим. Наиболее яркий пример - рассеянный склероз, который, согласно данным Оксфордского Уоркшопа, у населения Северной Европы имеет высокопозитивную ассоциацию с комплексом A3 - B7 - Dw2 - DR2. Значимость этой ассоциации уменьшается по мере продвижения на юг Европы, где отмечается уже другое неравновесное сцепление. У японцев ассоциация с Dw2/DR2 сменяется на DR7 [Dick Н., 1978].
Последнее наблюдение было хорошей иллюстрацией к гипотезе о том, что не HLA-A-,B- или HLA-DR-гены являются сами по себе структурами, определяющими восприимчивость к заболеванию, а имеются специальные "гены восприимчивости", определяющие интенсивность ответа на фактор внешней или внутренней среды организма. Эти гены находятся в высоком неравновесном сцеплении с аллелями HLA-A,B или HLA-Dw, DR, причем в разных популяциях они сцеплены с различными HLA-аллелями.
Таким образом, данная концепция была фактической заявкой на признание наличия у человека IR-гена, основанная на приведенном выше фактическом материале и подкрепленная открытиями в эксперименте (см. 6.1).
Первые два наблюдения (см. 6.3.1) приводили к общему выводу, что ген иммунного ответа связан (включен) с HLA-комплексом и может быть картирован в интервале B - D, как сейчас склонны считать, в непосредственной близости к локусу HLA-D. Из того факта, что различные группы болезней связаны не с одним, а с разными аллелями HLA-B или HLA-D, следует достоверное предположение, что IR-система у человека является многоаллельной. Взаимосвязь болезней с генами HLA-B и D является отражением высокого неравновесного сцепления известных аллелей с нераскрытыми пока аллелями IR-гена.
Некоторые наблюдения по наследованию восприимчивости к аллергенам непосредственно подтвердили связь постулируемого IR-гена с HLA-комплексом.
Удалось показать, что гены иммунного ответа на амброзию наследуются связанно с HLA-комплексом [Yoo J. et al., 1977]. Было выяснено, что чувствительность к очищенному аллергену пыльцы ржи ассоциирована с аллелем В8, в то время как чувствительность к аллергену амброзии высокой - с А2, что послужило основанием к постулированию даже двух IR-локусов [de Week А., 1977].
Как упомянуто выше, достоверные ассоциации с HLA-антигенами обнаружены пока главным образом для неинфекционных болезней (см. табл. 54). Начиная с 1973 г. приводятся интенсивные поиски подобных ассоциаций с инфекционными заболеваниями. При этом было показано, что у человека предрасположенность и иммунный ответ к некоторым вирусам, бактериальным и паразитическим болезням контролируются генами, связанными с HLA-комплексом [de Vries R., van Rood J., 1979], однако пока нет возможности выделить для этой группы болезней достоверные, многократные подтвержденные ассоциации.
В то же время именно для инфекционных заболеваний легче предложить гипотетическую схему, объясняющую взаимосвязь процессов, обусловливающих большую или меньшую предрасположенность к заболеваниям [de Vries R., van Rood J., 1979]. Эта схема изображена на рис. 28 и в общих чертах сводится к следующему:
- в HLA-комплексе имеется IR-ген, кодирующий соответствующие IR-детерминанты на клеточной поверхности;
- патоген, проникая в организм, взаимодействует с детерминантами, что приводит к активации иммунной системы;
- при высоком типе иммунного ответа имеет место низкая предрасположенность к болезни и соответственно низкая ее частота;
- при низком типе ответа имеет место высокая предрасположенность и соответственно высокая частота болезни.
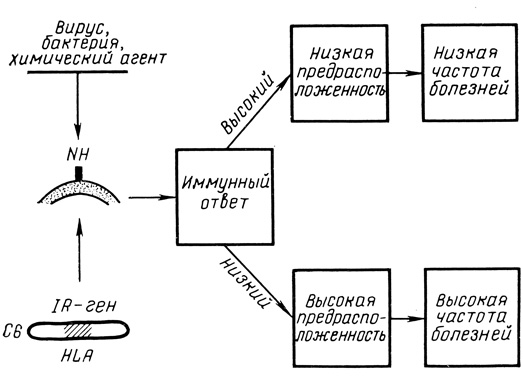
Рис. 28. Проявление функциональной активности IR-гена (адаптировано из R. de Vries и J. van Rood, 1979). Пояснение в тексте
Положение о высоком и низком типе иммунного ответа у человека было подтверждено исследованиями последнего пятилетия (1975 - 1980).
L. Greenberg et al. (1975) впервые показали, что HLA-фенотип связан с низким или высоким ответом Т-лимфоцитов в тесте бластообразования при стимуляции стрептококковым антигеном.
R. de Vries et al. (1976) определили, что чувствительность к проказе связана с определенным HLA-фенотипом, от которого зависит тип лепроматозной инфекции.
Сходные опыты проведены недавно японскими авторами [Sasazuki Т. et al., 1980]. Они использовали модель клеточной пролиферации Т-лимфоцитов в ответ на стимуляцию антигеном, полученным из Schizostoma japonicum (вид червя). Исследования проводились на инфицированных соответствующим патогеном индивидуумах. По отношению к шизостомальному антигену клеточную реакцию можно было разделить на сильный (82,5%) и слабый (17,5%) ответ; слабый тип ответа был четко ассоциирован с гаплотипом Aw24 - Bw52 - Dw12.
Если рассматривать предложенную схему (см. рис. 32) как отражение действия и реализации возможностей IR-гена, то очевидно, что аллель, побуждающий к высокому иммунному ответу, можно назвать геном-протектором, в то время как побуждающий к низкому ответу - геном-провокатором заболевания.
Аллель(ген)-провокатор в силу любого из предложенных и разобранных выше механизмов (6.2.2 и 6.3.1) повышает предрасположенность к заболеванию, провоцируя его манифестацию.
Естественно, что фенотипическая частота такого аллеля завышена в "больной" группе (позитивная ассоциация).
Но наряду с антигенами, положительно ассоциированными с болезнью, есть антигены, ассоциированные отрицательно. Это значит, что в выборке больных кодирующий ген встречается крайне редко, т. е. большинство людей-носителей данного гена не предрасположены к заболеванию. В противоположность гену-провокатору такой аллель следует рассматривать как ген-протектор для данной болезни.
Гены сублокуса HLA-A очень часто несут функции протекторов (за исключением тех, которые имеют высокое неравновесное сцепление с генами HLA-B).
Генами-провокаторами наиболее часто являются следующие группы: крег B7 (B7 - B27), крег B8 (B8 - B14, B18), крег B5 (B5, Bw35), крег DR2 - DR3 - DR4.
Рассматривая конкретный контроль IR-генами антителообразования, можно высказать вполне вероятное предположение, что в ходе эволюции происходила селекция IR-генов с высоким типом иммунного ответа, что обеспечивало иммунологическую защиту против патогенных организмов и позволило человеку "дожить" почти до третьего тысячелетия нашей эры.
Также можно предполагать, что с развитием интенсивной лекарственной терапии, с появлением в нашем веке промышленного производства антибиотиков и других сильнодействующих препаратов естественная селекция сильного IR-гена будет значительно видоизменена.
Объяснения механизмов IR-активности для группы неинфекционных болезней пока не могут быть признаны в достаточной степени адекватным клиническим фактам и не могут быть уложены в соответствующую гипотетическую схему. Однако можно с достаточным основанием предполагать, что для группы аутоиммунных болезней высокий тип IR-активности повысит риск развития заболевания, поскольку будет связан с высокой продукцией соответствующих аутоантител.
6.3.2. Рабочая гипотеза о путях реализации активности IR-гена
Следующий интересный аспект проблемы IR-гена человека касается путей реализации его активности на разных уровнях - молекулярном, субклеточном, клеточном. Данный аспект представляет собой в значительной степени "терра инкогнита".
Если вышеописанные эксперименты по сильному или слабому типу активации Т-лимфоцитов в. ответ на антигенную стимуляцию (см. 6.3.1) можно рассматривать как проявление IR-активности на клеточном уровне, то о механизмах реализации этой активности на субклеточном, а тем более молекулярном уровне неизвестно ничего. Мы располагаем некоторыми 'фактами, которые, как нам кажется, позволяют высказать рабочую гипотезу о возможных путях реализации активности IR-гена через систему митохондриальных гликолитических ферментов.
Мы исходим из предположения, что при отсутствии антигенного стимула IR-ген не проявляет активности в той степени, чтобы ее можно было зафиксировать. Следовательно, для выяснения путей реализации или маркеров активности IR-гена нужно выбрать ситуацию, которая связана с активным иммунным процессом. Такой ситуацией, в частности, является криз отторжения аллогенной почки.
Отрабатывая систему иммунологического мониторинга, мы использовали для диагностики криза отторжения определение в ЛПК активности парных гликолитических митохондриальных ферментов - α-глицерофосфатдегидрогеназы (α-ГФДГ) и сукцинатдегидрогеназы (СДГ) (см. 7.3).
Было проведено [Львицына Г. М., Зарецкая Ю. М., 1980] исследование активности α-ГФДГ и СДГ в ЛПК реципиентов аллогенной почки при разных посттрансплантационных ситуациях: клинически установленном кризе отторжения, предкризовом периоде, во время инфекционных осложнений (рис. 29).
В периоды, предшествующие кризам отторжения в большинстве определений (68%), активность фермента была высокой (>10 гранул); фракция определений с низкой активностью α-ГФДГ (<3 гранул) составляла всего 3,1%.
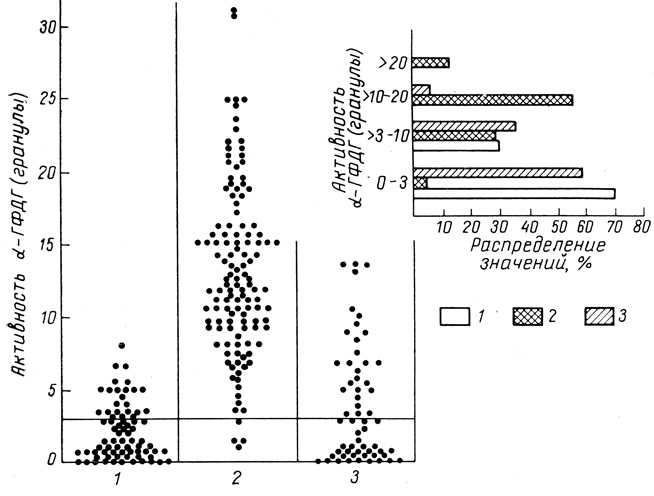
Рис. 29. Активность α-ГФДГ в ЛПК больных с пересаженной аллогенной почкой. Точки означают конкретные значения реакций. 1 - в период стабильной функции трансплантата на фоне иммунодепрессивной терапии; 2 - в предкризовый период; 3 - в период инфекционных осложнений. На графике справа - распределение значений реакций, по активности: основная масса реакций с высокой активностью α-ГФДГ (от 10 до 20 гранул) отмечена в предкризовом периоде
Определение коэффициента корреляции между активацией α-ГФДГ в ЛПК и предкризовым периодом показало, что для клинической ситуации он очень высок, составляя 0,78 (подробнее см. в разделе 7.3).
При инфекционных осложнениях имели место обратные соотношения: фракция случаев с низкой активностью фермента (до 3 гранул) составляла 58,4%, а высокоактивных (10 гранул) - лишь 6,1%.
Как следует из этих наших данных, повышение активности α-ГФДГ в ЛПК высоко коррелировало с последующей манифестацией криза отторжения и не было связано с другими ситуациями, встречающимися в посттрансплантационном периоде.
Предкризовый период, несомненно, является периодом повышенной активности IR-гена. Данная ситуация, если не увеличить иммунодепрессивную нагрузку, разрешится кризом отторжения трансплантата. Как видно, она сопровождается активацией α-ГФДГ. Манифестация инфекции связана, как можно думать, с низкой функциональной активностью IR-гена, не обеспечивающего механизмы противоинфекционной защиты; эта ситуация сопровождается низкой активностью α-ГФДГ.
На основании приведенных выше фактов мы склонны считать, что активность одного из гликолитических ферментов α-ГФДГ является маркером активности IR-гена и, возможно, реализация этой активности осуществляется через систему(ы) одитохондриальных ферментов.
Данное положение было проверено и на другой клинической модели - на пациентах, страдающих неинфекционно-аллергической формой бронхиальной астмы. Были исследованы [Зарецкая Ю. М., Болотина Г. С., Львицына Г. М., Попова Л. К., 1980] два иммунологических показателя -реакция бласттрансформации (РБТ) периферических лимфоцитов с фитогемагглютинином (ФГА) и активность α-ГФДГ в ЛПК.
В наших экспериментах была обследована кровь трех групп больных:
- с тяжелой формой аллергической бронхиальной астмы, не поддающейся специфической (вакцины из соответствующих аллергенов) или неспецифической (интал, бронхолтики, антигистаминные препараты) терапии;
- с бронхиальной астмой выраженной тяжести, но поддающейся двум упомянутым формам лечения;
- с легкой формой бронхиальной астмы, хорошо корригируемой терапией.
Значения активности фермента, равно как и значения интенсивности бласттрансформации, представлены на рис. 30.
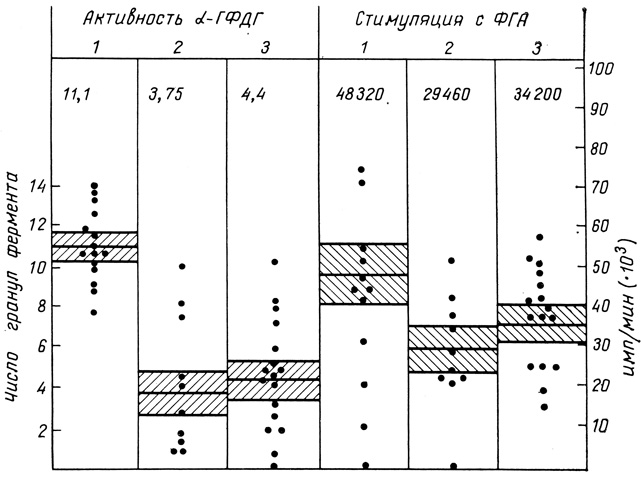
Рис. 30. Активность α-ГФДГ в ЛПК (слева) и интенсивность РБТ (справа) у больных неинфекционно-аллергической бронхиальной астмой. 1, 2, 3 - обозначения групп больных (см. текст); вверху колонок приведены средние значения; заштрихованная зона - доверительный интервал
Из этих данных следует два вывода:
1. При тяжелой форме болезни высока активность α-ГФДГ в ЛПК и значительно выше, чем в других группах, интенсивность РБТ; тяжелая не корригируемая терапией форма может быть связана с усиленной продукцией патогенетических факторов (иммуноглобулин Е?), свидетельствующей о функциональной напряженности IR-гена.
2. Один и тот же тип реакции (высокий - низкий) характеризует как активность α-ГФДГ в ЛПК, так и бласттрансформацию в одной и той же группе больных; так что можно констатировать параллелизм силы реакции по изученным показателям. Поскольку бласттрансформация есть феномен, связанный с активностью IR- гена, параллелизм активности α-ГФДГ служит косвенным доказательством причастности этого фермента к реализации активности IR-гена.
Мы понимаем, что в настоящем виде предположение о взаимосвязи α-ГФДГ с проявлениями функциональной активности IR-гена - не более чем рабочая гипотеза, требующая серьезной проверки и разработки. Едва ли есть основания считать, что на субклеточном уровне реализация активности IR-гена происходит только через один фермент, вероятнее предположить цепь ферментов. Возможно, что в ходе проверки эта рабочая гипотеза не подтвердится, однако на данном этапе этот путь исследований нам представляется перспективным.
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'