
7.3. Энзиматический тест (ЭТ) как вид иммунологического мониторинга кризов отторжения
Выбирая энзиматический тест в иммунологическом мониторинге, мы исходили из предположения, что изменение функциональной активности ЛПК, индуцированной главным образом различием между донором и реципиентом в HLA-совместимости и имеющей следствием манифестацию криза отторжения, должно сопровождаться изменением внутриклеточного метаболизма, а значит, опосредоваться через системы внутриклеточных ферментов. Мы встретили подтверждение этой мысли в экспериментальных исследованиях, выполненных группой отечественных исследователей [Фролова М. А. и др., 1975, 1976].
Определение внутриклеточных энзимов несложно. Для некоторых из них, в частности для парных гликолитических энзимов - α-ГФДГ и СДГ, существует модификация базового метода, позволяющая реанализировать количественный учет ферментной активности [Нарциссов Р. П., 1969].
Мы [Львицына Г. М., Зарецкая Ю. М., 1980] изучали активность этих ферментов у пациентов с синдромом ХПН до и после пересадки аллогенной кадаверной почки.
Определение активности ферментов производили микроскопически на мазке периферической крови после осуществления энзиматической "проводки".
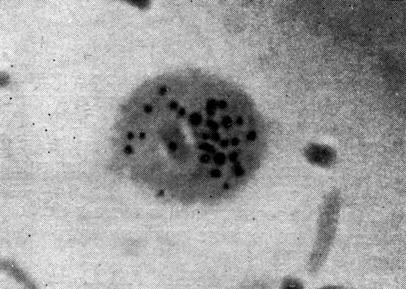
Рис. 34. Лимфоцит после цитохимической 'проводки' на выявление α-ГФДГ; видны гранулы фермента. Микрофото. Иммерсия. Ув. 10 × 90
Тест состоит из четырех этапов, хронометраж которых для одного исполнителя приведен ниже:
- приготовление реагирующих смесей - 10 мин на каждую;
- постановка реакции - 1 ч 15 мин;
- микроскопический анализ - 20 - 30 мин;
- вычисление активности для одного фермента - 3 мин.
Приготовление реагирующих смесей. Смесь № 1. В 300 мл 1/1,5 М фосфатного буфера (рН 7,2 - 7,4) добавляют 78 мг трилона-В (ЕДТА Na2, "Reanal") и 78 мг нитротетразолия фиолетового ("Reanal"); смесь фильтруют и хранят при 4°С; перед употреблением нагревают до 37°С.
Смесь № 2а (готовят ex tempore): 40 мл смеси № 1 + 630 мг а-глицерофосфата (глицерин-1-фосфатдинатриевая соль).
Смесь № 2б (готовят ex tempore): 40 мл смеси № 1 + 540 мг динатрий сукцината.
Постановка реакции. Кровь для приготовления мазка берут из пальца или мазок приготовляют из buffy coat, полученного в результате отстаивания крови, взятой у реципиента во время шунтирования, в 3% р-ре лимоннокислого Na в течение 11/2 - 2 ч.
- мазок фиксируют 30 мин в ацетон-трилоне В (60% раствор ацетона + 250 мг ЕДТА Na2) и затем промывают проточной водой;
- мазок помещают в смесь 2а (для α-ГФДГ) или 2б (для СДГ) на 1 ч (37°), после чего промывают в проточной воде;
- мазок окрашивают 0,25% раствором Janus grun (Merck) в течение 10 - 15 с; промывают и высушивают при 22°С, после чего он готов для подсчета.
Учет активности ферментов. Производится в течение 4 ч для СДГ и 24 ч для а-ГФДГ после приготовления мазка; под световым микроскопом (10 X 90) подсчитывают гранулы энзимов, образовавшиеся в результате цитохимических реакций и видные как фиолетовые включения, расположенные по всей поверхности клетки (рис. 34). Подсчитывают число гранул в 50 лимфоцитах (на двух разных мазках, для а-ГФДГ и для СДГ).
Активность фермента А в числе гранул рассчитывается по формуле А = S/N, где S - число гранул, а N - число просмотренных лимфоцитов.
Уровень активности ферментов показан в табл. 66.
Таблица 66
Средняя активность α-ГФДГ и СДГ в ЛПК реципиентов аллогенной почки в различных посттрансплантационных ситуациях
| Группы | Средняя активность энзима гранулы (М ± m) | Число больных | Число обследований | |
| α-ГФДГ | СДГ | |||
| 1 | 2 | 3 | 4 | 5 |
| 1. Синдром хронической почечной недостаточности до трансплантации почки | 6,83 ± 0,50 | 10,55 ± 0,63 | 83 | 129 |
| 2. После курса интенсивной иммунодепрессивной терапии в течение первых двух недель после трансплантации (не осложнено кризами отторжения или инфекциями) | 2,2 ± 0,18 | 9,5 ± 0,05 | 22 | 77 |
| 3. В предкризовом периоде (3 - 5 дней до криза отторжения) | 13,5 ± 0,54 | 13,72 ± 0,22 | 110 | 126 |
| 4. Во время инфекционных осложнений, не сопровождающих криз отторжения | 3,54 ± 0,36 | 13,2 ± 0,95 | 33 | 65 |
У больных с синдромом ХПН, находящихся на программном гемодиализе, активность ферментов соответствует в среднем 6,83 ± 0,50 (α-ГФДГ) и 10,55 ± 0,63 (СДГ) (табл. 66).
Влияние иммунодепрессивной терапии (учтены случаи, не осложненные кризами отторжения или инфекциями) снижало уровень α-ГФДГ; активность СДГ изменялась незначительно (см. табл. 66, 2).
Из 40 ложнопозитивных реакций 32 случая были связаны с ухудшением состояния трансплантата (неустойчивая функция, уплотнение, увеличение размера и т. п.), которое удалось купировать и оно не привело к манифестации криза отторжения.
Во время инфекционных осложнений, не совпадающих с кризами отторжения, активность α-ГФДГ не возросла (см. табл. 66,4), в то время как активность СДГ недостоверно повышалась.
В периоды, предшествующие клинически установленным кризам отторжения, наблюдается активация α-ГФДГ (в среднем до 13,5 ± 0,54) (см. табл. 66, 3), что отмечено, как правило, за 3 - 5 дней до клинически диагностируемого криза отторжения.
Число случаев без активации α-ГФДГ в периоды, предшествующие кризам, составляло всего 5,2% от числа обследований, произведенных в предкризовых периодах (на табл. 67 а + с). "Ложная" активация в периоды, не связанные с кризами отторжения, составляла 11,8% (b + d на табл. 67).
В табл. 67 представлен коэффициент корреляции между этими, процессами; он равен 0,78.
Таблица 67
Корреляционная зависимость между активацией α-ГФДГ в ЛПК и последующей манифестацией криза отторжения
| Предкризовый период | R = 0,781 | |||
| + | - | |||
| Активация α-ГФДГ | + | 126 а | 40 в | |
| - | 7 с | 297 d | ||
В табл. 68 приведены результаты дискретного анализа активности ферментов при различных формах инфекционных осложнений. Незначительное повышение активности α-ГФДГ имело местом только при нагноениях раны.
Начиная с 1-го месяца после пересадки, т. е. в период стабильной функции трансплантата, активность обоих ферментов близка к активности в ранний посттрансплантационный период после воздействия интенсивной иммунодепрессивной терапии. Из данных рис. 34 (см. 6.3.2) следует, что в предкризовой ситуации активность фермента аα-ГФДГ была высокой в подавляющем большинстве случаев, а при инфекционных осложнениях, наоборот, около 60% определений активности фермента давали низкие цифры. Высокий коэффициент корреляции и однозначная направленность процесса свидетельствуют о том, что активация аα-ГФДГ связана с последующей манифестацией криза отторжения и не связана с другими ситуациями посттрансплантационного периода.
Таблица 68
| Тип инфекции | Активность фермента, гранулы | Число больных | Число обследований | |
| α-ГФДГ | СДГ | |||
| Сепсис | 2,84 ± 0,55 | 10,5 ± 1,4 | 8 | 17 |
| Пневмония | 1,25 ± 0,40 | 8,86 ± 2,3 | 11 | 18 |
| Нагноения раны | 5,3 ± 0,62 | 16,8 ± 1,3 | 14 | 30 |
| Всего. . . | 3,54 ± 0,36 | 13,2 ± 0,95 | 33 | 65 |
Во время кризов отторжения превалирование высокой активности аα-ГФДГ нам установить не удалось: лишь в 26,6% случаев активность была более 10 гранул, активность до 3 гранул встречалась в 28,3% случаев. Это может быть объяснено интенсивной иммуносупрессией в период манифестации кризов отторжения, которая маскирует данную взаимосвязь. Подобные результаты (увеличение аα-ГФДГ-активности при острых кризах отторжения у 24 больных с трансплантированной аллогенной почкой получены Ж. К. Станайтене (1980).
Учитывая крайнюю простоту теста, возможность получения результатов в течение нескольких часов, можно рекомендовать определение активности α-ГФДГ в ЛПК как удобный и достаточно надежный тест иммунологического мониторинга.
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'