
7.2. Мониторинг киллерной активности лимфоцита
Всего несколько лет назад в модельных системах in vitro удалось зримо представить механизмы, с помощью которых реализуется эффектное звено клеточных взаимодействий, направленное на элиминацию чужеродных субстанций, попавших в организм. Эта модельная система — клеточный цитолиз в различных его типах и их вариантах — CML и D-CML (см. 2.3.2 и 4.3.2) и ADCC (см. 2.2.3). Есть достаточно оснований считать, что названные модельные системы являются аналогами процессов, разыгрывающихся в организме при ситуации, связанной с элиминацией «чужого», например трансплантированной ткани. Данные типы эффекторных реакций осуществляются клетками-киллерами, для которых необходима предварительная сенсибилизация - прямая (CML) или через посредство антител (ADCC).
Недавно в крови человека обнаружены клетки, осуществляющие киллерные реакции по отношению к мишеням, с которыми организм в нормальных условиях не встречается, т. е. киллеры, развивающие активность без предварительной сенсибилизации и получившие название натуральных (спонтанных) киллеров. Об их функциях in vivo практически ничего не известно. Мы предположили, что коль скоро есть основа для "натурального киллинга", он может вовлекаться в процесс отторжения трансплантата. Несколько видов мониторинга киллерной активности лимфоцитов и мононуклеаров рассмотрены ниже.
7.2.1. D-CML как тест иммунологического мониторинга
Одним из наиболее интересных и информативных видов контролирования киллерной активности лимфоцита является динамическое использование CML, а именно ускоренного его варианта, т. е. D-CML [Eijsvoogel V. et al., 1973; Garovoy M. et al., 1973]. Схема метода представлена на рис. 13 (см. 2.2.2).
Л. П. Алексеев (1978) оценивал с помощью этого теста киллерный эффект лимфоцитов реципиента по отношению к антигенам кадаверного трансплантата. В качестве антигенного материала были использованы спленоциты донора, сохраненные в криоконсервирующей среде, которые в дальнейшем служили мишенями в D-CML-тесте.
Было замечено, что в период стабильной функции аллотрансплантата киллерная активность лимфоцитов реципиента была невысока как по отношению к клеткам донора, так и по отношению к клеткам 3-го партнера. Однако при кризах отторжения наблюдалось специфическое возрастание киллерной активности Т-лимфоцитов реципиента только по отношению к клеткам донора (табл. 61).
Нами [Алексеев Л. П., Зарецкая Ю. М. и др., 1980] проведена оценка возможностей D-CML как теста иммунологического мониторинга кризов отторжения. Было определено, что средние значения киллинг-эффекта (19 случаев) по отношению к мишеням донорского генотипа составляли 5,4 ± 1,9%, в то время как в период криза отторжения (17 случаев) средние значения специфического киллинга соответствовали 28 ± 4,9%.
Во всех зарегистрированных случаях криза отторжения имела место активация D-CML; в период стабильной по клиническим показателям функции трансплантата активация D-CML имела место только в трех случаях. Коэффициент корреляции между активацией D-CML и манифестацией криза отторжения, вычисленный из "таблицы 2 × 2", оказался равным 0,85, что свидетельствует о высокой информативности D-CML как теста иммунологического мониторинга.
Таблица 61
D-CML как тест иммунологического мониторинга (по Л. П. Алексееву, 1978)
| Киллер-лимфоциты реципиента (фенотип HLA) | Мишени | Киллер-эффект (выход 51CR), % | ||
| принадлежность | фенотип HLA | стабильная функция трансплантата | криз отторжения | |
| A9, w25; B16, w22; Cwl | Донор | A2; B6, w22; Cw2 | 8,7; 9,5 | 38; 45; 54 |
| 3-й партнер | A2, w32 ; B27; w35; Cw2, Cw4 | 0,5; 1,3 | -1,2; -1,1 | |
| 3-й партнер | A2, w26 ; B13, 16; Cw? | -0,9 | -0,9; -6; -2; 0,5 | |
| A3, 9; B7, 18; Cwl, Cw4 | Донор | A3, w26; B7, wl2; Cw5 | 3,0; 5,0 | 29; 40 |
| 3-й партнер | Aw26; B5, 7; Cw2, Cw4 | 1,7 | 3,0 | |
| A2, w32; B27, w35; Cw2, Cw4 | Донор | A2, 11; Bw35; Cw4 | 6,42 | 32,5; 19,5 |
| 3-й партнер | Al, 11; B14; Cw? | 2,35 | 5,0; 6,5 | |
| A2, 10; Bw40; Cw2 | Донор | A2; B12, 40; Cw5 | 4,0 | 26 |
| 3-й партнер | A2; B12, 13; Cw5 | 4,5 | 7,0 | |
Далее нами изучены условия, которые следует расценивать как оптимальные для осуществления D-CML-мониторинга: соотношение между мишенями и киллерами и вид клеток-мишеней.
Испытание оптимального соотношения между мишенями и киллерами производили на донорских спленоцитах. Оказалось, что наиболее эффективный киллинг имеет место при соотношении мишеней и киллеров 1 : 25, хотя диапазон, при котором можно получить значимые цифры, значительно шире - от 1 : 100 до 1 : 10 (табл. 62).
Таблица 62
Влияние соотношения клеток-мишеней и киллеров на уровень реакции D-CML
| Количество исследований | Соотношение клеток-мишеней и киллеров; интенсивность реакции D-CML, % | ||||
| 1:100 | 1:50 | 1:25 | 1:10 | 1:5 | |
| 10 | 23,3±4,4 | 26,0±5,2 | 31,5±4,9 | 26,5±7,3 | 22,5±5,1 |
Для определения "оптимального" вида мишеней испытанию подверглись "замороженные-оттаянные" лимфоциты периферической крови и спленоциты донора, стимулированные ФГА.
Как следует из табл. 63, уровень киллинга при использовании спленоцитов в роли клеток-мишеней значительно превосходил таковой при использовании периферических лимфоцитов. Это обстоятельство очень важно в клинико-практическом отношении, так как селезенка донора более доступный материал, нежели периферическая кровь.
Таблица 63
D-CML при использовании в качестве мишеней периферических лимфоцитов и спленоцитов донора
| HLA-фенотип реципиента | HLA-фенотип донора | Уровень реакций D-CML, % | |
| при использовании в качестве клеток-мишеней спленоцитов | при использовании в качестве клеток- мишеней лимфоцитов периферической крови | ||
| HLA-A2, 10; B12 | HLA-A2, 10; B13, 27 | 22,5 | 16,5 |
| HLA-A1, 2; B8, 12 | HLA-A2; B12, w35 | 18,0 | 9,5 |
| HLA-A9, 25; B16, w22 | HLA-A2; B16; w22 | 38,0 | 23,0 |
| HLA-A2, w32; B27, w35; Cw2,4 | HLA-A2, 11; Bw39 | 32,5 | 18,0 |
| HLA-A3.9; B7, 18 | HLA-A3, w26; B7, 12 | 29,0 | 29,5 |
| М ± м | 28,0 ± 3,8 | 19,2 ± 3,9 | |
Таким образом, наши исследования показали, что D-CML является информативным тестом для диагностики кризов отторжения.
7.2.2. Мониторинг активности натуральных киллеров (NK-тест)
Как упоминалось выше, в крови человека обнаружены натуральные киллеры [Jondal М., Pross Н., 1975], обладающие спонтанной активностью in vitro, направленной против опухолевых клеточных линий аллогенной и ксеногенной природы (см. R. Floyd et al., 1979). Природа натуральных киллеров (NK) неизвестна; считают, что они не принадлежат ни к Т- или В-лимфоцитам, ни к макрофагам, ни к моноцитам; предполагается, что это специальный вид мононуклеаров, происходящих из костного мозга и независимых (автономных) от тимуса [Leibold М., Pater М., 1978].
Биологическая роль NK-клеток пока совсем не ясна. Поскольку in vitro они развивают активность преимущественно против опухолевых линий, предполагается, что in vivo они участвуют в контроле аберраций клеток, в контролировании элиминации клеток раннего опухолевого развития и в регуляции гомеостаза [Leibold W. et al., 1978; Floyd R. et al., 1979]. Выдвинуто предположение о возможном участии NK в отторжении аллогенного трансплантата [Leibold W., Peter М., 1978], осуществляемом или посредством прямого участия NK в киллинг-эффекте, или посредством "рекрутирования" специфических Т-киллеров в цитотоксический эффект; последний механизм был показан с использованием в качестве мишени опухолевых клеток линии К-562 [Masucci G. et al., 1980].
Мы предположили, что спонтанная активность натуральных киллеров, не примированная никаким антигенным стимулом, служит отражением нормальной активности гена иммунного ответа, постулируемого у человека (6. 3. 1), и в этом отношении должна испытывать флюктуации, зависящие от напряженности иммунных процессов в организме.
Удобство работы с NK заключается в том, что система мишеней при использовании, например, перевиваемых клеточных линий всегда стабильна, "нейтральна" по отношению к NK-клеткам, следовательно, интенсивность киллинга является исключительно функцией самих NK.
NK-тест был испытан нами (Ю. М. Зарецкая, Р. А. Бурханов) в иммунологическом мониторинге кризов отторжения. Ниже приведена модификация метода тестирования NK-активности, выполненная Р. А. Бурхановым на основе техники М. Jondal, S. Targan (1978) с использованием в качестве мишени миелоидной перевиваемой линии К-562, которая определена как высокочувствительная мишень в цитотоксическом тесте с NK [West W. et al., 1977; Collewart С. et al., 1979; Kail N.. Kokeh H., 1979].
Культивирование клеток-мишеней:
- клеточная линия К-562 выращивалась на культуральной среде. RPMI-1640 (Flow lab. U. К.), которую обогащали "добавками": 500 мл RPMI-1640 + 20mМ глютамина +20 mM Hepes (Serva) +100 ед/мл пенициллина +10 ед/мл стрептомицина или гентамицина; как сывороточную Добавку использовали инактивированную бычью сыворотку;
- в стерильный пенициллиновый флакон помещали 0,6 мл перевиваемой клеточной суспензии (содержащей 3 × 105 клеток), 0,6 мл инактивированной бычьей сыворотки и 1,8 мл среды RPMI-1640; флаконы инкубировали 4 сут при 37°С;
- на 4-е сутки культивирования, когда концентрация клеток достигала 5 × 105 в 1 мл, клетки перевивали в свежую среду.
Приготовление мишеней к опыту:
- клетки 2-го или 3-го дня культивирования осаждали центрифугированием при 150 g в течение 5 мин, ресуспендировали в свежей среде RPMI-1640 с добавлением 10% бычьей сыворотки; с помощью трипановой сини определяли процентное содержание жизнеспособных клеток, которое должно составлять не менее 95 - 97;
- 1 × 106 клеток метили 250 μCi51Cr (Na2CrO4) (92,5 × 105 БК) с удельной активностью 2 - 5 mCi/мМ (7,4 - 18,5 × 107 Бк) в объеме 0,5 мл, помещали в термостат и инкубировали в течение 1 ч при 37°С;
- клетки трижды отмывали в среде Хенкса с 5% бычьей сывороткой, центрифугируя при 150 g 5 мин; конечную концентрацию клеток доводили до 1 × 105 в 1 мл среды RPMI-1640 с 10% бычьей сывороткой.
Выделение киллеров:
- венозную кровь (6 мл) забирали в пенициллиновые флаконы с 0,2 мл 5% ЕДТА и разделяли в градиенте плотности фиколл/верографина (d = 1,077);
- полученную взвесь мононуклеарных клеток один раз отмывали в 8 мл фосфатного буфера (рН 7,2); две последующие отмывки производили в р-ре Хенкса + 5% бычьей сыворотки;
- определяли содержание жизнеспособных клеток с трипановой синью, которое не должно быть менее 95%; конечную концентрацию клеток доводили до 5 × 106/мл среды RPMI-1640 с добавлением 10% бычьей сыворотки.
Постановка NK-теста:
- клетки-мишени по 0,1 мл (1 × 104 клеток) раскапывали в лунки круглодонной панели фирмы "Соок" с учетом необходимого количества проб и объема опыта;
- клетки киллеры по 0,1 мл (0,5 × 106 клеток) раскапывали так, чтобы для каждой пробы исследуемой крови приходился свой ряд лунок; как опытные, так и контрольные пробы тестировали в триплете; к контрольным пробам вместо 0,1 мл суспензии киллеров добавляли 0,1 мл культуральной среды, соотношение клеток-мишеней и киллеров в опытных пробах соответствовало 1 : 50;
- на этапе раскапывания мишеней по 0,1 мл суспензии клеток заливали в центрифужные пробирки и хранили до окончания опыта; они служили для определения максимального включения 51Cr (М);
- панель помещали в инкубатор (37°С) с подачей 5% CO2 и относительной влажностью 100%, где инкубировали 16 ч;
- по окончании инкубации из лунок забирали 0,1 мл супернатанта, замеряли активность проб вместе пробами на γ-счетчике.
Подсчет цитотоксической активности:
- цитотоксическая активность NK-клеток выражалась в % с учетом общего включения 51Cr и его спонтанного выхода:
% лизиса = A - B/C - B × 100, где А - удвоенное среднее значение выхода 51Cr в трех опытных лунках; В - то же, но в контрольных лунках; С - 80% от общего включения 51Cr в 1 × 104 клеток (М)-мишеней (введение С рекомендовано М. Jondal, 1978).
Спонтанный выход 51Cr (В) при такой постановке опыта в среднем составлял 16% от значения С (1% в час).
Уровень N К-активности у здоровых людей (27 человек) составил в среднем 53,6 ± 3,7%, а у больных с синдромом хронической почечной недостаточности (ХПН), определенный на 36 пациентах, - 48,8 ± 3,5%.
Активность NK была изучена и у реципиентов с аллогенной почкой в разные сроки после трансплантации и при различном функциональном состоянии трансплантата. Всего реализовано 59 исследований NK-активности, начиная со 2-го по 60-й посттрансплантационный день.
На рис. 33 представлены все значения киллинг-эффекта, распределенные в "колонки" в соответствии с функциональным состоянием трансплантата. Сразу после операции NK-активность (1а) была значительно снижена, чем у здоровых людей и в дооперационном периоде. Причиной снижения активности у больных ХПН служила, как мы считаем, усиленная иммунодепрессивная терапия, используемая в первые послеоперационные дни. В период стабильной функции трансплантата (16), в предкризовом периоде (II) или при купировании криза (IV) отмечены флюктуации в значении средней NK-активности, однако они не были статистически значимыми; в целом в эти периоды NK-активность снижена по сравнению с нормой.
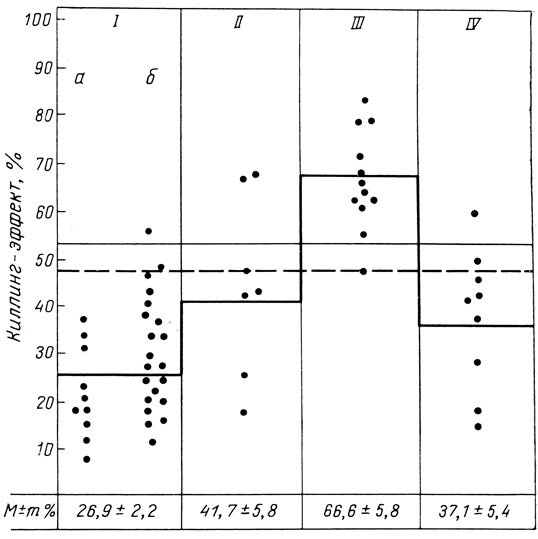
Рис. 33. Активность NK-клеток у реципиентов с аллогенным почечным трансплантатом (по Ю. М. Зарецкой, Р. А. Бурханову). Точками обозначены конкретные величины киллинг-эффекта. I - при стабильной функции трансплантата: а - в первые 2 нед после трансплантации, б - в более поздние сроки; II- в предкризовый период; III - в период криза отторжения; IV - после купирования криза. Сплошная линия - среднее значение киллинг-эффекта у здоровых людей,, штриховая - среднее значение киллинг-эффекта у больных с ХПН (до трансплантации)
NK-активность в период кризовых ситуаций резко повышена по сравнению с активностью в периоды стабильной функции трансплантата и значительно превышает средние значения NK-активности у здоровых людей. Определение достоверности различия между средними значениями NK-активности по критерию Стьюдента показало, что во всех случаях различие достоверно при 95% вероятности.
Перед каждой кризовой ситуацией, таким образом, мы отметили подъем NK-активности; коэффициент корреляции между подъемом NK-активности и наступлением криза отторжения показал их высокую взаимосвязь (табл. 64).
Таблица 64
Взаимосвязь повышения NK-активности с кризом отторжения трансплантата
| Повышение активности NK | ||||
| + | - | |||
| Криз отторжения | + | 15 | 0 | R = 0,78 |
| - | 7 | 65 | ||
При анализе подъема NK-активности перед кризом (табл. 65) возрастание киллинга соответствовало ≈20%, если предшествующий анализ NK-активности был произведен в предкризовый период, т. е. за 2 - 5 сут до клинической манифестации криза, и мог достигать 40% и более, если предшествующий анализ был произведен в период стабильной функции трансплантата (9 - 10 сут до криза).
Наши исследования показали, что NK-тест имеет значительную информативную ценность, позволяющую рекомендовать его в качестве теста для иммунологического мониторинга кризов отторжения. К преимуществам этого теста относятся простота постановки, позволяющая обследовать одновременно кровь от 6 - 10 индивидуумов, и быстрота получения ответа (на следующий день).
Таблица 65
Количественная оценка прироста NK-активности в кризовой ситуации, %
| Фамилия больного | NK-активность до криза | NK-активность в период криза | Прирост активности |
| П. | 43,3 (12)* | 66 (14) | 22,7 |
| К. | 6 (6) | 64,4 (15) | 58,4 |
| 58,5 (35) | 77,3 (40) | 19,5 | |
| 78,0 (44) | |||
| Б. | 58,5 (2) | 83,4 (7) | 24,0 |
| Г. | 42 (2) | 63,7 (7) | 21,7 |
| Б. | 35,6 (6) | 78,5 (16) | 42,9 |
| И. | 47,1 (4) | 65 (6) | 17,9 |
| З. | 26,4 (14) | 45,5 (22) | 19,1 |
*(В скобках - день после трансплантации, когда произведен анализ.)
7.2.3. Значение ADCC-теста в диагностике кризов отторжения
По-видимому, определенную перспективу (целиком пока не используемую из-за сложности реакции) имеет иммунологическое контролирование реакции антителозависимого лимфолиза (ADCC). Реакция, предложенная Q. Trinchieri (1973), выявляет киллерную активность лимфоцитов по наличию антител, специфичных к мишеням (см. 2.2.3).
F. Thomas et al. (1977) при использовании этого теста в мониторинге показали, что хроническое отторжение трансплантата связано с наличием позитивной ADCC.
Е. Etherag et al. (1979) нашли, что увеличение ADCC-активности по отношению к донорской ткани сопряжено с ухудшением выживаемости трансплантата и шансы выживаемости трансплантата падают еще более значительно, если позитивная ADCC сочетается с комплементзависимыми цитотоксическими антителами.
Сравнивая два теста, характеризующих киллерную активность лимфоцитов - CML и ADCC, С. Stiller и S. Sinclair (1979) установили, что коррелятивная связь между позитивной ADCC и кризами отторжения больше, чем связь кризов с MCL. P. Cauliunas и соавт. (1977) добавочно к ADCC проводили определение КЗЦТ в тесте с 51Cr и отметили хорошее совпадение этих двух показателей при кризах отторжения.
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'