
Глава V. Самоорганизация через циклический катализ: белки
§ V.1. Узнавание и ферментативный катализ
Прежде чем обсуждать вопрос о том, могут ли белки образовать самоинструктирующиеся системы, отметим некоторые из их свойств.
1. Как показано во введении (гл. I), имея двадцать видов аминокислот, можно образовать бесчисленное множество различных последовательностей (табл. 3), лишь небольшая часть которых могла бы образоваться случайно. С другой стороны, последовательности аминокислот не обладают внутренне присущей им способностью инструктировать образование идентичных или комплементарных последовательностей. Во всех тех случаях, когда нечто похожее на такую способность, казалось бы, имеется, как, например, в "складчатом слое", или в β-структурах, стабилизированных солевыми мостиками, или в других простых регулярных структурах с комплементарным расположением определенных аминокислот, как в коллагене, это оказывается следствием весьма специфического расположения аминокислот, а вовсе не свойством, присущим самим мономерам., как это было в случае нуклеиновых кислот. Такие специфические "инструктирующие" расположения лишены чрезвычайно важного свойства - способности мутировать. Ошибки здесь не смогли бы воспроизводиться. Кроме того, полипептидные цепи проявляют сильную тенденцию к свертыванию с образованием специфичной пространственной структуры, что очень мешало бы любому процессу прямого копирования.
2. Пространственная укладка, с другой стороны, лежит в основе способности белков узнавать специфичные структуры. Этой же уникальной особенностью определяются каталитические свойства ферментов при условии, что узнающие группы имеют, кроме того, согласованные каталитические функции. Для примера на рис. 10 и 11 изображен активный центр химотрипсина. Точное пространственное расположение функциональных групп было установлено лишь недавно методом рентгеноструктурного анализа [92].
![Рис. 10. Схематическое изображение конформации полипептидных цепей в а-химотрипсине [92]](pic/000377.jpg)
Рис. 10. Схематическое изображение конформации полипептидных цепей в α-химотрипсине [92]
![Рис. 11. Конформация некоторых боковых цепей аминокислот в активном центре а-химотрипсина, которая демонстрирует, что 'узнавание' белками - результат специфичной пространственной укладки, а не 'внутренне присущее' аминокислотам свойство [92]](pic/000378.jpg)
Рис. 11. Конформация некоторых боковых цепей аминокислот в активном центре α-химотрипсина, которая демонстрирует, что 'узнавание' белками - результат специфичной пространственной укладки, а не 'внутренне присущее' аминокислотам свойство [92]
Это прекрасный пример того, как функция может зависеть от очень сложной структуры, благодаря которой группы, находящиеся в совершенно различных местах последовательности аминокислот, оказываются рядом в строго определенном пространственном расположении. Колоссальное разнообразие специфичных участков узнавания демонстрируется также огромным числом различных антител, которые способны связывать любой гаптен, даже если этот гаптен никогда не контактировал с антителом в процессе эволюции. Далее, в лабораторных экспериментах было показано, что при случайном синтезе полипептидов возникает много каталитических функций, иногда очень специфичных (например, химотрипсиноподобная функция у полипептидов с беспорядочной структурой [93]). Эти продукты не образуются воспроизводимым образом. Даже если некоторые функции возникают воспроизводимо, их носителями оказываются совершенно различные и неродственные структуры.
3. Специфичное узнавание определенной макромолекулы ограничивается узнаванием коротких последовательностей или пространственных (третичных) структур, имеющих относительно малую протяженность. Так, некоторые ферменты (например, папаин [94]) расщепляют пептиды с определенными последовательностями аминокислот, тогда как другие ферменты синтезируют специфичные последовательности. Ф. Липман [95] и его группа недавно показали, что полный синтез грамицидина S (циклический декапептид) происходит при помощи одного только фермента, без участия нуклеиновых кислот. Этот фермент с молекулярной массой 280000, по-видимому, представляет собой сложную систему, состоящую из нескольких субъединиц. Во всяком случае, он функционирует в точности как "белковая матрица", соединяя АТФ-активированные аминокислоты в строго определенную последовательность
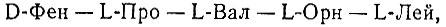
которая остается прикрепленной к белку тиоэфирной связью до тех пор, пока два законченных пентапептида не соединяются с образованием циклической молекулы грамицидина S. Таким образом, необходимо помнить, что специфичная и очень точная инструкция для образования белка может содержаться в самом белке, без участия кода нуклеиновых кислот. Такая инструкция, однако, пригодна только для образования относительно коротких последовательностей (например, пентапептидов). Тем не менее, имея в виду эту способность, можно представить себе систему ферментов, которые производят олигопептиды и затем специфично соединяют их друг с другом, пока после ряда стадий не получатся полные молекулы белка, способные, возможно, катализировать свое собственное воспроизведение.
4. По-видимому, в такой системе возможно очень точное регулирование. Поскольку для действия фермента необходимо точное пространственное расположение отдельных групп, свойства фермента могут сильно изменяться в результате конформационных изменений, вызванных связыванием индукторов или же взаимодействием с другими белками. Модели подобного регулирования функции ферментов были впервые предложены Ф. Жакобом и Ж. Моно [И]. Специальные механизмы были рассмотрены Ж. Шанжё, Ж. Моно и Дж. Уайманом [96], а также Д. Кошландом, Дж. Немети и Д. Филмером [97] и проверены исследованиями кинетики различных ферментативных реакций (например, К. Киршнер [98, 99] использовал релаксационные методы для исследования глицеральдегидфосфатдегидрогеназы). Было показано, что эти системы ферментов могут обладать всеми свойствами, присущими электронным регулирующим устройствам [73]. Поэтому любая самовоспроизводящаяся система, если она возникла, может обладать самыми сложными контрольными функциями.
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'