
2.3. Регуляторные последовательности эукариотического генома
Промоторы РНК-полимеразы II: TATA, CAAT и CG-блоки [67-70]. У эукариот собственно гены, или транскрибируемые отрезки ДНК, разделены между собою протяженными отрезками молчащей, нетранскрибируемой ДНК, которые были названы спейсерами, или разделителями. Однако из того, что эти участки не транскрибируются, отнюдь не следует, что они не играют никакой роли в транскрипции. Напротив, накапливается все более данных, что именно преимущественно в спейсерах располагаются те сегменты ДНК, которым принадлежит решающая роль в регуляции работы генов, т. е. в регуляции транскрипции.
Когда была определена первичная структура ряда эукариотических генов, авторы начали сравнивать между собою нуклеотидные последовательности, расположенные перед разными генами. Д. Хогнесс (США) обнаружил, что за 20-30 п. н. перед сайтом кэпирования (т. е. точкой начала транскрипции), как правило, лежит последовательность, которая в усредненном виде имеет структуру TATAAATA. По краям она обычно обрамлена короткими участками, обогащенными G и С. Первоначально эта последовательность была обозначена как "Hogness box", или блок Хогнесса, но затем за ней закрепилось название "ТАТА-box", или ТАТА-блок. Оказалось, что в полном виде она часто отсутствует, и наиболее характерным является сочетание TATA или TATAAA.
Поскольку ТАТА-блок расположен недалеко от точки начала транскрипции, можно было ожидать, что он выполняет функции промотора, т. е. элемента, связывающего РНК-полимеразу. Действительно, некоторые мутации в ТАТА-блоке, например замены А на G, часто резко снижают уровень транскрипции гена.
М. Бирнстил в Швейцарии изучил роль ТАТА-блоков в транскрипции на следующей остроумной системе. В ядра овоцитов лягушки вводили путем микроинъекции кольцевые ДНК, содержащие гены гистонов морского ежа, после инкубации из них выделяли РНК и определяли содержание в ней транскриптов с гистоновых генов морского ежа. Кроме того, определяли точки начала транскрипции. Оказалось, что в овоцитах лягушки гистоновые гены морского ежа правильно транскрибируются, т. е. транскрипт начинается с того же нуклеотида, что и в клетках морского ежа. Далее из гена был удален участок, содержащий ТАТА-блок. При этом уровень синтеза мРНК остался почти неизмененным, но вместо одной точки инициации появилось несколько новых, т. е. нарушилась специфичность инициации. Был сделан вывод, что ТАТА-блок определяет точное место начала транскрипции. Возможно, что он связывает белковые факторы при взаимодействии с которыми РНК-полимераза II приходит в активное состояние, состояние готовности к началу транскрипции.
Следует отметить, что не все гены имеют ТАТА-блок. В некоторых генах вместо ТАТА-блока лежит последовательность, сильно отличающаяся от него, но в то же время точно определяющая место начала транскрипции. В других случаях (например, поздние гены SV40) отсутствие ТАТА-блока ведет к тому, что транскрипция гена начинается с нескольких разных мест.
Помимо ТАТА-блока, во многих, но не во всех случаях, еще дальше от сайта кэпирования в области -40-100 п. н. располагается СААТ-блок, название которого отражает его усредненную структуру, ССААТ. (Здесь и далее используются обозначения областей перед геном числом со знаком (-), считая нулевой точкой отсчета сайт кэпирования, т. е. точку старта транскрипции.) Удаление области, содержащей СААТ-блок, часто резко снижает уровень транскрипции.
Наконец, перед многими генами, которые активны во всех типах клеток организма (house-keeping genes, или гены домашнего хозяйства), часто выявляется последовательность CCGCCC или соответственно GGGCGG (CG-блоки). Иногда встречается несколько таких блоков. Они расположены в той же области, что и СААТ-блок,и являются важными элементами транскрипции. Вероятно, CG-блоки как СААТ-блок, можно считать составным элементом ряда промоторов РНК-полимеразы II.
TATA, CAAT и CG-блоки обнаружены только перед генами, транскрибируемыми РНК-полимеразой II. Транскрипция генов, считываемых РНК-полимеразой III, вообще не зависит от последовательностей, расположенных перед геном, а определяется промотором, который лежит внутри этих генов и состоит, в случае генов тРНК, из двух блоков, разделенных отрезком ДНК длиной ∼20 п. н. Первый блок начинается через 8-30 п. н. после точки инициации траскрипции и представлен в усредненном виде последовательностью TGGCNNAGTGG. Усредненная последовательность для второго блока - (+51-+72) GGTTCGANNCC. Таким образом, промотор для РНК-полимеразы III - это в большинстве случаев расчлененный промотор.
Промотор для РНК-полимеразы I охарактеризован недостаточно хорошо. Удаление последовательностей, расположенных на том или ином расстоянии перед началом транскрипции рРНК, ведет во многих случаях к резкому снижению уровня синтеза рРНК. Однако эти участки у разных видов имеют разную структуру. Поэтому хотя участки спейсеров, соответствующие по своим свойствам промоторам, удается выявить, но невозможно дать для них усредненную последовательность.
В целом следует отметить определенное сходство между организацией промотора у эукариот и у бактерий. У эукариот наиболее важными элементами промотора являются ТАТА-блок и часто СААТ-блок, расположенные на расстоянии -25 и -40- -100 п. н. от стартовой точки.
У бактерий им соответствует блок Прибнова (ТАТААТ), расположенный примерно за 10 п. н. от старта, кстати очень похожий по последовательности на ТАТА-блок, и элемент -35 (TGTTGACA), расположенный за 35 п. н. от старта.
Однако у эукариот, как видно из дальнейшего изложения, существуют еще другие регуляторные элементы, обладающие рядом необычных свойств, для которых у бактерий нет аналогов. Речь идет об энхансерах и сайленсерах.
Открытие энхансеров [71, 72]. После того как М. Бирнстил и сотр. обнаружили, что уровень транскрипции изучаемого ими гистонового гена в овоцитах лягушки почти не меняется после удаления ТАТА-блока, они исследовали влияние на уровень транскрипции других участков ДНК, лежащих перед геном. Неожиданно оказалось, что при вырезании более удаленной от гена области, расположенной за 185 п. н. от сайта кэпирования, происходит примерно 100-кратное снижение уровня транскрипции гена. Иными словами, был открыт мощный позитивный регуляторный элемент в составе гистонового гена.
Сразу же было установлено, что этот элемент обладает двумя исключительно интересными свойствами. Его можно было поставить на то же место, где от был, но при этом изменить его ориентацию относительно гена на противоположную, и тем не менее активность гена при этом полностью восстанавливалась. Более того, активный фрагмент ДНК можно было встроить не перед геном, а за геном и опять-таки получить восстановление уровня транскрипции. Таким образом, расположение и ориентация открытого регуляторного элемента не играли решающей роли для его функционирования. Важно лишь было, чтобы он был физически соединен с геном (цис-элемент). Эта последовательность была названа "модулятором".
Вскоре после этого В. Шаффнер и сотр. (Швейцария) провели опыты по изучению контроля транскрипции ранних генов вируса SV40 (рис. 10). К клеткам культуры добавляли ДНК вируса и изучали в них синтез Т-антигена, основного продукта "ранней области" генома вируса. Это было возможно благодаря проникновению части добавленной ДНК в ядра клеток. Опять-таки исследовали влияние вырезания разных участков вирусной ДНК на работу гена. Было найдено, что удаление участка, расположенного от - 110 до -260 п. н. по отношению к раннему гену, снижает активность гена примерно на два порядка. Область генома вируса SV40, обладавшая регуляторной активностью, включала в себя две повторяющиеся последовательности длиной в 72 п. н. каждая, которые поэтому обозначают как 72 п. н.- повторы. За ней располагаются три повторяющиеся последовательности длиной по 24 п. н. (24 п. н.- повторы). Удаление двух 72 п. н.- повторов полностью инактивировало регуляторный элемент, в то время как удаление одного из 72 п. н.- повторов вообще не влияло на его активность. Как и в опытах с гистоновым геном, изменение ориентации элемента 72 п. н. или его встраивание после гена не влияло на его активирующее транскрипцию действие. Также и вставка других последовательностей между 72 п. н.- повтором и геном не снимала его эффект, хотя в некоторых случаях и несколько снижала его. Авторы назвали открытый ими элемент энхансером, или усилителем, и это название вытеснило затем термин модулятор.
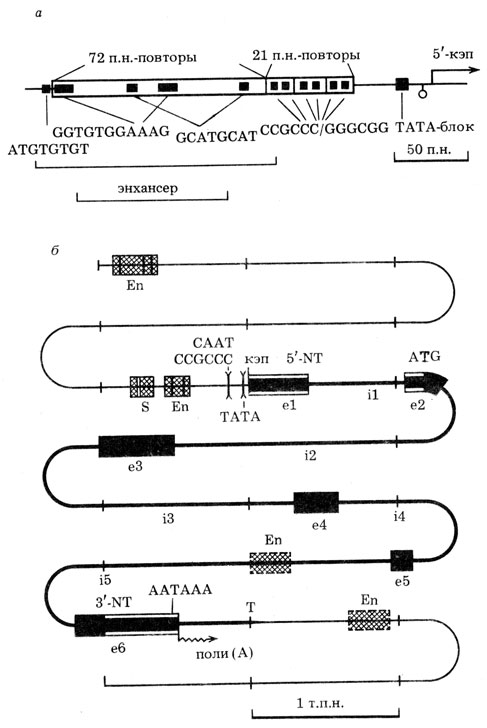
Рис. 10. Регуляторные последовательности эукариотического генома. а - регуляторные последовательности эукариотического вируса SV40. Черными прямоугольниками даны 'сердцевинные' последовательности энхансера и важнейшие элементы промотора (по результатам, полученным В. Шаффнером и соавт.); б - схема 'усредненного' эукариотического гена, состоящего из 6 экзонов (е) и 5 интронов (i) (в масштабе). Указаны энхансеры (En) и сайленсер (S) с их сердцевинными последовательностями (блоки внутри), возможные локализации энхансеров, элементы промотора, нетранслируемые области (5'-НТ и 3'-НТ) гена, инициирующий кодон (AUG)
Итак, под энхансером понимают генетический цис-элемент, обладающий усиливающим транскрипцию действием, которое практически не зависит от расположения элемента относительно контролируемого им гена. Подобные контрольные элементы не были известны у прокариот и их открытие указывало на существование особого типа регуляции транскрипции у эукариотических организмов.
По мере изучения экспрессии разных генов оказывалось, что почти у каждого гена есть свой энхансер, а иногда и несколько. Это общее свойство эукариотических генов, и оно заслуживает поэтому более подробного рассмотрения.
Методы изучения регуляции транскрипции. Прежде всего следует остановиться на основных методических подходах для изучения регуляции транскрипции у эукариот. В работе, как правило, используются клонированные гены, в которые вносят те или иные структурные изменения. В простейшем случае, о котором речь шла выше, можно вырезать какой-либо фрагмент ДНК с помощью подходящих рестриктаз и лигировать (сшить) между собой концы с помощью другого фермента, ДНК-лигазы. Можно, наоборот, встроить в то или иное место клонированной ДНК другие последовательности, разрезая ДНК в этом месте рестриктазой и затем вшивая туда вставку лигазой. Для вырезания более коротких блоков ДНК используют экзонуклеазную реакцию. После расщепления плазмиды рестриктазой в одной точке ее обрабатывают экзонуклеазой, разрушающей одну из цепей ДНК с ее свободного конца (3' или 5'). Реакцию можно вести так, чтобы удалить желаемое число нуклеотидов ДНК. Затем нуклеазой S1 удаляют одноцепочечные "хвосты" и лигируют концы ДНК.
Можно не удалять сегменты ДНК, но вносить в них нуклеотидные замены. Для этого существует много способов. Например, можно синтезировать олигонуклеотид, имеющий ту же последовательность, что и сегмент исследуемого гена, но с одной нуклеотидной заменой. Если этот фрагмент сгибридизовать с одноцепочечной ДНК плазмиды или фага и затем достроить ДНК до полной двухцепочечной копии ДНК-полимеразой I, то при заражении бактерий такой ДНК будут получены колонии, содержащие нормальную, и колонии, содержащие измененную, мутантную ДНК- В настоящее время имеется много других методов, позволяющих вносить любые желаемые изменения в ДНК и затем с помощью клонирования нарабатывать эту измененную ДНК в больших количествах.
Второй этап исследования - это введение ДНК в ту или иную систему транскрипции. Простейшей системой являются экстракты, приготовленные из клеток или из изолированных ядер, способные инициировать и вести транскрипцию. Однако уровень транскрипции в них невысок, и часто эффекты, выявляемые in vivo, с экстрактами наблюдать не удается. Другой подход включает инъекцию ДНК в ядра крупных клеток, например овоцитов лягушки (М. Бирнстил, Швейцария) или вьюна (М. Я. Тимофеева, Институт молекулярной биологии АН СССР). Введенная ДНК "одевается" белками и далее может активно транскрибироваться в овоцитах. Недостатком системы является ее гетерологичность, так как обычно работают с генами из других организмов, и ограниченность. Третья, широко используемая система - это временная экспрессия при трансфекции. Для этого ДНК добавляют в культуру клеток и вызывают ее проникновение внутрь их путем обработки фосфатом кальция или с помощью электрошока. Проникая в ядра клеток, ДНК траскрибируется в них в течение большего или меньшего промежутка времени. При этом можно использовать гомологичные системы. Минусом является низкий уровень синтеза, так как количество вошедшей в клетки экзогенной ДНК весьма невелико. Наконец, наиболее сложным, но, видимо, и наиболее адекватным методом является получение трансгенных животных. Для этого в ядра оплодотворенных яйцеклеток мыши или других млекопитающих или в эмбрионы дрозофилы вводят клонированную ДНК, а затем получают полноценных животных (для млекопитающих необходима имплантация яйцеклеток в матку). Многие из полученных животных оказываются со встроенным в них чужеродным геном. Экспрессию последнего можно легко изучать в разных органах и тканях.
На третьем этапе опыта, а именно для изучения работы гена также существуют различные подходы. Один из них - выявление синтеза белка, кодируемого геном. Для этого часто используются иммунологические методы анализа, позволяющие легко выявлять белок, к которому есть антитела. Иногда в конструкции ДНК удаляют свой ген, а на его место встраивают ген фермента хлорамфеникол-ацетилтрансферазы (CAT), экспрессию которого очень легко детектировать по ферментативной активности, проводя реакцию с меченым субстратом.
Другим походом к изучению экспрессии гена является исследование транскрипции. Наиболее часто используемый метод - анализ с помощью нуклеазы S1, разрушающей одноцепочечную ДНК и РНК (Sl-анализ). Для проведения S1-анализа РНК, выделенную из системы, гибридизуют с высокомеченным рестриктным фрагментом ДНК, подобранным так, чтобы он включал область начала транскрипции. Гибриды обрабатывают нуклеазой S1 и после электрофоретического разделения выявляют меченые фрагменты ДНК, устойчивые к нуклеазе S1. Таким способом можно не только количественно определить уровень синтеза данной РНК, но и правильность инициации транскрипции. Существует еще много других вариантов анализа, которые здесь не рассматриваются.
Свойства энхансеров [71-80]. Весь перечисленный арсенал методов позволил детально изучить свойства энхансеров.
Прежде всего энхансеры - это цис-элементы. Они активны только в том случае, если находятся в составе одной и той же молекулы ДНК с регулируемыми ими генами.
Энхансеры не обладают полярностью. Их ориентацию можно менять, не снижая практически их активность.
Местоположение энхансеров также можно менять в довольно широких пределах. Уже отмечалось, что энхансеры можно переносить в места, расположенные за геном, за его 3'-концом. Можно также удалять энхансер от 5'-конца гена, вставляя между ними другие последовательности ДНК- Правда, если при этом будет встроен ТАТА-блок, то в ряде случаев может произойти переключение транскрипции - она будет начинаться с последовательности, расположенной сразу же за этим новым ТАТА-блоком Уровень же правильной транскрипции соответственно снизится.
И в природе энхансеры могут занимать разное положение относительно гена. Чаще всего они располагаются перед геном на расстоянии в несколько сотен пар нуклеотидов от сайта кэпирования. Последнее время появляется много сообщений об энхансерах, расположенных на гораздо большем расстоянии, в позициях -3- -6 т. п. н.
В нескольких случаях энхансеры были обнаружены в интронах. Классическим примером являются энхансеры генов для тажелых цепей иммуноглобулинов, которые лежат в интроне, разделяющем экзоны, кодирующие вариабельную и константные части иммуноглобулинов. Описаны случаи, когда энхансеры лежат со стороны 3'-конца гена. Наконец иногда свойствами энхансера обладают кодирующие последовательности генов. Такая ситуация описана для одного из гистоновых генов морского ежа и для α-глобинового гена.
Энхансер безразличен по отношению к тому гену, который он регулирует. Вместо своего гена можно, например, подставить ген CAT из бактерий, и его транскрипция будет в такой же мере активироваться энхансером, как и транскрипция его "родного" гена.
Энхансеры обладают слабой видовой специфичностью. Они способны проявлять свою активность в клетках отдаленных видов: например, энхансер гистоновых генов морского ежа работает в клетках лягушки, энхансер гена теплового шока дрозофилы - в клетках млекопитающих. Тем не менее в "своих" клетках энхансеры работают несколько лучше. Энхансер обезьяньего вируса SV40 в 3 раза более активен в клетках обезьяны, чем в клетках мыши, а энхансер вируса лейкоза мышей - наоборот.
В то же время некоторые, хотя далеко не все энхансеры проявляют выраженную тканевую специфичность. Так, энхансер гена тяжелых цепей иммуноглобулинов активен исключительно в лимфоидных клетках, а энхансер глобиновых генов - только в клетках эритроидного ряда. Большинство генов, избирательно работающих в определенных дифференцированных клетках, содержат энхансеры, активные только в соответствующих клетках. Иными словами, энхансеры выступают как важный фактор дифференцировки. Наряду с тканеспецифичными существуют энхансеры с широким спектром действия, как, например, энхансер вируса SV40.
Энхансеры варьируют в широких пределах по силе своего действия. Есть слабые, активирующие транскрипцию всего в несколько раз, и сильные, эффект которых измеряется двумя или тремя порядками. Наиболее сильным из известных в настоящее время является энхансер цитомегаловируса.
Один ген может содержать несколько энхансеров, различающихся по своим свойствам. Например, гены, кодирующие лизоцим, альбумин, овальбумин и ряд других, содержат по крайней мере по два энхансера. Один, расположенный недалеко от сайта кэпирования, обеспечивает тканевую специфичность работы гена, но лишь довольно слабо активирует транскрипцию. Другой энхансер, расположенный за несколько тысяч пар нуклеотидов (3-7 т. п. н.) перед сайтом кэпирования ("дальний энхансер"), обладает очень сильной стимулирующей активностью, обеспечивая высокий уровень экспрессии гена.
Наконец, энхансеры могут контролироваться различными клеточными факторами, например гормонами. Так, у вируса рака молочных желез мышей в энхансере имеется несколько последовательностей, узнаваемых глюкокортикоидным рецептором. Удаление этих последовательностей инактивирует энхансер. В то же время активирующее действие энхансера проявляется только в присутствии соответствующего гормона.
Таким образом, энхансеры - это большая и разнообразная группа регуляторных элементов клетки, способных обусловить тонкую и разнообразную регуляцию работы генов.
Структура энхансеров [75-76]. Естественно, возник вопрос о структуре энхансеров и о роли этой структуры в их активности. Простое сравнение нуклеотидных последовательностей выявляет существование некоторых коротких последовательностей, сходных для различных энхансеров. Однако для установления связей между структурой и функцией были проведены однозначные опыты по мутагенезу энхансера путем внесения в последний делений или нуклеотидных замещений. Тем самым удается определить границы энхансера и выявить в его составе функционально активные элементы.
Границы энхансера в большинстве случаев оказываются размытыми. С какого-то места удаление или замещение нуклеотидных последовательностей вызывает постепенное уменьшение активности энхансера.
Обычно, однако, в энхансере выявляются дискретные области, мутации в которых резко понижают его активность. Часто такие области соответствуют зонам гомологии между разными энхансерами. Таким образом были выделены активные блоки или энхансерные сердцевинные последовательности. Сюда относится, например, последовательность CGTGTGGAAAG, выявленная в энхансере SV40 (в 72 п. н.- повторе). В усредненном виде (GGTGTGGTTT AAATTTG) она встречается и в целом ряде других энхансеров, например вируса полиомы или вируса саркомы мышей. Кроме нее, в энхансере SV40 выявлено еще две сердцевинные последовательности, содержащие чередующиеся пурины и пиримидины: ATGTGTGT и GCATGCAT (см. рис. 10).
Другая консервативная последовательность выявляется в энхансерах разных генов теплового шока. Ее структура G- -GAA- -TTC- -G. Обнаружены характерные последовательности в составе металлотионеиновых энхансеров и энхансеров, реагирующих на глюкокортикоиды. По-видимому, в ближайшее время число таких "энхансерных сердцевин" сильно возрастет.
Иногда энхансер включает в себя сразу несколько разных консервативных сердцевин, встречающихся в других энхансерах. Сюда относится, например, энхансер цитомегаловируса, который в настоящее время является самым сильным из известных энхансеров.
Между блоками энхансеров часто наблюдается синергизм в действии. Так, повреждение каждого из консервативных блоков энхансера SV40 снижает эффект от энхансера в 4-5 раз, а повреждение сразу двух - примерно в 100 раз.
Интересно, что если синтезировать ДНК, в которой просто повторен несколько раз один из эссенциальных блоков, например GGTGTGGAAAG, то такая синтетическая последовательность может успешно заменять природный энхансер. Если блок повторен 8 раз, то активность синтетического энхансера и 72 п. н.- повтора одинаковы. Таким образом, по крайней мере, некоторые энхансеры имеют модульную организацию.
К вопросу о природе этих модулей и вообще о механизме работы энхансеров мы вернемся в гл. 4.
Здесь отметим лишь еще одно, по-видимому, весьма важное свойство энхансеров, которое, правда, еще не распространено на все энхансеры. В опытах с иммуноглобулиновыми генами были получены клеточные мутанты миеломы (опухолевые клетки, активно синтезирующие иммуноглобулин), в которых энхансер был утрачен (делеция), но это никак не сказывалось на уровне транскрипции гена. Если же таким геном трансфецировать клетки, он оказывается полностью неактивным. Чтобы сделать ген активным, к нему надо снова подшить энхансер. Иными словами, роль по крайней мере некоторых энхансеров сводится к включению транскрипции гена, но не к поддержанию ее. Обобщение этого положения требует, однако, дальнейших исследований.
Сайленсеры, или ослабители транскрипции [81-83]. Вскоре после энхансеров обнаружили последовательности, по своим свойствам весьма напоминающие энхансеры, но имеющие, так сказать, обратный знак. Это сайленсеры - элементы, угнетающие транскрипцию, элементы негативного контроля.
Сайленсеры выявляются по активации транскрипции, после того как из клонированного сегмента генома удаляют определенную последовательность. В настоящее время описан целый ряд последовательностей такого типа. Например, сайленсер перед геном овальбумина кур содержит участок связывания глюкокортикоидного рецептора. В присутствии гормона достигается высокий уровень экспрессии гена. Однако если удалить отрезок ДНК, содержащий сайленсер, то тот же высокий уровень транскрипции гена получается и в отсутствие гормона. Вообще, синтез РНК становится независимым от добавления гормона, переходя из индуцибельного в конститутивный. Следовательно, сайленсер в данном случае выступает в качестве негативного элемента транскрипции, ингибирующее действие которого на транскрипцию преодолевается, однако, при связывании гормон-рецепторного комплекса.
Сайленсеры обладают многими общими свойствами с энхансерами. Они могут действовать на большом расстоянии от гена. Их ориентацию можно менять, не меняя при этом их действие. Как и энхансеры, они обладают только цис действием, влияя на гены, находящиеся в той же молекуле ДНК, что и сайленсер.
Механизм действия как сайленсеров, так и энхансеров пока не известен. Ряд возможностей рассматривается в гл. 4.
Сигналы терминации транскрипции [84]. Терминация транскрипции генов у эукариот - это пока довольно плохо изученный процесс. Ясно, однако, что он происходит за пределами собственно гена в области спейсера.
Это было впервые показано Дж. Дарнеллом (США), который выделил клеточную РНК после очень короткой инкубации клеток с меченым предшественником (порядка 1 мин) и затем исследовал гибридизацию этой РНК с фрагментами клонированной аденовирусной ДНК или ДНК глобинового гена (в зависимости от типа изучаемых клеток). Все фрагменты гена связывают метку пропорционально своей молекулярной массе, что указывает на более или менее равномерное движение РНК-полимеразы вдоль матрицы. Оказалось, однако, что и участок, расположенный сразу за местом, соответствующим 3'-концу мРНК, т. е. за сайтом полиаденилирования, тоже связывает вновь синтезированную РНК с той же эффективностью. Следовательно, он, так же как и участок собственно гена, прочитывается РНК-полимеразой. Контролем служит участок генома перед сайтом кэпирования, который совсем не связывает меченую РНК.
Лишь примерно через 1 т. п. н. располагается участок, в котором связывание меченой РНК на единицу длины . ДНК падает в 3 раза, а следующие за ним отрезки вообще не гибридизуются с РНК. Более подробный анализ области с пониженным связыванием РНК показывает, что синтез РНК обрывается не в одной определенной точке, но затухает в пределах отрезка длиной около 1 т. п. н. Для разных генов длина этой зоны терминации и ее расстояние от сайта полиаденилирования сильно варьирует, но принципиальная схема во всех случаях остается одной и той же.
Эксперименты с разными искусственными конструкциями показывают, что для терминации транскрипции нужно существование в геноме зоны терминации и обязательно расположенного перед нею сайта полиаденилирования. Если последний убрать, то транскрипция идет за зону терминации. В то же время зону терминации можно удалять и приближать к сайту полиаденилирования, и терминация все равно будет происходить в ее пределах.
Нуклеотидные последовательности зон терминации, прилежащих к разным генам, содержат ряд гомологичных областей, однако в настоящий момент вопрос о природе сигналов терминации остается открытым. Для этого необходимы опыты по мутагенезу в зонах терминации.
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'