
3.1.7. Гены-модификаторы
До сих пор мы рассматривали только моногенно контролируемые признаки. Однако на фенотипическое проявление одного гена обычно влияют другие гены. Эксперименты на животных, особенно на млекопитающих, показывают важность генетического фона. Один из способов преодолеть аналитические трудности, связанные с наличием такой изменчивости, состоит в использовании инбредных линий.
Генетический фон - довольно расплывчатое понятие, но в ряде случаев можно показать, что на пенетрантность или экспрессивность определенного гена оказывает влияние другой ген. Когда подразумевается влияние на экспрессивность, то соответствующий ген называют "геном-модификатором". Когда проявление гена подавляется полностью (т. е. он фенотипически не проявляется), используют термин "эпистаз" (или "гипостаз" в отношении подавленного гена). У экспериментальных животных известны случаи, когда взаимодействие двух мутаций по разным локусам приводит к совершенно новому фенотипу. Классическим примером служит взаимодействие генов, определяющих "розовидную" и "гороховидную" формы гребня у кур. В результате такого взаимодействия гомозиготы по обеим мутациям имеют гребни "ореховидной" формы. Насколько нам известно, подобная ситуация у человека не описана, хотя сведения о генах-модификаторах и эпистатических генах публиковались.
Гены-модификаторы в системе групп крови ABO. Наиболее детально изучено влияние генов-модификаторов в системе групп крови ABO. Наличие ABH-антигенов в слюне (или других секретах) зависит от секреторного гена Se. Рецессивные гомозиготы se/se не являются секреторами, гетерозиготы Se/se и гомозиготы Se/Se - секреторы. Следовательно, se - рецессивный ген-супрессор. Другие редкие супрессорные гены и вовсе подавляют экспрессию ABH-антигенов на поверхности эритроцитов.
Бхенде и др. (1952) [576] обнаружили фенотип, который они назвали "Bombay" (Бомбей). В этом случае эритроциты не агглютинируются ни одной из антисывороток анти-A, анти-B или анти-H, хотя сыворотка содержит все три агглютинина. Позже была описана другая семья, в которой носители этого необычного фенотипа имели нормальные АВО-аллели, но их проявление подавлялось. В дальнейшем было показано, что экспрессия антигена А также может быть подавлена, а имеющиеся семейные данные свидетельствуют об аутосомно-рецессивном типе наследования. В родословной, представленной на рис. 3.20, родители пробанда являются двоюродными сибсами.
![Рис. 3.20. Бомбейский тип антигена В, экспрессия которого подавлена рецессивным геном X (Blende и др., 1952 [576]). Обратите внимание, что мать (II.6) с группой крови 0 имеет ребенка A1B](pic/000147.jpg)
Рис. 3.20. Бомбейский тип антигена В, экспрессия которого подавлена рецессивным геном X (Blende и др., 1952 [576]). Обратите внимание, что мать (II.6) с группой крови 0 имеет ребенка A1B
Описанный локус не сцеплен с ABO. Пара генов обозначается H, h, гомозигота с фенотипом Бомбей - h/h. В зависимости от того, какой аллель подавлен, фенотип обозначают OhA1, OhA2 или OhB. Бомбейский фенотип имеет частоту примерно 1 на 13000 среди индусов, говорящих на языке махарати и живущих в окрестностях Бомбея. Он распространен также в изоляте на острове Реюньон [679]. По-видимому, признак детерминирован нарушением фермента, модифицирующего общий предшественник в антиген H, который в свою очередь является предшественником антигенов A и B [93; 116; 931]. Предполагается также наличие еще одной пары аллелей Yy, редкие гомозиготные комбинации которой частично подавляют экспрессию антигена A. Данные о семьях с таким фенотипом опубликованы.
Гены-модификаторы, ограниченные полом. Для других, более сложных фенотипов эффекты генов-модификаторов можно выявить статистическими методами.
Холдейн (1941) [697] пытался идентифицировать такие гены при хорее Гентингтона, используя семейные данные [565а]. Харрис (1948) [702а) исследовал ту же проблему при диафизарной аплазии (13370) - заболевании, которое проявляется множественными хрящевыми экзостозами вблизи эпифизарного хряща.
Тип наследования доминантный, однако заболевание встречается примерно в два раза чаще у мужчин, чем у женщин. В некоторых семьях оно может передаваться через здоровых женщин, но не через здоровых мужчин. Результаты статистического анализа обширных семейных данных, собранных Стоксом и Баррингтоном (1925) [901], позволяют предположить по крайней мере в части семей независимую сегрегацию фактора, определяющего неполную пенетрантность основного гена только у женщин, - ген-модификатор, ограниченный полом.
Модификация другим аллелем: антиципация (опережение). Фенотипическое выражение гена может быть модифицировано не только генами других локусов, но и нормальным аллелем. Такой пример дает генетика резус-фактора (разд. 3.5.4). Некоторые образцы крови при тестировании с сывороткой анти-RhD не дают ни строго положительной, ни строго отрицательной реакции, точнее, дают слабо положительную реакцию. Их называют Du. В большинстве случаев этот эффект обусловлен специфическим аллелем, но имеются исключения. В нескольких семьях реакция Du наблюдалась только у тех членов семьи, в генотипе которых гомологичный аллель был представлен гаплотипом Cde (рис. 3.21). С помощью дополнительного статистического анализа была показана аллельная модификация при доминантно наследующейся миотонической дистрофии (16090). При этом медленно прогрессирующем заболевании миотония сочетается с относительно мягкой мышечной дистрофией и катарактой. Это заболевание обнаруживает необычную степень варьирования возраста начала. Обследование обширной родословной, проведенное Беллом (1947) [566], обнаружило следующие особенности. У больных из ранних поколений родословной катаракта проявлялась в середине жизни и часто была единственным патологическим симптомом. С другой стороны, в последующих поколениях часто наблюдалась более тяжелая форма заболевания, с более ранним проявлением.
![Рис. 3.21. Модификация гомологичным аллелем в системе Rh. ● - D-положительная кровь с нормальной реакцией; © - слабая реакция (Du-вариант), ○ - D-отрицательная кровь. Гаплотип Cde снижает экспрессию фактора D, в результате этого формируется фенотип Du. [605]](pic/000148.jpg)
Рис. 3.21. Модификация гомологичным аллелем в системе Rh. ● - D-положительная кровь с нормальной реакцией;
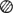 - слабая реакция (Du-вариант), ○ - D-отрицательная кровь. Гаплотип Cde снижает экспрессию фактора D, в результате этого формируется фенотип Du. [605]
- слабая реакция (Du-вариант), ○ - D-отрицательная кровь. Гаплотип Cde снижает экспрессию фактора D, в результате этого формируется фенотип Du. [605]На первый взгляд эти родословные свидетельствуют о явлении, считавшемся важным в доменделевскую эпоху медицинской генетики, - об антиципации. Существовало представление, что наследственные заболевания начинаются раньше и протекают тяжелее в последующих поколениях. Вайнберг первым показал, что это представление - статистический артефакт. Родословные обычно собираются через пробанда или пробандов в младших поколениях. Однако среди больных в родительском поколении будут зарегистрированы только те, у кого есть дети, и, следовательно, эти родители в большинстве случаев будут иметь более легкую форму заболевания, чем бездетные родители.
Данные по миотонической дистрофии были проанализированы Пенроузом (1948) [836]. Он обнаружил, что корреляция по возрасту начала заболевания между родителями и детьми более низкая (r=0,32), чем между сибсами (r=0,66).
В качестве возможных "причин" антиципации можно рассматривать пять факторов:
- Отбор пораженных родителей с поздним проявлением заболевания. Только те пораженные, которые достигли взрослого возраста, могут иметь детей.
- Отбор пораженных детей с ранним проявлением заболевания. Это вполне реальная причина, поскольку в поле зрения медиков попадают обычно только пораженные с клинически выраженными формами заболевания.
- Отбор случаев с одновременным началом заболевания у родителей и детей вследствие ограниченности во времени клинико-генетических исследований. Смещение за счет этого фактора будет особенно существенным.
- Любое из упомянутых выше смещений может порождать ложную антиципацию, если корреляция по возрасту начала заболевания между родителями и детьми слабая.
- Общая изменчивость возраста начала заболевания.
Таблица корреляций родитель - ребенок по возрасту начала миотонической дистрофии (табл. 3.2) оказалась несимметричной. Заметно некоторое различие между возрастом начала заболевания у родителей и детей в интервале 20-40 лет. По-видимому, оно вызвано смещением вследствие регистрации семей с одновременным началом заболевания у родителей и детей. Следовательно, эта таблица предлагает правдоподобное объяснение кажущейся антиципации.
![Таблица 3.2. Возраст начала миотонической дистрофии. (Penrose, 1948 [836]). Жирные линии: различие по возрасту начала заболевания между родителями и детьми в интервале 20-40 лет](pic/000149.jpg)
Таблица 3.2. Возраст начала миотонической дистрофии. (Penrose, 1948 [836]). Жирные линии: различие по возрасту начала заболевания между родителями и детьми в интервале 20-40 лет
Однако эти данные не объясняют различия в корреляциях по возрасту начала заболевания между родителями и детьми, с одной стороны, и сибсами-с другой. Здесь простейшее объяснение состоит в том, что экспрессивность зависит не только от мутантного аллеля, но и от нормального (рис. 3.22). Этот аллель всегда приходит от непораженного родителя. Следовательно, если модификация целиком вызвана нормальным аллелем, то ожидается, что корреляция родитель-ребенок будет равна 0, тогда как пораженные сибсы с вероятностью 0,5 имеют идентичный по происхождению нормальный аллель. Пенроуз, используя правдоподобные предположения, показал, что полученные корреляции согласуются с ожидаемыми при наличии аллельной модификации.
Рис. 3.22. Аллельная модификация. Если проявление доминантного аномального гена A модифицируется нормальным аллелем и если аллель a1 вместе с A приводит к тяжелому, а a2 вместе с A к более легкому проявлению гена А, то существует корреляция по степени проявления между пораженными сибсами, но не между пораженными родителем и ребенком. Пораженный ребенок не может получить модифицирующий аллель a2
Более позднее исследование миотонической дистрофии касалось всех семей с этим заболеванием, зарегистрированных в Северной Ирландии в течение определенного периода времени. Здесь результаты Пенроуза подтвердились лишь частично: корреляция родитель-ребенок по возрасту начала заболевания действительно отсутствовала, но только если не учитывали катаракту. Возможно, что модификация нормальным аллелем сказывается на всех проявлениях заболевания, кроме катаракты.
Другим примером аллельной модификации может служить "ногтенадколенный" синдром (16120) [854]. Однако суммарное количество случаев у человека, где проанализировано взаимодействие генов с хорошо очерченным фенотипическим эффектом, остается небольшим. Ряд примеров, когда анализ оказался возможным на молекулярном уровне, будет обсуждаться при рассмотрении полиморфизма глобиновых генов (разд. 4.3). Несомненно, что анализ влияния взаимодействия разных генов на их фенотипические проявления станет одной из главных задач генетики человека в ближайшем будущем.
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'