
3.4.2. Анализ сцепления у человека: классический метод родословных
Прямое обследование родословных. У человека анализ сцепления классическими методами, разработанными на дрозофиле, невозможен, поскольку невозможны прямые скрещивания. В ряде случаев некоторую информацию дает анализ родословной. Например, сцепление можно исключить, если один из генов локализован в X-хромосоме, а другой - в аутосоме, и напротив, сцепление можно с высокой вероятностью утверждать, если оба гена расположены в X-хромосоме. Выявление сцепления в этом случае может быть затруднено, если гены далеко отстоят друг от друга и разделяются кроссинговером. Это справедливо и для аутосомных генов. Гены, находящиеся в одной хромосоме, называют синтенными. При этом неважно, можно ли формально продемонстрировать сцепление при семейном анализе или нет. Чтобы выявить кроссинговер, нужно исследовать либо большую родословную, либо несколько небольших родословных. На рис. 3.23, А приведена родословная, в которой одновременно наследуются цветовая слепота (на красный и зеленый цвет - 30380, 30390) и гемофилия. Сибсы мужского пола в группах риска либо имеют оба признака, либо здоровы. Гены находятся в фазе притяжения (или цис-положении). В родословной на рис. 3.23, Б наблюдается противоположная картина: здесь гены находятся в фазе отталкивания (или транс-положении). В родословной на рис. 3.23, В кроссинговер должен произойти дважды в материнском ооците. Либо мать несет два мутантных аллеля в цис-положении, и второй и третий сыновья окажутся кроссоверами; либо у нее два мутантных аллеля в транс-положении, и тогда кроссоверами будут первый и четвертый сыновья. К сожалению, информация о цветовом зрении деда со стороны матери отсутствует, а именно она и могла бы разрешить этот спорный вопрос. В настоящее время имеется весьма подробная карта X-хромосомы человека (разд. 3.4.3, рис. 3.28).
![Рис. 3.23. Родословные с цветовой слепотой на красный и зеленый цвет (), гемофилией () и обоими признаками () в фазе притяжения (А), в фазе отталкивания (Б). В этой семье кроссинговер между двумя локусами должен был произойти дважды: либо в ооците, из которого происходят III.1 и III.4, либо в ооците, из которого происходят III.2 и III.3 (A. Madlener, 1928 [772]; Б. Birch, 1937; B. Rath, 1938 [849]; Stern, 1973 [204].)](pic/000185.jpg)
Рис. 3.23. Родословные с цветовой слепотой на красный и зеленый цвет (
 ), гемофилией (
), гемофилией ( ) и обоими признаками (
) и обоими признаками ( ) в фазе притяжения (А), в фазе отталкивания (Б). В этой семье кроссинговер между двумя локусами должен был произойти дважды: либо в ооците, из которого происходят III.1 и III.4, либо в ооците, из которого происходят III.2 и III.3 (A. Madlener, 1928 [772]; Б. Birch, 1937; B. Rath, 1938 [849]; Stern, 1973 [204].)
) в фазе притяжения (А), в фазе отталкивания (Б). В этой семье кроссинговер между двумя локусами должен был произойти дважды: либо в ооците, из которого происходят III.1 и III.4, либо в ооците, из которого происходят III.2 и III.3 (A. Madlener, 1928 [772]; Б. Birch, 1937; B. Rath, 1938 [849]; Stern, 1973 [204].)Сцепление аутосомных генов в некоторых случаях может быть установлено простым обзором обширной родословной. На рис. 3.24, А изображена большая родословная, в которой хорея Гентингтона сегрегирует вместе с ДНК-маркером G8, выявляющим HindIII-полиморфизм в соответствующем фрагменте генома человека [693]. В этой родословной наследуется четыре аллельных варианта маркера G8: A, B, C и D. Ген болезни Гентингтона неизменно проявляется у носителей аллеля С. Только одна женщина (VI.5, указана стрелкой) еще не заболела. Вероятно, это случится позже. Данная родословная указывает на тесное сцепление гена хореи Гентингтона и ДНК-маркера G8: было выявлено несколько кроссоверов, доля которых (т. е. фракция рекомбинантов) оказалась не выше 4%. На рис. 3.24, Б показана родословная с сегрегацией эллиптоцитоза (овальная форма эритроцитов) и комплекса генов системы резус (Rh). Почти все члены семьи с эллиптоцитозом имели комплекс CDe; выявлено лишь два исключения (II.9; II.11). Многие непораженные сибсы имели другие комбинации. При анализе этой родословной можно сделать вывод о наличии сцепления между локусом Rh и эллиптоцитозом. Такой вывод подтверждается другими родословными. Эти примеры показывают, что тип фазы аллелей двух анализируемых локусов (цис- или транс-положение) обычно можно установить с большой точностью, а рекомбинанты относительно легко идентифицируются, если для анализа доступны (по крайней мере) три поколения и много сибсов.
![Рис. 3.24. А. Большая родословная из Венесуэлы с болезнью Гентингтона. А, В, С обозначают три разных 'аллеля' полиморфного ДНК-маркера. Ген болезни Гентингтона передается вместе с аллелем С. Один индивид (указан стрелкой) до сих пор не заболел. Весьма вероятно, что эта женщина заболеет позже. (По Gusella et al. [694].) Б. Аутосомное сцепление между локусом Rh и доминантным эллиптоцитозом (■). Имеются два кроссовера (указаны стрелками): II11 и III.9. Во всех других случаях ген эллиптоцитоза находится в фазе притяжения (цис-положение) с гаплотипом CDe. n - не обследован. (Lawler, Sandler, Ann. Eugen. 1954.)](pic/000186.jpg)
Рис. 3.24. А. Большая родословная из Венесуэлы с болезнью Гентингтона. А, В, С обозначают три разных 'аллеля' полиморфного ДНК-маркера. Ген болезни Гентингтона передается вместе с аллелем С. Один индивид (указан стрелкой) до сих пор не заболел. Весьма вероятно, что эта женщина заболеет позже. (По Gusella et al. [694].) Б. Аутосомное сцепление между локусом Rh и доминантным эллиптоцитозом (■). Имеются два кроссовера (указаны стрелками): II11 и III.9. Во всех других случаях ген эллиптоцитоза находится в фазе притяжения (цис-положение) с гаплотипом CDe. n - не обследован. (Lawler, Sandler, Ann. Eugen. 1954.)
Статистический анализ. В большинстве случаев анализ сцепления намного труднее. Обширные родословные, подобные приведенным на рис. 3.24, -не правило, а исключение. Большинство семей состоит только из родителей и детей. В этом случае проблема заключается в том, что фаза сцепления обычно неизвестна: двойная гетерозигота может быть AB/ab (цис) или Ab/aB (транс). Когда аллели распределены в популяции равномерно, оба типа ожидаются примерно с одинаковыми частотами. Индивиды AB/ab будут формировать гаметы в отношении

С другой стороны, у гетерозиготы Ab/aB гаметы формируются в отношении
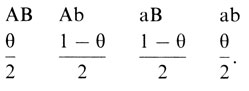
Если два указанных типа имеют примерно равные частоты, то средняя частота всех четырех типов гамет в популяции будет
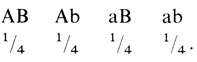
и все четыре типа гамет оказываются с одинаковыми частотами независимо от вероятности рекомбинации θ. Сцепление не приводит к какой-либо ассоциации аллелей A, B или a, b в популяции. Должен быть найден какой-нибудь другой критерий сцепления, который не зависит от фазы двойных гетерозигот.
Такой критерий должен быть основан на распределении детей в сибствах. В браках AB/ab (цис-положение) большинство детей должны иметь аллельные комбинации своих родителей; в браках лиц Ab/aB (транс-положение) большинство детей будут иметь новые аллельные комбинации. Как измерить эти отклонения от равномерного распределения внутри сибств и использовать их для установления сцепления и определения вероятности рекомбинации? Первым предложил такой метод Бернштейн (1931) [571]. В настоящее время для установления сцепления обычно используют метод "лод-баллов", разработанный Холдейном и Смитом (1947) [699], а также Мортоном (1955 и далее) [796; 797; 798; 799]. Его принцип заключается в следующем.
Вычисляется вероятность P2 того, что имеющиеся семейные данные соответствуют случаю двух несцепленных, свободно рекомбинирующих генов. Аналогично определяется вероятность P1 того, что те же семейные данные соответствуют случаю двух сцепленных генов с частотой рекомбинации θ. Отношение этих двух вероятностей есть отношение правдоподобий, которое выражает шансы за и против сцепления. Это отношение P1(F/θ)/P2(F/(1/2)) должно быть вычислено для каждой семьи F.
Пусть, например, один из супругов (муж) имеет генотип двойной гетерозиготы по паре аллелей A,a и B,b, а второй (жена)-генотип двойной гомозиготы по двум рецессивным аллелям этих генов aa, bb. Кроме того, пусть двое сыновей в этой семье являются, подобно отцу, двойными гетерозиготами, т. е. они унаследовали от отца аллели A и B. Если гены сегрегируют независимо, то вероятность такого события равна 1/2·1/2=1/4. Если гены тесно сцеплены, то в отсутствии кроссинговера вероятность такой родословной может быть вычислена следующим образом. Гены находятся либо в фазе притяжения AB/ab, и тогда вероятность совместной передачи двум сыновьям составляет 1/2 (передача комбинации ab также имеет вероятность 1/2), либо в фазе отталкивания Ab/aB, и тогда передача обоих доминантных аллелей одному сыну предполагает наличие кроссинговера, т. е. при тесном сцеплении и отсутствии кроссинговера вероятность совместной передачи в условиях фазы отталкивания равна 0. Следовательно, суммарная вероятность передачи комбинации aB обоим сыновьям равна 1/2 и отношение правдоподобий составляет P1P2=(1/2)/(1/4=2 в пользу тесного сцепления. Таким же способом можно вычислить аналогичные отношения правдоподобий для любой степени сцепления.
Для удобства используется логарифм отношения правдоподобий "log odds" (логарифм шансов):
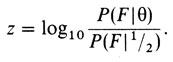
(3.3)
В этой формуле P(F|θ) означает вероятность семьи F, когда частота рекомбинации равна θ. Преимущество в использовании логарифмов вместо самих вероятностей состоит в том, что zi любой вновь обследованной семьи просто суммируется с предшествующим результатом, давая z=∑zi для всех обследованных семей.
В уравнении (3.3) подразумевается, что частота рекомбинантов одинакова для обоих полов. Поскольку существуют половые различия в уровнях рекомбинации [855], то для реальных данных величина z должна быть вычислена отдельно для каждого из полов:
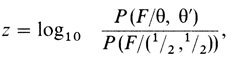
(3.4)
где θ - частота рекомбинации у женщин, а θ′ - у мужчин.
Из определения отношения правдоподобий следует, что с увеличением числителя повышаются шансы в пользу наличия сцепления. В терминах логарифмов это означает, что, чем больше величина z, тем лучше обосновано наличие сцепления. Обычно лод-балл z≥3 рассматривается как доказательство сцепления. При вычислении шансов необходимы небольшие поправки на доминирование и регистрацию родословных с редкими признаками, но здесь мы не будем касаться этого вопроса [882].
Лод-балл z(θ, θ′) для всей выборки семей равен сумме лод-баллов отдельных семей. Для упрощения вычислений в первом приближении можно положить θ=θ′. Когда наличие сцепления уже установлено, можно тестировать половые различия.
Лод-баллы. Существует большое число таблиц лод-баллов, публиковавшихся вместе с правилами их применения. В работе с достаточно обширными родословными рекомендуется использовать алгоритм, предложенный Оттом [831а, б, в; 612а]. В идеальном для исследователя браке один из супругов должен быть двойной гетерозиготой, т. е. гетерозиготой по двум разным генам, а второй - гомозиготой по этим же генам. С другой стороны, есть семьи, которые не дают никакой информации для вывода о сцеплении:
а) в которых ни один из родителей не является двойной гетерозиготой;
б) в которых не выявляется никакой сегрегации;
в) в которых фазы двух генов у супругов неизвестны и, кроме того, имеется лишь один ребенок.
Большинство исследований по сцеплению основаны на анализе либо двух часто встречающихся в популяции генетических маркеров, либо какого-то частого маркера и редкого наследственного заболевания. Благоприятные возможности установить сцепление между двумя редкими генами вряд ли когда-либо реализуются. Идеальная родословная для изучения сцепления включает три поколения и много брачных пар с большим числом детей [945, 946]. Сибства большого размера встречаются в западных странах все реже. Альтернативный подход заключается в тестировании большого числа малодетных семей. Хотя в большинстве случаев выборки такого типа содержат слишком мало данных о сцеплении, но иногда в очень больших выборках можно выявить некоторую новую информацию о сцеплении.
Программа LIPED - компьютерная программа, которая дает оценки максимального правдоподобия параметров сцепления на основе всех данных о родословных. Эта программа вычисляет наиболее вероятные генотипы членов родословной и использует эти данные для получения наиболее вероятного значения частоты рекомбинации. Поскольку скорость компьютера намного превышает скорость ручных расчетов, программа LIPED стала стандартным инструментом в изучении сцепления у человека [831].
Как уже упоминалось в разд. 2.1.2.4, длина генетической карты генома человека составляет примерно 25,8 морганид. Если считать, что в гаплоидном геноме содержится примерно 3,5·109 нуклеотидных пар, то 1 сМ соответствует ≈1,356·106 нуклеотидных пар (или 1356 т.п.н.). Однако, как будет обсуждаться ниже, распределение сайтов кроссинговера в различных хромосомах не является равномерным.
Когда установлено сцепление и получена максимально правдоподобная оценка θ, необходимо решить вопрос о возможной гетерогенности этого параметра. Например, если имеется сцепление между полиморфным маркером и локусом редкого доминантного признака, то тест на гетерогенность сцепления может оказаться полезным для выявления генетической гетерогенности синдрома (если сцепление справедливо только для некоторой части семейного материала). В приложении 9 приведены два численных примера: для сцепления средней степени и для отсутствия сцепления (или независимой рекомбинации).
Вероятности рекомбинации и генетическая карта. Когда сцепление между несколькими локусами уже установлено, следующий шаг заключается в оценке расстояния между этими локусами на генетической карте. Эти расстояния выражаются в морганидах (или сантиморганидах). Одна сантиморганида (сМ) соответствует 1 % рекомбинации (θ=0,01), если анализируются короткие участки хромосом. Для больших расстояний между локусами необходима поправка на двойной кроссинговер. Для этого были предложены разные методы вычисления так называемой картирующей функции [612а]. С помощью специального графика (рис. 3.25) для заданной частоты рекомбинации 0 расстояние по карте можно определить непосредственно.
![Рис. 3.25. Соотношение между вероятностью рекомбинации и расстоянием (w) в морганидах [612а]. Зависимость экспоненциальная, поскольку количество двойных (и множественных) кроссоверов растет с увеличением расстояния на карте](pic/000192.jpg)
Рис. 3.25. Соотношение между вероятностью рекомбинации и расстоянием (w) в морганидах [612а]. Зависимость экспоненциальная, поскольку количество двойных (и множественных) кроссоверов растет с увеличением расстояния на карте
Аутосомное сцепление, половые различия и влияние возраста родителей. Сцепление аутосомных генов у человека впервые было выявлено для локуса системы эритроцитарных антигенов Лютеран и локуса секреции антигенов системы ABO. Несколько лет спустя удалось установить сцепление между локусами системы Rh и эллиптоцитозом (16690). Эти данные использовали для выявления генетической гетерогенности эллиптоцитоза, поскольку не все семьи с этим синдромом обнаруживали сцепление. Впоследствии сцепление было показано для локуса системы ABO и локуса доминантного ногте-надколенного синдрома (16120). В этом случае впервые удалось выявить половые различия по частоте рекомбинации у человека: расстояние на генетической карте составляло 8 сМ у мужчин и 14 сМ у женщин. Аналогичные половые различия были установлены для пары локусов Lu/Se (мужчины: 10 сМ; женщины: 16 сМ), для пары ABO/Ak (аденилаткиназа) (мужчины: 12 сМ; женщины: 19 сМ), для пары HLA-PGM3 (мужчины: 15 сМ; женщины: 3 сМ). Как мы уже говорили, при анализе сцепления теперь используют полиморфизм по длине рестрикционных фрагментов. В некоторых случаях, например для длинного плеча хромосомы 13, этот метод позволил подтвердить более высокую частоту кроссинговера у женщин [945]. Однако имеются литературные данные и о том, что уровень рекомбинации может быть выше у мужчин. Такой вывод сделан, например, для дистальной трети короткого плеча хромосомы 11 [944].
Более высокая частота рекомбинации у самок была обнаружена также и для мыши [853]. Эти результаты подтверждают сформулированное Холдейном еще в 1922 г. правило, согласно которому кроссинговер чаще происходит у гомогаметного пола (т. е. XX),чем у гетерогаметного (т. е. XY). Например, у самцов дрозофилы кроссинговера нет вовсе.
В свое время имела место продолжительная дискуссия относительно влияния возраста родителей на уровень рекомбинации. Имеющиеся данные на мышах свидетельствуют о том, что с возрастом частота рекомбинации у самок снижается, а у самцов повышается. Вейткамп (1972) [939] для восьми тесно сцепленных локусов у человека обнаружил значимое увеличение частоты рекомбинаций с возрастанием порядкового номера беременности, что указывает на влияние возраста родителей (оно было одинаковым и у женщин, и у мужчин). Зависимость частоты рекомбинации от возраста родителей характерна для пар локусов Лютеран/секретор и Лютеран/миотоническая дистрофия (16090), а для пар локусов ABO/ногте-надколенный синдром и Rh/PGD такое влияние обнаружено не было. Вероятно, частота рекомбинаций разных локусов в мейозе зависит от возраста по-разному [855].
Как следует из публикаций, цитогенетические данные о частоте хиазм у 204 мужчин свидетельствуют о небольших (или нелинейных) изменениях с возрастом [754а]. Для женщин подобные цитогенетические данные отсутствуют. Расхождения между данными формально-генетического анализа сцепления и цитогенетическими данными о частоте хиазм не находят пока четкого объяснения.
Морфологические маркеры хромосом. Пары или кластеры сцепленных аутосомных генов (группы сцепления) невозможно соотнести с конкретными хромосомами на основе использования только формально-генетического анализа родословных. Впервые собственно локализация гена в определенной хромосоме у человека была осуществлена следующим образом [629; 855].
В длинном плече первой хромосомы у человека часто обнаруживается вторичная перетяжка вблизи центромеры. Примерно в 0,5% случаев в популяции эта перетяжка оказывается намного тоньше и длиннее, чем в норме. Такие варианты наследуются доминантно. Если один из гомологов первой пары хромосом обнаруживает аномальный фенотип, то предполагается, что он несет аллель (фактор деспирализации). Имеются данные о тесном сцеплении между локусом группы крови Даффи и локусом Un-1: θ=0,05. С другой стороны, ранее было установлено сцепление между локусами Даффи и врожденной очаговой катаракты (11620). Следовательно, группу сцепления из трех локусов: катаракты, Даффи и Un-1 можно соотнести с первой хромосомой или "приписать" ее к этой хромосоме.
Другая возможность локализации гена на конкретной хромосоме связана с анализом делеций. Например, если ген, для которого известна доминантная мутация, оказывается утерянным вследствие делеций, то отсутствие этого гена может детерминировать фенотип, сходный с тем, который обусловливает доминантная мутация. Когда делеция достаточно велика по размеру и захватывает участки, смежные с данным локусом, можно ожидать, что в фенотипе будут представлены дополнительные симптомы. В 1963 г. у умственно отсталого ребенка с двусторонней ретинобластомой была обнаружена делеция в длинном плече одной из хромосом группы D [1531] (как выяснилось позже - хромосомы 13). Делеция 13ql4 была найдена и в ряде других случаев с ретинобластомой и дополнительными аномалиями. У больных ретинобластомой без дополнительных симптомов делеция обычно не наблюдалась. Из приведенных фактов следует, что локус ретинобластомы относится к хромосоме 13.
Другой, по-видимому чаще используемый, подход основывается на количественном исследовании ферментативной активности в случаях с хромосомными аномалиями. Большинство ферментов характеризуются четко различимым эффектом дозы гена, т. е. гетерозиготы по ферментативной недостаточности обнаруживают примерно 50%-ную ферментативную активность. Сходный эффект дозы гена можно ожидать и в том случае, когда ген теряется вследствие делеции. Такой подход к картированию использовался для большого числа генетических маркеров. Чаще всего результат оказывался отрицательным, но такого рода "исключающее картирование" полезно тем, что может сузить область вероятной локализации генов-маркеров. Следует, правда, учесть, что на основе этого подхода были сделаны и неправильные выводы, поскольку наличие "молчащего" (нулевого) аллеля, т. е. непроявляющейся мутации, может имитировать эффект делеции.
Если верно, что гетерозиготы и моносомики обнаруживают эффект дозы гена, то вполне реально ожидать наличие такого же эффекта и у трисомиков. Первые исследования активности ферментов при синдроме Дауна (трисомия по 21-й хромосоме), казалось бы, подтвердили такой вывод. Однако, чем больше ферментов включали в анализ, тем больше среди них обнаруживали таких, которые следовало бы отнести к 21-й хромосоме (активность большинства изученных ферментов оказалась повышенной). Кроме того, у больных с синдромом Дауна обнаружилось неожиданное увеличение активности X-сцепленного фермента G6PD. Отсюда следует, что количественные изменения ферментативной активности у трисомиков in vivo могут быть связаны с нарушениями регуляции активности генов, локализованных в разных хромосомах.
Тем не менее все большее число случаев эффекта дозы генов описывается для трисомных и моносомных клеток, культивируемых in vitro [1185] (разд. 4.7.4.3). Остановимся лишь на одном примере. Активность фермента фосфорибозилглицинамидсинтетазы (GARS) изучалась в нескольких случаях частичной моносомии и частичной или полной трисомии 21. Эти исследования были стимулированы предшествующими данными о наличии эффекта дозы гена для этого фермента. При регулярной трисомии коэффициент превышения по отношению к норме составил 1,55. В других случаях соотношения были: 0,99 для моносомии 21q21 → 21 pter; 0,54 для 21q22 → 21 qter-моносомии; 0,88 для 21q21 → 21 pter-трисомии и 1,46 для 2lq22.1-трисомии. Анализируя эти данные, можно прийти к выводу о возможной локализации гена GARS в субсегменте 21q22.1 [322]. Некоторые другие примеры приведены в табл. 4.27 и приложении 9. Использование разных вариантов хромосомной морфологии (таких, как упомянутая выше вторичная перетяжка на хромосоме 1) и эффекта дозы гена для картирования - путь медленный и недостаточно надежный. Новый метод картирования, основанный на гибридизации клеток, привел к большим успехам в этой области.
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'