
Глава 2. Картирование генов органелл
2.1. Картирование митохондриальных генов
Большинство признаков, которыми различаются разные штаммы грибов, определяются ядерными генами. Закономерности их наследования были рассмотрены в предыдущей главе. Помимо этого наблюдаются случаи, когда тот или иной признак наследуется необычным способом, так что приходится допустить, что гены, его контролирующие, находятся не в ядре, а в цитоплазме. Естественны поиски тех клеточных структур, с которыми может быть связана такая внеядерная наследственность. Важнейшими из них оказались митохондрии, в которых, как теперь известно, имеется собственная ДНК. В более редких случаях за тот или иной цитоплазматически наследуемый признак могут быть ответственны и другие самовоспроизводящиеся структуры цитоплазмы, содержащие либо ДНК, либо способную к репликации РНК.
Митохондрии - органеллы, свойственные всем эукариотическим клеткам, осуществляющие дыхание и окислительное фосфорилирование. Они обладают собственной системой белкового синтеза (митохондриальные рибосомы, митохондриальные тРНК). Генетический аппарат дрожжевых митохондрий - кольцевые молекулы ДНК размером 70-75 тпн (у других грибов они меньше) - содержит информацию лишь о немногих компонентах митохондрий (около 5 % всех белков митохондрий кодируется мтДНК). Остальные синтезируются под контролем ядра на цитоплазматических рибосомах и оттуда поступают в митохондрии, принимая участие в образовании их структуры и в осуществлении их функций.
Известны два типа митохондриальных мутаций. Один из них связан с заменой (или выпадением) отдельных нуклеотидов в ДНК, как и обычные генные мутации. Фенотипические эффекты этих мутаций - приобретение клеткой устойчивости к антибиотикам, специфически ингибирующим белоксинтезирующую систему митохондрий (устойчивость к эритромицину - мутации ER, хлорамфениколу - CR и др.; общее обозначение - antR-мутации), или потеря способности к дыханию (mit- - мутации). Мутации другого типа имеют фенотипическое проявление, сходное с mit- - мутациями - это грубые изменения в мтДНК. Эта ДНК может вообще исчезать из клетки (ρ0- или rho0 - мутации) либо терять более или менее протяженные участки (ρ- - или rho- - мутации). Мутации первого типа получены у ряда грибов, второго - у дрожжей-сахаромицетов.
Если для признаков, определяемых ядерными генами, характерно стабильное наследование при вегетативном размножении гибридных диплоидов и закономерное, в определенных соотношениях, расщепление при образовании аскоспор в результате мейоза, то цитоплазматически детерминируемые признаки, напротив, не показывают расщепления в мейозе и наоборот нередко сегрегируют при вегетативном размножении культуры. Причина этого - отсутствие специального аппарата (наподобие аппарата веретена), который правильно распределял бы многочисленные копии цитоплазматических наследственных элементов при клеточном делении.
Наиболее общий критерий обнаружения цитоплазматической детерминации изучаемого признака - отсутствие расщепления в мейозе. Так, при скрещивании нормальных дрожжевых клеток с rho- -мутантами большинство образующихся диплоидов оказываются нормальными по способности к дыханию. При проведении тетрадного анализа, как правило, все четыре гаплоидные споры каждого аска дают клоны, нормальные по дыханию, т. е. расщепление не происходит, что контрастирует с картиной наследования признаков, контролируемых ядерными генами.
В скрещиваниях, в которых родительские штаммы различаются по некоторым цитоплазматически детерминируемым признакам, может наблюдаться частое расщепление в митотических делениях. Так, при скрещивании ER х ES (соответственно штаммы, устойчивые и чувствительные к эритромицину) каждая образующаяся зигота дает смешанный клон, состоящий примерно наполовину из устойчивых и чувствительных клеток. Расщепление заканчивается примерно через 20 клеточных поколений. При споруляции клеток стабильных устойчивых и чувствительных субклонов не наблюдается мейотическое расщепление.
Митотическое расщепление по митохондриальным мутациям позволяет изучать митохондриальную рекомбинацию. Для этого проводят скрещивания типа EROS х ESOR, где один родитель устойчив к эритромицину, другой к олигомицину. В митотическом потомстве образовавшихся зигот обнаруживаются в преобладающем числе клетки родительских типов, но появляются также и стабильные рекомбинанты - устойчивые к обоим антибиотикам (EROR) и чувствительные (ESOS). Помимо дрожжей, такая митохондриальная рекомбинация была обнаружена у Aspergillus nidulans и Podospora anserina.
Открытие в конце 60-х годов митохондриальной рекомбинации породило надежду на возможность картирования генетическими методами митохондриальной ДНК. Дальнейшие исследования, однако, показали, что рекомбинационный анализ, который так плодотворно себя проявил в изучении организации хромосом, мало пригоден при изучении мтДНК. Основная причина - высокая вероятность рекомбинации, приходящейся на единицу длины мтДНК: мутации, находящиеся на расстоянии всего 30 пар нуклеотидов, показывают 0,1-0,3 % рекомбинации, а удаленные на 1 тпн ведут себя как несцепленные [5]. Таким образом, рекомбинационный анализ может использоваться при картировании мутаций внутри гена, но не дает информации о расположении и расстояниях между разными генами в мтДНК.
Дополнительные трудности создает популяционный характер митохондриальных скрещиваний. Действительно, если в профазе мейоза в каждом ядре взаимодействуют две гомологичные хромосомы, между которыми происходит акт обмена, то митохондриальная рекомбинация представляет собой результат взаимодействия нескольких десятков молекул митохондриальной ДНК, содержащихся в одной гибридной зиготе. В течение нескольких делений зиготы и ее потомства молекулы мтДНК многократно реплицируются и вступают в акты рекомбинации, а затем сегрегируют по мере попадания в дочерние клетки одинаковых по генотипу (родительских или рекомбинантных) молекул.
Одно из следствий популяционного характера рекомбинации то, что несцепленные гены должны показывать не 50 % рекомбинации, а лишь 25. Действительно, в пуле молекул возможны спаривания как между разными генотипами, так и между тождественными, что происходите равной вероятностью. К образованию рекомбинантов приводят лишь спаривания первого типа, однако частота образовавшихся рекомбинантов будет рассчитываться на все потомство.
Для описания охарактеризованного выше процесса митохондриальной рекомбинации предложена математическая модель, сходная с моделью, описывающей рекомбинацию внутриклеточных бактериофагов [6]. Предложенная модель основана на следующих трех положениях: случайности спаривания и рекомбинации разных молекул мтДНК в клеточном пуле; множественности циклов спаривания и рекомбинации (по расчетам происходит около четырех таких циклов); случайности сегрегации - выщеплении родительских и рекомбинантных молекул, их переходе в "гомоплазменное" (по аналогии с "гомозиготным") состояние. Модель позволяет связать наблюдаемую частоту рекомбинантов с действительной вероятностью обменов между двумя маркерами, но, как указывалось, такие расчеты мало полезны для генетического картирования.
Помимо биохимических методов картирования мтДНК, о которых кратко будет сказано ниже, наиболее плодотворным оказался делеционный метод картирования, с успехом применяемый в генетике дрожжевых митохондрий. Он основан на легкости получения именно у этого организма протяженных делеций в мтДНК, которые выделяются при отборе возникающих с большой частотой так называемых rho-мутантов.
Оказалось, что при их появлении часто, хотя и не всегда, теряются маркеры антибиотикоустойчивости. Очевидно, что вероятность выпадения из митохондриального генома одновременно двух маркеров в результате одной делении тем больше, чем ближе они расположены друг к другу, и наоборот, вероятность сохранения одного при выпадении другого увеличивается для маркеров, находящихся на значительном расстоянии друг от друга. Это рассуждение было положено в основу принципа картирования митохондриальных генов с помощью делеций [7, 8].
Пример [1]. Изучалось расположение маркеров ER, OR, MR, NR в мтДНК дрожжей Saccharomyces cerevisiae. При изучении 401 клона было установлено такое их распределение (%) для следующих сочетаний маркеров (порядок записи Е, О, М, N):

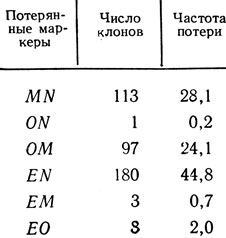
Таблица 2.1. Частота совместной потери митохондриальных маркеров антибиотикоустойчивости у Saccharomyces cerevisiae, %
Отсюда находим частоту (%) рекомбинантов для пар маркеров

Во всех случаях процент рекомбинантов близок к максимально выраженному (25 %) и определить расположение генов по этим данным нельзя.
После УФ-облучения клеток штамма, несущего все четыре маркера антибиотикоустойчивости, было отобрано 1 250 rho- - клонов, сохранивших один или несколько маркеров устойчивости. Среди них 402 обладали каждый двумя маркерами. По потере маркеров они распределились следующим образом (табл. 2.1). Видно, что одни пары маркеров совместно теряются часто, другие намного реже.
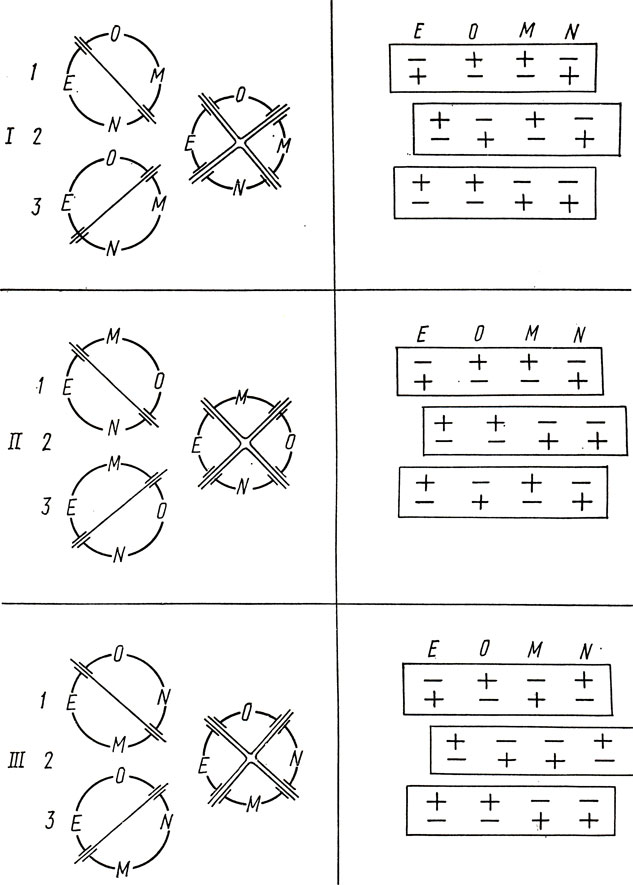
Рис. 2.1. Схема делеционного картирования митохондриальных генов: слева - три (I, II, III) возможных порядка четырех генов; 1, 3 - делеции, захватывающие сразу два гена; 2 - делеции, захватывающие по одному гену; справа - наличие маркеров в зависимости от порядка генов и от того, как произошла делеция: (+) - сохранение, (-) - потеря маркера
Дальнейший ход анализа, представленный на рис. 2.1, показывает, что трем возможным на кольцевой карте порядкам четырех генов соответствуют разные редкие типы потерь двух маркеров, которые, как ожидается, являются результатом возникновения двух независимых делеций. Опытные данные (самые редкие классы ЕМ и ON) соответствуют только порядку 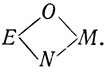 .
.
Карты митохондриального генома дрожжей-сахаромицетов построены как с помощью описанного выше метода делеционного картирования, так и с применением молекулярно-биохимических методик. У других грибов мутанты с потерей значительных фрагментов мтДНК не могут быть получены в связи с их нежизнеспособностью. В этих случаях карты мтДНК строят лишь биохимическими методами (Neurospora crassa, Aspergillus nidulans) [4, 9].
Особенно полезным оказывается применение рестриктаз - ферментов, разрезающих ДНК по специфическим последовательностям. Электрофоретическое разделение образовавшихся фрагментов позволяет определить их размер, а применение нескольких различных рестриктаз дает возможность определить последовательность фрагментов в молекуле.
Другой широко применяемый метод - молекулярная гибридизация. Информационное содержание отдельных фрагментов мтДНК, которые сохраняются при образовании делеций у rho- -мутантов или которые получают с помощью рестриктаз, может быть выявлено путем гибридизации этих фрагментов с радиоактивными пробами нуклеиновых кислот - транспортными и рибосомными РНК, реже - информационными РНК или специфическими ДНК. Этот метод почти единственный, который позволяет картировать многочисленные гены митохондриальных транспортных РНК.
Учитывая, что молекулы мтДНК - кольцевые (по данным, полученным биохимическими методами), картированные митохондриальные гены располагают на кольцевой карте, принимая ее общую длину за 100 ед.
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'