
Глава 4. "Повозки" для генов
Недостаточно овладеть премудростью, нужно также научиться пользоваться ею.
Когда в конце 70-х годов стало ясно, что взаимодействие агробактерий с пораненным растением приводит к переносу Т-района бактериальной плазмиды в растительную клетку и его включению в ядерную ДНК, ученые задумались, нельзя ли в составе Т-ДНК ввести в растительный геном другие, не имеющие отношения к Ti- и Ri-плазмидам гены? Положительный ответ на этот вопрос имел бы очень важные последствия, ведь в таком случае в руках ученых оказывались замечательные возможности создавать растения с новыми признаками.
Какие же гены следует переносить в растения? Ответ на этот вопрос кажется яснее ясного: конечно, те, что сделают растения высокоурожайными, устойчивыми к болезням, холоду, засухе, повышенной засоленности почвы, пестицидам - словом, снабдят их многими полезными свойствами. Так-то оно так, но ведь нужно еще точно знать, какие гены отвечают за эти признаки, откуда их брать, будут ли они работать в том виде растений, которым хотят придать новое свойство. Большинство требующих улучшения признаков растений зависит от многих генов, а выделение нужных генов у растений представляет пока довольно сложную задачу. Это и неудивительно, поскольку генетическое строение растений намного более сложно и потому значительно менее изучено, чем строение бактерий, остававшихся до недавнего времени основным объектом генной инженерии.
Конечно, возможности современной науки, в особенности молекулярной генетики, очень велики, и природе все труднее, как принято говорить, хранить свои тайны. И все же загадок пока больше, чем разгадок, поэтому ученые не стали ждать, когда все станет ясным, а пошли испытанным путем - от простого к сложному. Ход рассуждений был примерно таким: если у нас нет пока в руках тех генов, которые в будущем можно будет переносить в растения, чтобы придать им новые хозяйственные признаки, то нельзя ли на первых порах использовать как модели хотя бы те гены, что уже более или менее изучены и отвечают за легко определяющиеся у растений признаки. К таким признакам относится устойчивость к антибиотикам. Клетки многих растений не могут культивироваться in vitro, если их поместить в питательную среду, содержащую антибиотики, например, относящиеся к так называемой аминогликозидной группе: неомицин, канамицин, гентамицин, генетицин и некоторые другие. Многие бактерии сумели к ним приспособиться благодаря тому, что несут в составе своих плазмид "прыгающий" генетический элемент - транспозон Tn5 с геном фермента, инактивирующего эти препараты. Полное название фермента - неомицинфосфот-рансфераза II, но так как нам еще не раз придется говорить о нем, обозначим его короче - НФТ. Точно так же и его ген для краткости называют геном устойчивости к канамицину (kan), хотя речь идет не только о канамицине, но и о близких к нему антибиотиках.
А что, если попробовать выделить этот ген из бактерий, включить его в плазмиду Ti и с ее помощью перенести из агробактерий в клетки растений? Будет ли работать в них бактериальный ген и придаст ли устойчивость к антибиотику?
Кстати, а как доставить гены антибиотико-устойчивости в растения? Первыми начали изучать возможность использования Ti -плазмид для переноса генов в растения бельгийские ученые. В Т-район Ti -плазмид стали встраивать бактериальные транспозоны, определяющие устойчивость к различным антибиотикам. Например, Tn7, содержащий ген устойчивости к триметоприму (метатрексату), либо Tn9, несущий ген устойчивости к хлорамфениколу, многим более знакомому по его "аптечному" имени - левомицетин. Эти транспозоны встраивали поначалу так, чтобы они не повредили онкогены - ведь их можно будет использовать как селективные маркеры, поскольку образование корончатого галла всегда означает, что Т-район проник в растительные клетки. Затем, рассуждали ученые, следует посмотреть, приобрели ли опухолевые клетки устойчивость к антибиотикам, то есть передался ли в них в составе Т-района новый чужеродный ген и появился ли в таких клетках кодируемый этим геном фермент, разрушающий антибиотик. Увы, ни признаков устойчивости, ни наличия ферментов - свидетельств тому, что введенные в состав Т-ДНК бактериальные гены могут нормально работать в растениях, обеспечивая продукцию соответствующих белков, получено не было. О причинах этой неудачи мы поговорим в следующей главе. Здесь же нам важно, что сам факт передачи бактериальных генов устойчивости в растения сомнения не вызывал: в ДНК опухолевых клеток они присутствовали. Использовать такие большие молекулы ДНК, как плазмиды Ti в качестве векторов довольно сложно. "Вшить" в них какой-либо новый ген с помощью рестриктаз напрямую не удается - трудно подобрать фермент, который смог бы разрезать плазмидное кольцо так, чтобы образовалась одна линейная молекула, а не множество кусков. Обычные векторы, применяемые в генной инженерии бактерий, скажем, упоминавшаяся уже pBR322 раз в 40 - 50 меньше, чем плазмиды агробактерий. На основе этой и ряда других небольших плазмид стали создавать так называемые промежуточные векторы. Гены, которые хотят перенести в растения, вшивают в эти векторы в клетках E. coli, а затем гибридные ДНК переносят в агробактерий, а уж из них - в растения. Сами по себе такие векторы переноситься не могут. Поэтому решено было воспользоваться помощью природных переносчиков - Ti-плазмид. В векторы стали включать участок Т-района Ti, который, если помните, умеет внедряться в геном растения, а уже в него вшивали предназначенный для переноса ген, например, уже знакомый нам ген устойчивости к канамицину. В результате такой операции вектор и Ti-плазмида получали возможность "опознать" друг друга - оба несли одинаковые последовательности ДНК. В пределах этой последовательности могло происходить объединение (интеграция) Ti-плазмиды и вектора в одну гибридную молекулу-коинтеграт. Как и обычная Ti - плазмида, он способен передавать в растения свой Т-район, а вместе с ним и чужеродный ген.
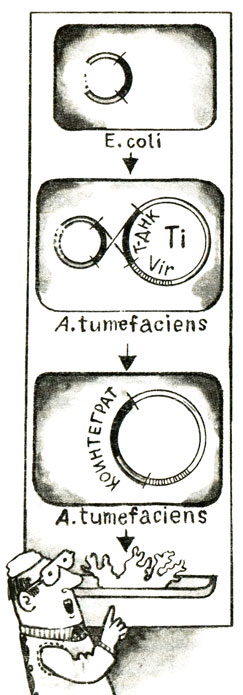
Рис. 19
Промежуточные векторы бывают двух типов. Одни, как челноки, способны курсировать между E. coli и агробактериями и одинаково хорошо чувствуют себя в обоих хозяевах. В агробактериях они могут мирно сосуществовать с Ti-плазмидами, могут и объединяться с ними в коинтеграты. Векторы другого типа созданы на основе плазмид, способных самостоятельно существовать в E. coli, но не в агробактериях. Для них попадание в агробактерию равносильно самоубийству. Поэтому их называют векторами суицидального типа (от слова "суицид" - самоубийство). Когда такой вектор проникнет в агробактерию, то у него оказывается только одна возможность, чтобы выжить, - образовать коинтеграт с Ti-плазмидой.
Следующим шагом на пути совершенствования систем для переноса генов в растения стало конструирование "обезоруженных" Ti-плазмид. Было замечено, что клетки и ткани растений, трансформированные Ti-плазмидами, из Т-района которых удалены онкогены, кодирующие синтез фитогормонов, намного легче регенерируются в зрелые растения, чем опухолевые клетки, содержащие полноценную Т-ДНК. "Обезоруживание" Ti-плазмид путем удаления из них онкогенов происходило постепенно. Сначала были получены измененные Ti-плазмиды, лишенные только одного онкогена - того, что отвечает за синтез цитокинина. Оказалось, что это уже неплохо: трансформированные ткани табака регенерировались в целые растения. Дальнейшие опыты, однако, обнаружили, что это верно лишь для табака, но не для других видов.
Патриция Замбриски с соавторами создали на основе одной из плазмид нопалинового типа "обезоруженную" Ti-плазмиду, лишенную всех генов биосинтеза фитогормонов, присутствующих в норме в Т-ДНК. Вместо них полученная плазмида, названная pGV3850, содержит в Т-районе последовательность известного вектора E. coli - плазмиду pBR322. Такая вставка обеспечивает возможность образования коинтеграта между pGV3850 и промежуточными векторами, созданными на основе pBR322. Эти векторы относятся к суицидальным, поскольку плазмида pBR322 самостоятельно в агробактериях существовать не может. Однако, утратив онкогены, "обезоруженная" плазмида pGV3850 сохранила ген нопалинсинтазы, то есть маркер, который наряду с геном антибиотикоустойчивости, включенным в Ti-район промежуточного вектора, легко обнаружить в трансформированных растительных клетках.
На основе плазмиды pBR322 была создана плазмида pMON200 - типичный промежуточный вектор суицидального типа. На примере этой плазмиды можно понять, как создаются подобные векторы и как они ведут себя в агробактериях.
Плазмида pMON200 содержит два участка pBR322. Один из них обеспечивает существование pMON200 в E. coli, а другой необходим для того, чтобы эта, сама по себе неконъюгативная, плазмида могла бы с помощью плазмиды-помощника переноситься в другие бактерии. Оба эти участка pBR322 были подсоединены к фрагменту Т-района из плазмиды нопалинового типа, содержащему лишь одну (правую) из двух повторяющихся последовательностей из 25 пар нуклеотидов, окаймляющих Т-район. Кроме того, в плазмиду pMON200 включили: ген устойчивости к канамицину (npt), подшитый к промотору гена синтеза нопалина (nos) из Т-района Ti-плазмиды - сигнальному элементу, способному обеспечить экспрессию присоединенного к нему гена в растениях; ген str из E. coli, кодирующий устойчивость бактерий к стрептомицину; сам ген nos, ответственный за синтез нопалина в растениях и, наконец, полилинкер - искусственно синтезированную последовательность ДНК, содержащую участки для разных рестриктаз.
Каждый из этих элементов необходим для решения главной задачи - переноса гена устойчивости к канамицину в растения. Присутствие гена устойчивости к стрептомицину позволяет использовать этот антибиотик как маркер при наблюдении за плазмидой pMON200 в клетках E. coli. Ген синтеза нопалина обеспечивает появление в растениях легко определяемых признаков. Участок Т-района дает плазмиде pMON200 возможность включиться в состав Ti-плазмиды путем рекомбинации между общими для обеих плазмид последовательностями. Находящийся под необычным для себя эукариотическим (нопалиновым) промотором и потому химерный ген устойчивости к канамицину как бы уже готов к работе в растительной клетке, остается его только туда доставить. Наличие полилинкерного участка нацелено в будущее - потребуется же когда-нибудь перенести в растения не модельный, а какой-нибудь действительно полезный признак, вот и пригодится такой участок: фрагмент ДНК, содержащий нужный ген, можно будет включить в этом месте в плазмиду.
Всем вроде неплоха плазмида pMON200, но сама перейти в растения не может, в этом ей помогает "обезоруженная" Ti-плазмида. Общие последовательности этих плазмид "опознают" друг друга и обеспечивают возможность встраивания pMON200 в Т-район плазмиды Ti. Появление у агробактерий устойчивости к стрептомицину указывает на то, что в клетках этих бактерий находится коинтеграт промежуточного вектора и Ti-плазмиды. Таким образом собирается структура, готовая "прыгнуть" из агробактерий в растение.
Образование коинтегратов между "обезоруженной" Ti-плазмидой и промежуточными векторами суицидального типа процесс не очень частый. А нельзя ли вообще обойтись без формирования коинтегратов? В случае положительного ответа на этот вопрос можно было бы попытаться переносить чужеродные гены в растения в составе промежуточного вектора, используя Ti лишь как плазмиду-помощника. В принципе это могло бы напоминать ситуацию, возникающую, когда нужно перенести неконъюгативные плазмиды из одной бактериальной клетки в другую. Такие плазмиды не несут собственных генов переноса, но этот дефект компенсируется дополнительно содержащейся в клетке конъюгативной плазмидой-помощником. Для этого вовсе не обязательно образовывать коинтеграты. Белков, кодируемых помощником, достаточно, чтобы обеспечить перенос обеих плазмид без прямого соприкосновения между ними.
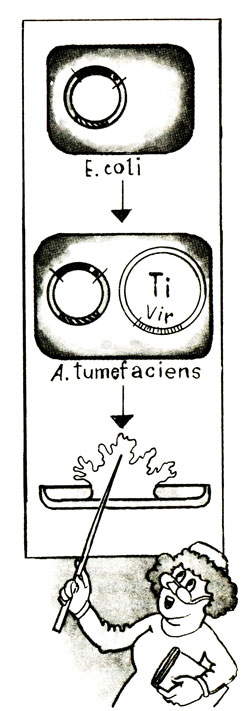
Рис. 20
Этот принцип был положен в основу создания векторов, названных бинарными. Сотрудники лаборатории профессора Р. Шильперурта в Голландии еще в 1983 году (недаром он считается годом рождения генной инженерии растений) сделали важное наблюдение. Они сконструировали две плазмиды. Одна из них представляла собой "обезоруженную" Ti-плазмиду, лишенную Т-района, но сохранившую гены Vir. Другая была создана на основе плазмиды R772, вовсе не имеющей отношения к агробактериям, но способной в них стабильно существовать. В плазмиду R772 вшили Т-район Ti. Когда обе эти плазмиды ввели в агробактерии и заразили растения, то на них образовались корончатогалловые опухоли. Как же так? Плазмида Ti в этих бактериях дефектна, лишена онкогенов, а опухоли образуются? На самом деле в этом нет ничего сверхъестественного. Просто здесь четко прослеживается взаимодействие двух плазмид. Гены vir дефектной плазмиды Ti обеспечивают, как им и положено природой, перенос Т-ДНК из бактерии в растения, не различая, находится ли Т-ДНК и vir-гены в одной и той же плазменной молекуле или на разных.
На основе подобных наблюдений стали создавать удобные в работе бинарные векторы. Один из них, обозначенный Вin 19, получен в США в лаборатории М. - Д. Чилтон. Плазмида Bin 19 сконструирована на основе плазмиды широкого спектра хозяев RK2, способной поддерживаться в агробактериях. К небольшому участку этой плазмиды, обеспечивающему ее репликацию в агробактериях, был присоединен химерный ген устойчивости к канамицину (npt) под контролем сигнальных элементов гена nos, сам ген nos, ген npt под контролем бактериальных сигнальных элементов, а также повторы, находящиеся на левом и правом фланге Т-района. Вектор Bin 19 переносили в агробактерии, уже содержащие Ti -плазмиду, несущую Vir -район, но лишенную Т-района. За переносом вектора в растениях следили по появлению трансформированных клеток, устойчивых к канамицину. В таких клетках, как и в сформировавшихся из них тканях, активно работали гены, включенные в состав вектора.
Использование бинарных векторов облегчило проблему введения в агробактерии генов, предназначенных для переноса в растения, и открыло новые возможности для поиска и клонирования генов растительных.
Завершая разговор о плазмидных векторах, отметим одну деталь. Хотя приведенные здесь примеры относились к Ti-плазмидам, те же подходы используют и при создании систем для переноса генов в растения на основе Ri-плазмид ризогенных бактерий. Они имеют даже некоторые преимущества, например не нуждаются в "обезоруживании", поскольку, в отличие от клеток корончатых галлов, клетки, включившие Т-ДНК Ri -плазмид, способны, как уже говорилось, формировать нормальные растения. Поэтому векторные системы на основе Ri-плазмид особенно хороши, когда гены переносят в те виды растений, которые могут регенерироваться из трансформированных корневых клеток. К ним относятся репа, морковь, томаты и другие.
Последнее время конструируют принципиально новые векторы для переноса генов в растения. Некоторые из них основаны на использовании вирусов растений. Чаще всего для этой цели используют вирус мозаики цветной капусты (CaMV). В природе этот вирус заражает только крестоцветные растения, однако известно, что в экспериментальных условиях он способен поражать и другие виды. Геном CaMV представляет собой небольшую двунитевую кольцевую ДНК. Некоторые из генов вируса несущественны для его жизнедеятельности и поэтому могут быть заменены на другие, интересующие исследователя. Расчет здесь на то, что проникнув, как ему и положено природой, в растительную клетку, вирус внесет в нее не только свою собственную ДНК, но и встроенный в нее чужеродный ген. Оказалось, что это действительно так. В 1984 году ученые из Базельского биоцентра в Швейцарии и среди них Инго Патрикус, один из основных разработчиков методов прямого переноса генов в растения, о которых будет рассказано далее, заменили один из малонужных генов вируса CaMV на бактериальный ген устойчивости к триметоприму и добились его стабильного размножения в турнепсе.
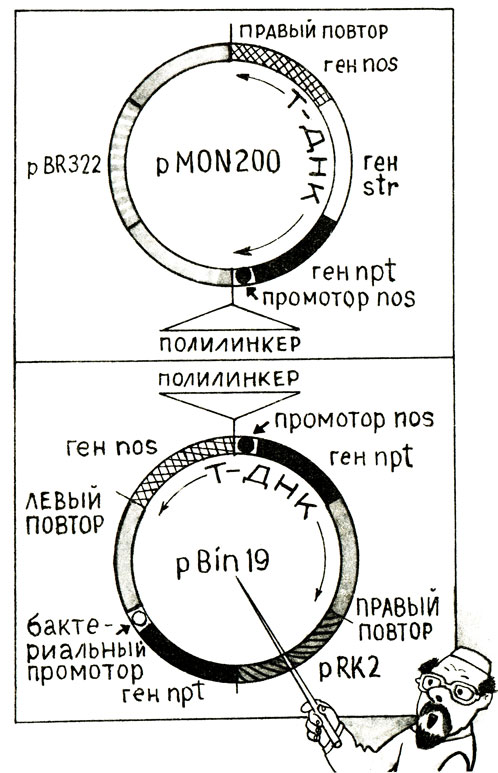
Рис. 21
Однако вирусная инфекция губит растительную клетку, поэтому цель ученых - "обезоружить" вирус CaMV и использовать его как промежуточный вектор. Привлекательность этого объекта состоит еще и в том, что по крайней мере два его гена находятся под контролем промоторов (их называют 19S и 35S), превосходящих по своей силе промоторы генов синтеза опинов из Ti-плазмид. Использование таких сильных промоторов, как мы узнаем из следующей главы, оказалось очень полезным для повышения эффективности работы введенных генов в растениях.
Возможно, что вскоре удастся заставить служить векторами и другую группу вирусов растений, геном которых также образован ДНК, но не двунитевой, как у CaMV, а в виде одного или двух небольших однонитевых колец. В природе такие вирусы разносятся насекомыми. К вирусам этого типа относятся вирус золотой мозаики томатов, вирус исчерченности кукурузы и другие. Уже показана возможность переноса генетического материала этих вирусов в растения не в результате вирусной инфекции, а через посредничество Ti-плазмид. Этот процесс называют агроинфекцией. Между прочим, агроинфекция очень чувствительный тест, позволяющий проследить за тем, может ли Т-район проникнуть в растения. С его помощью, как мы узнаем ниже, удалось установить, что Ti-плазмиды агробактерий можно использовать как векторы для переноса генов и в однодольные растения, в том числе злаки.
Список вирусов, способных быть переносчиками желаемых генов в растения на этом, однако, не кончается. Существует еще одна большая группа вирусов растений, у которых генетический материал представляет собой молекулу РНК. Вирусы этой группы способны с высокой частотой проникать в растительные клетки, активно в них размножаться и тем самым обеспечивать высокий уровень экспрессии введенных генов за счет увеличения их количества. РНК-овые вирусы заражают широкий круг растений. Первые работы по их использованию в качестве векторов уже начаты. Например, один из генов вируса табачной мозаики, кодирующий белок вирусной оболочки, был использован для создания in vitro его кДНК-копии. К ней присоединили необходимые регуляторные элементы и с помощью "обезоруженной" Ti-плазмиды перенесли в табак. Трансформированные клетки табака начали синтезировать вирусный белок оболочки. Интересно, что, когда растения, полученные путем регенерации этих трансформированных клеток, заражали нормальным вирусом ВТМ, симптомы болезни были очень стертыми, либо вовсе не проявлялись.
Все рассмотренные здесь векторные системы основаны на использовании плазмид или вирусов растений. Но существует еще один способ "забросить" нужные гены в растения. Связан он с использованием МГЭ - мобильных генетических элементов, о которых речь шла выше, однако понять каким образом они могут служить векторами для растений мы приглашаем лишь самых любознательных читателей.
Возможность использовать для переноса генов в растения бактериальные транспозоны открыла работа молодого венгерского исследователя Чабы Конча. Он сумел видоизменить транспозон устойчивости к канамицину Тп5, включив в него последовательности из плазмиды широкого спектра хозяев RK2, необходимые для ее репликации и переноса между бактериями, и окружив их повторами из 25 пар нуклеотидов - теми самыми, без чьей помощи Т-ДНК не может внедриться в растительный геном. Такой искусственно созданный элемент был назван Tn5-RV. Подобно Tn5, он способен "прыгать" в различные ДНК, но может и кое-что другое.
Представим себе, что Tn5-PV еще в клетках E.coli попал в какую-то гибридную плазмиду, содержащую ген, который желательно перенести в растения. Но плазмида не способна служить вектором. Векторные свойства ей придает внедрение Tn5-PV: присутствующие в этом элементе последовательности из 25 пар нуклеотидов теперь как бы заключают между собой всю плазмидную ДНК. В агробактериях, несущих "обезоруженную" Ti-плазмиду, гибридная плазмида, включившая Tn5-PV, начинает вести себя как обычный бинарный вектор, эффективно переносится в растения и встраивается подобно Т-ДНК в растительный геном. Использование Tn5-PV избавляет ученых от необходимости конструировать специальные векторы, поскольку в растения теперь может быть передан любой фрагмент ДНК, куда встроился подобный элемент. Tn5-PV дает прямую и простую возможность для переноса и последующего изучения работы различных генов в растениях.
Предпринимаются также попытки использовать в качестве векторов и собственные мобильные элементы растений, например, ту же, ставшую классической, систему Ас - Ds у кукурузы, о которой рассказывалось в предыдущей главе. Надеются, что предназначенный для переноса ген можно будет встроить в дефектный Ds-элемент и использовать для трансформации растений Ti-плазмиду, в качестве помощника содержащую нормальный по способности к перемещениям Ас-элемент. Уже появились сообщения о том, что таким способом фрагмент чужеродной ДНК удалось перенести в клетки табака.
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'