
42. Что происходит в репликационной вилке?
Нити ДНК перекручены одна вокруг другой. Для обеспечения полуконсервативной репликации обеих нитей их необходимо раскрутить. Это раскручивание осуществляется АТФазой, носящей название геликаза (кодируемой геном rep Е. coli). Раскручивание нитей ДНК вызывает напряжения в молекуле, что приводит к перекручиванию всей молекулы вокруг оси и появлению супервитков. Эти супервитки элиминируются белками, названными топоизомеразами, которые способны вызывать переходящие и обратимые разрывы фосфодиэфирных связей. Различают два типа топоизомераз: топоизомераза I, лишенная АТФазной активности и вызывающая обратимые разрывы одиночных цепей (протеин ω у Е. coli); топоизомераза II, обладающая АТФазной активностью и вызывающая разрывы двойной цепи. Примером служит фермент топоизомеразы II, гиразы, состоящей из двух субъединиц, одна из которых кодируется геном gyr А и чувствительна к действию налидиксовой кислоты, а другая, кодируемая геном gyr В, - к новобиомицину. Репликация ДНК бактерий ингибируется обоими агентами, кроме штаммов, получивших в результате мутации гиразу, устойчивую к налидиксовой кислоте и новобиомицину. Раскручивание обеих цепей ДНК приводит к образованию однонитчатых зон. Эти зоны должны быть стабилизированы (предотвращение спаривания и восстановления двойной спирали) и защищены от действия ДНКазы. Эти функции выполняются протеином, названным DNA binding protein (ДНК-связывающий белок), который специфически связывается с одиночными цепями ДНК. Этот комплекс (ДНК + ДНК-связывающий белок), по-видимому, является субстратом для ДНК-полимеразы III.
Все известные ДНК-полимеразы могут синтезировать ДНК только в присутствии затравки, а при ее отсутствии они не могут инициировать синтез. Синтез затравки осуществляется белком-инициатором, названным примазой, который необходим для репликации бактериальной хромосомы. Имеются мутанты, термочувствительные по этому белку (dna Gts E. coli). In vitro белок-инициатор катализирует полирибонуклеотидную затравку, начиная с рибонуклеозидтрифосфата, т. е. его активность аналогична активности РНК-полимеразы, но отличается от нее некоторыми физико-химическими свойствами. Например, этот белок нечувствителен к рифампицину (специфический ингибитор бактериальной РНК-полимеразы). Значит, первый рибонуклеотид неподвластен корректирующему действию экзонуклеазы 3′ → 5′, осуществляемой ДНК-полимеразой, хотя впоследствии он все же элиминируется. ДНК-полимераза может перемещать инициаторный белок и использовать рибонуклеотидную затравку для синтеза фрагмента ДНК (фрагмент Оказаки). Таким образом, взаимное действие белка-инициатора и ДНК-полимеразы III ведет к образованию цепи ДНК 5′ → 3′, содержащей на 5′-конце фрагмент РНК и ДНК, соединенную с этим фрагментом на 3′-конце ковалентной связью. Для получения готовой ДНК, во-первых, необходимо удалить рибонуклеотидную затравку и, во-вторых, репарировать в этом месте цепь, полимеризуя дезоксирибонуклеотидтрифосфаты. Удаление затравки - функция ДНК-полимеразы I, как и заполнение бреши в цепи путем замены рибонуклеотидов на дезоксирибонуклеотиды. Итак, одна цепь ДНК реплицируется непрерывно в направлении движения вилки. Синтез второй цепи осуществляется путем образования фрагментов. Сшивка фрагментов обеспечивается полинуклеотидлигазой, которая образует связь между 3′-ОН и 5′-монофосфатом (рис. 17).
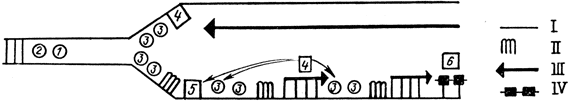
Рис. 17. Схема репликационной вилки: 1 - геликаза; 2 - топоизомераза; 3 - белок, стабилизирующий однонитчатую ДНК; 4 - ДНК-полимераза III; 5 - примаза; 6 - ДНК-полимераза I; 7 - лигаза; I - матричная цепь; II - РНК, синтезируемая под контролем белка-инициатора; III - ДНК, синтезируемая ДНК-полимеразой III; IV - ДНК, синтезируемая ДНК-полимеразой I
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'