
IV.3.1. Изучение генетического контроля синтеза бурого глазного пигмента у дрозофилы
Бидл и Эфрусси (1935) изучили метаболический путь, нарушение которого различными мутациями приводило к изменению окраски глаз у дрозофилы (Drosophila melanogaster), и выявили характер неаллельных взаимодействий генов, контролирующих ее.
С помощью химического анализа они установили, что в глазах мух дикого типа имеются два пигмента - бурый и красный. Гибридологическим методом определили, что мутации, контролирующие ярко-красную окраску глаз, затрагивают различные гены, локализованные в разных хромосомах: vermillion (v) в I хромосоме, cinnaber (cn) во II хромосоме, scarlet (st) и cardinal (cd) в III хромосоме. Авторы установили, что в глазах всех этих мутантных мух отсутствует бурый пигмент.
Биохимические эффекты действия каждой из этих мутаций выявили с помощью трех методов:
- Трансплантацией имагинальных дисков из личинок мух одного генотипа в гемоцель личинок мух другого генотипа.
- Химическим анализом продуктов мутантных генов.
- Кормлением личинок разными предшественниками пигмента (или их инъекцией).
Имагинальные диски закладываются и растут в период личиночной стадии насекомого и представляют собой зачатки органов взрослой мухи. Имплантация имагинального диска, из которого в течение окукливания развивается глаз, в личинку-реципиента приводит к тому, что на брюшке реципиента развивается дополнительный глаз, содержащий определенные пигменты. Его фенотип определяется взаимодействием генных продуктов, вырабатываемых в трансплантанте и в реципиенте (рис. IV.3).
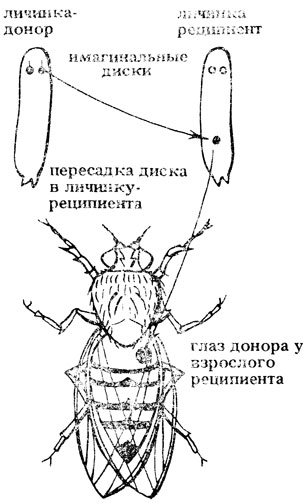
Рис. IV.3. Трансплантация имагинальных дисков у дрозофилы (Drosophila melanogaster)
Глаз можно вскрыть, определить пигменты и их количества. При пересадке имагинальных дисков из мутантных мух cinnabar (или vermillion) в личинку нормальных мух на брюшке реципиента ("хозяина") развивались красные глаза, как у нормальных мух. Это говорит о том, что в теле нормальных мух содержатся и могут диффундировать какие-то промежуточные вещества, способные превращаться в бурый пигмент, отсутствующие у мутантов. Пересадка имагинальных дисков из личинок vermillion в личинку cinnabar также приводила к образованию бурого пигмента. Реципрокная пересадка - cinnabar→vermillion, а также трансплантации от доноров с генотипами st/st или cd/cd в мух с генотипами +/+ , или cn/cn, или v/v - не вызывали образования бурого пигмента, и пересаженный глаз оставался ярко-красным (табл. IV.1).

Таблица IV. 1. Образование бурого пигмента в пересаженных глазах дрозофилы
Примечание. + наличие пигмента, - отсутствие пигмента.
На основе этих данных Бидл и Эфрусси сделали вывод, что бурый пигмент формируется по следующему метаболическому пути: предшественник→вещество I→вещество II→вещество III→бурый пигмент.
В личинке-хозяине дикого типа Урансплантанты мутантов v/v и cn/cn получают вещества, которые ни способны превращать в бурый пигмент. При трансплантации v→cn пересаженная ткань получает от реципиента вещество, необходимое для образования бурого пигмента, реципрокная пересадка (cn→v) не дает такого эффекта. Очевидно, в личинке cn/cn отсутствует вещество, необходимое для синтеза бурого пигмента. Из этого следует, что эти мутации нарушают разные этапы биосинтеза и мутация cinnabar действует на более позднем этапе. Следовательно, у мутанта vermillion блокирована реакция превращения предшественника в вещество I, у мутанта cinnabar - реакция превращения вещества I в вещество II. Они были выделены, идентифицированы и синтезированы; установлена последовательность реакций, ведущих к образованию бурого пигмента - оммохрома. Анализ промежуточных продуктов у мух с разными генотипами показал, что у мутантов vermillion образуется и накапливается "предшественник" - триптофан, у мутантов cinnabar накапливается кинуренин (вещество I), у мутантов starlet и cardinal - оксикинуренин (вещество II).
Об этом же свидетельствуют опыты с кормлением личинок недостающими веществами (или их инъекцией). Так, кормление личинок генотипа v/v формилкинуренином и кинуренином приводило к образованию бурого пигмента. При кормлении личинок cn/cn этими же веществами бурый пигмент не образовывался.
Пересадки от доноров st/st и cd/cd в реципиентов даже дикого типа не приводили к образованию бурого пигмента, что позволяет сделать вывод о том, что эти мутации блокируют следующий этап биосинтеза и вещество III неспособно диффундировать из реципиента в трансплантант (рис. IV.4).
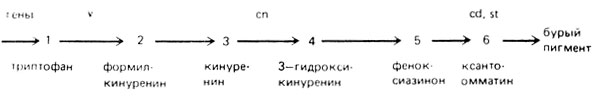
Рис. IV.4. Схема образования бурого глазного пигмента у дрозофилы и его генетический контроль, v - vermillion, 1,33; cn - cinnabar 2,57,3; st - scarlet - 3,44,0; cd - cardinal 3,75,7 - мутации, обусловливающие ярко-красную окраску глаз
Очевидно, зная последовательность реакций, ведущих к образованию бурого пигмента и этапы биосинтеза, которые блокируются мутациями соответствующих генов, можно предсказать характер взаимодействия этих генов. Любой ген, контролирующий ранние этапы биосинтеза, очевидно, должен проявлять эпистатичное действие по отношению к генам, контролирующим более поздние его этапы.
Это хорошо подтверждается данными гибридологического анализа. У потомков первого поколения, полученных от скрещивания самок cn с самцами v, глаза красные (дикий тип), что свидетельствует о наличии у них как красного, так и бурого пигментов. В F1 обратного скрещивания (♀v×♂cn) самки имеют красные, а самцы - ярко-красные глаза, а в F2 появляются особи с красными и с ярко-красными глазами в соотношении 3/8:5/8. Эти расщепления с позиций формально-генетического подхода можно объяснить либо как комплементарное взаимодействие аллелей cn+ и v+, либо как двойной рецессивный эпистаз. Однако знание конкретного биохимического механизма действия этих генов и метаболического пути, который они контролируют, указывает на то, что в данном случае проявляется эпистатическое действие аллеля v, так как он прерывает метаболический путь вначале. Этот пример демонстрирует необходимость анализа неаллельных взаимодействий на биохимическом уровне - только такой подход может объяснить истинный характер этих взаимодействий. Он свидетельствует также о возможности участия многих генов в контроле ряда последовательных реакций и объясняет механизм эпистатического взаимодействия.
Эффекты взаимодействия могут проявляться между генами, контролирующими два или больше разных метаболических путей, но имеющих одного общего предшественника:
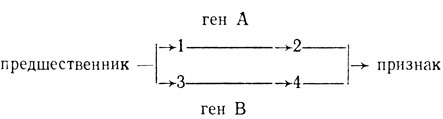
Если синтез предшественника ограничен, то может возникать конкуренция за него, приводящая к изменению фенотипа, вследствие усиления одной из цепей метаболизма. Например, некоторые окраски цветков у растений зависят от наличия нескольких пигментов, в частности от антоциана и антоксантина, имеющих общего предшественника.
Наконец, проявление целого ряда признаков может определяться множеством независимых метаболических реакций, контролируемых многими генами. Так, например, у животных окраска шерсти зависит от закладки нервного валика, из которого развиваются меланобласты, от изменения скорости их миграции из него; от образования меланоцитов - специализированных клеток, в которых образуются меланосомы; от типа меланосом (амеланические - без пигмента или меланические). Недостаток мелано-бластов, уменьшение скорости их миграции, изменение формы меланоцитов приводит к ослаблению окраски, пегости, альбинизму. Все многообразие окраски млекопитающих и птиц зависит также от наличия или отсутствия меланина, который существует в двух формах - эумеланин (коричневый или черный пигмент) и феомеланин (желтый или красноватый пигмент), и его распределения.
Каждый из перечисленных выше процессов находится под контролем более 70 генов, а окраска есть результат взаимодействия продуктов этих генов.
Изучение различных мутантов с помощью генетических, молекулярно-генетических, биохимических методов служит источником для выделения и идентификации продуктов действия отдельных генов, способствует пониманию существа аллельных и неаллельных взаимодействий и решению других задач генетического анализа, связанных с исследованием механизмов генетических процессов.
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'