
7.5. Прогнозирование на основе тестов иммунологического мониторинга
Чрезвычайно перспективной ветвью иммунологического мониторинга, формирующейся в последние годы, является прогнозирование клинического процесса на основании определенных иммунологических показателей.
Исходя из концепции о том, что сила иммунного ответа у человека генетически детерминирована (см. 6.3.1), логично было предположить, что по определенным иммунологическим показателям, характеризующим тип иммунного ответа (высокий - низкий), можно прогнозировать характер клинического процесса и его исход, а также заранее планировать тактику лечения. Эти предположения и попытки их реализовать относятся к концу 70-х годов; они пока немногочисленны и были осуществлены практически одновременно в нескольких исследовательских коллективах.
Интересный вариант динамического наблюдения, позволяющий прогнозировать исход трансплантаций, предположили F. Thomas и соавт. (1977). На основании предоперационного определения динамики РБТ на ФГА были выделены две группы пациентов - с низким и высоким уровнем бласттрансформации. После пересадки неродственного трансплантата частота необратимых острых отторжений была значительно ниже, а одногодовая выживаемость значительно выше в "низко" реактивной группе по сравнению с оппозитной.
J. Schmidtke и сотр. (1979) для клинического прогнозирования судьбы трансплантата определяли до пересадки MLC, РБТ (на ФГА), количество T- и В-лимфоцитов и моноцитов. При пересадке почек от живых доноров авторы показали, что высокая MLC и высокая РБТ до трансплантации ассоциируются с кризами отторжения после пересадки, в то время как низкая - с отсутствием кризов.
Нами (Ю. М. Зарецкая, Г. М. Львицына, Г. С. Болотина) подробно изучено прогностическое значение ЭТ на двух клинических моделях; результаты анализа изложены ниже.
7.5.1. Прогностическое значение ЭТ при аллогенной трансплантации
Исходя из концепции о включении гликолитических митохондриальных ферментов в реализацию иммунной активности (а возможно, и в реализацию специфической активности IR-гена, см. 6.3.2), мы (Ю. М. Зарецкая, Г. М. Львицына) исследовали возможность использования ЭТ для прогнозирования течения раннего посттрансплантационного периода.
Как известно, 1 - 3-й месяц после трансплантации - период наиболее критический в "жизни" пересаженного органа, сопровождающийся наибольшим "отсевом" донорских почек и наибольшим числом кризов отторжения. Мы предположили, что высокий уровень α-ГФДГ-активности до операции, свидетельствующий о высокой напряженности иммунной активности лимфоцитов реципиента, должен означать плохой прогноз, особенно в ранние сроки после трансплантации, а низкая α-ГФДГ-активность до операции может, наоборот, предсказывать благоприятный прогноз.
На обследовании находилось 38 больных с пересаженной неродственной почкой, у которых был установлен фон α-ГФДГ-активности до трансплантации. Пациенты были условно разделены на 3 группы - с высокой (10 - 30 гранул на клетку), средней (3,1 - 10 гранул) и низкой (0 - 3 гранулы) активностью α-ГФДГ.
Эффективность трансплантаций оценивали по среднему сроку манифестации криза отторжения в группе, т. е. по коэффициенту отторжения (КО), определяемому как среднее число кризов на одного больного в группе. Определяли также фракцию пациентов с реакцией отторжения разной степени выраженности и фракцию пациентов с проявившимися инфекционными осложнениями.
Таблица 71
Прогностическое значение ЭТ (отношение между исходным фоном α-ГФДГ и прогнозом трансплантата за 1-й месяц после трансплантации)
| Группа | Число пациентов | Исходная активность аα-ГФДГ | Средняя несовместимость | Функция трансплантата за 1-й месяц | Фракция больных с инфекционными осложнениями, % | ||||
| степень* активности | средние значения | границы колебаний | срок первого криза (средний), сут | коэффициент отторжения (КО) | |||||
| 1 | 10 | Высокая | 17,0 ± 2,1 | 10,3 - 29 | 2,2 | 8,2 ± 1,2 | 1,33 ± 0,11 | 100 | 20 |
| 2 | 18 | Средняя | 6,2 ± 0,48 | 3,9 - 9,8 | 2,4 | 17,3 ± 2,4 | 0,78 ± 0,18 | 72 | 33 |
| 3** | 10 | Низкая | 1,36 ± 0,31 | 0,16 - 3,0 | 2,3 | 26,3 ± 2,6 | 0,32 ± 0,41 | 30 | 58 |
*(Степень активности устанавливали, основываясь назначениях α-ГФДГ-активности у здоровых людей: высокой считали значения выше 10, что составляет среднюю норму у здоровых [Соколов В. В. и др., 1974]; низкой считали значения меньше 4, что составляет нижнюю границу у здоровых [Подображникова О. К., 1973].)
**(У части больных этой группы не было кризов отторжения в течение 1-го месяца; в этом случае для выведения показателя считали, что криз наступал на 30-й день.)
Наблюдение за больными в 1-й месяц после трансплантации выявило существенные различия в течении послеоперационного периода у трех групп пациентов (табл. 71). У больных с исходной (до операции) высокой активностью α-ГФДГ значительно раньше проявлялась реакция отторжения: КО был в 4 раза выше, чем в группе с низкой исходной активностью аα-ГФДГ. У всех пациентов были налицо осложнения, связанные с началом криза отторжения или его манифестацией. При сравнительном анализе трех групп обращает на себя внимание определенная закономерность: уменьшение связанных с реакцией отторжения расстройств и осложнений находилось в прямой корреляционной связи с уменьшением фонового значения аα-ГФДГ-активности.
С другой стороны, мы отметили обратную зависимость для проявления инфекционных осложнений, учтенных за первый посттрансплантационный месяц: при высокой фоновой активности аα-ГФДГ гнойные и другие инфекционные осложнения отмечены примерно в 2 раза реже, чем у пациентов с исходной низкой аα-ГФДГ-активностью.
Был проведен анализ гистограмм (дифференциальное содержание лимфоцитов с низким, средним и высоким числом гранул в каждой клетке) реципиентов с целью определения его прогностического значения. В соответствии с данными литературы содержание гранул фермента в лимфоцитах здорового человека равно 10 - 11 [Соколов В. В. и др., 1975], поэтому мы считали клетки, содержащие более 10 гранул, активными, а более 20 гранул - высокоактивными.
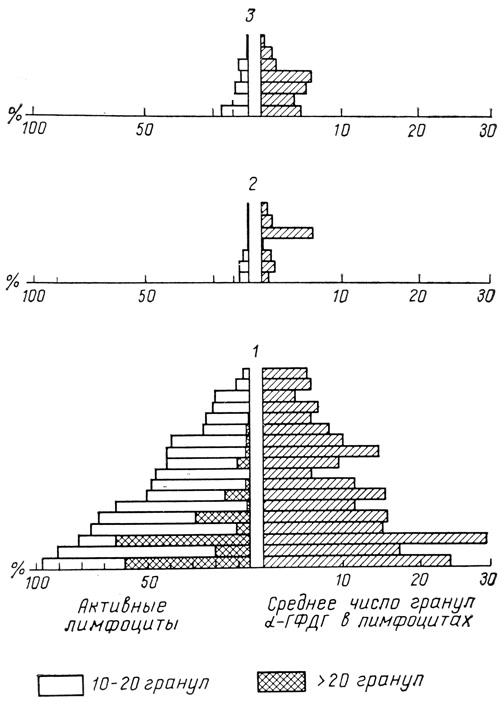
Рис. 35. Предоперационные гистограммы больных (слева) и α-ГФДГ-активность (справа). Группы больных: 1 - 'оторжение'; 2 - 'инфекция'; 3 - 'благополучное течение'. Пояснение в тексте
В данном анализе 32 пациента были распределены на группы: пациенты, имевшие кризы отторжения, составили группу, условно названную "отторжение", имевшие инфекцию - "инфекция" и 3-ю группу составили пациенты с благополучным течением, не имевшие ни кризов отторжения, ни инфекций за 1-й месяц после операции. Для каждой из названных групп были составлены гистограммы и результаты анализа отражены на диаграмме (рис. 35).
Обращает на себя внимание, что у всех больных, имевших ранние кризы отторжения, присутствовали в значительном (как правило) количестве активные и у 72% больных высокоактивные клетки. У 2 больных ("отторжение", рис. 35) фракция высокоактивных клеток была очень значительной (около 60%); у каждого из них криз отторжения в течение 1-го месяца имел место дважды. У некоторых пациентов этой группы значение исходной α-ГФДГ-активности ЛПК было не столь высоким (пациенты), однако наличие активных и высокоактивных форм, как видно из анализа гистограмм, совпадало с отягощенным течением послеоперационного периода.
Во 2-й группе ("инфекция") обращает на себя внимание отсутствие или крайне низкое содержание в исходном анализе активных и полное отсутствие высокоактивных клеток при общем крайне низком (за исключением одного случая) исходном фоне α-ГФДГ-активности.
Аналогичные отношения в гистограмме имеют место в группе, "прошедшей" 1-й месяц без осложнений, однако в ней исходный фон α-ГФДГ-активности был несколько выше, чем в группе "инфекция".
Таким образом, наш опыт показывает, что дооперационная активность α-ГФДГ в ЛПК может служить хорошим признаком, определяющим прогноз трансплантата.
Высокая исходная активность данного фермента дает основание для прогноза вероятного осложнения в функционировании трансплантата и манифестации кризов отторжения. В то же время вероятность инфекционных осложнений, по крайней мере в ранние сроки после трансплантации, при исходно высокой α-ГФДГ невелика.
Таблица 72
Характер иммунодепрессивной терапии в зависимости от исходной активности аα-ГФДГ в ЛПК
| Исходная ?α-ГФДГ-активность | Исходный анализ гистограмм | Основная опасность | Иммунодепрессивная терапия |
| Высокая | Наличие высокоактивных клеток | Криз отторжения | Сильная* |
| Отсутствие высокоактивных клеток | Криз отторжения | Сильная | |
| Средняя | Наличие высокоактивных или активных клеток | Криз отторжения | Сильная |
| Отсутствие активных клеток | Инфекция | Умеренная | |
| Низкая | Наличие активных клеток | Инфекция - криз отторжения | Умеренная (добавочно антибиотики) |
| Отсутствие активных клеток | Инфекция | Слабая (добавочно антибиотики) |
*(Понятие о силе терапии устанавливается каждым трансплантационным центром применительно к конкретным условиям и принятому протоколу лечения.)
Низкий исходный фон α-ГФДГ-активности прогнозирует незначительную вероятность кризовых ситуаций и в то же время значительную вероятность инфекционных осложнений. Возможные варианты иммунодепрессивной терапии в связи с этим прогнозом, дополненным дифференциальным анализом гистограмм, представлены в табл. 72.
7.5.2. Прогностическое значение ЭТ при неинфекционно-аллергической бронхиальной астме
Предполагая, что активность митохондриальных гликолитических ферментов, в частности α-ГФДГ, служит маркером напряженности иммунных процессов в организме (6.3.1), мы совместно с Г. С. Болотиной, Г. М. Львицыной и Л. К. Поповой предприняли попытку оценить прогностические возможности ЭТ на модели заболевания с четким аллергическим профилем.
В качестве модели была избрана неинфекционно-аллергическая форма бронхиальной астмы (НАБА), основным аллергическим инициатором которой являлась пыльца растений или домашняя пыль (ДП). Для этого вида патологии характерна сезонность проявления (обострение в сезон цветения растений), но сама болезнь присутствует всегда, поскольку контакт с аллергеном ДП постоянен. Особенностью терапии является цикличность, состоящая из курсов лечения, заканчивающихся к моменту предполагаемого обострения, т. е. поре цветения.
У 46 пациентов до начала очередного цикла лечения была определена активность α-ГФДГ в ЛПК. Основываясь на исходном фоне α-ГФДГ-активности, всех пациентов разделили на 2 группы: с низкой α-ГФДГ-активностью ЛПК (1 - 10 гранул на клетку) - 26 человек и с высоким исходным фоном α-ГФДГ-активности лимфоцитов (10,1 - 20 гранул) - 20 человек.
Больным назначались 2 разных вида терапии:
- специфическое лечение, проводившееся по схеме гипосенсибилизации, включало подкожные инъекции, смеси тех аллергенов (миксты), к которым пациент чувствителен; курс проводился по схеме десенсибилизации и состоял из 40 - 60 инъекций, заканчивающихся за 2 - 3 нед до начала поры цветения;
- неспецифическое лечение включало ингаляции интала (30 - 40 сеансов), начинавшиеся за 11/2 - 2 мес до начала критического периода и заканчивавшиеся за 1 мес до сезона цветения; лечение рассчитано на предотвращение выхода биологически активных веществ из тучных клеток.
Оценку результатов проводили по следующим показателям:
- переносимость терапии, под которой при специфическом лечении понимали отсутствие местных или общих осложнений, а при неспецифическом - отсутствие дискомфортных ощущений (осложнений);
- эффективность терапии - состояние пациента в период наибольшего контакта с аллергеном; при этом эффективным считали такой исход лечения, который обеспечивал состояние пациента, оцененное как "отличное" или "хорошее" по международной шкале оценки эффективности [Адо А. Д., 1978].
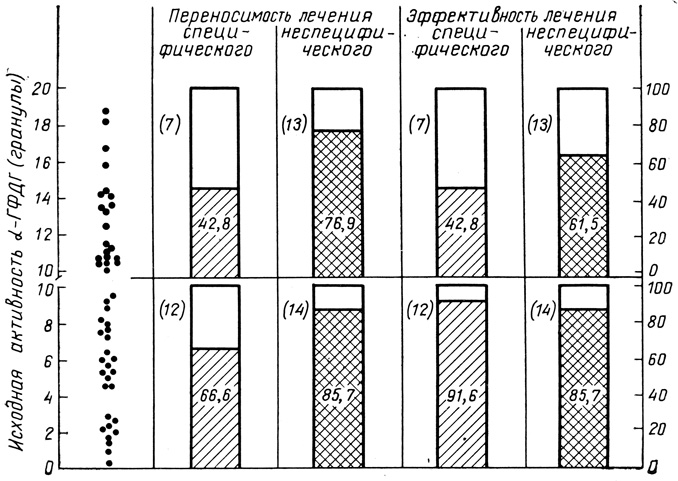
Рис. 36. Использование ЭТ для прогнозирования эффективности специфического и неспецифического лечения при неинфекционно-аллергической бронхиальной астме. Цифры в столбиках - положительный результат (%); цифры в скобках - число больных
Диаграмма, представленная на рис. 36, отражает результаты этих исследований.
В группе больных, имевших высокий фон аα-ГФДГ-активности ЛПК, переносимость лечения, особенно специфического, была хуже, чем в группе больных с исходной низкой активностью аα-ГФДГ.
Эффективность специфического лечения в группе с низкой активностью аα-ГФДГ была в 2 раза выше, чем в группе с исходной высокой активностью фермента.
На основании нашего анализа можно сделать вывод о характере терапии, которую следует применить к больному: в случае низких значений аα-ГФДГ в исходном анализе оба вида лечения оказываются приблизительно равными по эффективности, хотя неспецифическое лечение более переносимо, чем инъекции специфического аллергена. При высоком исходном значении α-ГФДГ предпочтительнее неспецифическая терапия, в частности инталом, которая легче переносится и оказывается более эффективной.
Таким образом, прогностическое определение α-ГФДГ-активности ЛПК при НАБА оказалось информативным: исходный высокий фон α-ГФДГ-активности прогнозирует осложненное течение НАБА, трудно поддающееся терапии, и в этом отношении результаты, полученные для прогноза аллогенного почечного трансплантата, аналогичны.
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'