
2.1.2. Нормальный кариотип человека в митозе и мейозе
2.1.2.1. Митоз
Клеточный цикл. На рис. 2.4 представлена схема клеточного цикла делящейся клетки млекопитающих. Приведенные временные интервалы хотя и относятся конкретно к клеткам гепатомы крысы in vitro, но для других клеток они почти такие же. На стадии G1 синтезируются белки и РНК, и клетка готовится к репликации ДНК, которая происходит в S-фазе. Как показали опыты с 3H-тимидином, поступающим в клетку в разное время на протяжении S-фазы, различные участки хромосом реплицируются асинхронно. С помощью радиоавтографии можно идентифицировать те участки хромосом, которые еще не завершили репликацию и поэтому включают меченый предшественник ДНК. Во время фазы G2, когда клетка готовится к митозу (M), происходит "внеплановый", или репаративный, синтез. На стадии G1 материал каждой хромосомы диплоидного набора (2n) представлен однократно. На стадии G2 каждая хромосома уже удвоена и два идентичных составляющих ее элемента называются сестринскими хроматидами. (Более правильным был бы термин "сестринские хромосомы", но терминология сложилась в то время, когда были известны только морфологические, а не биохимические аспекты митоза.) Поскольку материал каждой хромосомы теперь удвоен, то для клетки в целом имеет место (2×2n=4n)*.
* (Строго говоря, это так, но ситуацию в G2 принято обозначать в терминах числа хромосом как 2n=46 и в терминах содержания ДНК как 4c ДНК. - Прим. ред.)
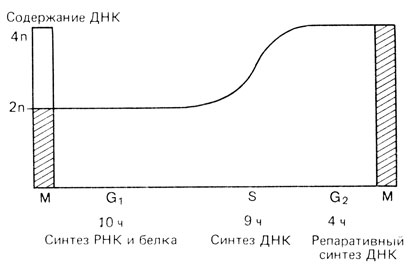
Рис. 2.4. Клеточный цикл делящейся клетки млекопитающего. В фазе G1 диплоидный набор хромосом (2n) представлен однократно. После синтеза ДНК (фаза S) диплоидный хромосомный набор удвоен (4n). М - митоз; заштрихованные столбики характеризуют содержание ДНК во время митоза. Подробности см. в тексте
Во время и после репликации две сестринские хроматиды обмениваются сегментами, так что обе хроматиды митотической хромосомы содержат участки другой хроматиды (сестринские хроматидные обмены, СХО). В этом можно убедиться с помощью специального окрашивания хромосом после обработки клеток аналогом тимидина - бромдезоксиуридином (БДУ) (рис. 2.5) [411].

Рис. 2.5. Сестринские хроматидные обмены в нормальной метафазе человека. Локализация обменов указана стрелками. (Courtesy of Dr. T. M. Schroeder-Kurth)
Митоз. Фазы митоза изображены на рис. 2.6. Митоз начинается с момента конденсации хроматина (рис. 2.6, А; ранняя профаза). К концу профазы хромосомы становятся отчетливо видимыми, обе сестринские хроматиды тесно прилежат одна к другой. В этот момент ядерная мембрана растворяется, ядрышко исчезает и формируется веретено деления. Оно состоит из микротрубочек, в состав которых входит белок тубулин. Микротрубочки обнаруживаются под микроскопом как нити веретена. Они соединяют центромерные районы хромосом с полюсами веретена - центриолями. Профаза завершается исчезновением ядерной мембраны, клетка вступает в метафазу. Центромеры всех хромосом располагаются в экваториальной плоскости между двумя полюсами. Хроматиды каждой хромосомы начинают отделяться одна от другой, оставаясь соединенными только в центромерной области. Наконец разделяются и центромеры, и сестринские "полухромосомы" расходятся к противоположным полюсам с помощью нитей веретена. Функцию микротрубочек веретена можно продемонстрировать, обработав делящиеся клетки колхицином. Колхицин препятствует агрегации молекул тубулина, разрушает микротрубочки, что приводит к дезорганизации хромосом в экваториальной пластинке и подавлению их анафазного движения к полюсам, хотя собственно разделение хроматид происходит и в присутствии колхицина. В последней фазе митоза, телофазе, хромосомы деконденсируются, нити веретена дезинтегрируются (микротрубочки при этом сохраняются в клетке), образуется новая ядерная мембрана и начинается клеточное деление. Наиболее подходящей стадией для исследования хромосом является метафаза.
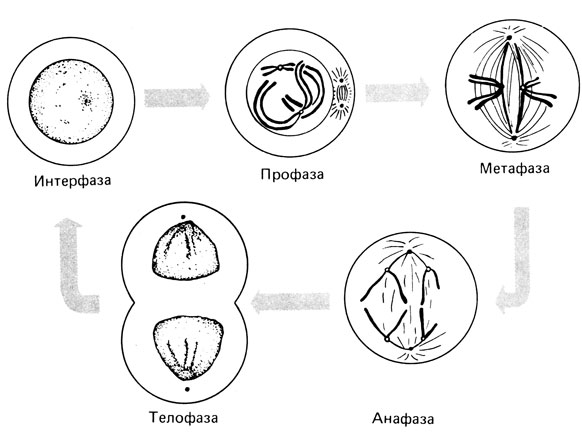
Рис. 2.6. Митоз. Изображены только 2 хромосомы из 46. (Buselmaier, 1976.)
2.1.2.2. Приготовление и окрашивание препаратов метафазных хромосом [201; 88; 406]
Препараты хромосом можно приготовить из всех тканей и клеточных суспензий, содержащих делящиеся клетки. У человека в большинстве случаев используют препараты из клеток костного мозга, кратковременной культуры крови или из длительной культуры фибробластов. Наиболее простым и доступным является метод культивирования клеток крови. Пункция костного мозга или биопсия кожи для культивирования фибробластов технически сложнее, и к тому же аспирация костного мозга - весьма неприятная процедура. Препараты из костного мозга имеют, однако, то преимущество, что дают возможность изучать митозы in vivo.
В крови здоровых людей (или больных, но не лейкозами) нет делящихся клеток. Однако митоз этих клеток можно стимулировать искусственно, например обработав их фитогемагглютинином ФГА). Спустя один час после инкубации с ФГА в малых (Т-) лимфоцитах отмечается синтез РНК, а через 24 ч начинается синтез ДНК. Суспензию лейкоцитов выращивают в культуральной среде 72 ч и затем готовят препараты хромосом. Чтобы остановить клетки в прометафазе, подавляют образование веретена деления веществами с колхициноподобным действием, предпочтительно колцемидом. В специальных условиях время культивирования можно сократить до 48 ч. Для свободного распределения хромосом в плоскости препарата клетки обрабатывают в течение 10-30 мин гипотоническим раствором, а затем фиксируют смесью этанола и уксусной кислоты. Каплю такой суспензии наносят на стекло, высушивают на воздухе и окрашивают.
Препараты клеток костного мозга получают из материала пункции грудины или подвздошной кости. Клетки культивируют только 2 ч с колцемидом. Процедура приготовления препаратов несколько отличается от процедуры, описанной выше. Культуру фибробластов получают из материала биопсии кожи. Ее измельчают и выращивают в культуральной среде таким образом, чтобы кусочки были прикреплены к поверхности культурального сосуда. Через 10 дней клетки начинают расти по этой поверхности, через 21 день готовят суспензию и делают препараты.
Окрашивание. Наиболее простой способ окрашивания - красителем Гимза или 2%-ным ацетоорсеином, или 2%-ным ацеткармином. Эти красители окрашивают хромосомы целиком, равномерно и интенсивно. Для некоторых диагностических целей (например, для выявления численных аномалий хромосом) этот метод вполне достаточен. Для получения более детальной картины структуры хромосом и идентификации отдельных хромосом или их сегментов используются различные способы дифференциального окрашивания.
Дифференциальное окрашивание. Многие исследователи отмечали в хромосомах, окрашенных по обычной методике, некоторую неоднородность в плотности окрашивания отдельных участков. Этот факт оставался без внимания, пока Касперсон с сотр. (1968) [320] не обнаружили, что после обработки акрихин-ипритом флуоресценция по длине хромосомы распределена не равномерно, а в виде сегментов. Затем Касперсон с сотр. показали, что каждую хромосому человека можно надежно идентифицировать с помощью такого метода окрашивания. Вскоре после этого стало ясно, что очень сходный рисунок сегментации можно получить и с помощью красителя Гимза, если дополнить процедуру окрашивания некоторыми приемами. Многие исследователи предложили методики для окрашивания прицентромерных районов. Было показано, что частичная тепловая денатурация также приводит к выявлению сегментов в хромосомах. На Парижской конференции по стандартизации и номенклатуре хромосом человека в 1971 г. [468] полученные к тому времени данные были сопоставлены, и оказалось, что все методы выявляют в принципе одни и те же структуры, но каждый из них специфичен в отношении определенных хромосомных сегментов.
Общепринятые методы [341; 200]. Различные типы сегментов обозначают по методам, с помощью которых они выявляются наиболее отчетливо:
а) Q-сегменты (quinacrine, акрихин) - участки хромосом, флуоресцирующие после окрашивания акрихин-ипритом или сходными соединениями.
б) G-сегменты (Giemsa, Гимза) выявляются при окрашивании красителем Гимза в сочетании с дополнительными процедурами, которые способствуют тому, что краситель адсорбируется наиболее интенсивно на определенных участках. Q- и G-сегменты идентичны. В большинстве лабораторий в повседневной работе предпочитают G-метод, поскольку он не требует использования флуоресцентного микроскопа и окрашенные препараты можно длительно хранить. Однако специфическое преимущество Q-метода состоит в том, что он позволяет даже в интерфазном ядре идентифицировать Y-хромосому человека по яркой флуоресценции.
в) R-сегменты (reverse, обратные) окрашиваются после контролируемой тепловой денатурации. Они располагаются между Q- (или G-) сегментами.
г) C-сегменты (constitutive heterochromatin, конститутивный гетерохроматин) ограничивают прицентромерные районы в обоих плечах хромосомы.
д) Т-сегменты (telomeric, теломерные) расположены в теломерных районах хромосом. Детальное описание этих методов можно найти в многочисленных публикациях. Многие лаборатории используют свои собственные модификации.
Химические различия, выявляемые методами дифференциального окрашивания. Природа химических различий, выявляемых этими методами, еще только исследуется. Обычно обсуждаются две основные гипотезы: так называемая ДНК-вая и белковая. Первая исходит из данных о том, что различные участки хромосом человека отличаются по количественному содержанию А-Т (аденин - тимин) и G-C (гуанин - цитозин) пар оснований. Акрихин-иприт связывается преимущественно с АТ-богатыми участками [466, 341]. Акридиновый оранжевый, соединяясь с одноцепочечной ДНК, дает красную флуоресценцию. После контролируемой денатурации R-сегменты окрашиваются в красный цвет. На основании этих данных можно предложить следующую гипотезу:
а) Q-сегменты соответствуют участкам, богатым А-Т-парами.
б) R-сегменты соответствуют участкам, богатым G-С-парами, которые более устойчивы к тепловой денатурации, чем А-Т-богатые участки.
Эта гипотеза не объясняет, однако, все особенности рисунка сегментации. С другой стороны, белковая гипотеза исходит из данных о том, что протеолитическая обработка индуцирует появление G-сегментов. Но поскольку разные ДНК связаны в хромосомах с разными белками, можно полагать, что рисунок сегментации тем или иным образом зависит от особенностей целостного комплекса ДНК-белок.
Окрашивание серебром районов ядрышкового организатора (ЯОР) [363, 511, 518]. Метод серебрения специфичен для ядрышкообразующих районов. Они видны как темные пятна на желто-коричневом фоне хромосом (рис. 2.7). При этом окрашиваются только те ЯОР, которые функционировали в предшествующей интерфазе.
Рис. 2.7. Окрашивание серебром (стрелки) районов ядрышковых организаторов акроцентрических хромосом. (Courtesy of Dr. T. M. Schroeder-Kurth.)
Хромосомы в сперматозоидах человека. Несколько лет назад был предложен метод приготовления препаратов хромосом непосредственно из сперматозоидов человека. Для этого сперму сначала инкубировали с ооцитами золотистого хомячка, лишенными блестящей оболочки, чтобы индуцировать митозы [489]. Этот метод весьма важен для прямого определения хромосомных аномалий в сперматозоидах человека. Однако его воспроизводимость очень плохая [431]. В одном исследовании частота хромосомных аномалий в сперматозоидах оказалась равной 8,5% [432].
2.1.2.3. Нормальный кариотип человека в метафазе митоза
Стандартное окрашивание. Хромосомы располагаются и нумеруются в зависимости от их длины. Согласно Денверской классификации, предложено нумеровать пары хромосом от 1 до 23 (1960). Патау (1960) [471] показал, однако, что в некоторых группах хромосомы нельзя однозначно классифицировать, и предложил идентифицировать пары на основании относительной длины и положения центромеры. В соответствии с этой последней характеристикой различают метацентрические, субметацентрические и акроцентрические хромосомы. Патау предложил разбить 23 пары на восемь групп от A до G. Это предложение было принято в качестве альтернативной процедуры. Все три пары метацентрических хромосом группы А можно идентифицировать. В группе E обычно легко выделить хромосому 16, а хромосомы 17 и 18 поддаются идентификации, только если препараты высокого качества. Y-хромосому обычно можно отличить от других хромосом группы G. Все остальные хромосомы групп B, C (включая X-хромосому), D, F и G не идентифицируются. Важным параметром является центромерный индекс, который отражает отношение (в %) длины короткого плеча к длине всей хромосомы.
Дифференциальное окрашивание. Кариотип человека представлен на рис. 2.8-2.10, использованы различные методы. В настоящее время каждую хромосому можно идентифицировать. На рис. 2.11 изображены схема распределения G- и Q-сегментов и их нумерация. Отдельные хромосомы, а также их наиболее часто встречающиеся "нормальные" варианты описываются следующим образом [392].
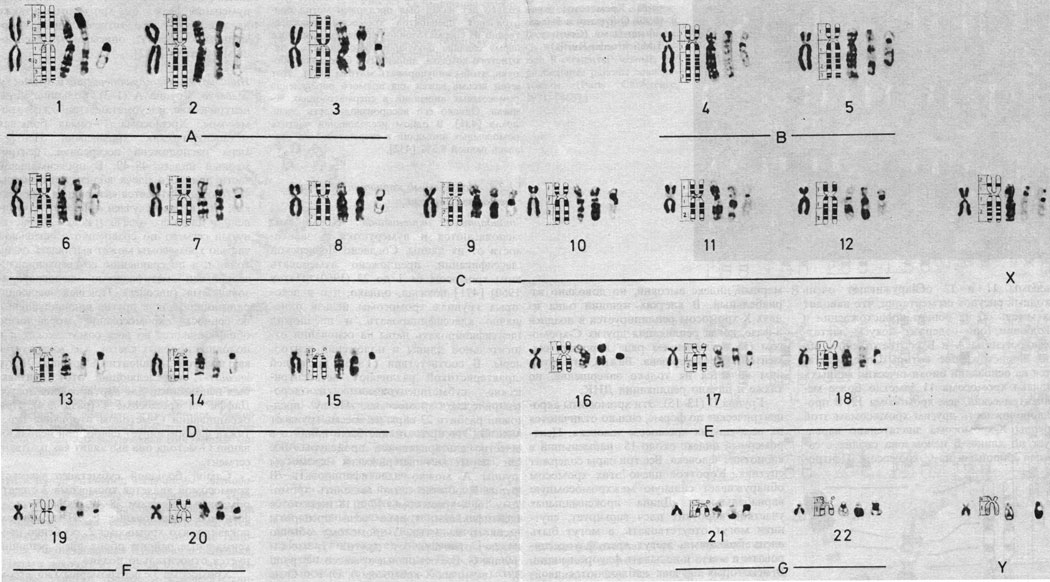
Рис. 2.8. Кариотип мужчины: хромосомы окрашены стандартным методом и методами, выявляющими характерную сегментацию. Слева направо: стандартное окрашивание; схематическое изображение рисунка сегментации; G-метод; R-метод; C-метод. (Courtesy of Dr. T. M. Schroeder-Kurth.)
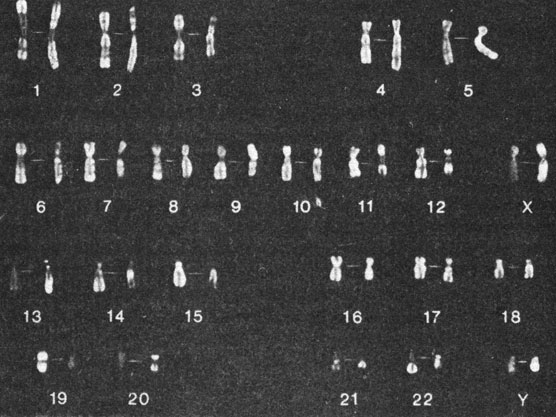
Рис. 2.9. Кариотип мужчины. Хромосомы окрашены Q - (справа) и R - (слева) методами. (Courtesy of T. M. Schroeder-Kurth.)
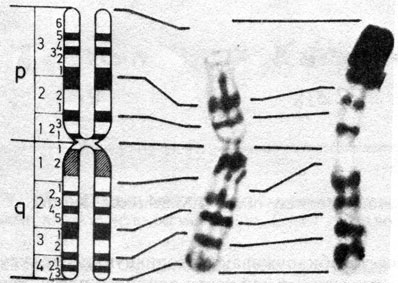
Рис. 2.10. Хромосома 1: сравнение реальной G- и R-сегментации со схематическим изображением G- и R-сегментов. (Courtesy of T. M. Schroeder-Kurth.)
![Рис. 2.11. Рисунок сегментации в соответствии с Парижской номенклатурой (G-, Q- и R-сегменты). Позитивные G- и Q-сегменты и негативные R-сегменты - черные, вариабельные районы заштрихованы (Paris Conference, 1971, [468].)](pic/000015.jpg)
Рис. 2.11. Рисунок сегментации в соответствии с Парижской номенклатурой (G-, Q- и R-сегменты). Позитивные G- и Q-сегменты и негативные R-сегменты - черные, вариабельные районы заштрихованы (Paris Conference, 1971, [468].)
Индивидуальные характеристики хромосом человека. Группа А (1-3). Большие, метацентрические и субметацентрические хромосомы. Хромосома 1-самая большая метацентрическая хромосома. Центромера расположена посередине, центромерный индекс 48-49. В проксимальной части длинного плеча вблизи центромеры часто обнаруживается "вторичная перетяжка", что в ряде случаев приводит к удлинению длинного плеча (рис. 2.12). Растянутый сегмент по сравнению с остальной частью хромосомы может выглядеть очень тонким, а по сравнению со сверхспирализованными метафазными - "недоспирализованным" (uncoiler). Признак "недоспирализации", как и другие индивидуальные особенности хромосомной морфологии, обнаруживается во всех соматических и в половине половых клеток, т. е. наследуется как простой доминантный признак. Локус uncoiler-1, определяющий этот признак, был использован для картирования локуса Даффи на хромосоме 1 (разд. 3.4). При окрашивании Q-методом вторичная перетяжка флуоресцирует слабо, при использовании G-метода она выглядит как плотный сегмент.
![Рис. 2.12. Гетероморфизм конститутивного гетерохроматина во вторичной перетяжке хромосом 1, 9, и 16; C-метод [406]](pic/000016.jpg)
Рис. 2.12. Гетероморфизм конститутивного гетерохроматина во вторичной перетяжке хромосом 1, 9, и 16; C-метод [406]
Самой большой субметацентрической хромосомой является хромосома 2 с центромерным индексом 38-40. Радиоавтографическое исследование с 3Н-тимидином показало, что хромосома 2, особенно проксимальные районы обоих плеч, реплицируется относительно поздно.
Хромосома 3 с центромерным индексом 45-46 почти на 20% короче хромосомы 1 и, следовательно, легко идентифицируется. При окрашивании Q-методом в проксимальном районе ее длинного плеча часто выявляется ярко флуоресцирующий сегмент. Интенсивность флуоресценции значительно варьирует у разных индивидов, но постоянна во всех клетках для одного и того же хромосомного варианта.
Группа B (4 и 5). Большие субметацентрические хромосомы (центромерный индекс 24-30) не различаются между собой без радиоавтографии или дифференциального окрашивания. Согласно данным радиоавтографических исследований, хромосома 4 является поздно реплицирующейся по всей своей длине, в то время как в хромосоме 5 поздно реплицируется только короткое плечо. Рисунки распределения R- и G-сегментов у этих хромосом совершенно различны.
Группа C (6-12). Хромосомы среднего размера, субметацентрические. При стандартном окрашивании X-хромосому нельзя отличить от других хромосом этой группы. Хромосомы 6, 7, 8, 11 и 12 являются относительно субметацентрическими, их центромерный индекс 27-35. В хромосоме 9 часто обнаруживают вторичную перетяжку в проксимальной части длинного плеча. Все эти хромосомы легко идентифицируются с помощью Q- и G-окрашивания. Вторичная перетяжка хромосомы 9 не окрашивается ни акрихином, ни красителем Гимза. Хромосомы 11 и 12 обнаруживают очень сходный рисунок сегментации, что наводит на мысль об их общем происхождении и эволюции (они содержат локусы лактатдегидрогеназы A и B соответственно, общее происхождение которых предполагается на основании биохимических данных). Однако хромосома 11 заметно более метацентрическая, чем хромосома 12. В противоположность другим хромосомам этой группы X-хромосома значительно варьирует по длине. В целом она сходна с самыми длинными из С хромосом. Центромерный индекс высокий, но довольно вариабельный. В клетках женщин одна из двух X-хромосом реплицируется в поздней S-фазе, когда репликация других C-хромосом (за исключением ряда коротких сегментов) уже завершена. Важно, что поздним является не только завершение, но также и начало репликации ДНК.
Группа D (13-15). Эти хромосомы акроцентрические по форме, сильно отличаются от всех других хромосом человека. Центромерный индекс около 15 - наименьший в кариотипе человека. Все три пары содержат спутник. Короткое плечо этих хромосом обнаруживает сильную межхромосомную вариабельность. Длина проксимальных участков коротких плеч варьирует, спутники могут отсутствовать, а могут быть очень большими, могут ярко флуоресцировать, а могут и не давать флуоресценции. В некоторых случаях наблюдаются двойные (тандемные) спутники. Длинные плечи трех хромосом четко различаются по Q- и G-сегментам. Для выявления вариантов в группе D-G сравнивают длины короткого плеча этих хромосом с длиной короткого плеча хромосомы 18 в той же клетке. Плечо считают длинным (ph +), если оно такой же длины, как короткое плечо хромосомы 18, и очень длинным, если оно длиннее короткого плеча этой хромосомы. Большие спутники обозначают (ps +), двойные спутники (pss), укороченное короткое плечо со спутниками или без них (ph -). Частота гетероморфизма гомологов в этой группе составляет 3,7% (8 из 216) в препаратах после дифференциального окрашивания и 2,3% (411 из 24400) в стандартных препаратах [422] (рис. 2.14).
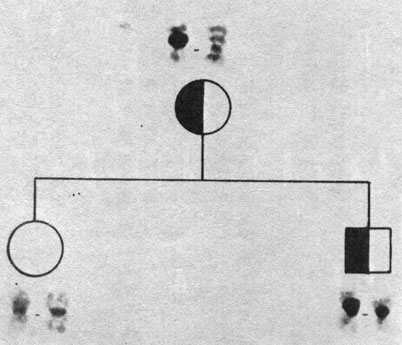
Рис. 2.13. Наследование C-хромосомы, содержащей особенно большой блок конститутивного гетерохроматина (C-сегмент), от отца дочери. (Courtesy of Dr. T. M. Schroeder-Kurth)
![Рис. 2.14. Гетероморфизм акроцентрических маркерных хромосом групп D или G. Первый ряд: нормальные хромосомы группы D и хромосома 18 для сравнения. Второй ряд: Dp +: короткие плечи такой же длины, как короткие плечи хромосомы 18; p+s: спутники нормальных размеров на удлиненных коротких плечах. Третий ряд: D-хромосомы со структурными вариантами спутничного района, ss - двойные спутники; s + - увеличенные спутники; st - удлиненные спутничные нити [1711]](pic/000018.jpg)
Рис. 2.14. Гетероморфизм акроцентрических маркерных хромосом групп D или G. Первый ряд: нормальные хромосомы группы D и хромосома 18 для сравнения. Второй ряд: Dp +: короткие плечи такой же длины, как короткие плечи хромосомы 18; p+s: спутники нормальных размеров на удлиненных коротких плечах. Третий ряд: D-хромосомы со структурными вариантами спутничного района, ss - двойные спутники; s + - увеличенные спутники; st - удлиненные спутничные нити [1711]
Группа E (16-18). Относительно короткие метацентрические или субметацентрические хромосомы. Хромосома 16 имеет центромерный индекс около 40. В среднем ее длина составляет чуть более одной трети длины хромосомы 1, но обнаруживает значительную изменчивость. В длинном плече примерно в 10% случаев выявляется вторичная перетяжка. Длина проксимального G-сегмента варьирует в зависимости от выраженности этой перетяжки. Хромосома 18 примерно на 5-10% короче хромосомы 17 и имеет более короткое длинное плечо (у хромосомы 17 центромерный индекс составляет 31 по сравнению с 26 у хромосомы 18). Хромосома 17 реплицируется рано, хромосома 18-поздно.
Группа F (19-20). Эти две хромосомы имеют центромерный индекс в пределах 36-46. В стандартных препаратах они выглядят одинаково, но при дифференциальном окрашивании резко различаются.
Группа G (21 и 22). У этих маленьких акроцентрических хромосом центромерный индекс варьирует в пределах 13-33. Они легко различаются по рисунку сегментации. Изменчивость их коротких плеч так же значительна, как и в хромосомах группы D. Здесь классифицируют такие же варианты, как и в группе D (рис. 2.14). Флуоресценция спутников и коротких плеч может быть слабой, умеренной и сильной, так же как и интенсивность окрашивания при использовании G-метода. В выборке из 2444 новорожденных 3,5% обнаруживают удлиненные короткие плечи. Другие варианты, такие, как гигантские спутники, удлиненные или укороченные короткие плечи, встречаются намного реже. По данным некоторых исследователей, общая частота вариантов хромосом группы G составляет 1,8% по препаратам с дифференциальным окрашиванием и 1,6% в стандартных препаратах. Короткие плечи хромосом группы D и G содержат ядрышковый организатор и специфично окрашиваются методом серебрения.
Y-хромосома обычно (но не всегда) больше, чем хромосомы группы G, и хроматиды ее длинного плеча, как правило, лежат параллельно одна другой. Этим она отличается от хромосом группы G, у которых хроматиды длинных плеч часто образуют широкий угол. Центромера видна менее четко, спутники отсутствуют, размер длинного плеча сильно варьирует, и некоторые варианты его длины наследуются. Центромерный индекс варьирует от 0 до 26 (в среднем ~ 16). При окрашивании акрихином обнаруживается довольно изменчивый ярко флуоресцирующий дистальный участок длинного плеча. Во многих случаях находят два сильно флуоресцирующих сегмента, реже - три. В популяционных исследованиях частота выраженных вариантов размеров длинного плеча Y-хромосомы составляет 5,6% (в выборке из 2444 новорожденных). В большинстве случаев Y-хромосома была удлиненной; у 5% новорожденных она оказалась длиннее F-хромосомы, у 0,33%-длиннее хромосомы 18; однако в 0,25% образцов была обнаружена очень маленькая Y-хромосома.
Хроматин [201, 516]. В интерфазных ядрах дистальный интенсивно флуоресцирующий участок длинного плеча Y-хромосомы выявляется как яркое пятно диаметром 0,3-1,0 мкм. На рис. 2.15 показан Y-xpoматин в эпителиальных клетках, гранулоцитах, больших лимфоцитах и в сперматозоидах.
![Рис. 2.15. Окрашивание акрихин-ипритом ядер из клеток мужчины с нормальным кариотипом. А. Слизистая оболочка рта, соскоб. Y-хроматин виден как двойная структура. Б. Гранулоцит периферической крови, мазок. Y-хроматин выдается из ядра. В. Большой лимфоцит периферической крови, мазок. Г. Сперматозоиды. Y-хроматин обнаруживается на краю сильно флуоресцирующей области головки (X 2400). [201]](pic/000019.jpg)
Рис. 2.15. Окрашивание акрихин-ипритом ядер из клеток мужчины с нормальным кариотипом. А. Слизистая оболочка рта, соскоб. Y-хроматин виден как двойная структура. Б. Гранулоцит периферической крови, мазок. Y-хроматин выдается из ядра. В. Большой лимфоцит периферической крови, мазок. Г. Сперматозоиды. Y-хроматин обнаруживается на краю сильно флуоресцирующей области головки (X 2400). [201]
Измерения хромосом. Измерения митотических хромосом сопряжены с определенными трудностями, так как положение центромеры не всегда можно определить достаточно точно. Парижская конференция (1971) [468] разработала рекомендации относительно измерений хромосом. В табл. 2.1 представлены усредненные данные о размерах митотических хромосом человека.
![Таблица 2.1. Относительная длина (в процентах от длины гаплоидного набора аутосом) и центромерный индекс (отношение длины короткого плеча к общей длине хромосомы × 100). Хромосомы окрашены орсеином или методом Гимза 9 и предварительно идентифицированы с помощью Q-метода. (Парижская конференция, 1971 [468].)](pic/000021.jpg)
Таблица 2.1. Относительная длина (в процентах от длины гаплоидного набора аутосом) и центромерный индекс (отношение длины короткого плеча к общей длине хромосомы × 100). Хромосомы окрашены орсеином или методом Гимза 9 и предварительно идентифицированы с помощью Q-метода. (Парижская конференция, 1971 [468].)
Данные получены H. A. Lubs, T. Hostetter, L. Ewing при исследовании 95 клеток от 11 нормальных индивидов (6-10 клеток от каждого). Средняя общая длина хромосом на клетку: 176 мкм. Стандартное отклонение представляет собой среднее от стандартных отклонений для каждого из 11 индивидов (6-10 клеток от каждого).
Гетероморфизм хромосом. Морфология отдельных хромосом не всегда одинакова у разных индивидов. Гетероморфизм особенно выражен в отношении размера спутничной области акроцентрических хромосом, длины Y-хромосомы, особенно ее гетерохроматического участка, и "вторичных перетяжек" хромосом 1 и 9. Характерен он и для гетерохроматических сегментов других хромосом (о гетерохроматине см. разд. 2.3.14). При анеуплоидии гетероморфизм гомологов по гетерохроматическим районам можно использовать для выяснения происхождения данной хромосомы от одного из родителей (разд. 5.1.2.3).
Во многих хромосомах обнаруживаются фрагильные (ломкие) участки, т. е. участки, подверженные хромосомным и хроматидным разрывам (разд. 2.2.2). Такие разрывы относительно просто индуцировать удалением фолиевой кислоты из питательной среды [390а]. Недавно обнаружена ассоциация фрагильного участка в дистальном районе длинного плеча Х-хромосомы с характерной формой умственной отсталости (разд. 8.2.1.2).
Высокоразрешающее дифференциальное окрашивание. Хромосомы в профазе и прометафазе конденсированы не столь сильно, как метафазные хромосомы. При обработке культуры лимфоцитов метотрексатом (для частичной синхронизации клеточного цикла) можно накопить достаточное число клеток, находящихся в профазе и прометафазе. Сокращение времени инкубации с колцемидом позволяет избежать сильной конденсации. В препаратах таких хромосом отдельные сегменты, выявляемые стандартными методами, можно подразделить на субсегменты. Степень разрешения зависит от стадии, на которой клетки были зафиксированы. Некоторые авторы описывают свыше 2000 сегментов [550]. Обычно в поздней профазе можно увидеть 800-1200 сегментов (рис. 2.16). Хотя этот метод не заменяет стандартный, используемый при рутинной диагностике, однако он полезен для более точной идентификации точек разрывов и мелких аберраций, например в случае наследуемых сбалансированных и несбалансированных транслокаций или особенно в цитогенетике опухолей.

Рис. 2.16. Схема, иллюстрирующая сегментацию хромосом человека (1700 сегментов). Широки темные и белые полосы это G-позитивные и G-негативные сегменты, видимые в прометафазе (стадия 850 сегментов), пунктирные линии соответствуют сегментам, различимым в средней профазе (стадия 1700 сегментов). (По Yunis, Hum. Genet., 56, p. 296, 1980.)
Электронно-микроскопическая картина хромосом [490, 517]. Чтобы выявить тонкую структуру хромосом человека, были использованы многочисленные методы электронной микроскопии. Современные модели организации генетического материала эукариот будут обсуждаться в разд. 2.3, здесь же достаточно сказать, что данные электронной микроскопии не противоречат модели, предполагающей, что хроматин состоит из сверхспирализованных нитей, причем имеется несколько порядков спирализации (рис. 2.17). Обнаружено три типа хроматиновых фибрилл: фибриллы первого типа имеют диаметр 250 А, фибриллы второго типа - 100 Å и третьего - только 30-50 Å. Имеются довольно убедительные доказательства того, что фибриллы этого последнего типа представляют собой генетически активный хроматин. Двойная спираль чистой ДНК имеет диаметр ~ 20 Å, следовательно, фибриллы 30-50 Å соответствуют диаметру нити ДНК вместе с белками (гистонами и негистонами). Фибриллы диаметром 100 Å отражают, по-видимому, вторичную спирализацию фибрилл 30-50 Å, а нити 250 Å могут отражать третичный уровень спирализации. В метафазной хромосоме эти "третичные спирали" могут иметь примерно такую укладку, как указано на рис. 2.17. Примерно девять фибрилл 250 Å, вероятно, каким-то образом связаны вместе, и два таких пучка образуют различимую на электронно-микроскопических изображениях спиральную структуру, характерную для каждой хромосомы [490]. В отдельных препаратах обнаруживаются остатки мембраны, предположительно ядерной. Некоторые исследователи считают этот факт доказательством того, что интерфазные хромосомы в разных точках прикреплены к мембране. Следует учесть, однако, что процесс приготовления препаратов для электронной микроскопии хромосом включает целый ряд процедур, и потому трудно решить, существуют ли эти или другие структуры in vivo или они являются попросту артефактами.
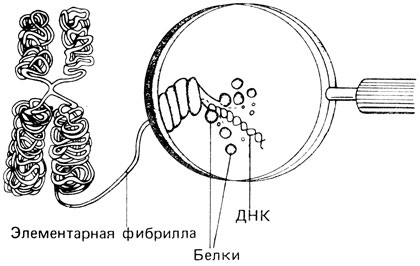
Рис. 2.17. Схематическое изображение хромосомы на стадии метафазы. (Buselmaier, Biologie für Mediziner, 1985.)
2.1.2.4. Мейоз
Биологическая функция мейоза. Благодаря митозу поддерживается постоянство числа хромосом в ряду клеточных поколений. В отличие от митоза мейотический процесс обеспечивает уменьшение (редукцию) диплоидного числа хромосом (46 у человека) наполовину до гаплоидного (23 у человека). При оплодотворении в результате слияния двух гаплоидных половых клеток в зиготе восстанавливается диплоидное число 46, которое сохраняется во всех последующих митотических делениях. В мейозе расхождение гомологичных хромосом в разные половые клетки происходит случайно, что увеличивает генетическую изменчивость. Соматические клетки являются диплоидными (2n), они содержат обе гомологичные хромосомы одной пары, в то время как половые клетки гаплоидны (n) и несут только один гомолог из каждой пары. Последний цикл регулярного синтеза ДНК происходит в интерфазе непосредственно перед первым мейотическим делением и предшествует фазам мейоза, показанным на рис. 2.18.
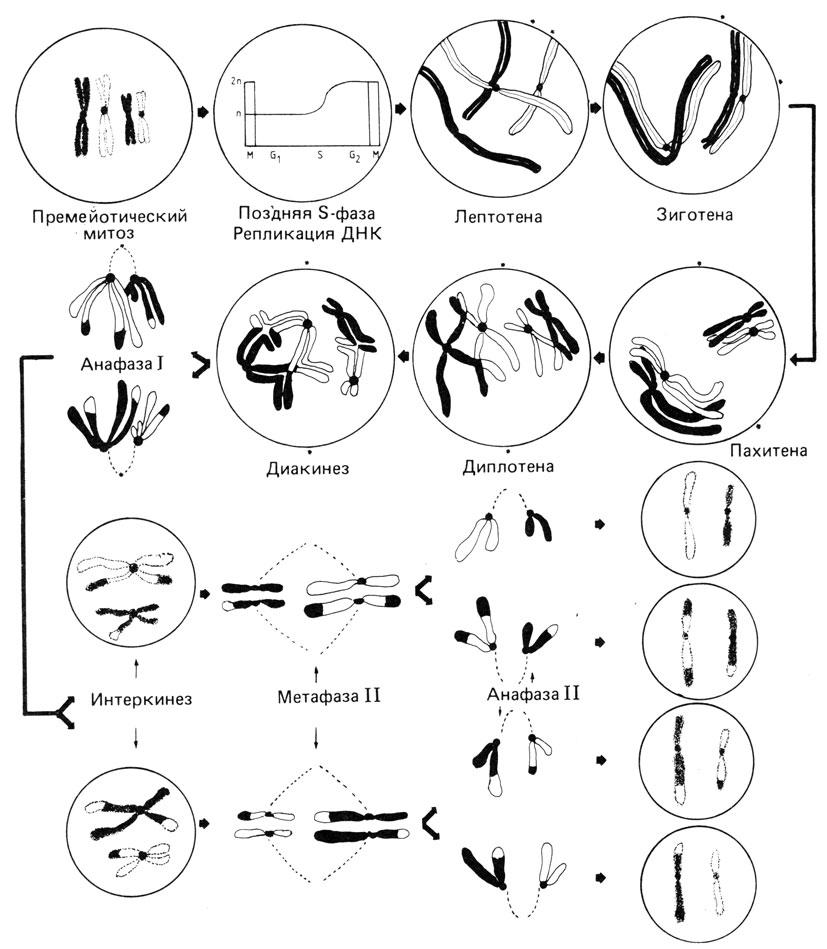
Рис. 2.18. Стадии мейоза. Отцовские хромосомы окрашены в черный цвет, материнские - в белый. На рисунке изображен мейоз у мужчины. В мейозе у женщины образуется полярное тельце
Первое деление мейоза. Профаза I. На этой стадии становятся видимыми длинные хромосомные нити (лептотена), затем происходит конъюгация (спаривание) гомологичных хромосом, которая часто начинается с теломерных районов (зиготена). Точный молекулярный механизм конъюгации хромосом еще не известен. Две конъюгированные гомологичные хромосомы (называемые на этой стадии "бивалентом") формируют на субмикроскопическом уровне характерную двойную структуру, так называемый синаптонемальный комплекс (рис. 2.19). К моменту завершения конъюгации хромосомы вследствие спирализации становятся короче и толще (пахитена). В каждом биваленте обнаруживается продольная щель и становятся видимыми расположенные бок о бок четыре хроматиды (диплотена). В то время как сестринские хроматиды остаются спаренными, несестринские - разделяются. На этой стадии несестринские хроматиды соединяются между собой в некоторых точках, образуя фигуру, напоминающую греческую букву %. Такие фигуры получили название "хиазм".
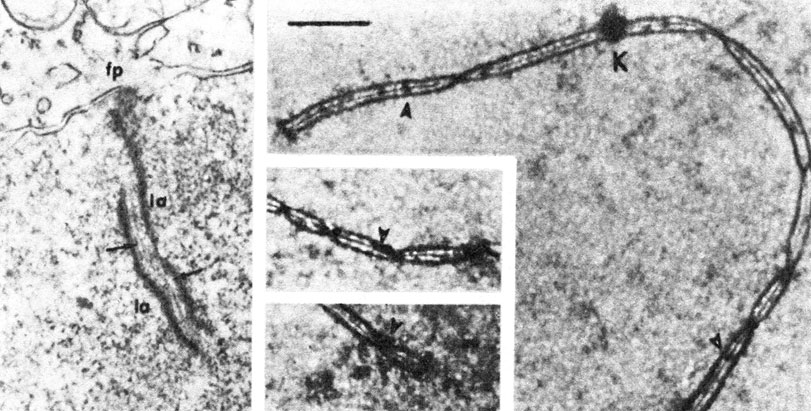
Рис. 2.19. Слева: электронная микрофотография синаптонемального комплекса с точкой фиксации (fp) в середине пахитены (сперматоцит мыши). Видны два электроноплотных латеральных плеча (la) и темный участок средней плотности, соответствующий месту спаривания. OsO4, Vestopal, × 36000. (Schleiermacher, Schmidt, 1973.) Справа. Синаптонемальный комплекс сперматоцита человека. К - центромера; стрелки указывают на плотные участки. Верхняя и нижняя врезки: полосы, параллельные оси синаптонемального комплекса. Увеличение × 15800; полосы могут соответствовать местам рекомбинации. (По Solari, Chromosoma, 81, p. 330, 1980.)
Метафаза I. Хромосомы располагаются в экваториальной плоскости, а их центромерные районы оттянуты к полюсам. Гомологичные хромосомы начинают разделяться, но еще удерживаются в участках хиазмообразования, особенно часто - в дистальных районах.
Анафаза I. Начинается "терминализация" хиазм, т. е. они перемещаются к концам хромосом и затем исчезают. Гомологичные хромосомы окончательно разделяются и перемещаются к противоположным полюсам. Образуются дочерние ядра (интеркинез).
Второе деление мейоза. В принципе, это митотическое деление удвоенного гаплоидного набора хромосом. Как указывалось выше, мейоз начинается после завершения последнего цикла репликации ДНК, в результате чего количество генетического материала в ходе первого деления остается учетверенным (2×2 гомологичных хромосом), но после завершения второго деления оно распределяется по четырем половым клеткам. Второй важный аспект мейоза состоит в случайном распределении негомологичных хромосом, благодаря чему существует большое число возможных комбинаций хромосом в разных половых клетках. При наличии у человека 23 пар хромосом число возможных комбинаций в одной гамете составляет 223=8388608. Число возможных комбинаций хромосом в потомстве данной пары родителей составляет 223×223, а в действительности еще больше - за счет кроссинговера (перекреста), происходящего во время конъюгации гомологичных хромосом. Морфологическим проявлением кроссинговера являются хиазмы. Каждая хиазма соответствует одному событию кроссинговера, в котором участвуют две несестринские хроматиды (рис. 2.20). Одно время активно дебатировался вопрос о том, происходит ли кроссинговер во время последнего цикла репликации ДНК посредством механизма "выбора копии" или уже после синтеза ДНК путем разрыва и последующего крестообразного воссоединения несестринских хроматид в гомологичных сайтах (рис. 2.21). Эта альтернатива теперь, по-видимому, разрешена в пользу гипотезы "обменов". Например, в профазе I наблюдается так называемый внеплановый синтез ДНК, который вполне может отражать процесс воссоединения концов при кроссинговере. Молекулярные механизмы рекомбинации не являются специфической проблемой генетики человека. Они обстоятельно обсуждаются в руководствах по молекулярной генетике.
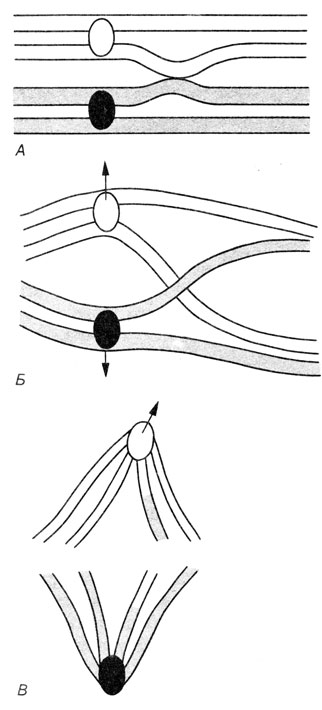
Рис. 2.20. Кроссинговер и образование хиазм. А. Гомологичные хроматиды соединены между собой. Б. Происходит кроссинговер с образованием хиазм. В. Разделение хиазм
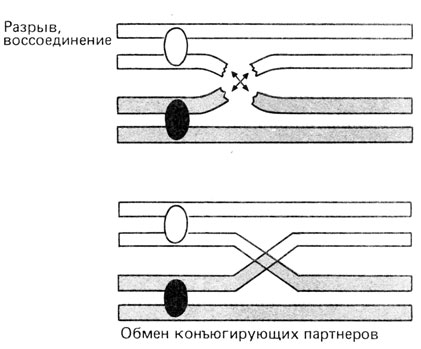
Рис. 2.21. Разрыв и воссоединение несестринских хроматид при кроссинговере
Сперматогенез. С наступлением половой зрелости сперматоциты мужчины постоянно претерпевают мейотические деления. После второго мейотического деления происходит плотная упаковка ДНК и митохондрий и завершается формирование спермиев, которые приобретают способность активно двигаться. Препараты хромосом на стадии сперматогониальных митозов или на стадии мейотического деления можно получить из материала биопсии тестикул, удаленных при хирургической операции.
Хромосомы на стадии диакинеза в мейозе у мужчины показаны на рис. 2.22. Гомологи еще тесно прилежат один к другому в их теломерных районах, в то время как центромерные районы уже начали перемещаться к полюсам. Половой бивалент четко отличается от всех остальных благодаря тому, что X- и Y-хромосомы ассоциируют "конец в конец" и хиазмы в нем не обнаруживаются. Во время пахитены половой бивалент начинает конденсироваться раньше других и находится в "половом пузырьке". Часть района короткого плеча X-хромосомы и короткое плечо Y-хромосомы конъюгируют (рис. 2.23). Гибридизационные эксперименты с ДНК-зондами показали, что эти районы структурно гомологичны [502]. В случае свободной рекомбинации генов, локализованных в гомологичных сегментах X- и Y-хромосом, их поведение не должно было бы отличаться от поведения аутосомных генов. Такие "псевдоаутосомные" X- и Y-сцепленные гены действительно были идентифицированы [315а; 488а]. Холдейн (1936) [372], учитывая возможность редкого кроссинговера между X- и Y-хромосомами, предположил существование частичного сцепления с полом тех генов человека, которые локализованы в гомологичном для X- и Y-хромосом сегменте. Однако удовлетворительные доказательства такого частичного сцепления с полом у человека пока не получены. Более того, локусы стероид-сульфатазы и эритроцитарного антигена Xg, расположенные очень близко к псевдоаутосомному району Х-хромосомы, сегрегируют в соответствии с классическим Х-сцепленным наследованием.
![Рис. 2.22. Мейоз у мужчины. Стадия диакинеза. Ясно виден бивалент XY [405]. Стрелки указывают на хиазмы](pic/000027.jpg)
Рис. 2.22. Мейоз у мужчины. Стадия диакинеза. Ясно виден бивалент XY [405]. Стрелки указывают на хиазмы
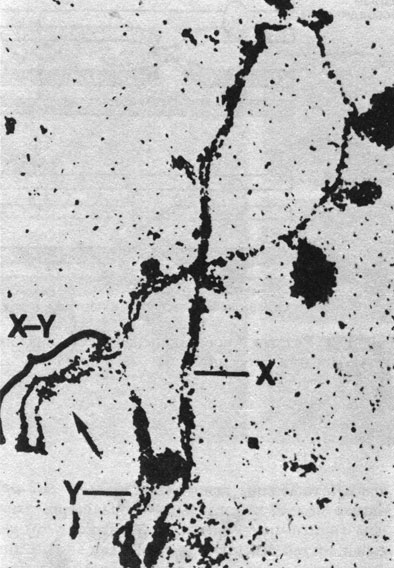
Рис. 2.23. Спаривание коротких плеч хромосом X и Y в раннем мейозе человека. (Courtesy of Dr. Goetz.)
Среднее число хиазм на клетку и размах изменчивости по этому показателю приведены в табл. 2.2. Некоторые биваленты могут содержать несколько хиазм, свыше пяти и даже шесть. Исходя из числа хиазм, генетическая длина (разд. 3.4) генома человека составляет около 25,5 морганиды у мужчин; у женщин эта величина больше, но точные оценки еще не получены [450]. Домовая мышь - единственное млекопитающее, кроме человека, для которого получены достоверные оценки, - имеет геном длиной 16,2-19,2 морганиды [88].
![Таблица 2.2. Число хиазм в мейозе у мужчины (1-е деление) [88]](pic/000029.jpg)
Таблица 2.2. Число хиазм в мейозе у мужчины (1-е деление) [88]
Оогенез. У всех млекопитающих оогенез сильно отличается от сперматогенеза. Общая схема представлена на рис. 5.13 (разд. 5.1.3.3). На рис. 2.24 и 2.25 приведена схема цитологических процессов. Ооциты полностью формируются уже на поздней эмбриональной стадии. После диплотены клетка переходит в стадию диктиотены, для которой характерна морфология хромосом типа "ламповых щеток". В этой стадии мейоз останавливается на долгие годы. После рождения большинство ооцитов дегенерирует. В процессе полового созревания некоторые ооциты начинают расти, заканчивают первое мейотическое деление и вступают в профазу II и затем в метафазу II. В это же время начинается овуляция. Мейоз завершается только после оплодотворения. Вокруг женских и мужских гаплоидных наборов хромосом образуется ядерная мембрана, и зигота теперь содержит два "пронуклеуса". Эта стадия особо чувствительна к нарушениям, вызванным, например, мутагенными агентами (разд. 5.2.1). Несколько часов спустя два пронуклеуса сливаются, образуя диплоидное ядро, и зигота начинает делиться путем обычных митозов.
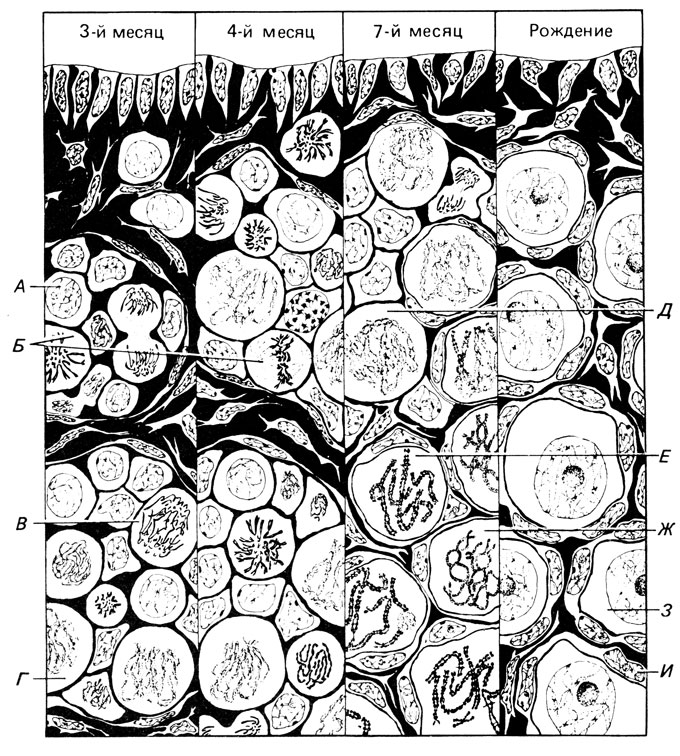
Рис. 2.24. Митоз и мейоз у плода женского пола человека. До 3-го месяца отмечаются только митотические деления (А - интерфаза; Б - метафаза; В - анафаза). Затем становятся видимыми первые мейотические деления (Г - лептотена; Д - зиготена). Начиная с 7-го месяца в мейоз входят новые ооциты. Первые пахитены (Е) и диплотены (Ж) наблюдаются у семимесячного плода. Затем мейоз задерживается, формируется ядерная мембрана, образуется ядрышко и клетки входят в 'фазу покоя', диктиотену (З). Клетки, окружающие ооцит (И), выполняют функции питающих; позднее они дадут начало фолликулу, в котором заключен ооцит. (По Ohno et al, 1962; см. также Bresch, Hausmann, Klassische und Molekulare Genetik, 1972.)
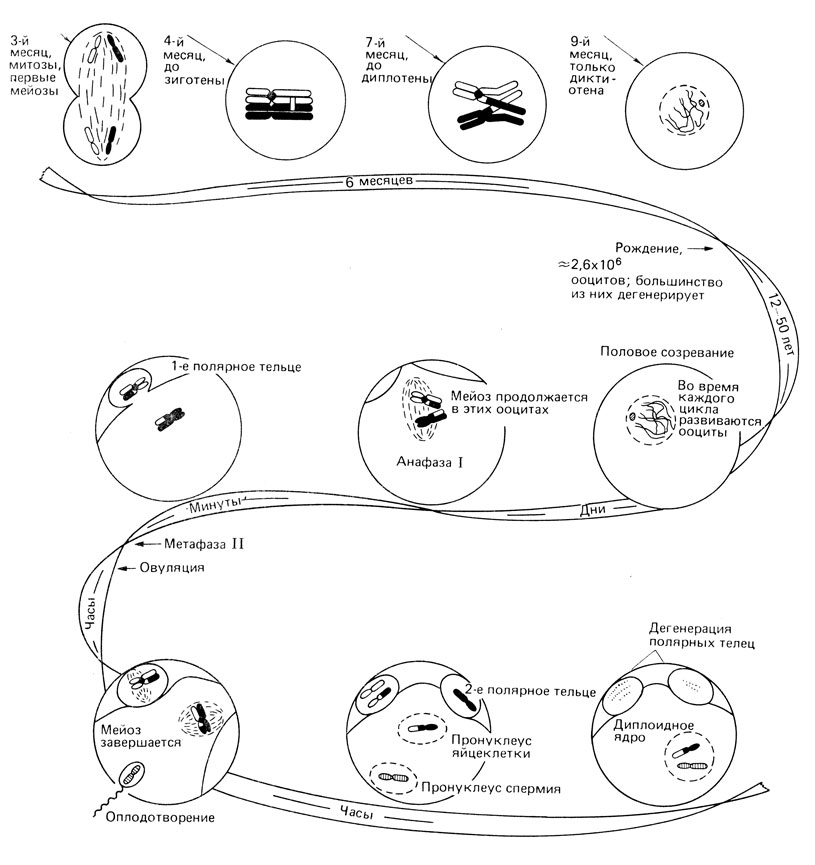
Рис. 2.25. Мейоз у женщины. Мейоз начинается после трех месяцев пренатального развития. В детстве цитоплазма ооцита увеличивается в объеме, но ядро остается неизменным. Около 90% всех ооцитов дегенерирует к началу полового созревания. В первой половине каждого месяца лютеинизирующий гормон (LH) стимулирует мейоз, и он почти завершается (завершаются профаза, которая началась в эмбриональном периоде; метафаза I, анафаза I, телофаза I и в течение нескольких минут - профаза II и метафаза II). Затем мейоз снова останавливается. Овуляция индуцируется лютеинизирующим гормоном (LH). Оплодотворение происходит в фаллопиевой трубе. После этого завершается второе мейотическое деление. Образуется ядерная мембрана, окружающая материнские и отцовские хромосомы. Спустя несколько часов два 'пронуклеуса' сливаются и начинается первое деление дробления. (Bresch, Hausmann, Klassische und Molekulare Genetik, 1972.)
Исследование мейотических хромосом в оогенезе сопряжено с большими трудностями. Было опубликовано лишь несколько удовлетворительных микрофотографий (рис. 2.26). Анализ генетического сцепления показывает, что кроссинговер у женщин происходит чаще, чем у мужчин (разд. 3.4), следовательно, и хиазм у женщин должно быть больше.
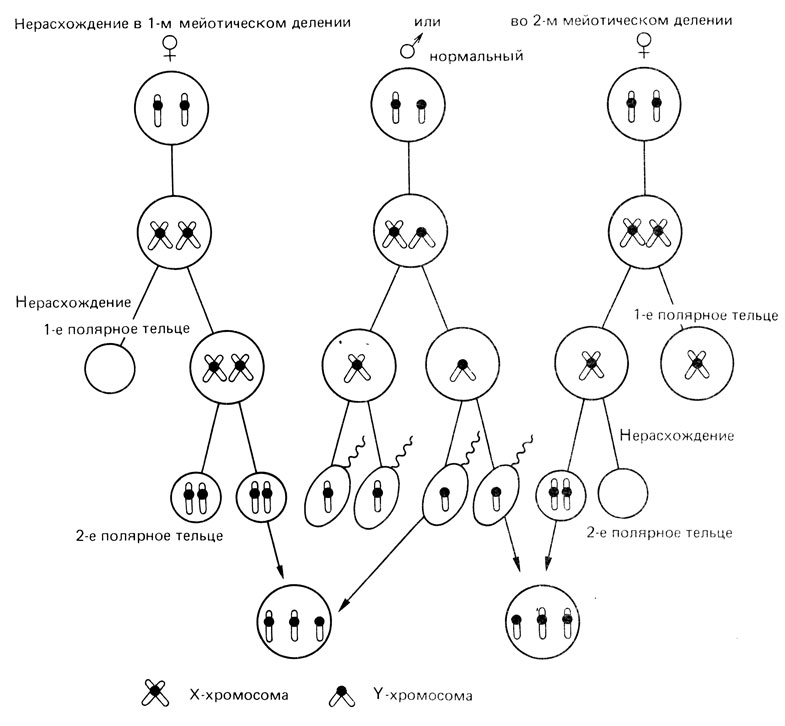
Рис. 2.26. Нерасхождение X-хромосомы в первом (слева) и во втором (справа) делении мейоза у женщины. Оплодотворение нормальным сперматозоидом. Индивид с набором XXY может появиться в результате нерасхождения как в первом, так и во втором мейотическом делении
У женщин только одна из четырех клеток - продуктов мейоза развивается в ооцит, три другие формируют полярные тельца, которые в норме не оплодотворяются. Обычно считают, что вероятность для хромосомы оказаться в полярном тельце не зависит от ее генетических особенностей. Данные о сохранении стандартных сегрегационных вероятностей для большинства генных мутаций (50:50, 25:75 и т. д.) свидетельствуют, что это допущение справедливо. Однако имеются и исключения (разд. 3.1.4): в случае структурных аберраций хромосом возможно неслучайное расхождение нормальных и аберрантных гомологов в полярные тельца.
Половые различия в мейозе. Две основные особенности отличают мейоз у мужчин и женщин:
- У мужчин все четыре клетки, образующиеся в результате мейотического деления, развиваются в зрелые гаметы, в то время как у женщин только одна из них становится зрелым ооцитом, остальные дегенерируют.
- У мужчин мейоз следует непосредственно за серией митотических делений; он завершается, когда сперматиды начинают трансформироваться в зрелые спермин. У женщин мейоз начинается на очень ранних стадиях эмбрионального развития, и ему предшествует намного меньше оогониальных митотических делений. После этого мейотический процесс прерывается на длительный период и завершается только после оплодотворения.
Эти различия важны для генетики человека. То обстоятельство, что только одна из четырех клеток развивается в зрелый ооцит, а три полярных тельца почти (или совсем) не имеют цитоплазмы, дает возможность этому ооциту передать новой зиготе полный набор цитоплазматических компонентов, таких, как митохондрии и информационные РНК (разд. 4.7.1). Эти различия в клеточной кинетике, вероятно, обусловливают разницу между мужчинами и женщинами в частоте трисомий, с одной стороны, и точковых мутаций - с другой (разд. 5.1 и 5.2).
|
ПОИСК:
|
© GENETIKU.RU, 2013-2022
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'
При использовании материалов активная ссылка обязательна:
http://genetiku.ru/ 'Генетика'